Method Article
La hidroponía: un sistema versátil para el Estudio de nutrientes Las respuestas de las plantas a la asignación y disponibilidad de nutrientes y la exposición a elementos tóxicos
En este artículo
Resumen
Here, we present an easy-to-follow protocol to establish a successful hydroponic system for plant nutrition studies. This protocol has been extensively tested in Arabidopsis and can easily be adapted to other plant species to study specific nutritional requirements or the effect of non-essential elements on plant growth and development.
Resumen
sistemas hidropónicos se han utilizado como uno de los métodos estándar para la investigación de biología vegetal y también se utilizan en la producción comercial de varios cultivos, incluyendo lechuga y tomate. Dentro de la comunidad de investigación de plantas, numerosos sistemas hidropónicos se han diseñado para estudiar la respuesta de las plantas a estreses bióticos y abióticos. Aquí se presenta un protocolo hidropónico que se puede implementar fácilmente en los laboratorios interesados en seguir estudios sobre la nutrición mineral de las plantas.
Este protocolo describe el sistema hidropónico configurar en detalle y la preparación de material vegetal para experimentos exitosos. La mayor parte de los materiales descritos en este protocolo se puede encontrar fuera de las empresas de suministro científicos, haciendo que el establecido para los experimentos hidropónicos menos costosa y conveniente.
El uso de un sistema de cultivo hidropónico es más ventajosa en situaciones en las que tienen que estar bien controlado los medios nutrientes y cuando ro intactaots necesitan ser cosechadas para aplicaciones posteriores. También demostramos cómo las concentraciones de nutrientes puede ser modificado para inducir respuestas de las plantas a ambos nutrientes esenciales y los elementos no esenciales tóxicos.
Introducción
Las plantas son de los pocos organismos que pueden sintetizar todos los metabolitos necesarios de iones inorgánicos, agua y CO2 utilizando la energía captada del sol 1. La hidroponía es un método de cultivo de plantas que se aprovecha de este hecho al proporcionar todos los nutrientes, en su forma inorgánica, en una solución líquida con o sin medios sólidos. Sistemas hidropónicos se han utilizado ampliamente por los científicos para explorar las necesidades de nutrientes y también la toxicidad de algunos elementos en Arabidopsis y otras especies de plantas 2-5. Por ejemplo, Berezin y col. 3, Conn et al. 4, y Alatorre-Cobos et al. 2 utiliza sistemas hidropónicos y varias especies de plantas incluyendo el tomate y el tabaco, para generar suficiente biomasa vegetal para análisis de minerales 2-4. Aplicaciones industriales de la hidroponía también se han desarrollado para cultivos tales como tomate y lechuga 6. En este sentido, oSQUEMA el uso de hidroponía en el contexto de la investigación, las posibles variaciones en los métodos disponibles, y, finalmente, presentar un sistema que puede ser fácilmente escalable y útil para los laboratorios de investigación interesados en estudiar la nutrición vegetal mineral.
Sistemas hidropónicos permiten una fácil separación de tejido de la raíz y el control preciso de la disponibilidad de nutrientes
La hidroponía ofrece varias ventajas sobre los sistemas basados en el suelo. Cuando se extrae del suelo, el tejido de la raíz a menudo a cizallamiento mecánico que causa la pérdida de tejido o daño. Esto es particularmente cierto para las estructuras de la raíz finos tales como raíces laterales y pelos radiculares. sistemas hidropónicos que no utilizan un medio inerte en partículas permiten una separación menos invasiva de las raíces y retoños tejidos.
En los sistemas de suelo, los cambios de biodisponibilidad de nutrientes a través de la matriz del suelo como nutrientes se unen a las partículas del suelo, creando micro-ambientes dentro de la tierra. este heterogeneity podría añadir un nivel adicional de complejidad en los experimentos que necesitan un control preciso de la concentración externa de nutrientes o de otras moléculas. En contraste, la solución hidropónica es homogénea y se puede sustituir fácilmente a través del curso del experimento.
Las variantes de los sistemas hidropónicos
Todos los cultivos hidropónicos se basan en una solución de nutrientes para entregar elementos esenciales para la planta. Además de los nutrientes, las raíces también necesitan un suministro constante de oxígeno. Cuando las raíces se vuelven anóxicos no son capaces de asumir y metabolitos de transporte con el resto del cuerpo de la planta 7. sistemas hidropónicos se pueden clasificar en función de cómo entregar el oxígeno y otros nutrientes a las raíces: el aporte de oxígeno mediante la saturación de la solución con aire (hidroponía clásicos), al no sumergir las raíces en todo momento, o permitiendo que las raíces para ser completamente expuestos a el aire (aeroponía) 8. En hidroponía,solución de nutrientes puede ser saturada con aire antes de su uso y cambiar con frecuencia, o el aire puede ser suministrado de forma continua en la solución durante el ciclo de vida de la planta 9. Alternativamente, las plantas también pueden ser cultivadas en medios inerte (gránulos, por ejemplo, lana de roca, vermiculita, o arcilla) y se sometieron a ciclos de húmedo-seco por la solución de goteo a través de los medios de comunicación o sumergiendo el sustrato en la solución de nutrientes 10 periódicamente. En aeroponía, las raíces son rociados con la solución de nutrientes para evitar la desecación.
Las desventajas de los sistemas hidropónicos
Aunque los cultivos hidropónicos ofrecen claras ventajas sobre los sistemas basados en el suelo, hay algunas consideraciones que deben ser reconocidos en la interpretación de los datos. Por ejemplo, los sistemas hidropónicos exponen las plantas a condiciones que pueden ser vistos como no fisiológica. Por lo tanto, fenotipos o respuestas de las plantas detectan utilizando sistemas hidropónicos pueden variar en magnitud cuando planeesn plantas se cultivan en sistemas alternativos (por ejemplo, el suelo o los medios de comunicación basados en agar). Estas consideraciones no son únicos para los sistemas hidropónicos; respuestas diferenciales también se pueden observar si las plantas se cultivan en diferentes tipos de suelo 11,12.
El siguiente protocolo proporciona instrucciones paso a paso sobre cómo configurar un sistema hidropónico en un laboratorio. Este protocolo se ha optimizado para Arabidopsis thaliana (Arabidopsis); Sin embargo, similar o en algunos casos pasos idénticos se puede utilizar para cultivar otras especies.
Protocolo
1. Planta de semillero del cuarto de niños
- La esterilización en fase vapor de las semillas de Arabidopsis
- Verter semillas (40-50 mg) en 1,5 ml tubos de centrífuga. (Véase la Figura 1 para el volumen de semilla adecuada, ~ 50 l). Etiqueta de cada tubo con lápiz (tinta puede desaparecer durante la esterilización). Colocar cada tubo etiquetado, la tapa abierta, en un desecador de 13.
- Coloque el desecador en una campana de extracción activa y cerrar la válvula del desecador.
- Alícuota de 100 ml de lejía (NaClO 6,15%) en un vaso de 250 ml y luego se coloca en el desecador.
- Añadir rápidamente 3 ml de ácido clorhídrico 12 M a la lejía usando una pipeta de transferencia. cerrar rápidamente la tapa de la desecador como la reacción procede rápidamente. Dejar que la esterilización de proceder durante 4 horas (marcado un tubo con tinta y viendo la tinta se desvanecen ayuda a visualizar que se ha generado una cantidad suficiente de gas de cloro).
PRECAUCIÓN: El gas cloro es tóxico; encargarse desus restos con las precauciones de seguridad adicionales en una campana de humos funcional. Póngase en contacto con las autoridades locales o visite la página web de la Salud Ambiental y el Departamento de Seguridad - Universidad de Missouri (ESH-MU) 14 para la seguridad química y las directrices para el uso de una campana de humos: https://ehs.missouri.edu/chem/. - Quince minutos antes de la esterilización es completa (3.75 horas), se convierten en una campana de flujo laminar y limpiar la superficie con etanol al 70%.
- Después de 4 horas de la esterilización abrir la válvula, retire brevemente la tapa del desecador en el interior de la campana de humos, retire la lejía, y disponer de acuerdo a los procedimientos institucionales. Este paso dará a conocer una gran parte de los vapores de cloro. Sellar la cámara de esterilización y llevarlo a la campana de flujo laminar. Abra la tapa ampliamente y airear las semillas esterilizadas durante aproximadamente 40 min. Después de este tiempo, utilizar las semillas inmediatamente o almacenar en un lugar seco.
Nota: se recomienda la esterilización con vapor de las semillas, pero otros métodos doch lavados alternos con etanol, agua y cloro, como se describe en Alatorre-Cobos et al. 2 son igualmente eficientes.
- Medios de cultivo para la germinación de semillas
Nota: El medio de cultivo preparado en este paso es ¼ de Murashige y Skoog (MS) con vitaminas 15.- Añadir 450 ml de agua desionizada (agua DI), 0,55 g de medio MS más vitaminas, MES 0,3 g (hidrato de ácido 4-morpholineethanesulfonic), y una barra de agitación magnética en un vaso de precipitados de vidrio de 1 L.
- Disolver y ajustar el pH a 5,7 con NaOH y luego añadir 3,5 g fitoagar. Mantener la agitación la solución durante 5 minutos más.
- Verter toda la solución en un cilindro graduado y añadir agua DI hasta 500 ml. Esta solución autoclave de 500 ml, con la barra de agitación magnética en el interior, utilizando una botella de autoclave de 1 l.
- Después de que la solución se ha esterilizado en autoclave, se agita la solución para 7-10 min utilizando el agitador magnético en la botella.
- Después de los medios de comunicación se ha enfriadoa 50-60 ° C, se vierte el medio en placas en condiciones estériles y se deja solidificar. Las placas pueden ser almacenados para su uso posterior en la habitación fría.
- chapado de semillas
- Encienda la campana de flujo laminar 15 minutos antes de usar y limpiar la superficie con etanol al 70%. Se requieren los siguientes elementos: semillas estériles, papel de filtro, palillos de dientes, cinta de microporos y placas de ¼ MS.
- Coloque las semillas estériles en un papel de filtro estéril. Ligeramente húmedo un extremo de un palillo de dientes estéril (con agua estéril o por meter los medios de comunicación ¼ MS). Utilice este fin hidratada para recoger las semillas desde el papel de filtro y luego las ponen sobre la superficie de los medios de comunicación.
- Separó las semillas a través de la placa a una densidad de aproximadamente 1 semilla por cm 2 (Figura 2). A continuación, utilice la cinta de microporos de mantener la tapa placa situada en el cuerpo de placa. Este tipo de cinta ayuda a evitar la contaminación al tiempo que permite el intercambio de gases entre el aire y el microclima inside la placa.
- Antes de la germinación, las semillas de estratificar por mantener las placas de dos días en la cámara frigorífica protegido de la luz.
- Después de la estratificación, colocar las semillas en una cámara de crecimiento o en un lugar con condiciones óptimas de crecimiento (23 ° C, 16 h luz / 8 h de oscuridad y 60% de humedad relativa durante Arabidopsis). Las plántulas estarán listas para el cultivo hidropónico 10-12 días después de la germinación.
Nota: Durante la germinación puede haber condensación significativa debajo de la tapa de la placa, para prevenir el ahogamiento, el exceso de agua debe ser desechada en condiciones estériles en una campana de flujo laminar.
2. Configuración y Trasplante hidropónico Proceso
- solución hidropónica
Nota: Como se ha mencionado en la introducción, las plantas pueden tener requisitos nutricionales específicos Arabidopsis se ha cultivado con éxito con la solución de nutrientes se muestra en la Tabla 1 16 Dependiendo de los proveedores, el..sales enumerados aquí pueden tener diferentes contenidos de agua (hidratado) y el uso de tales alternativas no afecta a las propiedades de la solución de nutrientes, siempre y cuando la molaridad se mantiene constante.- Preparar las soluciones madre de cada uno de macronutrientes en diferentes botellas (Tabla 1) y todos los micronutrientes excepto Fe-EDTA en una botella estéril (esterilizar por filtración utilizando 0,22 micras membranas). Siempre agregue Fe-EDTA a última hora de mezclar la solución. Preparar una solución de nutrientes 10x con antelación del experimento, pero autoclave y se almacena a 4 ° C. Usar o cambiar los nutrientes sólo cuando la solución nutritiva se ha alcanzado la temperatura ambiente.
- Trasplante
- Preparar titular de la planta y contenedores hidropónicos
- Hacer una incisión en la espuma, corriendo a lo largo de su longitud usando una hoja de afeitar (véase la Figura 3). Preparar un enchufe por planta.
- tapones para tubos de espuma líquidos autoclave remojadas en agua DI.
- Cortar el panel de espuma en tablas más pequeñas, asegurándose de que la anchura y la longitud de las planchas de espuma son 0,5-1,0 cm menos que el tamaño del contenedor (ver figura 4).
- Use un perforador de corcho para crear agujeros en el tablero de la espuma. La densidad de las plantas debe ser distribuida de manera uniforme, lo ideal es 1 planta por 10 cm2. Esta densidad mantendrá plantas cuidadosamente separados uno de otro; densidades más altas sin embargo son posibles y no impedirá el éxito de los experimentos. Asegúrese de que el tamaño de los agujeros coincida con el tamaño de los tapones (véase la Figura 4).
- Llenar los contenedores con la solución de nutrientes. Asegúrese de que la profundidad de la solución es suficiente para el desarrollo radicular (por lo menos 5 cm). A continuación, coloque cuidadosamente las placas de espuma sobre la superficie de la solución.
- Establecer el sistema de bomba de aire para proporcionar oxígeno en la solución (véase la Figura 5).
Nota: Rellene el recipiente con solución nutritiva hidropónica el samdía plántulas de correos están siendo trasplantadas. Cubriendo las paredes del recipiente de la luz ayudará a prevenir el crecimiento de algas.
- La transferencia de plántulas a partir de placas de sistema hidropónico
- Utilice pequeñas pinzas para tirar suavemente cada plántula fuera de la placa de medio y sentar las raíces a lo largo de la incisión del tapón del tubo de espuma. conecte con cuidado el tubo de espuma que sostiene la plántula en el tablero de la espuma a continuación, colocar la placa posterior al recipiente hidropónico. Véase la Figura 6 para la manipulación apropiada.
- Preparar titular de la planta y contenedores hidropónicos
3. Experimentos hidropónicos
- Reemplazo de solución de nutrientes y la manipulación
- Reemplazo de solución nutritiva
- Para sustituir la solución de nutrientes, preparar la solución hidropónica fresca tal como se describe en el paso 2.1. Retire la placa de espuma que contiene las plantas del recipiente hidropónico y colocarlo en un recipiente lleno de temporalagua o solución hidropónica.
- Desechar la solución de edad, enjuagar el recipiente brevemente tres veces con agua DI. Añadir la solución hidropónica recien preparada en este recipiente y colocar suavemente el tablero de la espuma con las plantas de nuevo en el recipiente hidropónico. Vuelva a colocar la solución hidropónica dos veces a la semana.
- Modificación de la composición de nutrientes de la solución hidropónica
- Ajustar la composición de la solución hidropónica se muestra en la Tabla 1 para modificar la concentración final de un elemento de interés. Por ejemplo, para inducir la deficiencia de hierro (Fe), modificar la solución hidropónica para disminuir la concentración de Fe-EDTA. Incluir un conjunto de plantas de control cultivadas en solución completa (o llena) hidropónico, sin ninguna modificación, para su comparación.
- Para manipular la solución nutriente con un elemento tóxico, preparar primero una solución madre independiente del elemento tóxico deseado, preferiblemente 1,000x concentrado. Usar unapipeta a pico la solución hidropónica con el elemento tóxico a la concentración final deseada mediante la madre concentrada 1,000x.
- Por ejemplo, con el fin de hacer 3 L de solución hidropónica que contiene 20 mM de cadmio, preparar una 2 stock 0,5 M CdCl, y añadir 120 l de la 2 stock 0,5 M CdCl en la solución hidropónica 3 L. Incluir un conjunto de control de las plantas cultivadas en hidroponía sin CdCl2 para la comparación.
PRECAUCIÓN: Tóxico elementos como el cadmio, el arsénico y el plomo son muy peligrosas para la salud humana y el medio ambiente. Por favor, póngase en contacto con las autoridades locales o visite la página web de la EHS-MU (https://ehs.missouri.edu/train/chemical.html) 14 de las normas de seguridad ambiental y de salud antes de la realización de experimentos.
- Reemplazo de solución nutritiva
- Esterilización de instrumentos para los próximos experimentos
- Como casi todo el material utilizado para preparar el hidropónico establecido puede serreutilizados, limpiar las diferentes partes con lejía diluida (NaClO 0,6%).
- Después de aclarar con lejía, enjuague todos los materiales a fondo con agua DI. Mantener los recipientes, placas de espuma de burbujas, y piedras de acuario en un lugar seco para su uso futuro. tapones de espuma están listos para su reutilización después de la eliminación de las raíces y de ser tratado en autoclave.
Resultados
En esta sección, los resultados de dos tipos de experimentos, utilizando el sistema hidropónico se describe aquí, se presentan. En el primer experimento, la solución de nutrientes se modificó para obtener diferentes concentraciones de zinc. También modificamos la solución de nutrientes mediante la adición de concentraciones no letales del cadmio elemento tóxico (Figura 7). En el segundo experimento, hemos utilizado con plasma acoplado inductivamente espectrometría de emisión óptica (ICP-OES) 1 para medir la composición elemental de raíces y hojas de plantas cultivadas en la solución que contiene cadmio hidropónica (Figura 8). Este experimento ilustra las ventajas de la obtención de raíces y hojas por separado.
Experimento 1
Plantas de semillero de Arabidopsis (Col-0) se hicieron crecer en el sistema hidropónico se describe en el protocol pasos 1 y 2. Las plantas se dejaron crecer durante un total de 3 semanas antes de ser tratado con diferentes concentraciones de zinc (Figura 7A-B) o una concentración no letal de cadmio (Figura 7C). Seis días post-tratamiento, las plantas cultivadas a altas concentraciones de zinc (> 42 mM) mostraron retraso en el crecimiento debido a la toxicidad de Zn, mientras que las plantas sin zinc adicional también añaden muestran retraso en el crecimiento en comparación con las plantas cultivadas con 7 M de Zn 2+. Figura 7 también muestra el reducción en el crecimiento de los brotes, crecimiento de las raíces y de hojas cloróticas síntomas típicos de las plantas expuestas al cadmio (Figura 7C).
Experimento 2
Col-0 plantas se cultivaron como se describe en los pasos 1 y 2. Después de dos semanas, la solución no modificado (repleta) se reemplazó con 80 ml de solución hidropónica que contiene 20 mM de CD. Después de 72 horass, tejidos de la raíz se lavaron mediante la transferencia de todo el tablero de la espuma con las plantas a un nuevo recipiente que contiene 80 ml de Tris 20 mM (pH 8,0) y EDTA 5 mM. Esta solución elimina los metales pesados unidos a la superficie de la raíz. Las plantas se incubaron en la solución que contiene EDTA-en un agitador rotatorio durante 5 minutos. a continuación, solución de EDTA fue reemplazado por 80 ml de agua DI y las plantas se incubaron en un agitador rotatorio durante 5 minutos. Esta etapa de aclarado con agua DI se repitió dos veces. Después de enjuagar las plantas con agua DI, hojas y raíces tejidos se recogieron de forma independiente y se procesaron para ICP-OES 1. La figura 8 muestra que la composición elemental de las hojas es diferente de raíces, donde los macronutrientes (Ca, K y Mg) en tejido de las hojas están presentes en una concentración más alta en comparación con las raíces. Por otro lado, micronutrientes tales como Zn y Fe se acumulan preferentemente en las raíces. Se encontró que la concentración de cadmio elemento no esencial para ser hi gher en las raíces en comparación con brotes.
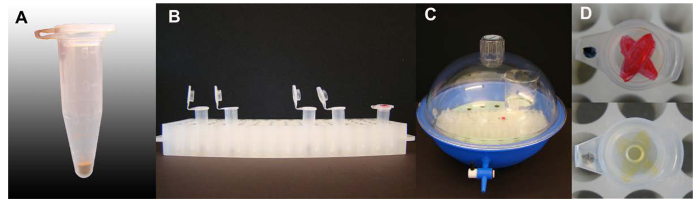
Figura 1. esterilización con vapor de las semillas de Arabidopsis. (A) Cantidad de semillas de Arabidopsis por 1,5 ml tubos de centrífuga. (B) Los tubos que contienen las semillas con los casquillos abiertos en el soporte de bastidor de tubo listo para la esterilización, un tubo con una tinta se incluye-marcado en la tapa. (C) La esterilización creó dentro de un desecador, se tapa y válvula cerrada. (D) La tinta marca en la tapa de un tubo incluido en el proceso de esterilización de semillas con un fuerte color de la tinta-marca antes y después de la esterilización. Haga clic aquí para ver una versión más grande de esta figura.
archivos / ftp_upload / 54317 / 54317fig2.jpg "/>
Figura 2. paso de recubrimiento de semillas. Las semillas (A) se coloca en un papel esterilizados antes de la siembra. También se requiere un palillo de dientes esterilizado para este paso. (B) mojar ligeramente el extremo del palillo de dientes con los medios de comunicación o de agua en el lado de la placa de medio. (C) Las semillas se mueven a ¼ de placas de EM. (D) Una densidad ideal de semillas es ≈1 semillas / cm2. Haga clic aquí para ver una versión más grande de esta figura.
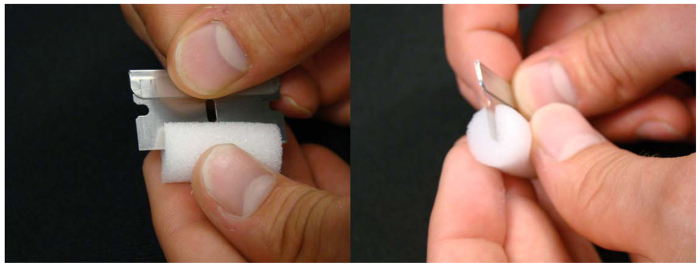
Figura 3. tapón de espuma se utiliza para mantener las plántulas en la solución nutritiva. Se hace una incisión en la mitad del tapón de tubo de espuma ayuda a la celebración de la plántula durante el transplante de las placas de cultivo hidropónico.Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Preparación Tablero de la espuma. (A) Compruebe el tamaño de la tabla de espuma plantilla con el tamaño del contenedor antes de preparar las planchas de espuma en grandes cantidades. Dos pequeñas perforaciones realizadas en el centro del tablero de la espuma hacen que sea más fácil de sujetar y manipular la espuma con unas pinzas. (B-C) Un perforador de corcho se utiliza para crear agujeros en el tablero de la espuma. (D) Comprobar el ajuste adecuado entre el tapón de tubo de espuma y los agujeros creados en el tablero de la espuma. Haga clic aquí para ver una versión más grande de esta figura.

. Figura 5. ajuste de la bomba de aire para el experimento hidropónico de vista superior (A) y vista lateral (B) Los números indican: 1 - bomba de suministro de aire; 2 - tubo de plástico que conecta la bomba de aire con el sistema de válvula para controlar el flujo de aire; 3 - el sistema de válvula; 4 y 5 - tubo de plástico que conecta el sistema de válvulas con piedras de burbujas para aireación; 6 y 7 -. Piedras burbuja (que se venden para los tanques de peces) Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. La transferencia de plántulas al sistema hidropónico. (A) utilizar pinzas para tomar una planta de semillero de la placa de soporte. (B) Coloque la plántula Root lo largo de la incisión en el tapón de tubo de espuma. (C) Introducir el tapón del tubo de espuma en el tablero de la espuma. (D) Una Fijación de tablero de la espuma con plántulas listas para ser colocado en la solución nutritiva. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 7. Soluciones nutritivas pueden ser modificados para probar la deficiencia o efectos tóxicos de los elementos 4 semanas de edad, cultivo hidropónico de Arabidopsis 6 días después del tratamiento:. (AB) plantas cultivadas con 0, 7, 14, 21, 28, 35, 42, y 50 mM de Zn. Las plantas que crecen a altas concentraciones de Zn (> 42 m) muestran retraso en el crecimiento (toxicidad), mientras que el crecimiento de las plantas sin Zn también agregó muestran retraso (deficiencia de nutrientes) en comparación con las plantas cultivadas con 7 M Zn 2+. (C) Las plantas cultivadas en ausencia (izquierda) o la presencia de 20 mM de Cd en la solución nutritiva (foto fue tomada después de 6 días de exposición Cd). La exposición al cadmio induce clorosis y reduce el crecimiento. Haga clic aquí para ver una versión más grande de esta figura.
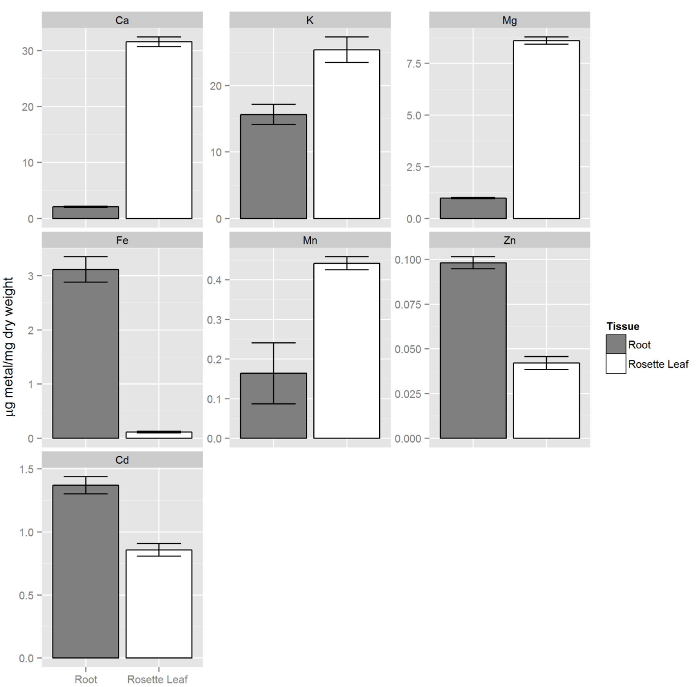
Figura 8. Composición elemental de raíces y brotes a partir de cultivos hidropónicos. Los brotes contienen más macronutrientes (Ca, K, Mg) en comparación con las raíces, mientras que los micronutrientes esenciales zinc y el hierro se concentran más en las raíces. Del mismo modo el cadmio elemento no esencial se acumula preferentemente en las raíces. Las barras de error representan los intervalos de confianza del 95% (n = 14, brotes y n = 9, raíces)._upload / 54317 / 54317fig8large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
| Tipo de nutriente | Sal / Reactivo | Concentración en la solución hidropónica | Unidad |
| macronutrientes | KNO3 | 1.250 | mM |
| macronutrientes | KH 2 PO 4 | 0,625 | mM |
| macronutrientes | MgSO 4 | 0,500 | mM |
| macronutrientes | Ca (NO 3) 2 | 0,500 | mM |
| micronutrientes | H 3 BO 3 | 17.500 | M |
| micronutrientes | MnCl 2 | 5.500 | M |
| micronutrientes | ZnSO 4 | 0,500 | M |
| micronutrientes | Na 2 MoO $ 4 | 0,062 | M |
| micronutrientes | NaCl 2 | 2.500 | M |
| micronutrientes | CoCl 2 | 0,004 | M |
| micronutrientes | FeEDTA | 12.500 | M |
Tabla 1. Concentración efectiva de los nutrientes en la solución hidropónica.
Discusión
La salud de las plantas de semillero se utilizan para el cultivo hidropónico es uno de los principales factores que contribuyen al éxito de un experimento hidropónico. La esterilización de los instrumentos, las semillas y los medios de cultivo también juegan un papel importante en la reducción del riesgo de contaminación y proporciona un buen punto de partida para las plantas antes de que se trasplantan en el sistema hidropónico. Un entorno de trabajo con instalaciones como un autoclave, campana extractora de humos, frío-habitación (4 ° C), y el espacio de crecimiento con condiciones controladas (intensidad de luz y temperatura) es necesario para dar un buen experimental arriba.
La frescura de la solución nutritiva también determina la salud de las plantas y, a su vez determina el éxito de un experimento hidropónico. Dado que el agua se evapora más rápido en condiciones de iluminación directa, la concentración de sales va a cambiar debido a una reducción del volumen total de la solución; Por lo tanto, lo mejor es cambiar la solución hidropónica al menos dos veces a la semana. Sin embargo, si los contenedores grandes y profundosequipado con un sistema de bomba de aire se utilizan puede que no sea necesario sustituir la solución de nutrientes para los experimentos que son de corta duración. Observamos que en el caso de Arabidopsis se utilizaron vasos Magenta (77 mm de ancho x 77 mm de longitud x 97 mm de altura) pero otros recipientes más grandes, también se pueden utilizar para dar cabida a las plantas más grandes.
Para los investigadores interesados en nutrientes para las plantas, los experimentos hidropónicos proporcionan un entorno único para probar fenotipos y respuestas de las plantas a diferentes disponibilidad de nutrientes 17. Mediante la manipulación de las concentraciones de los elementos de interés, los investigadores pueden establecer diferentes experimentos para probar los efectos de la suficiencia, la deficiencia, o concentraciones tóxicas de nutrientes esenciales y no esenciales. En comparación con el sistema basado en tierra, el sistema hidropónico proporciona un medio nutriente más homogénea a las plantas con menos riesgo de enfermedades transmitidas por el suelo. Además, tanto las raíces y retoños tejidos pueden ser cosechadas y se separan fácilmentepara profundizar el análisis de tejidos vegetales específicos.
En la sección representativa, presentamos dos ejemplos en los que un sistema hidropónico sencilla se utilizó para estudios más detallados sobre la nutrición de las plantas. En el primer ejemplo, por las plantas que crecen en un gradiente de concentración de cinc, hemos sido capaces de ilustrar el nivel de control que se puede alcanzar en la composición de nutrientes utilizando este sistema hidropónico. Las plantas cultivadas con 7 M Zn crecieron mucho más vigorosa en comparación con las plantas cultivadas en 50 mM de Zn, mientras que las plantas cultivadas sin adición de Zn tenían retraso del crecimiento adicional en comparación con las plantas cultivadas con 7 M de Zn. Esto fue en parte debido a la longitud de tiempo se permitió que las plantas para crecer en condiciones suficientes; la eliminación temprana de Zn de los medios de comunicación es probable que induzca síntomas de deficiencia de zinc-fuertes. Aplicando el mismo principio, hemos sido capaces de inducir toxicidad usando el metal no esencial, cadmio, que es conocido por afectar el crecimiento de las plantas.
En el segundoejemplo, la composición elemental de Col-0 raíces y brotes tratados con 20 mM Cd durante 72 horas se determinó por ICP-OES. Encontramos diferencias en todos los metales detectados entre las raíces y brotes. Macro-elementos se encuentran en concentraciones más altas en los brotes relativos a las raíces, mientras que el hierro y el zinc se encontraron más abundantes en las raíces. Cadmio siguió un patrón similar al hierro y zinc, siendo más concentrada en las raíces en comparación con brotes. Estos datos refuerzan la idea de que las hojas y las raíces proporcionan información diferente sobre el estado ionome de la planta y por lo tanto ambos tejidos deben ser analizados por separado para entender la nutrición mineral y composición en el nivel de planta entera. Además de ICP-OES varios métodos espectroscópicos tales como espectroscopía de absorción atómica (AAS) o plasma acoplado inductivamente espectrometría de masas (ICP-MS) también puede ser utilizado para medir la composición elemental (ionome) de tejidos vegetales 18-20.
En una hydroponic experimento, los síntomas y los fenotipos de las plantas responden a diferentes condiciones de nutrientes representan el comienzo de lo que podría ser extendido a más elaborados tales como los análisis de la expresión génica (transcriptómica) y la abundancia de proteínas (proteómica). Estas técnicas ómicas son claves para integrar el metabolismo vegetal, considerando los procesos de una manera específica de tejido.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This research was supported by the University of Missouri Research Board (Project CB000519) and the US National Science Foundation (IIA-1430428 to DMC). Nga T. Nguyen was supported by the Vietnam Education Foundation Training Program (Exchange visitor program No. G-3-10180). We also thank Roger Meissen (MU Bond Life Sciences Center) for his assistance and expertise during the video recording and editing sessions.
Materiales
| Name | Company | Catalog Number | Comments |
| For seed sterilization | |||
| Bleach | The Clorox Company | NA | The regular bleach www.cloroxprofessional.com |
| Hydrochloric acid | Fisher Scientific | A144-500 | |
| Desiccator body | Nalgene | D2797 SIGMA | Marketed by Sigma-Aldrich |
| Desiccator plate | Nalgene | 5312-0230 | Marketed by Thermo Scientific |
| For one quarter MS medium preparation | |||
| MES | Acros Organics | 172591000 | 4-Morpholineethanesulfonic acid hydrate |
| Murashige and Skoog (MS) | Sigma-Aldrich | M0404-10L | |
| KOH | Fisher Scientific | P250-500 | |
| Phytoagar | Duchefa Biochemie | P1003.1000 | |
| Square plate | Fisher Scientific | 0875711A | Disposable Petri Dish With Grid |
| For seed plating | |||
| Filter paper | Whatman | 1004090 | |
| Toothpick | Jarden Home Brands | NA | |
| Aluminum foil | Reynolds Wrap | NA | Standard aluminum foil |
| Micropore tape | 3M Health Care | 19-898-074 | Surgical tape; Marketed by Fisher Scientific |
| For hydroponic solution preparation | |||
| KNO3 | Fisher Scientific | BP368-500 | |
| KH2PO4 | Fisher Scientific | P386-500 | |
| MgSO4 | Fisher Scientific | M63-500 | |
| Ca(NO3)2 | Acros Organics | A0314209 | |
| H3BO3 | Sigma | B9645-500G | |
| MnCl2 | Sigma-Aldrich | M7634-100G | |
| ZnSO4 | Sigma | Z0251-100G | |
| Na2MoO4 | Aldrich | 737-860-5G | |
| NaCl2 | Fisher Scientific | S271-1 | |
| CoCl | Sigma-Aldrich | 232696-5G | |
| FeEDTA | Sigma | E6760-100G | |
| “Stericup & Steritop” bottle | Milipore Corporation | SCGVU02RE | Micronutrient container www.milipore.com |
| For root wash buffer preparation | |||
| EDTA | Acros Organics | A0305456 | |
| Tris | Fisher Scientific | BP154-1 | |
| For hydroponic setup | |||
| Autoclavable foam tube plug | Jaece Industries Inc. | L800-A | Identi-Plugs fit to holes with 2R = 6-13 mm |
| Foam Board | Styrofoam Brand Dow | ESR-2142 | Thickness is 1/2 inches |
| Cork borer | Humboldt | H-9662 | Cork Borer Sets with Handles, , Plated Brass Set of 6, 3/16" to 1/2" OD Size |
| Air pump | Aqua Culture | MK-1504 | |
| Air pump | Marketed by Wal-mart Stores, Inc. | ||
| Airline tubing and aquarium bubble stones | Aqua Culture | Tubing: 928/25-S | |
| Airline tubing and aquarium bubble stones | Marketed by Wal-mart Stores, Inc. | Stone: ASC-1 | |
| Other | |||
| Ethanol | Fisher Scientific | A995-4 | Reagent Alcohol |
| Cadmium Chloride (CdCl2) | Sigma-Aldrich | 10108-64-2 | |
Referencias
- McDowell, S. C., et al. Elemental Concentrations in the Seed of Mutants and Natural Variants of Arabidopsis thaliana Grown under Varying Soil Conditions. PLoS ONE. 8, 1-11 (2013).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14, 69-69 (2014).
- Berezin, I., Elazar, M., Gaash, R., Avramov-Mor, M., Shaul, O., Asao, T. The Use of Hydroponic Growth Systems to Study the Root and Shoot Ionome of Arabidopsis thaliana. Hydroponics - A Standard Methodology for Plant Biological Researches. , (2012).
- Conn, S. J., et al. Protocol: optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9, 4-4 (2013).
- Kopittke, P. M., Blamey, F. P. C., Asher, C. J., Menzies, N. W. Trace metal phytotoxicity in solution culture: a review. J. Exp. Bot. 61, 945-954 (2009).
- Gent, M. P. N. Composition of hydroponic lettuce: effect of time of day, plant size, and season. J. Sci. Food Agric. 92, 542-550 (2012).
- Gibbs, J., Turner, D. W., Armstrong, W., Darwent, M. J., Greenway, H. Response to oxygen deficiency in primary maize roots. I. Development of oxygen deficiency in the stele reduces radial solute transport to the xylem. Funct. Plant Biol. 25, 745-758 (1998).
- Zobel, R. W., Del Tredici, P., Torrey, J. G. Method for Growing Plants Aeroponically. Plant Physiol. 57, 344-346 (1976).
- Chang, D. C., Park, C. S., Kim, S. Y., Lee, Y. B. Growth and Tuberization of Hydroponically Grown Potatoes. Potato Research. 55, 69-81 (2012).
- Resh, H. M. . Hydroponic Food Production : A Definitive Guidebook for the Advanced Home Gardener and the Commercial Hydroponic Grower, Seventh Edition. , 199-292 (2012).
- Sharma, H. K., Chawan, D. D., Daiya, K. S. Effect of different soil types on plant growth, leaf pigments and sennoside content in Cassia species. Pharmaceutisch weekblad. 2, 65-67 (1980).
- Strojny, Z., Nowak, J. S. Effect of different growing media on the growth of some bedding plants. Acta horticulturae. 19, 157-162 (2004).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 2, 87-103 (2006).
- . Chemical Safety Environmental Health and Safety - University of Missouri Available from: https://ehs.missouri.edu/ (2013)
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiol. Plant. 15, 473-497 (1962).
- Lee, D. A., Chen, A., Schroeder, J. I. ars1, an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake. Plant J. 35, 637-646 (2003).
- Pii, Y., Cesco, S., Mimmo, T. Shoot ionome to predict the synergism and antagonism between nutrients as affected by substrate and physiological status. Plant Physiol. Biochem. 94, 48-56 (2015).
- Baxter, I. Ionomics: studying the social network of mineral nutrients. Curr. Opin. Plant Biol. 12, 381-386 (2009).
- Baxter, I. Ionomics: The functional genomics of elements. Brief Funct Genomics. 9, 149-156 (2010).
- Salt, D. E. Update on plant ionomics. Plant Physiol. 136, 2451-2456 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados