Method Article
Hydroponics: un sistema versatile per studiare nutrienti allocazione e vegetali risposte a disponibilità di nutrienti e l'esposizione a elementi tossici
In questo articolo
Riepilogo
Here, we present an easy-to-follow protocol to establish a successful hydroponic system for plant nutrition studies. This protocol has been extensively tested in Arabidopsis and can easily be adapted to other plant species to study specific nutritional requirements or the effect of non-essential elements on plant growth and development.
Abstract
sistemi idroponici sono state utilizzate come uno dei metodi standard per la ricerca Biologia Vegetale e sono utilizzati anche nella produzione commerciale per diverse colture, tra cui lattuga e pomodoro. All'interno della comunità di ricerca impianto, numerosi sistemi idroponici sono stati progettati per studiare le risposte delle piante agli stress biotici e abiotici. Qui vi presentiamo un protocollo idroponica che può essere facilmente implementato in laboratori interessati a perseguire studi sulla nutrizione minerale delle piante.
Questo protocollo descrive il sistema idroponico impostato in dettaglio e la preparazione di materiale vegetale per esperimenti di successo. La maggior parte dei materiali descritti in questo protocollo può essere trovato al di fuori società di fornitura scientifici, rendendo il set up per esperimenti idroponiche meno costoso e conveniente.
L'uso di un sistema di crescita idroponica è più vantaggiosa in situazioni in cui devono terreno nutritivo essere ben controllata e quando intatta roOTS devono essere raccolte per le applicazioni a valle. Abbiamo inoltre dimostrato come le concentrazioni di nutrienti può essere modificato in modo da indurre risposte pianta per entrambe le sostanze nutrienti essenziali e gli elementi non essenziali tossici.
Introduzione
Le piante sono tra i pochi organismi che possono sintetizzare tutti i metaboliti richiesti da ioni inorganici, acqua e CO 2 che utilizzano l'energia catturata dal sole 1. Hydroponics è un metodo di coltivazione di piante che sfrutta questo fatto fornendo tutti i nutrienti, nella loro forma inorganica, in una soluzione liquida con o senza supporto solido. Sistemi idroponici sono stati ampiamente utilizzati dagli scienziati per esplorare i requisiti nutrizionali e anche la tossicità di alcuni elementi in Arabidopsis e di altre specie vegetali 2-5. Per esempio, Berezin et al. 3, Conn et al. 4, e Alatorre-Cobos et al. 2 utilizzati sistemi idroponici e diverse specie di piante, tra cui pomodoro e tabacco, di generare sufficiente biomassa vegetale per l'analisi minerale 2-4. Applicazioni industriali di coltura idroponica sono stati sviluppati anche per le colture come il pomodoro e lattuga 6. Qui, outline l'uso idroponica nel contesto della ricerca, possibili variazioni metodi disponibili, e infine presentare un sistema che può essere facilmente scalabile ed utili per laboratori di ricerca interessati a studiare nutrizione minerale delle piante.
Sistemi idroponici permettono una facile separazione dei tessuti radice e il controllo preciso della disponibilità di nutrienti
Hydroponics offre diversi vantaggi rispetto ai sistemi basati sul suolo. Quando viene rimosso dal suolo, il tessuto radice è spesso tranciato meccanicamente causando la perdita di tessuto o di danni. Questo è particolarmente vero per le strutture di root sottili come le radici laterali e peli radicali. sistemi idroponici che non utilizzano un supporto particellare inerte, consentono una separazione meno invasiva di radice e sparare tessuti.
Nei sistemi di suolo, i cambiamenti dei nutrienti di biodisponibilità in tutta la matrice del suolo come nutrienti si legano alle particelle di terreno che creano microambienti all'interno del terreno. Questo heterogeneità potrebbe aggiungere un ulteriore livello di complessità in esperimenti che necessitano di un controllo preciso sulla concentrazione esterna di sostanze nutritive o di altre molecole. Al contrario, la soluzione idroponica è omogenea e può essere facilmente sostituito in tutto il corso dell'esperimento.
Varianti di sistemi idroponici
Tutte le colture idroponiche basano su una soluzione nutritiva per trasportare gli elementi essenziali alla pianta. Oltre alle sostanze nutritive, le radici anche bisogno di un rifornimento costante di ossigeno. Quando le radici diventano anossico non sono in grado di prendere e metaboliti di trasporto per il resto del corpo dell'impianto 7. sistemi idroponici possono essere classificati in base a come fornire ossigeno e altri nutrienti alle radici: l'apporto di ossigeno saturando la soluzione con l'aria (coltura idroponica classiche), non immergendo le radici in ogni momento, o permettendo alle radici essere completamente esposti a l'aria (aeroponica) 8. In coltura idroponica,soluzione nutriente può essere saturo di aria prima del suo utilizzo e sostituiti frequentemente, o aria può essere fornito in continuo nella soluzione durante il ciclo di vita della pianta 9. In alternativa, le piante possono essere coltivate su supporti inerti (ad esempio pellet, lana di roccia, vermiculite o argilla) e sottoposti a secco-umido cicli per gocciolamento una soluzione attraverso i media o periodicamente immergendo il substrato nella soluzione nutritiva 10. In aeroponica, le radici vengono spruzzati con la soluzione nutritiva per prevenire l'essiccamento.
Svantaggi di sistemi idroponici
Anche se le culture idroponiche offrono chiari vantaggi rispetto ai sistemi basati sul suolo, ci sono alcune considerazioni che devono essere riconosciuti quando si interpretano i dati. Per esempio, sistemi idroponici espongono impianti a condizioni che possono essere visti come non fisiologica. Pertanto, fenotipi o risposte delle piante rilevati utilizzando sistemi idroponici possono variare in grandezza when piante sono coltivate in sistemi alternativi (ad esempio, del suolo o dei media agar-based). Queste considerazioni non sono gli unici per i sistemi idroponici; risposte differenziali possono essere osservati anche se le piante sono coltivate in diversi tipi di terreno 11,12.
Il seguente protocollo fornisce istruzioni passo-passo su come impostare un sistema idroponico in un laboratorio. Questo protocollo è stato ottimizzato per Arabidopsis thaliana (Arabidopsis); tuttavia, simili o in alcuni casi passaggi identici possono essere utilizzati per crescere altre specie.
Protocollo
1. piantina Nursery
- Sterilizzazione in fase vapore di semi di Arabidopsis
- Versare semi (40-50 mg) in 1,5 ml provette da centrifuga. (Vedi Figura 1 per il volume del seme del caso, ~ 50 ml). Etichettare ogni tubo con la matita (inchiostro potrebbe scomparire durante la sterilizzazione). Mettere ogni tubo con etichetta, tappo aperto, in un essiccatore 13.
- Posizionare il essiccatore in una cappa attiva e chiudere la valvola del essiccatore.
- Aliquota 100 ml di candeggina (NaClO 6,15%) in un bicchiere da 250 ml e poi posto in un essiccatore.
- Aggiungere rapidamente 3 ml di 12 M di acido cloridrico per la candeggina con una pipetta di trasferimento. chiudere rapidamente il coperchio del essiccatore come la reazione procede rapidamente. Lasciare che la sterilizzazione di procedere per 4 ore (segnando un tubo con inchiostro e di vedere l'inchiostro svanire aiuta a visualizzare che una quantità sufficiente di gas di cloro è stato generato).
ATTENZIONE: Il gas di cloro è tossico; manigliai suoi residui con misure di sicurezza supplementari in una cappa aspirante funzionale. Contattare le autorità locali o visitare la pagina web del Dipartimento di salute ambientale e sicurezza - University of Missouri (ESH-MU) 14 per la sicurezza chimica e le linee guida per l'utilizzo di una cappa aspirante: https://ehs.missouri.edu/chem/. - Quindici minuti prima della sterilizzazione è completo (3,75 ore), si trasformano in una cappa a flusso laminare e pulire la superficie con il 70% di etanolo.
- Dopo 4 h di sterilizzazione aprire la valvola, rimuovere brevemente il coperchio del essiccatore interno della cappa, rimuovere la candeggina, e smaltire secondo le procedure istituzionali. Questo passaggio rilascerà una gran parte dei fumi di cloro. Sigillare la camera di sterilizzazione e portarlo alla cappa a flusso laminare. Aprire il coperchio ampiamente e aerare i semi sterilizzati per circa 40 min. Trascorso questo tempo, utilizzare i semi subito o conservare in un luogo asciutto.
Nota: la sterilizzazione in fase vapore di semi è consigliato, ma altri metodi doch lavaggi come si alternano con l'etanolo, acqua e candeggina, come descritto in Alatorre-Cobos et al. 2 sono ugualmente efficaci.
- Terreni di coltura per i semi di germinazione
Nota: I terreni di coltura preparato in questa fase è ¼ Murashige e Skoog (MS) con vitamine 15.- Aggiungere 450 ml di acqua deionizzata (DI) di acqua, 0,55 g supporti MS Plus vitamine, 0,3 g MES (4-idrato morpholineethanesulfonic acido), e una ancoretta magnetica in un bicchiere di vetro 1 L.
- Sciogliere e aggiustare il pH a 5,7 con NaOH e quindi aggiungere 3,5 g phytoagar. Continuate a mescolare la soluzione per altri 5 minuti.
- Versare l'intera soluzione in un cilindro graduato e aggiungere acqua deionizzata fino a 500 ml. Autoclave questa soluzione da 500 ml, con l'ancoretta magnetica all'interno, utilizzando una bottiglia autoclavabile 1 L.
- Dopo che la soluzione è stata autoclavato, agitare la soluzione per 7-10 min usando l'agitatore magnetico nella bottiglia.
- Dopo che i media si è raffreddatoa 50-60 ° C, versare i mezzi di comunicazione in piastre in condizioni sterili e lasciate solidificare. Le piastre possono essere memorizzati per un uso successivo nel freddo-stanza.
- placcatura Seed
- Accendere la cappa a flusso laminare 15 minuti prima dell'uso e pulire la superficie con il 70% di etanolo. Sono necessari i seguenti elementi: semi sterili, carta da filtro, stuzzicadenti, nastro micropori e piatti ¼ MS.
- Mettere i semi sterili su una carta da filtro sterile. Leggermente bagnato un'estremità di uno stuzzicadenti sterile (con acqua sterile o colpendo media ¼ MS). Utilizzare questo fine idratata a raccogliere i semi dalla carta da filtro e poi li mettono sulla superficie dei media.
- Diffondere i semi attraverso la piastra ad una densità di circa 1 seme per cm 2 (Figura 2). Quindi utilizzare il nastro micropori per tenere il coperchio piatto attaccato al corpo piatto. Questo tipo di nastro aiuta a prevenire contaminazioni pur consentendo lo scambio di gas tra l'aria e il microclima insidvia e la piastra.
- Prima di germinazione, i semi stratificare mantenendo le piastre due giorni in cella coperti dalla luce.
- Dopo stratificazione, mettere i semi in una camera di crescita o in un luogo con condizioni di crescita ottimali (23 ° C, 16 ore luce / 8 ore buio e il 60% di umidità relativa per Arabidopsis). Piantine saranno pronti per la coltura idroponica 10-12 giorni dopo la germinazione.
Nota: Durante la germinazione ci può essere significativo condensa sotto il coperchio della piastra, per evitare annegamento, l'acqua in eccesso deve essere smaltita in condizioni sterili in una cappa a flusso laminare.
2. processo di installazione e Trapianto idroponica
- soluzione idroponica
Nota: Come menzionato nell'introduzione, piante possono avere requisiti nutrizionali specifici Arabidopsis è stato coltivato con successo con la soluzione nutritiva mostrato nella Tabella 1 16 A seconda dei fornitori, il..sali qui elencati possono avere un contenuto di acqua diversa (idrato) e con tali alternative non influenza le proprietà della soluzione nutritiva finché la molarità viene mantenuto costante.- Preparare le soluzioni madre di ogni macronutrienti in bottiglie diverse (Tabella 1) e tutti i micronutrienti ad eccezione di Fe-EDTA in una bottiglia sterile (sterilizzare per filtrazione 0,22 micron utilizzando membrane). Aggiungere sempre Fe-EDTA finalmente durante la miscelazione la soluzione. Preparare una soluzione nutritiva 10x in anticipo dell'esperimento ma autoclave e conservare a 4 ° C. Utilizzare o modificare le sostanze nutritive solo quando la soluzione nutritiva ha raggiunto la temperatura ambiente.
- trapianto
- Preparare titolare impianti e contenitori idroponiche
- Fare un'incisione nella schiuma, che corre lungo la sua lunghezza con una lama di rasoio (vedere Figura 3). Preparare una spina per pianta.
- spine tubo di schiuma a liquido autoclave imbevuto di acqua deionizzata.
- Tagliare il pannello di schiuma in tavole più piccole, assicurandosi che la larghezza e la lunghezza dei pannelli in schiuma sono 0,5-1,0 cm in meno dimensioni del contenitore (vedere Figura 4).
- Utilizzare una sonda di carotaggio per creare fori sul pannello isolante. La densità delle piante dovrebbe essere uniformemente distribuito, idealmente 1 pianta per 10 cm 2. Questa densità manterrà piante nettamente separati gli uni dagli altri; densità superiori tuttavia sono possibili e non preclude il successo degli esperimenti. Assicurarsi che la dimensione dei fori corrisponde alla dimensione dei tappi (vedere Figura 4).
- Riempire i contenitori con la soluzione nutritiva. Assicurarsi che la profondità della soluzione è sufficiente per lo sviluppo delle radici (almeno 5 cm). Poi posto con attenzione i pannelli in schiuma sulla superficie della soluzione.
- Impostare l'impianto di pompa per fornire ossigeno nella soluzione (vedi Figura 5).
Nota: Riempire il contenitore idroponica con soluzione nutritiva il same piantine giorno vengono trapiantate. Coprire i lati del contenitore dalla luce aiuterà a prevenire la crescita delle alghe.
- Trasferimento Seedling da piastre per sistema idroponico
- Utilizzare piccole pinzette per estrarre delicatamente ogni piantina fuori del piatto medio e gettare le radici lungo l'incisione della spina tubo di schiuma. inserire con attenzione il tubo di schiuma tenendo la piantina nel pannello isolante quindi posizionare il pannello posteriore al contenitore idroponica. Vedi Figura 6 per la manipolazione appropriata.
- Preparare titolare impianti e contenitori idroponiche
3. Esperimenti idroponici
- La sostituzione della soluzione nutritiva e la manipolazione
- La sostituzione della soluzione nutritiva
- Per sostituire la soluzione nutritiva, preparare una soluzione fresca idroponiche come descritto al punto 2.1. Rimuovere il pannello isolante contenente le piante dal contenitore idroponica e metterlo in un contenitore riempito di temporaneaacqua o soluzione idroponica.
- Eliminare la vecchia soluzione, sciacquare il contenitore per breve tempo tre volte con acqua deionizzata. Aggiungere la soluzione idroponica appena preparata in questo contenitore e delicatamente posizionare il pannello isolante con le piante nel contenitore idroponica. Sostituire la soluzione idroponica due volte a settimana.
- Modifica della composizione dei nutrienti della soluzione idroponica
- Regolare la composizione della soluzione idroponica mostrato in Tabella 1 per modificare la concentrazione finale di un elemento di interesse. Ad esempio, per indurre carenza di ferro (Fe), modificare la soluzione idroponica per diminuire la concentrazione di Fe-EDTA. Include una serie di piante di controllo coltivate su una soluzione completa (o piena) idroponica, senza alcuna modifica, per il confronto.
- Per manipolare la soluzione nutritiva con un elemento tossico, prima preparare una soluzione madre indipendente del elemento tossico desiderato, preferibilmente 1,000x concentrato. Usare unpipetta a picco la soluzione idroponica con l'elemento tossico alla concentrazione finale desiderato utilizzando il brodo concentrato 1,000x.
- Ad esempio, al fine di rendere 3 L di soluzione idroponica contenente 20 mM di cadmio, preparare un 0,5 M CdCl 2 stock, e aggiungere 120 ml di 2 stock 0,5 M CdCl nella soluzione idroponica 3 L. Include una serie di controllo di piante coltivate in idroponica, senza CdCl 2 per il confronto.
ATTENZIONE: Toxic elementi quali cadmio, arsenico e piombo sono molto pericolosi per la salute umana e per l'ambiente. Si prega di contattare le autorità locali o visitare la pagina web del EHS-MU (https://ehs.missouri.edu/train/chemical.html) 14 per le linee guida di sicurezza ambientale e la salute prima di effettuare esperimenti.
- La sostituzione della soluzione nutritiva
- Sterilizzazione degli strumenti per i prossimi esperimenti
- Come quasi tutto il materiale utilizzato per preparare la idroponica impostato può essereriutilizzato, pulire le varie parti con candeggina diluita (NaClO 0,6%).
- Dopo il risciacquo con candeggina, lavare tutti i materiali accuratamente con acqua deionizzata. Tenere i contenitori, pannelli in schiuma, e le pietre bolla acquario in un luogo asciutto per un utilizzo futuro. tappi di schiuma sono pronti per il riutilizzo dopo la rimozione delle radici e di essere autoclavato.
Risultati
In questa sezione, i risultati di due tipi di esperimenti, utilizzando il sistema idroponico qui descritto, sono presentati. Nel primo esperimento, la soluzione nutritiva è stata modificata per ottenere diverse concentrazioni di zinco. Abbiamo inoltre modificato la soluzione nutritiva con l'aggiunta di concentrazioni non letali del cadmio elemento tossico (Figura 7). Nel secondo esperimento, abbiamo utilizzato plasma accoppiato induttivamente ottica spettrometria di emissione (ICP-OES) 1 per misurare la composizione elementare di radici e foglie di piante coltivate in soluzione contenente cadmio idroponica (Figura 8). Questo esperimento illustra i vantaggi di ottenere radici e foglie separatamente.
esperimento 1
Piantine di Arabidopsis (Col-0) sono state coltivate in sistema idroponico descritto in protocol punti 1 e 2. Le piante sono state lasciate crescere per un totale di 3 settimane prima di essere trattate con diverse concentrazioni di zinco (Figura 7A-B) o una concentrazione non letale di cadmio (Figura 7C). Sei giorni dopo il trattamento, piante cresciute a concentrazioni elevate di zinco (> 42 micron) hanno mostrato un ritardo di crescita a causa di Zn tossicità, mentre le piante senza zinco extra aggiunti anche mostrare un ritardo di crescita rispetto alle piante coltivate con 7 micron Zn 2+. Figura 7 mostra anche il riduzione della crescita riprese, la crescita delle radici e foglie di clorotico sintomi tipici di piante esposte al cadmio (Figura 7C).
esperimento 2
Col-0 piante sono state coltivate come descritto nei passaggi 1 e 2. Dopo due settimane, la soluzione non modificato (piene) è stato sostituito con 80 ml di soluzione idroponica contenente 20 mM Cd. Dopo 72 ores, tessuti radicali sono stati lavati con il trasferimento di tutto il bordo della gomma piuma con le piante in un nuovo recipiente contenente 80 ml di Tris 20 mM (pH 8,0) e 5 mM EDTA. Questa soluzione rimuovere i metalli pesanti legati alla superficie della radice. Le piante sono state incubate nella soluzione EDTA contenente su un agitatore rotante per 5 minuti. EDTA è stato poi sostituito con 80 ml di acqua deionizzata e le piante sono state incubate rotativo per altri 5 minuti. Questa fase di risciacquo con acqua deionizzata è stato ripetuto due volte. Dopo il risciacquo le piante con acqua DI, foglie e radice tessuti sono state raccolte in maniera indipendente e trattati per ICP-OES 1. La Figura 8 mostra che la composizione elementare di foglie è diverso da radici, dove macronutrienti (Ca, K e Mg) nel tessuto fogliare sono presenti in concentrazione superiore rispetto alle radici. D'altra parte, micronutrienti come Zn e Fe sono preferenzialmente accumulati nelle radici. La concentrazione dell'elemento cadmio non essenziale è risultato hi gher in radici rispetto ai germogli.
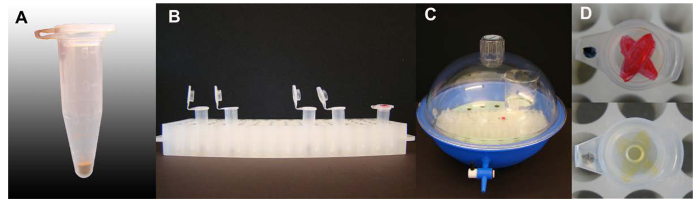
Figura 1. Vapor-fase di sterilizzazione dei semi di Arabidopsis. (A) Quantità di semi di Arabidopsis per 1,5 ml provette da centrifuga. (B) Tubi contenenti semi con tappi aperti nel supporto cremagliera tubo pronto per la sterilizzazione, un tubo con un inchiostro marcata sul tappo è incluso. (C) Sterilizzazione allestita all'interno di un essiccatore, coperchio e valvola chiusa. (D) L'inchiostro marchio sul coperchio di un tubo inserito nel processo di sterilizzazione del seme con un forte colore di inchiostro-mark, prima e dopo la sterilizzazione. Cliccate qui per vedere una versione più grande di questa figura.
file / ftp_upload / 54317 / 54317fig2.jpg "/>
Figura 2. passo Seed placcatura. (A) semi vengono posti sulla carta sterilizzati prima placcatura. è anche necessario un stuzzicadenti sterilizzato per questo passo. (B) leggermente bagnare l'estremità dello stuzzicadenti con i media o acqua sul lato della piastra supporto. (C) I semi vengono spostati a ¼ piastre MS. (D) Una densità ideale di semi è ≈1 seme / cm 2. Cliccate qui per vedere una versione più grande di questa figura.
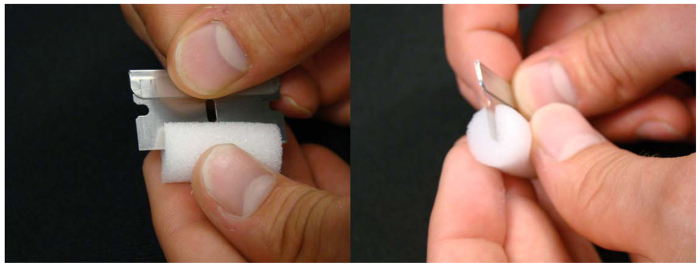
Figura 3. spina Schiuma utilizzato per contenere piantine nella soluzione nutritiva. Un'incisione sulla metà del tappo tubo di schiuma aiuta tenendo la piantina durante trapianto da piastre per coltura idroponica.Clicca qui per vedere una versione più grande di questa figura.

Figura 4. Schiuma preparazione bordo. (A) Controllare la dimensione del bordo della gomma piuma modello con la dimensione del contenitore prima di preparare pannelli in schiuma in grandi quantità. Due piccole perforazioni effettuate in centro del bordo di schiuma rendono più facile da tenere e gestire la schiuma con una pinzetta. (B- C) una sonda di carotaggio viene utilizzato per creare fori sul pannello isolante. (D) Verificare il corretto montaggio tra la spina tubo schiuma e fori creati sul pannello isolante. Cliccate qui per vedere una versione più grande di questa figura.

. Figura 5. impostazione Air-pompa per l'esperimento idroponica da top-view (A) e vista laterale (B) I numeri indicano: 1 - pompa di alimentazione dell'aria; 2 - tubi in plastica che collega la pompa di aria con il sistema di valvola per controllare il flusso d'aria; 3 - il sistema di valvole; 4 e 5 - tubi in plastica che collega il sistema di valvole con pietre bolla per l'aerazione; 6 e 7 -. Pietre bolla (venduti per acquari) Clicca qui per vedere una versione più grande di questa figura.

Figura 6. Trasferimento di piantine per il sistema idroponico. (A) Utilizzare le pinzette per prendere una piantina dalla piastra di media. (B) Posizionare il roo piantinat lungo l'incisione sulla spina tubo espanso. (C) Inserire la spina tubo di schiuma nel pannello isolante. (D) A compilato impostazione bordo della gomma piuma con piantine pronte per essere immesse sul soluzione nutritiva. Clicca qui per vedere una versione più grande di questa figura.

Figura 7. Le soluzioni nutrizionali possono essere modificati per testare carenza o effetti tossici di elementi 4 settimane di età hydroponically cresciuto Arabidopsis 6 giorni dopo il trattamento. (AB) piante coltivate con 0, 7, 14, 21, 28, 35, 42, e 50 mM di Zn. Le piante coltivate a concentrazioni elevate Zn (> 42 micron) mostrano ritardo della crescita (tossicità) la crescita (carenza di nutrienti), mentre piante senza Zn aggiunto anche mostrare in ritardo rispetto alle piante coltivate con 7 micron Zn 2+. (C) Le piante coltivate in assenza (a sinistra) o la presenza di 20 micron Cd nella soluzione nutritiva (foto è stata scattata dopo 6 giorni di esposizione Cd). Esposizione al cadmio induce clorosi e riduce la crescita. Cliccate qui per vedere una versione più grande di questa figura.
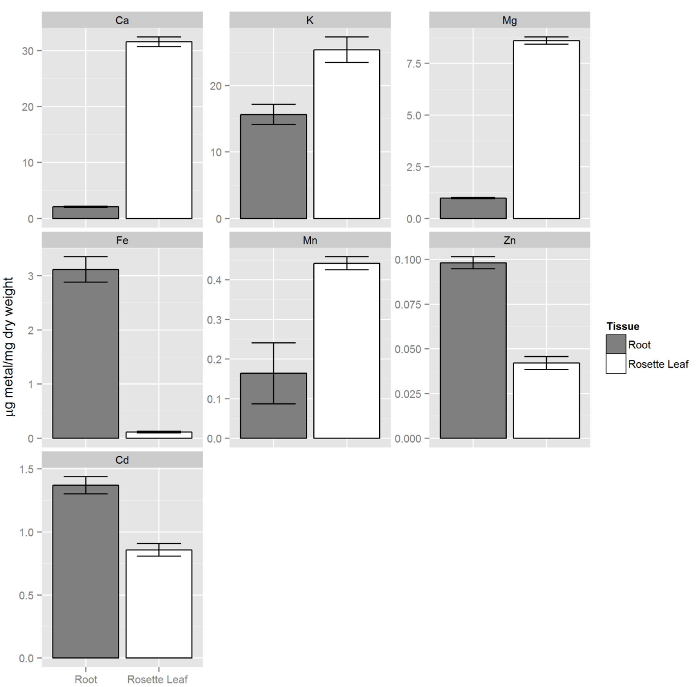
Figura 8. composizione elementare di radici e germogli da piante coltivate idroponica. Shoots contengono più macronutrienti (Ca, K, Mg) rispetto alle radici mentre i micronutrienti essenziali zinco e ferro sono più concentrati nelle radici. Analogamente l'elemento cadmio non essenziale è preferenzialmente accumulato nelle radici. Le barre di errore rappresentano gli intervalli di 95% di confidenza (n = 14, germogli e n = 9, radici)._upload / 54317 / 54317fig8large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
| Tipo di nutrienti | Sale / Reattivo | Concentrazione nella soluzione idroponica | Unità |
| macronutrienti | KNO 3 | 1.250 | mM |
| macronutrienti | KH 2 PO 4 | 0,625 | mM |
| macronutrienti | MgSO 4 | 0.500 | mM |
| macronutrienti | Ca (NO 3) 2 | 0.500 | mM |
| micronutrienti | H 3 BO 3 | 17.500 | micron |
| micronutrienti | MnCl 2 | 5.500 | micron |
| micronutrienti | ZnSO4 | 0.500 | micron |
| micronutrienti | Na 2 Moo 4 | 0,062 | micron |
| micronutrienti | NaCl 2 | 2.500 | micron |
| micronutrienti | CoCI 2 | 0.004 | micron |
| micronutrienti | FeEDTA | 12.500 | micron |
Tabella 1. concentrazione attiva di nutrienti nella soluzione idroponica.
Discussione
La salute delle piantine utilizzate per la coltura idroponica è uno dei principali fattori che contribuiscono al successo di un esperimento idroponica. Sterilizzazione degli strumenti, semi e terreni di coltura anche svolgere un ruolo importante nel ridurre il rischio di contaminazione e di fornire un buon inizio per le piante prima vengono trapiantate nel sistema idroponico. Un ambiente di lavoro con strutture come un'autoclave, cappa, fredda camera (4 ° C), e lo spazio di crescita con condizioni controllate (intensità luminosa e temperatura) è necessario per un buon sperimentale impostato.
La freschezza della soluzione nutritiva determina anche la salute delle piante e, a sua volta determina il successo di un esperimento idroponica. Poiché l'acqua evapora più velocemente sotto illuminazione diretta, la concentrazione di sali cambierà a causa di una riduzione del volume totale della soluzione; quindi è meglio cambiare la soluzione idroponica almeno due volte alla settimana. Tuttavia, se grandi contenitori profondidotato di un sistema di pompa di aria vengono utilizzati può non essere necessario sostituire la soluzione nutritiva per esperimenti che sono di breve durata. Si noti che in caso di Arabidopsis abbiamo utilizzato vasi Magenta (77 mm di larghezza x 77 mm di lunghezza x 97 mm di altezza), ma altri contenitori, più grandi possono essere utilizzati anche per ospitare impianti di maggiori dimensioni.
Per i ricercatori interessati a elementi nutritivi, esperimenti idroponici offrono un ambiente unico per testare fenotipi e le risposte della pianta a differenti disponibilità di nutrienti 17. Manipolando le concentrazioni degli elementi di interesse, i ricercatori possono impostare diversi esperimenti per testare gli effetti di sufficienza, la carenza o concentrazioni tossiche di nutrienti essenziali e non essenziali. Rispetto al sistema a base di terreno, il sistema idroponico fornisce un mezzo nutriente più omogenea agli impianti con meno rischi di malattie del terreno. Inoltre, sia radice e sparare tessuti possono essere raccolte e separate facilmenteper ulteriori analisi su tessuti vegetali specifici.
Nella sezione rappresentante, abbiamo introdotto due esempi in cui un semplice sistema idroponico è stato utilizzato per gli studi più dettagliati sulla nutrizione delle piante. Nel primo esempio, per la coltivazione di piante su un gradiente di concentrazione di zinco, siamo riusciti a illustrare il livello di controllo che può essere raggiunto sulla composizione nutriente utilizzando questo sistema idroponico. Le piante coltivate con 7 micron Zn è cresciuto molto più vigoroso rispetto a piante coltivate in 50 micron Zn, mentre le piante coltivate senza ulteriore Zn aggiunto sono stati stentata rispetto alle piante coltivate con 7 micron Zn. Questo è in parte a causa della lunghezza di tempo le piante sono state lasciate crescere in condizioni sufficienti; in precedenza la rimozione del Zn dai media rischia di indurre forti sintomi di zinco-carenza. Applicando lo stesso principio, siamo stati in grado di indurre tossicità utilizzando il metallo non essenziale, cadmio, che è noto per alterare la crescita delle piante.
Nel secondoad esempio, la composizione elementare di Col-0 radici e germogli trattati con 20 mM Cd per 72 ore è stata determinata mediante ICP-OES. Abbiamo trovato differenze in tutti i metalli rilevati tra radici e germogli. Macro-elementi sono stati trovati in concentrazioni più elevate nei germogli relativi alle radici, mentre il ferro e zinco sono stati trovati più abbondante nelle radici. Il cadmio ha seguito un modello simile a ferro e zinco, essendo più concentrata nelle radici rispetto ai germogli. Questi dati rafforzano l'idea che le foglie e le radici forniscono diverse informazioni sullo stato ionome della pianta e quindi entrambi i tessuti devono essere analizzati separatamente per capire nutrizione minerale e la composizione a livello di impianto complesso. Oltre ICP-OES diversi metodi spettroscopici, come spettroscopia di assorbimento atomico (AAS) o plasma accoppiato induttivamente spettrometria di massa (ICP-MS) può essere utilizzato anche per misurare la composizione elementare (ionome) di impianto dei tessuti 18-20.
In un hydroponic esperimento, i sintomi e fenotipi di piante che rispondono alle diverse condizioni di nutrienti rappresentano l'inizio di quello che potrebbe essere esteso in più elaborate analisi, come l'espressione genica (trascrittomica) e l'abbondanza di proteine (proteomica). Queste tecniche -omic sono le chiavi per integrare il metabolismo della pianta considerando i processi in maniera tessuto-specifica.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
This research was supported by the University of Missouri Research Board (Project CB000519) and the US National Science Foundation (IIA-1430428 to DMC). Nga T. Nguyen was supported by the Vietnam Education Foundation Training Program (Exchange visitor program No. G-3-10180). We also thank Roger Meissen (MU Bond Life Sciences Center) for his assistance and expertise during the video recording and editing sessions.
Materiali
| Name | Company | Catalog Number | Comments |
| For seed sterilization | |||
| Bleach | The Clorox Company | NA | The regular bleach www.cloroxprofessional.com |
| Hydrochloric acid | Fisher Scientific | A144-500 | |
| Desiccator body | Nalgene | D2797 SIGMA | Marketed by Sigma-Aldrich |
| Desiccator plate | Nalgene | 5312-0230 | Marketed by Thermo Scientific |
| For one quarter MS medium preparation | |||
| MES | Acros Organics | 172591000 | 4-Morpholineethanesulfonic acid hydrate |
| Murashige and Skoog (MS) | Sigma-Aldrich | M0404-10L | |
| KOH | Fisher Scientific | P250-500 | |
| Phytoagar | Duchefa Biochemie | P1003.1000 | |
| Square plate | Fisher Scientific | 0875711A | Disposable Petri Dish With Grid |
| For seed plating | |||
| Filter paper | Whatman | 1004090 | |
| Toothpick | Jarden Home Brands | NA | |
| Aluminum foil | Reynolds Wrap | NA | Standard aluminum foil |
| Micropore tape | 3M Health Care | 19-898-074 | Surgical tape; Marketed by Fisher Scientific |
| For hydroponic solution preparation | |||
| KNO3 | Fisher Scientific | BP368-500 | |
| KH2PO4 | Fisher Scientific | P386-500 | |
| MgSO4 | Fisher Scientific | M63-500 | |
| Ca(NO3)2 | Acros Organics | A0314209 | |
| H3BO3 | Sigma | B9645-500G | |
| MnCl2 | Sigma-Aldrich | M7634-100G | |
| ZnSO4 | Sigma | Z0251-100G | |
| Na2MoO4 | Aldrich | 737-860-5G | |
| NaCl2 | Fisher Scientific | S271-1 | |
| CoCl | Sigma-Aldrich | 232696-5G | |
| FeEDTA | Sigma | E6760-100G | |
| “Stericup & Steritop” bottle | Milipore Corporation | SCGVU02RE | Micronutrient container www.milipore.com |
| For root wash buffer preparation | |||
| EDTA | Acros Organics | A0305456 | |
| Tris | Fisher Scientific | BP154-1 | |
| For hydroponic setup | |||
| Autoclavable foam tube plug | Jaece Industries Inc. | L800-A | Identi-Plugs fit to holes with 2R = 6-13 mm |
| Foam Board | Styrofoam Brand Dow | ESR-2142 | Thickness is 1/2 inches |
| Cork borer | Humboldt | H-9662 | Cork Borer Sets with Handles, , Plated Brass Set of 6, 3/16" to 1/2" OD Size |
| Air pump | Aqua Culture | MK-1504 | |
| Air pump | Marketed by Wal-mart Stores, Inc. | ||
| Airline tubing and aquarium bubble stones | Aqua Culture | Tubing: 928/25-S | |
| Airline tubing and aquarium bubble stones | Marketed by Wal-mart Stores, Inc. | Stone: ASC-1 | |
| Other | |||
| Ethanol | Fisher Scientific | A995-4 | Reagent Alcohol |
| Cadmium Chloride (CdCl2) | Sigma-Aldrich | 10108-64-2 | |
Riferimenti
- McDowell, S. C., et al. Elemental Concentrations in the Seed of Mutants and Natural Variants of Arabidopsis thaliana Grown under Varying Soil Conditions. PLoS ONE. 8, 1-11 (2013).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14, 69-69 (2014).
- Berezin, I., Elazar, M., Gaash, R., Avramov-Mor, M., Shaul, O. The Use of Hydroponic Growth Systems to Study the Root and Shoot Ionome of Arabidopsis thaliana. Hydroponics - A Standard Methodology for Plant Biological Researches. Asao, T. , InTech. ISBN: 978-953-51-0386-8 (2012).
- Conn, S. J., et al. Protocol: optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9, 4-4 (2013).
- Kopittke, P. M., Blamey, F. P. C., Asher, C. J., Menzies, N. W. Trace metal phytotoxicity in solution culture: a review. J. Exp. Bot. 61, 945-954 (2009).
- Gent, M. P. N. Composition of hydroponic lettuce: effect of time of day, plant size, and season. J. Sci. Food Agric. 92, 542-550 (2012).
- Gibbs, J., Turner, D. W., Armstrong, W., Darwent, M. J., Greenway, H. Response to oxygen deficiency in primary maize roots. I. Development of oxygen deficiency in the stele reduces radial solute transport to the xylem. Funct. Plant Biol. 25, 745-758 (1998).
- Zobel, R. W., Del Tredici, P., Torrey, J. G. Method for Growing Plants Aeroponically. Plant Physiol. 57, 344-346 (1976).
- Chang, D. C., Park, C. S., Kim, S. Y., Lee, Y. B. Growth and Tuberization of Hydroponically Grown Potatoes. Potato Research. 55, 69-81 (2012).
- Resh, H. M. Hydroponic Food Production : A Definitive Guidebook for the Advanced Home Gardener and the Commercial Hydroponic Grower, Seventh Edition. , CRC Press. 199-292 (2012).
- Sharma, H. K., Chawan, D. D., Daiya, K. S. Effect of different soil types on plant growth, leaf pigments and sennoside content in Cassia species. Pharmaceutisch weekblad. 2, 65-67 (1980).
- Strojny, Z., Nowak, J. S. Effect of different growing media on the growth of some bedding plants. Acta horticulturae. 19, 157-162 (2004).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 2, 87-103 (2006).
- Chemical Safety Environmental Health and Safety - University of Missouri. , University of Missouri. Available from: https://ehs.missouri.edu/ (2013).
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiol. Plant. 15, 473-497 (1962).
- Lee, D. A., Chen, A., Schroeder, J. I. ars1, an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake. Plant J. 35, 637-646 (2003).
- Pii, Y., Cesco, S., Mimmo, T. Shoot ionome to predict the synergism and antagonism between nutrients as affected by substrate and physiological status. Plant Physiol. Biochem. 94, 48-56 (2015).
- Baxter, I. Ionomics: studying the social network of mineral nutrients. Curr. Opin. Plant Biol. 12, 381-386 (2009).
- Baxter, I. Ionomics: The functional genomics of elements. Brief Funct Genomics. 9, 149-156 (2010).
- Salt, D. E. Update on plant ionomics. Plant Physiol. 136, 2451-2456 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon