Method Article
Hidroponia: um sistema versátil para estudar nutrientes de alocação e de plantas As respostas a disponibilidade de nutrientes e exposição a elementos tóxicos
Neste Artigo
Resumo
Here, we present an easy-to-follow protocol to establish a successful hydroponic system for plant nutrition studies. This protocol has been extensively tested in Arabidopsis and can easily be adapted to other plant species to study specific nutritional requirements or the effect of non-essential elements on plant growth and development.
Resumo
sistemas hidropónicos têm sido utilizados como um dos métodos padrão para a investigação de biologia planta e são também utilizados na produção comercial de várias culturas, incluindo a alface e tomate. Dentro da comunidade de pesquisa planta, numerosos sistemas hidropônicos foram concebidos para estudar as respostas das plantas a estresses bióticos e abióticos. Aqui apresentamos um protocolo hidropônico que pode ser facilmente implementado em laboratórios interessados em prosseguir estudos sobre nutrição de plantas mineral.
Este protocolo descreve o sistema hidropônico configurar em detalhe e a preparação de material vegetal de experiências bem sucedidas. A maioria dos materiais descritos neste protocolo pode ser encontrado fora empresas de fornecimento científicas, tornando a configuração para experimentos hidropônicos menos caro e conveniente.
A utilização de um sistema de crescimento hidropónico é mais vantajoso em situações em que os meios nutrientes necessitam de ser bem controlada e, quando intacta roots precisam ser colhidas para aplicações a jusante. Nós também demonstrar como as concentrações de nutrientes pode ser modificado para induzir respostas das plantas de ambos os nutrientes essenciais e não essenciais elementos tóxicos.
Introdução
As plantas estão entre os poucos organismos que podem sintetizar todos os metabólitos necessários de íons inorgânicos, água e CO2, utilizando a energia captada do sol 1. Hidroponia é um método de crescimento de plantas que tira proveito deste facto, fornecendo todos os nutrientes, na sua forma inorgânica, numa solução líquida, com ou sem meios sólidos. Sistemas hidropônicos têm sido amplamente utilizados por cientistas para explorar necessidades de nutrientes e também a toxicidade de alguns elementos em Arabidopsis e outras espécies de plantas 2-5. Por exemplo, Berezin et al. 3, Conn et al. 4, e Alatorre-Cobos et al. 2 utilizadas sistemas hidropônicos e várias espécies de plantas, incluindo tomate e tabaco, para gerar biomassa vegetal suficiente para a análise mineral 2-4. As aplicações industriais de hidroponia também foram desenvolvidos para as culturas, tais como tomate e alface 6. Aqui, outline o uso de hidroponia no contexto de pesquisa, possíveis variações nos métodos disponíveis, e, finalmente, apresentar um sistema que pode ser facilmente escaláveis e útil para laboratórios de pesquisa interessados em estudar a nutrição das plantas mineral.
Sistemas hidropônicos permitir a fácil separação do tecido da raiz e um controlo preciso da disponibilidade de nutrientes
Hidroponia oferece várias vantagens em relação aos sistemas à base de solo. Quando removido do solo, tecido de raiz é muitas vezes mecanicamente cortado, causando a perda de tecido ou danos. Isto é particularmente verdadeiro para estruturas de raiz finos, tais como raízes laterais e pêlos radiculares. sistemas hidropônicos que não utilizam uma mídia de partículas inertes permitem uma separação menos invasiva de raízes e parte aérea tecidos.
Em sistemas do solo, as alterações de nutrientes de biodisponibilidade em toda a matriz do solo como nutrientes se ligam às partículas do solo, criando micro-ambientes dentro do solo. este heterogeneity poderia adicionar um nível extra de complexidade em experimentos que necessitam de um controle preciso sobre a concentração externa de nutrientes ou outras moléculas. Em contraste, a solução hidropónica é homogénea e podem ser facilmente substituídas em todo o decorrer da experiência.
Variantes de sistemas hidropônicos
Todas as culturas hidropónicas contar com uma solução nutritiva para fornecer elementos essenciais para a planta. Além dos nutrientes, as raízes também precisa de um fornecimento constante de oxigênio. Quando as raízes se tornar anóxica eles são incapazes de assumir e metabolitos de transporte para o resto do corpo da planta 7. sistemas hidropônicos podem ser classificados com base em como eles entregar oxigênio e outros nutrientes para as raízes: fornecimento de oxigênio saturando a solução com o ar (hidroponia clássicas), por não submergir as raízes em todos os momentos, ou permitindo que as raízes de ser completamente expostos a o ar (aeroponics) 8. Em hidroponia,solução nutritiva pode ser saturada com ar antes da sua utilização e mudado com frequência, ou o ar pode ser continuamente fornecido na solução ao longo do ciclo de vida da planta 9. Em alternativa, as plantas podem também ser cultivadas em meios inerte (por exemplo, peletes, lã de rocha, vermiculite, argila ou) e submetidos a ciclos molhada e seca por gotejamento de uma solução através dos meios de comunicação ou periodicamente, submergindo o substrato na solução nutritiva 10. Em aeroponics, as raízes são pulverizadas com a solução de nutrientes para prevenir a dessecação.
Desvantagens dos sistemas hidropônicos
Embora culturas hidropónicas oferecer vantagens claras sobre sistemas baseados em solo, existem algumas considerações que devem ser reconhecidos na interpretação dos dados. Por exemplo, sistemas hidropónicos expor plantas a condições que podem ser consideradas como não-fisiológico. Portanto, fenótipos ou respostas das plantas detectados utilizando sistemas hidropónicos podem variar em magnitude wheN plantas são cultivadas em sistemas alternativos (por exemplo, solos ou o suporte à base de agar). Estas considerações não são exclusivos para sistemas hidropônicos; respostas diferenciais pode também ser observado se as plantas são cultivadas em diferentes tipos de solo 11,12.
O protocolo a seguir fornece instruções passo-a-passo sobre como configurar um sistema hidropônico em um laboratório. Este protocolo foi optimizado para Arabidopsis thaliana (Arabidopsis); no entanto, semelhantes ou, em alguns casos passos idênticos podem ser utilizados para cultivar outras espécies.
Protocolo
1. Viveiro de Mudas
- Em fase de vapor de esterilização de sementes de Arabidopsis
- Despeje sementes (40-50 mg) em 1,5 ml tubos de centrífuga. (Ver Figura 1 para o volume de sementes adequada, ~ 50 ul). Rotular cada tubo com lápis (tinta pode desaparecer durante a esterilização). Coloque cada tubo rotulado, tampão aberto, em um secador 13.
- Coloque o secador em uma coifa ativo e fechar a válvula do secador.
- Alíquota de 100 ml de água sanitária (NaClO 6,15%) para um copo de 250 ml e, em seguida, colocá-lo no exsicador.
- Rapidamente adicionar 3 ml de ácido clorídrico 12 M para o branqueamento utilizando uma pipeta de transferência. Rapidamente fechar a tampa do exsicador medida que a reacção prossegue rapidamente. Permitir que a esterilização prosseguir durante 4 h (a marcação de um tubo de tinta com a tinta e vendo desaparecer ajuda a visualizar que uma quantidade suficiente de gás de cloro foi gerado).
CUIDADO: O gás de cloro é tóxico; manusearseus resíduos com precauções de segurança extra em um exaustor funcional. Contacte as autoridades locais ou visite a página Web da Saúde Ambiental e Segurança - University of Missouri (ESH-MU) 14 para a segurança química e orientações para a utilização de um exaustor: https://ehs.missouri.edu/chem/. - Quinze minutos antes da esterilização está completa (3,75 horas), ligue uma capela de fluxo laminar e limpar a superfície com etanol 70%.
- Após 4 h de esterilização abrir a válvula, retirar a tampa momentaneamente do exsicador no interior do exaustor de fumos, remover a lixívia, e eliminá-lo de acordo com procedimentos institucionais. Esta etapa irá liberar uma grande parte dos fumos de cloro. Selar a câmara de esterilização e trazê-lo para a capela de fluxo laminar. Abra a tampa amplamente e arejar as sementes esterilizadas por cerca de 40 min. Após este tempo, usar as sementes imediatamente ou armazenar em local seco.
Nota: em fase de vapor de esterilização de sementes é recomendada, mas outros métodos de such lavagens como alternativas com etanol, água sanitária e água, conforme descrito na Alatorre-Cobos et al. 2 são igualmente eficientes.
- Meios de cultura para a germinação das sementes
Nota: O meio de cultura preparado neste passo é de ¼ de Murashige e Skoog (MS) com 15 vitaminas.- Adicionar 450 ml de água desionizada (água Dl), 0,55 g de meios MS mais vitaminas, MES 0,3 g de hidrato do ácido (4-morpholineethanesulfonic), e uma barra de agitação magnética numa proveta de vidro de 1 L.
- Dissolver e ajustar o pH para 5,7 utilizando NaOH e, em seguida, adicionar 3,5 g phytoagar. Mantenha a agitar a solução durante mais 5 minutos.
- Despeje a solução inteira em um cilindro graduado e adicionar DI água até 500 ml. Autoclave esta solução a 500 ml, com a barra de agitação magnética no interior, usando um frasco de 1 L autoclavável.
- Depois a solução foi autoclavada, agita-se a solução para 7-10 min, utilizando o agitador magnético na garrafa.
- Depois que a mídia tenha arrefecido50-60 ° C, despeje a mídia em placas em condições estéreis e deixá-lo solidificar. As placas podem ser armazenadas para utilização posterior em quarto frio a.
- chapeamento de sementes
- Ligue o exaustor de fluxo laminar 15 min antes de usar e limpar a superfície com etanol a 70%. Os seguintes itens são necessários: sementes estéreis, papel de filtro, palitos, fita micropore e placas de ¼ de MS.
- Coloque as sementes estéreis num papel de filtro estéril. Ligeiramente molhada uma extremidade de um palito estéril (com água estéril ou picando a mídia ¼ de MS). Utilize este fim hidratada para escolher as sementes do papel de filtro e, em seguida, colocá-los para a superfície da mídia.
- Espalhe as sementes em toda a placa com uma densidade de cerca de uma semente por cm 2 (Figura 2). Em seguida, use fita micropore para manter a tampa placa anexado ao corpo da placa. Este tipo de fita ajuda a evitar a contaminação, permitindo a troca gasosa entre o ar e o microclima insidÊ O prato.
- Antes de germinação, sementes estratificar por manter as placas de dois dias em câmara fria coberta da luz.
- Após a estratificação, coloque as sementes em câmara de crescimento ou em um local com condições óptimas de crescimento (23 ° C, 16 horas de luz / 8 h escuro e 60% de humidade relativa para Arabidopsis). Mudas estará pronto para hidroponia 10-12 dias após a germinação.
Nota: Durante a germinação pode haver condensação significativa sob a tampa da placa, para impedir o afogamento, o excesso de água deve ser descartado em condições estéreis numa câmara de fluxo laminar.
2. processo de instalação e Transplante hidropónica
- solução hidropônica
Observação: Como mencionado na introdução, as plantas podem ter requisitos nutricionais específicos de Arabidopsis foi cultivada com sucesso com a solução nutritiva mostrados na Tabela 1 16 Dependendo dos fornecedores, o..sais enumerados aqui podem ter um conteúdo de água diferente (hidratado) e usando estas alternativas não afecta as propriedades da solução de nutrientes, desde que a molaridade é mantida constante.- Preparar as soluções de estoque de cada um dos macronutrientes em frascos diferentes (Tabela 1) e os micronutrientes, com excepção de Fe-EDTA em um frasco estéril (esterilizar por filtração utilizando membranas de 0,22 um). Sempre adicionar Fe-EDTA, finalmente, para misturar a solução. Prepara-se uma solução de nutrientes 10x antes da experiência, mas autoclave e armazenar a 4 ° C. Usar ou alterar os nutrientes somente quando a solução nutritiva atingiu a temperatura ambiente.
- transplante
- Prepare o suporte de plantas e recipientes hidropônico
- Realizar uma incisão na espuma, que corre ao longo do seu comprimento com uma lâmina de barbear (ver Figura 3). Prepare uma ficha por planta.
- plugues de tubo de espuma líquido-autoclave embebido em água DI.
- Cortar o painel de espuma em placas menores, certificando-se de que a largura e comprimento de placas de espuma são 0,5-1,0 cm menor do que o tamanho do recipiente (ver Figura 4).
- Use um furador de cortiça para criar furos na placa de espuma. A densidade das plantas devem ser distribuídos uniformemente, de preferência uma planta por 10 cm 2. Esta densidade irá manter as plantas nitidamente separadas umas das outras; densidades mais altas, porém, são possíveis e não impedirá o sucesso dos experimentos. Certifique-se o tamanho dos orifícios corresponde ao tamanho dos tampões (ver Figura 4).
- Encha os recipientes com solução nutritiva. Certifique-se de que a profundidade da solução é suficiente para o desenvolvimento das raízes (pelo menos, 5 cm). Em seguida, coloque cuidadosamente as placas de espuma na superfície da solução.
- Configure o sistema de bomba de ar para fornecer oxigênio para a solução (ver Figura 5).
Nota: Preencha o recipiente hidropônico com solução nutritiva a sammudas e dia estão a ser transplantado. Cobrir os lados do recipiente de luz vai ajudar a evitar o crescimento de algas.
- Transferência de plântulas a partir de placas de sistema hidropônico
- Use pequenas pinças para puxar delicadamente cada muda para fora da placa de médio e deitou a raiz ao longo da incisão da tampa do tubo de espuma. Cuidadosamente conecte o tubo de espuma segurando a muda para a placa de espuma, em seguida, colocar a placa de volta ao recipiente hidropônico. Ver Figura 6 para a manipulação apropriada.
- Prepare o suporte de plantas e recipientes hidropônico
3. Os experimentos hidropônicos
- Substituição da solução de nutrientes e manipulação
- Substituição solução nutritiva
- Para substituir a solução nutritiva, prepare solução hidropônica fresco como descrito no passo 2.1. Remova a placa de espuma contendo plantas do recipiente hidropônico e colocá-lo em um recipiente temporária preenchida comágua ou solução hidropônica.
- Descartar a solução antiga, lavar o recipiente brevemente três vezes com água DI. Adicionar a solução hidropônica recém-preparados para este recipiente e coloque delicadamente a placa de espuma com as plantas de volta para dentro do recipiente hidropônico. Substitua a solução hidropônica duas vezes por semana.
- Alterar a composição de nutrientes da solução hidropônica
- Ajustar a composição da solução hidropónica mostrado na Tabela 1 para modificar a concentração final de um elemento de interesse. Por exemplo, para induzir a deficiência de ferro (Fe), modificar a solução nutritiva para diminuir a concentração de Fe-EDTA. Incluem um conjunto de plantas de controlo cultivadas em cheio (ou repleta) hidropônico solução, sem qualquer modificação, para comparação.
- Para manipular a solução nutritiva com um elemento tóxico, primeiro preparar uma solução estoque independente do elemento tóxico desejado, de preferência 1.000 vezes concentrado. Use umpipeta para cravar a solução nutritiva com o elemento tóxico na concentração final desejada utilizando o material de 1.000x concentrada.
- Por exemplo, a fim de tornar 3 L de solução nutritiva contendo 20 uM de cádmio, preparar uma 2 estoque 0,5 M CdCl, e adicionar 120 ul de estoque a 2 0,5 M CdCl para a solução nutritiva 3 G. Incluir um conjunto de plantas cultivadas em hidroponia sem CdCl2 controlo para comparação.
CUIDADO: Tóxico elementos como cádmio, arsênico e chumbo são muito perigosas para a saúde humana e para o ambiente. Entre em contato com as autoridades locais ou visite a página Web do EHS-MU (https://ehs.missouri.edu/train/chemical.html) 14 para orientações de segurança ambientais e de saúde anteriores à realização de experiências.
- Substituição solução nutritiva
- Esterilização de instrumentos para experiências seguintes
- Como quase todo o material utilizado para preparar a hidropónico definido acima pode serreutilizados, limpar as diferentes partes com água sanitária diluída (NaClO 0,6%).
- Depois de enxaguar com água sanitária, lavar todos os materiais cuidadosamente com água DI. Manter os recipientes, placas de espuma, e pedras bolha aquário em um lugar seco para uso futuro. plugs de espuma estão prontos para reutilização depois de remover as raízes e ser autoclavado.
Resultados
Nesta secção, os resultados de dois tipos de experiências, utilizando o sistema de hidroponia aqui descrito, são apresentados. Na primeira experiência, a solução de nutrientes foi modificada para obter diferentes concentrações de zinco. Nós também modificado na solução nutritiva pela adição de concentrações não letais de o elemento de cádmio tóxicas (Figura 7). No segundo experimento, usamos com plasma indutivamente acoplado a espectrometria de emissão óptica (ICP-OES) 1 para medir a composição elementar de raízes e folhas de plantas cultivadas na solução contendo cádmio hidropônico (Figura 8). Esta experiência ilustra as vantagens de se obter separadamente raízes e folhas.
experimento 1
Mudas de Arabidopsis (Col-0) foram cultivadas em sistema hidropônico descrito no protocol passos 1 e 2. As plantas foram deixadas crescer durante um total de 3 semanas antes de serem tratadas com diferentes concentrações de zinco (Figura 7A-B) ou uma concentração subletal de cádmio (Figura 7C). Seis dias após o tratamento, as plantas cultivadas em altas concentrações de zinco (> 42 mm) apresentaram atraso de crescimento devido ao Zn toxicidade, enquanto que as plantas sem zinco extra também acrescentou mostram retardo de crescimento em comparação com as plantas crescidas com 7 mM Zn 2+. Figura 7 mostra também o de redução no crescimento da parte aérea, o crescimento da raiz e da folha chlorotic sintomas típicos de plantas expostos ao cádmio (Figura 7C).
experiência 2
Col-0 plantas foram cultivadas tal como descrito nas etapas 1 e 2. Depois de duas semanas, a solução não modificado (repleto) foi substituído com 80 ml de solução nutritiva contendo 20 ^ M de Cd. Depois de 72 horass, tecidos da raiz foram lavados através da transferência de toda a placa de espuma com as plantas para um novo vaso contendo 80 ml de Tris 20 mM (pH 8,0) e EDTA 5 mM. Esta solução irá remover os metais pesados ligados à superfície da raiz. As plantas foram incubadas na solução contendo EDTA sobre um agitador rotativo, durante 5 minutos. solução de EDTA foi então substituído por 80 ml de água desionizada e plantas foram incubadas no agitador rotativo durante mais 5 minutos. Este passo de enxaguamento com água Dl foi repetido duas vezes. Depois de se enxaguar as plantas com água DI, folhas e raízes tecidos foram colhidos de forma independente e processados por ICP-OES 1. A Figura 8 mostra que a composição elementar das folhas é diferente de raízes, onde macronutrientes (Ca, K, e Mg) em tecido de folha estão presentes em maior concentração em comparação com raízes. Por outro lado, os micronutrientes tais como Zn e Fe são preferencialmente acumulado nas raízes. A concentração do elemento de cádmio não essencial foi encontrado para ser oi gher em raízes comparado a tiros.
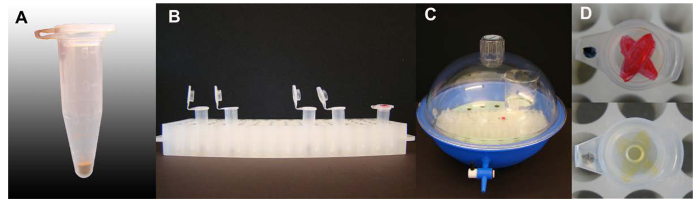
Figura 1. esterilização em fase de vapor de sementes de Arabidopsis. (A) Quantidade de sementes de Arabidopsis por 1,5 ml tubos de centrífuga. (B) Os tubos contendo sementes com tampões abertos no suporte cremalheira do tubo pronto para esterilização, um tubo com uma na tampa marcados de tinta está incluído. (C) Esterilização criado dentro de um secador, tampa e válvula fechada. (D) A tinta à marca na tampa de um tubo incluído no processo de esterilização de sementes com uma forte cor de tinta de marca de antes e depois da esterilização. Por favor clique aqui para ver uma versão maior desta figura.
files / ftp_upload / 54317 / 54317fig2.jpg "/>
Figura 2. etapa chapeamento Semente. Sementes (A) são colocados no papel esterilizados antes do plaqueamento. Um palito esterilizado também é necessário para este passo. (B) ligeiramente molhado que o fim do palito com os meios de comunicação ou de água sobre o lado da placa de meio. (C) As sementes são movidos a ¼ placas de MS. (D) Uma densidade ideal de sementes é ≈1 semente / cm 2. Por favor clique aqui para ver uma versão maior desta figura.
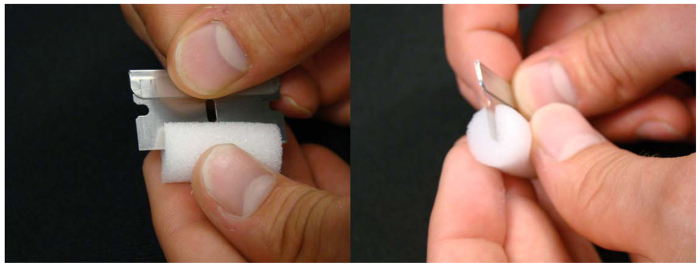
Figura 3. tampão de espuma usada para manter mudas em solução nutritiva. Uma incisão na metade da tampa do tubo de espuma ajuda a segurar o mudas durante o transplante a partir de placas de hidroponia.Por favor clique aqui para ver uma versão maior desta figura.

Figura 4. preparação placa de espuma. (A) Verifique o tamanho da placa de espuma modelo com o tamanho do recipiente antes de preparar placas de espuma em grandes quantidades. Duas pequenas perfurações feitas no centro da placa de espuma torná-lo é mais fácil de segurar e manusear a espuma usando uma pinça. (B- C) uma sonda é usado para criar furos na placa de espuma. (D) Verifique o encaixe adequado entre a tampa do tubo de espuma e buracos criados na placa de espuma. Por favor clique aqui para ver uma versão maior desta figura.

. Figura configuração 5. Ar-bomba para experimento hidropônico de top-view (A) e de visão lateral (B) Os números indicam: 1 - air fornecimento de bomba; 2 - tubos de plástico que liga a bomba de ar com o sistema de válvula para controlar o fluxo de ar; 3 - do sistema de válvula; 4 e 5 - tubos de plástico que liga o sistema de válvula com pedras de arejamento de bolha por; 6 e 7 -. Pedras bolha (vendidos para tanques de peixes) Por favor clique aqui para ver uma versão maior desta figura.

Figura 6. Transferência de mudas para o sistema hidropônico. (A) Use uma pinça para tirar uma muda para fora da placa médio. (B) Coloque o roo mudast ao longo da incisão na tampa do tubo de espuma. (C) Introduza a ficha do tubo de espuma na placa de espuma. (D) A preenchido definição placa de espuma com mudas prontas para ser colocado na solução nutritiva. Por favor clique aqui para ver uma versão maior desta figura.

Figura 7. As soluções de nutrientes pode ser modificado para testar a deficiência ou efeitos tóxicos dos elementos hidroponicamente 4 semanas de idade, cultivada Arabidopsis 6 dias após o tratamento:. Plantas cultivadas (AB) com 0, 7, 14, 21, 28, 35, 42, e 50 uM de Zn. As plantas cultivadas em altas concentrações de Zn (> 42 uM) mostram crescimento retardado (toxicidade) Crescimento (deficiência de nutrientes), enquanto plantas sem Zn também acrescentou mostram atrasado em comparação com as plantas cultivadas com 7 uM de Zn 2+. (C) Plantas cultivadas na ausência (à esquerda) ou na presença de 20 mM Cd na solução nutritiva (foto foi tirada após 6 dias de exposição Cd). A exposição ao cádmio induz clorose e reduz o crescimento. Por favor clique aqui para ver uma versão maior desta figura.
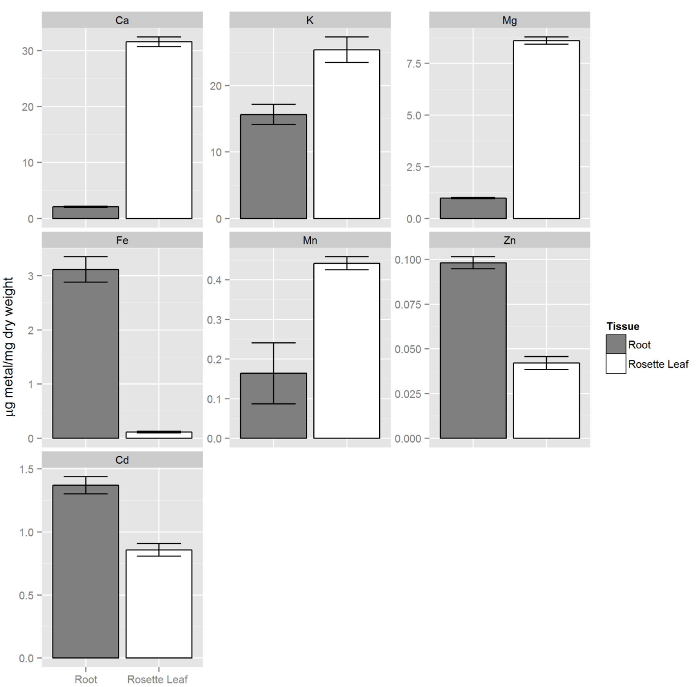
Figura 8. composição elementar de raízes e parte aérea das plantas em cultivo hidropônico. Shoots contêm mais macronutrientes (Ca, K, Mg) em comparação com raízes enquanto os micronutrientes essenciais zinco e ferro são mais concentrados nas raízes. Da mesma forma o elemento de cádmio não essencial é preferencialmente acumulado nas raízes. As barras de erro representam os intervalos de confiança de 95% (n = 14, brotos e n = 9, raízes)._upload / 54317 / 54317fig8large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
| Tipo de nutriente | Sal / Reagente | Concentração na solução hidropônica | Unidade |
| macronutrientes | KNO 3 | 1.250 | milímetros |
| macronutrientes | KH 2 PO 4 | 0,625 | milímetros |
| macronutrientes | MgSO4 | 0,500 | milímetros |
| macronutrientes | Ca (NO 3) 2 | 0,500 | milímetros |
| Micro nutriente | H 3 BO 3 | 17.500 | ? M |
| Micro nutriente | MnCl2 | 5.500 | ? M |
| Micro nutriente | ZnSO4 | 0,500 | ? M |
| Micro nutriente | Na 2 MoO 4 | 0,062 | ? M |
| Micro nutriente | NaCl 2 | 2.500 | ? M |
| Micro nutriente | CoCl2 | 0,004 | ? M |
| Micro nutriente | FeEDTA | 12.500 | ? M |
Tabela 1. concentração eficaz de nutrientes na solução hidropônica.
Discussão
A saúde das mudas utilizadas para hidroponia é um dos principais factores que contribuem para o sucesso de uma experiência hidropônico. A esterilização de instrumentos, sementes, e meios de cultura também desempenham um papel importante na redução do risco de contaminação e proporcionar um bom começo para as plantas antes de serem transplantados para o sistema de hidroponia. Um ambiente de trabalho com equipamentos, tais como uma autoclave, exaustor, frio quartos (4 ° C), e no espaço de crescimento com condições controladas (intensidade de luz e temperatura) é necessário para uma boa montagem experimental.
A frescura da solução nutritiva também determina a saúde das plantas e, por sua vez determina o sucesso de uma experiência hidropônico. Como a água evapora mais rápido sob iluminação direta, a concentração de sais vai mudar devido a uma redução do volume total de solução; portanto, é melhor mudar de solução hidropônica, pelo menos, duas vezes por semana. No entanto, se recipientes grandes, profundasequipado com um sistema de bomba de ar são usados pode não ser necessário para substituir a solução de nutrientes para as experiências que são de curta duração. Note-se que no caso de Arabidopsis foi utilizado vasos Magenta (77 milímetros de largura x 77 mm de comprimento x 97 mm de altura), mas outros recipientes maiores podem também ser utilizados para acomodar instalações de maiores dimensões.
Para os pesquisadores interessados em nutrientes para as plantas, os experimentos hidropônicos proporcionam um cenário único para testar fenótipos de plantas e respostas a diferentes disponibilidade de nutrientes 17. Ao manipular as concentrações dos elementos de interesse, os investigadores podem configurar diferentes experiências para testar os efeitos da suficiência, deficiência, ou concentrações tóxicas de nutrientes essenciais e não essenciais. Em comparação com o sistema à base de solo, o sistema de hidroponia fornece um meio nutriente mais homogénea para as plantas com menos risco de doenças com origem no solo. Além disso, tanto raízes e parte aérea tecidos podem ser colhidas e separadas facilmentepara mais análises sobre tecidos vegetais específicos.
Na seção representativa, introduzimos dois exemplos em que um sistema hidropônico simples foi usado para estudos mais detalhados sobre a nutrição das plantas. No primeiro exemplo, por cultivo de plantas em um gradiente de concentração de zinco, que eram capazes de ilustrar o nível de controlo que pode ser conseguida sobre a composição nutriente utilizando este sistema de hidroponia. As plantas cultivadas com 7 mM Zn cresceu muito mais vigorosamente em comparação com as plantas cultivadas em 50 mM de Zn, enquanto que as plantas cultivadas sem extras Zn adicionado foram atrofiado em comparação com as plantas crescidas com 7 mM Zn. Este foi, em parte, devido ao período de tempo as plantas foram deixadas crescer sob condições suficientes; remoção anterior do Zn dos meios de comunicação é susceptível de induzir sintomas de deficiência de zinco mais fortes. Aplicando o mesmo princípio, fomos capazes de induzir toxicidade usando o metal não-essencial, o cádmio, o que é conhecido para afectar o crescimento das plantas.
No segundoexemplo, a composição elementar de Col-0 raízes e brotos tratados com 20 mM Cd durante 72 horas foi determinada por ICP-OES. Foram encontradas diferenças em todos os metais detectados entre raízes e parte aérea. Os macro-elementos foram encontrados em concentrações mais elevadas nos rebentos em relação às raízes, enquanto o ferro e zinco foram encontrados mais abundante nas raízes. Cádmio seguiu um padrão semelhante ao ferro e zinco, sendo mais concentrada nas raízes em comparação com brotos. Esses dados reforçam a ideia de que folhas e raízes fornecem informações diferentes sobre o status ionoma da planta e, portanto, ambos os tecidos precisam ser analisados separadamente para entender a nutrição mineral e composição para todo o nível da planta. Além ICP-OES vários métodos espectroscópicos tais como Atomic Absorption Spectroscopy (EAA) ou de plasma indutivamente acoplado espectrometria de massa (ICP-MS) também pode ser utilizado para medir a composição elementar (ionoma) de tecidos vegetais 18-20.
Numa hydroponic experimento, os sintomas e os fenótipos de plantas respondem a diferentes condições nutricionais representam o início do que poderia ser estendido em mais elaboradas análises como a expressão do gene (transcriptomics) e abundância de proteínas (proteômica). Estas técnicas -omic são chaves para integrar o metabolismo das plantas, considerando os processos de uma forma específica de tecido.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
This research was supported by the University of Missouri Research Board (Project CB000519) and the US National Science Foundation (IIA-1430428 to DMC). Nga T. Nguyen was supported by the Vietnam Education Foundation Training Program (Exchange visitor program No. G-3-10180). We also thank Roger Meissen (MU Bond Life Sciences Center) for his assistance and expertise during the video recording and editing sessions.
Materiais
| Name | Company | Catalog Number | Comments |
| For seed sterilization | |||
| Bleach | The Clorox Company | NA | The regular bleach www.cloroxprofessional.com |
| Hydrochloric acid | Fisher Scientific | A144-500 | |
| Desiccator body | Nalgene | D2797 SIGMA | Marketed by Sigma-Aldrich |
| Desiccator plate | Nalgene | 5312-0230 | Marketed by Thermo Scientific |
| For one quarter MS medium preparation | |||
| MES | Acros Organics | 172591000 | 4-Morpholineethanesulfonic acid hydrate |
| Murashige and Skoog (MS) | Sigma-Aldrich | M0404-10L | |
| KOH | Fisher Scientific | P250-500 | |
| Phytoagar | Duchefa Biochemie | P1003.1000 | |
| Square plate | Fisher Scientific | 0875711A | Disposable Petri Dish With Grid |
| For seed plating | |||
| Filter paper | Whatman | 1004090 | |
| Toothpick | Jarden Home Brands | NA | |
| Aluminum foil | Reynolds Wrap | NA | Standard aluminum foil |
| Micropore tape | 3M Health Care | 19-898-074 | Surgical tape; Marketed by Fisher Scientific |
| For hydroponic solution preparation | |||
| KNO3 | Fisher Scientific | BP368-500 | |
| KH2PO4 | Fisher Scientific | P386-500 | |
| MgSO4 | Fisher Scientific | M63-500 | |
| Ca(NO3)2 | Acros Organics | A0314209 | |
| H3BO3 | Sigma | B9645-500G | |
| MnCl2 | Sigma-Aldrich | M7634-100G | |
| ZnSO4 | Sigma | Z0251-100G | |
| Na2MoO4 | Aldrich | 737-860-5G | |
| NaCl2 | Fisher Scientific | S271-1 | |
| CoCl | Sigma-Aldrich | 232696-5G | |
| FeEDTA | Sigma | E6760-100G | |
| “Stericup & Steritop” bottle | Milipore Corporation | SCGVU02RE | Micronutrient container www.milipore.com |
| For root wash buffer preparation | |||
| EDTA | Acros Organics | A0305456 | |
| Tris | Fisher Scientific | BP154-1 | |
| For hydroponic setup | |||
| Autoclavable foam tube plug | Jaece Industries Inc. | L800-A | Identi-Plugs fit to holes with 2R = 6-13 mm |
| Foam Board | Styrofoam Brand Dow | ESR-2142 | Thickness is 1/2 inches |
| Cork borer | Humboldt | H-9662 | Cork Borer Sets with Handles, , Plated Brass Set of 6, 3/16" to 1/2" OD Size |
| Air pump | Aqua Culture | MK-1504 | |
| Air pump | Marketed by Wal-mart Stores, Inc. | ||
| Airline tubing and aquarium bubble stones | Aqua Culture | Tubing: 928/25-S | |
| Airline tubing and aquarium bubble stones | Marketed by Wal-mart Stores, Inc. | Stone: ASC-1 | |
| Other | |||
| Ethanol | Fisher Scientific | A995-4 | Reagent Alcohol |
| Cadmium Chloride (CdCl2) | Sigma-Aldrich | 10108-64-2 | |
Referências
- McDowell, S. C., et al. Elemental Concentrations in the Seed of Mutants and Natural Variants of Arabidopsis thaliana Grown under Varying Soil Conditions. PLoS ONE. 8, 1-11 (2013).
- Alatorre-Cobos, F., et al. An improved, low-cost, hydroponic system for growing Arabidopsis and other plant species under aseptic conditions. BMC Plant Biol. 14, 69-69 (2014).
- Berezin, I., Elazar, M., Gaash, R., Avramov-Mor, M., Shaul, O., Asao, T. The Use of Hydroponic Growth Systems to Study the Root and Shoot Ionome of Arabidopsis thaliana. Hydroponics - A Standard Methodology for Plant Biological Researches. , (2012).
- Conn, S. J., et al. Protocol: optimising hydroponic growth systems for nutritional and physiological analysis of Arabidopsis thaliana and other plants. Plant Methods. 9, 4-4 (2013).
- Kopittke, P. M., Blamey, F. P. C., Asher, C. J., Menzies, N. W. Trace metal phytotoxicity in solution culture: a review. J. Exp. Bot. 61, 945-954 (2009).
- Gent, M. P. N. Composition of hydroponic lettuce: effect of time of day, plant size, and season. J. Sci. Food Agric. 92, 542-550 (2012).
- Gibbs, J., Turner, D. W., Armstrong, W., Darwent, M. J., Greenway, H. Response to oxygen deficiency in primary maize roots. I. Development of oxygen deficiency in the stele reduces radial solute transport to the xylem. Funct. Plant Biol. 25, 745-758 (1998).
- Zobel, R. W., Del Tredici, P., Torrey, J. G. Method for Growing Plants Aeroponically. Plant Physiol. 57, 344-346 (1976).
- Chang, D. C., Park, C. S., Kim, S. Y., Lee, Y. B. Growth and Tuberization of Hydroponically Grown Potatoes. Potato Research. 55, 69-81 (2012).
- Resh, H. M. . Hydroponic Food Production : A Definitive Guidebook for the Advanced Home Gardener and the Commercial Hydroponic Grower, Seventh Edition. , 199-292 (2012).
- Sharma, H. K., Chawan, D. D., Daiya, K. S. Effect of different soil types on plant growth, leaf pigments and sennoside content in Cassia species. Pharmaceutisch weekblad. 2, 65-67 (1980).
- Strojny, Z., Nowak, J. S. Effect of different growing media on the growth of some bedding plants. Acta horticulturae. 19, 157-162 (2004).
- Bent, A. Arabidopsis thaliana floral dip transformation method. Methods Mol Biol. 2, 87-103 (2006).
- . Chemical Safety Environmental Health and Safety - University of Missouri Available from: https://ehs.missouri.edu/ (2013)
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiol. Plant. 15, 473-497 (1962).
- Lee, D. A., Chen, A., Schroeder, J. I. ars1, an Arabidopsis mutant exhibiting increased tolerance to arsenate and increased phosphate uptake. Plant J. 35, 637-646 (2003).
- Pii, Y., Cesco, S., Mimmo, T. Shoot ionome to predict the synergism and antagonism between nutrients as affected by substrate and physiological status. Plant Physiol. Biochem. 94, 48-56 (2015).
- Baxter, I. Ionomics: studying the social network of mineral nutrients. Curr. Opin. Plant Biol. 12, 381-386 (2009).
- Baxter, I. Ionomics: The functional genomics of elements. Brief Funct Genomics. 9, 149-156 (2010).
- Salt, D. E. Update on plant ionomics. Plant Physiol. 136, 2451-2456 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados