Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La síntesis de hidrogeles funcionalizado-RGD como una herramienta para aplicaciones terapéuticas
En este artículo
Resumen
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Resumen
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introducción
Los hidrogeles son redes tridimensionales formadas por polímeros reticulados hidrófilos, que son naturales o sintéticos, y caracterizado por una estructura tridimensional distintivo. Estos aparatos son cada vez más atractivo en los campos de la biomedicina de la administración de fármacos, la ingeniería de tejidos, los portadores del gen y sensores inteligentes 1,2. De hecho, su alto contenido de agua, así como sus propiedades reológicas y mecánicas los hacen candidatos adecuados para imitar microambientes de tejidos blandos y hacerlos herramientas eficaces para citoquina soluble en agua o entrega del factor de crecimiento. Uno de los más prometedores es el uso como un biomaterial inyectable que lleva células y compuestos bioactivos. Los hidrogeles pueden mejorar la supervivencia celular y destino de la célula de control de potencia colocando y entregar con precisión las señales de regulación de células madre de una manera relevante fisiológico, como se observa en in vitro e in vivo en experimentos de 3,4. La ventaja principal de esto es la posibilidadpara mantener las células inyectadas dentro de la zona de inoculación (in situ), minimizando la cantidad de células que sale de la zona y se extravasa en el torrente circulatorio, migrando por todo el cuerpo y perder el objetivo de destino 5. La estabilidad de las redes de hidrogel tridimensionales se debe a sus sitios de reticulación, formados por enlaces covalentes o fuerzas de cohesión entre las cadenas de polímero 6.
En este marco, la química selectiva ortogonal aplicado a cadenas de polímero es una herramienta versátil capaz de mejorar el rendimiento de hidrogel 7. En efecto, la modificación de polímeros con grupos químicos adecuados podría ayudar a proporcionar químico apropiado, física y las propiedades mecánicas para mejorar la viabilidad celular y su uso en la formación de tejido. De la misma manera, entre las técnicas para cargar las células o factores de crecimiento dentro de la matriz de gel, el uso del péptido RGD permite mejoras en la adhesión celular y la supervivencia. RGD es un tripéptido compuestode arginina, glicina y ácido aspártico, que es con mucho el más eficaz y a menudo empleado tripéptido debido a su capacidad para hacer frente a más de un receptor de adhesión celular y su impacto biológico en anclaje de células, el comportamiento y la supervivencia 8,9. En este trabajo, la síntesis de hidrogeles RGD-funcionalizado se estudió con el objetivo de diseñar redes caracterizadas por propiedades bioquímicas suficientes para un microambiente celular hospitalario.
El uso de radiación de microondas en la síntesis de hidrogel ofrece un procedimiento sencillo para minimizar las reacciones secundarias y obtener mayores velocidades de reacción y los rendimientos en un periodo de tiempo más corto en comparación con los procesos térmicos convencionales 10. Este método no requiere etapas de purificación y los rendimientos de hidrogeles estériles debido a las interacciones de los polímeros y la ausencia de disolvente orgánico en el sistema de reacción 11. Por lo tanto, se asegura un alto porcentaje de RGD vinculados a la red polimérica, porque no modespecifica- se requiere que los grupos químicos de polímeros que intervienen en la formación de gel. Los grupos carboxilo, de PAA y carbómero, y grupos hidroxilo, de PEG y de agarosa, dan lugar a la estructura tridimensional de hidrogel a través de una reacción de policondensación. Los polímeros mencionados se utilizan para la síntesis de hidrogeles en los tratamientos de reparación de lesiones de médula espinal 12. Estos dispositivos, como se informó en trabajos anteriores 13,14, muestran una alta biocompatibilidad, así como propiedades mecánicas y fisicoquímicas que se asemejan a los de muchos tejidos vivos y en la naturaleza tixotrópica. Por otra parte, permanecen localizados in situ, en la zona de la inyección.
En este trabajo, los grupos carboxilo de PAA se modifican con un resto alquino (Figura 1), y un compuesto RGD-azida se sintetiza la explotación de la reactividad del grupo terminal tripéptido -NH 2 con un compuesto químico preparado con la estructura (CH 2) n - N 3 ( Figura 2). Posteriormente, el PAA modificado reacciona con el derivado de RGD-azida a través de CuAAC reacción clic 15-17 (Figura 3). El uso de un catalizador de cobre (I) conduce a importantes mejoras tanto en la velocidad de reacción y de la regioselectividad. La reacción CuAAC es ampliamente utilizado en la síntesis orgánica y en la ciencia de polímeros. Combina alta eficiencia y una alta tolerancia a los grupos funcionales, y no se ve afectado por el uso de disolventes orgánicos. Una alta selectividad, un tiempo de reacción rápida y sencilla un procedimiento de purificación permiten la obtención de polímeros estrella, copolímeros de bloques o cadenas de injerto restos deseados 18. Esta estrategia clic hace que sea posible modificar polímeros después de la polimerización para personalizar las propiedades físico-químicas de acuerdo con la aplicación bioquímica final. Las condiciones experimentales CuAAC son fácilmente reproducible (la reacción es insensible al agua, mientras que la oxidación de cobre se puede producir mínimamente), y la naturaleza detriazol formado asegura la estabilidad del producto. El uso de metal de cobre se puede considerar un punto crítico, debido a su potencial efecto tóxico contra las células y en el microambiente biológica, pero la diálisis se utiliza como un método de purificación para permitir la completa eliminación de residuos catalíticos. Finalmente, PAA modificada RGD se utiliza en la síntesis de hidrogel (Figura 4) y las propiedades fisicoquímicas de las redes resultantes son investigados, con el fin de comprobar la funcionalidad potencial de estos sistemas como células o fármacos portadores.
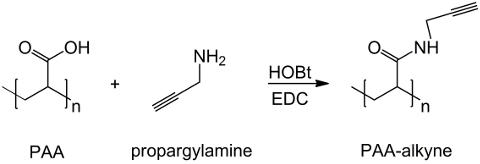
Figura 1: PAA modificó la síntesis de alquino Un esquema de funcionalización PAA con el grupo alquino;. "n" indica los monómeros con grupo carboxilo que reacciona con propargilamina. Haga clic aquí para veruna versión más grande de esta figura.

Figura 2:.. RGD-azida síntesis La síntesis de derivados de RGD-azida Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Haga clic en el Esquema de reacción de la reacción entre el derivado clic RGD-azida y alquino-PAA.. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Hidrogel syntHESIS. RGD funcionalizado procedimiento de síntesis de hidrogel. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Nota: Los productos químicos se usaron como se recibieron. Linear RGD se compra, pero se puede preparar mediante síntesis de péptidos Fmoc en fase sólida estándar de 16,19. Los disolventes son de calidad analítica. La diálisis requiere el uso de membrana con un M w de corte igual a 3.500 Da. Los compuestos sintetizados se caracterizan por espectros de 1 H NMR registrado en un espectrómetro 400 usando cloroformo MHz (CDCl3) u óxido de deuterio (D 2 O) como disolventes, y los desplazamientos químicos se informan como valores delta en partes por millón. Además, los hidrogeles se someten a análisis FT-IR utilizando la técnica de pastilla de KBr y su caracterización física implica estudios de gelificación evaluó mediante el tubo de ensayo invertido a 37 ° C.
1. Síntesis de 4-Azidobutanoyl Cloruro de 1
- Disolver 500 mg de 4-azidobutanoic ácido (3,90 mmol) en 10 ml de diclorometano y 0,5 ml de dimetilformamida.
- Se enfría la solución a 0 ° C, Utilizando un baño de hielo.
- Añadir 505 l de cloruro de oxalilo (5,85 mmol) a 5 ml de diclorometano y se añade lentamente gota a gota al sistema de reacción, mientras se agita.
- Después de 1 hora a 0 ° C utilizando un baño de hielo, vuelva a la temperatura ambiente.
- Eliminar el disolvente bajo presión reducida usando un evaporador rotatorio.
- Caracterizar el producto obtenido mediante espectroscopia 1H-RMN, disolviendo la muestra en CDCl3 16.
2. Síntesis de RGD-azida derivado de 2
- Disolver 50 mg de RGD (0,145 mmol) en 1 ml de NaOH 1 M.
- Disolver 24 mg de 1 (0,16 mmol) en 2 ml de tetrahidrofurano.
- Añadir toda la solución de RGD a la solución 1 gota a gota a 0 ° C usando un baño de hielo.
- Volver a la temperatura ambiente y se agitó durante la noche.
- Añadir 1 ml de HCl 1 M.
- Eliminar el disolvente bajo presión reducida usando un evaporador rotatorio.
- Caracterizar el OBTained producto por espectroscopia 1 H-NMR, la disolución de la muestra en D 2 O 16.
3. Modificación 3 PAA Acetileno
- Disolver 200 mg de 35% w / w solución de PAA (2,8 mmol) en 15 ml de agua destilada.
- Añadir 15,4 mg de clorhidrato de propargilamina (0,20 mmol).
- Disolver 42,8 mg de hidrato de 1-hidroxibenzotriazol (HOBt, 0.28 mmol) en 14 ml de una mezcla 1: 1 v / v de acetonitrilo: solución de agua destilada por calentamiento a 50 ° C.
- Añadir toda la solución de HOBt a la solución de PAA a temperatura ambiente.
- Añadir 53,6 mg de etildimetilaminopropilcarbodiimida (EDC, 0,28 mmol) a la mezcla de reacción.
- Utilice M HCl 1 para ajustar el pH a 5,5 y se agita el sistema de reacción durante la noche a temperatura ambiente.
- Se dializa la solución. Disolver 11,2 g de cloruro sódico en 2 L de agua destilada y a continuación, añadir 0,2 ml de 37% w / w HCl. Se dializa la solución usando una membrana con un M w de corte de 3,5 kDa.
- perform diálisis durante tres días. Cambie la solución de diálisis a diario con 2 L de agua destilada recién preparada que contenga 0,2 ml de 37% w / w HCl.
- Almacenar la solución final a -80 ° C. Liofilizar en un liofilizador de acuerdo con los protocolos del fabricante.
- Caracterizar el polímero funcionalizado por espectroscopia 1H-RMN, disolviendo la muestra en D2O 16.
4. Síntesis de PAA-RGD de polímero 4
- Disolver 78 mg de PAA modificada alquino 3 (1,083 mmol) en 10 ml de agua destilada.
- Disolver 25 mg de la RGD derivado de azida 2 (0,0722 mmol) en 5 ml de tetrahidrofurano.
- Añadir toda la solución de RGD a la solución polimérica.
- Añadir 2,2 mg de yoduro de cobre (0,0116 mmol) y 2,2 mg de ascorbato de sodio (0,0111 mmol).
- Se somete a reflujo la mezcla resultante durante la noche a 60 ° C, con agitación.
- Enfriar la mezcla a 25 ° C.
- Dialyze la solución. Disolver 11,2 g de cloruro sódico en 2 L de agua destilada y a continuación, añadir 0,2 ml de 37% w / w HCl. Se dializa la solución usando una membrana con un M w de corte de 3,5 kDa.
- Realizar la diálisis durante tres días. Cambie la solución de diálisis a diario con 2 L de agua destilada recién preparada que contenga 0,2 ml de 37% w / w HCl.
- Almacenar la solución final a -80 ° C. Liofilizar en un liofilizador de acuerdo con los protocolos del fabricante.
- Caracterizar el producto obtenido mediante espectroscopia 1H-RMN, disolviendo la muestra en D2O 16.
5. RGD-funcionalizado Hidrogel Síntesis
- Preparar la PBS. Disolver 645 mg de sal de PBS en 50 ml de agua destilada.
- Mezcla de 40 mg de carbómero y 10 mg de PAA funcionalizado 4 en 9 ml de PBS (paso 5.1), a temperatura ambiente, hasta la disolución completa (30 min).
- Añadir 400 mg de PEG a la solución y mantener la agitación durante 45 min.
- Detener la agitación y dejar que el sistema se estabilice durante 30 minutos.
- Utilice NaOH 1 N para ajustar el pH a 7,4.
- A 5 ml de la mezcla obtenida, añadir 25 mg de polvo de agarosa.
- Irradiar el sistema con radiación de microondas a 500 W hasta que hierva, durante un tiempo por lo general entre 30 segundos y 1 min, y electromagnéticamente calentar hasta 80 ° C.
- Dejar reposar la mezcla se expone a temperatura ambiente hasta que su temperatura se reduce a 50 ° C y añadir 5 ml de PBS (paso 5.1), con el fin de obtener una solución en una proporción 1: 1 volumétrica.
- Preparar 12 cilindros de acero de la placa que contiene múltiples pocillos con un diámetro de 1,1 cm.
- Tomar 500 ml de alícuotas de la solución y colocarlos a cada uno cilindros de acero.
- Deja en reposo durante 45 minutos hasta que la gelificación completa del sistema.
- Retirar los cilindros utilizando una pinza de acero inoxidable para obtener los hidrogeles.
6. La carga de herramienta terapéutica (medicamentos o células)
- Repita steps 05.01 a 05.07.
- Cuando la mezcla (ya en estado de sol) alcanza 37 ° C, añadir 5 ml de la solución que contiene la solución de fármaco o de células de cultivo deseada, con el fin de obtener un sistema final en una proporción 1: 1 volumétrica.
- Repita los pasos 5.9 a 5.12 para obtener redes poliméricas con biocompuestos físicamente atrapado dentro del gel.
7. Hidrogel Caracterización
- El análisis FT-IR
- Después de la formación de gel, en remojo uno de los hidrogeles sintetizados en 2,5 ml de agua destilada durante 24 horas.
- Retire el medio acuoso en el que se sumerge hidrogel y liofilizar con N2 líquido.
- Laminar la muestra de hidrogel de acuerdo con la técnica de pastilla de KBr.
- Añadir una espátula llena de KBr en un mortero de ágata. Tomar una pequeña cantidad de muestra de hidrogel (0,1-2% de la cantidad de KBr, o sólo lo suficiente para cubrir la punta de espátula) y se mezcla con el polvo de KBr.
- Moler la mezcla hasta que el polvo es fina y homogénea.
- Utilice el kit de pastilla de KBr para formar el pellet IR. Pulse el polvo usando una prensa de laboratorio Manual: durante 3 min a la capacidad de presión igual a 5 toneladas y luego durante 3 minutos a la capacidad de presión de 10 toneladas.
- Liberar la presión para obtener el sedimento final lo más homogénea y transparente en apariencia. Insertar el pellet en el soporte de muestra de IR y ejecutar el espectro 16.
- Estudios de gelificación
- Llene el tubo de microcentrífuga de 2 ml con 900 l de PBS y se equilibre a 37 ° C.
- Añadir 100 l de la solución de polímero preparada para formar el hidrogel y se incuba a 37 ° C.
- Invertir el tubo y observe si el gel fluye a 1, 2, 5, 10 y 20 min. Registre el tiempo en el que el gel no fluye como el tiempo de gelificación.
Access restricted. Please log in or start a trial to view this content.
Resultados
El derivado de alquino PAA se sintetiza de manera eficiente a partir de ácido poliacrílico y propargilamina, como se muestra en la Figura 1 donde n etiquetas de los monómeros cuyos grupos carboxilo reaccionar con la amina. La identidad del producto se confirmó por espectroscopía de 1 H-NMR. Figura 5 muestra el espectro de 1H-NMR de PAA modificada con triple enlace.
Access restricted. Please log in or start a trial to view this content.
Discusión
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
Agradecimientos
Los autores desean agradecer al Prof. Maurizio Masi para la discusión fructífera y la señorita Chiara Allegretti para la edición de idioma. la investigación de los autores es apoyado por Bando Giovani Ricercatori 2010 (Ministero della Salute GR-2010-2312573).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
Referencias
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados