Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La Synthèse des RGD-fonctionnalisé hydrogels comme un outil pour les applications thérapeutiques
Dans cet article
Résumé
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Résumé
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introduction
Les hydrogels sont des réseaux tridimensionnels formés par des polymères réticulés hydrophiles, qui sont naturelles ou synthétiques, et caractérisé par une structure tridimensionnelle particulière. Ces dispositifs sont de plus en plus attrayante dans les domaines biomédical de délivrance de médicaments, l' ingénierie tissulaire, les porteurs du gène et des capteurs intelligents 1,2. En effet, leur teneur élevée en eau, ainsi que leurs propriétés rhéologiques et mécaniques rendent les candidats aptes à imiter microenvironnement des tissus mous et les rendre des outils efficaces pour la cytokine soluble dans l'eau ou la livraison de facteur de croissance. Un de l'utilisation la plus prometteuse est comme un biomatériau injectable portant des cellules et des composés bioactifs. Les hydrogels peuvent améliorer la survie des cellules et de la tige de commande le destin des cellules en maintenant et délivrer précisément des signaux de régulation de cellules souches d'une manière pertinente physiologique, comme observé in vitro et dans des expériences in vivo 3,4. Le principal avantage est la possibilitéà maintenir les cellules injectées dans la zone d'inoculation (in situ), ce qui réduit la quantité de cellules qui quitte la zone extravasates et dans le torrent circulatoire, la migration de tout le corps et la perte de l'objectif visé 5. La stabilité des réseaux tridimensionnels d' hydrogel est due à ses sites de reticulation, formées par des liaisons covalentes ou des forces de cohésion entre les chaînes de polymère 6.
Dans ce cadre, la chimie sélective orthogonale appliquée aux chaînes de polymère est un outil polyvalent capable d'améliorer les performances d' hydrogel 7. En effet, la modification de polymères avec des groupes chimiques appropriés peut aider à fournir des propriétés mécaniques et chimiques appropriées, physiques et d'améliorer la viabilité des cellules et leur utilisation dans la formation des tissus. De la même façon, parmi les techniques de charger des cellules ou des facteurs de croissance dans la matrice de gel, l'utilisation du peptide RGD permet l'amélioration de l'adhérence cellulaire et la survie. RGD est un tripeptide composéde l' arginine, la glycine et l' acide aspartique, qui est de loin le plus efficace et souvent employé tripeptide en raison de sa capacité à traiter plus d'un récepteur d'adhésion cellulaire et son effet biologique sur l' ancrage des cellules, le comportement et la survie de 8,9. Dans ce travail, la synthèse des hydrogels RGD-fonctionnalisé est étudiée dans le but de concevoir des réseaux caractérisés par des propriétés biochimiques suffisantes pour un microenvironnement cellulaire hospitalier.
L'utilisation d' un rayonnement micro - ondes dans la synthèse de l' hydrogel propose une procédure simple pour minimiser les réactions secondaires et d' obtenir des taux et des rendements de réaction plus élevés dans une période de temps plus courte par rapport aux procédés thermiques classiques 10. Cette méthode ne nécessite pas d' étapes de purification et des rendements des hydrogels stériles en raison des interactions entre les polymères et l'absence de solvant organique dans le système réactionnel 11. Par conséquent, il garantit un pourcentage élevé de RGD liés au réseau polymère, car aucun modificateurfications sont nécessaires pour les groupes chimiques de polymères impliqués dans la formation de gel. Les groupes carboxyles, de l'AAP et le carbomère, et les groupes hydroxyle, de PEG et d'agarose, donnent lieu à l'hydrogel structure tridimensionnelle par une réaction de polycondensation. Les polymères mentionnés sont utilisés pour la synthèse d'hydrogels dans la moelle lésion de la moelle 12 réparation des traitements. Ces dispositifs, tel que rapporté dans les précédents travaux 13,14, montrent une biocompatibilité élevée ainsi que des propriétés mécaniques et physico - chimiques qui ressemblent à celles de nombreux tissus vivants et dans la nature thixotrope. De plus, ils restent localisés in situ, dans la zone d'injection.
Dans ce travail, des groupes carboxyle PAA sont modifiés avec un alcyne (figure 1), et un composé RGD azoture est synthétisé en exploitant la réactivité du groupe terminal tripeptidique -NH 2 avec un composé chimique préparée avec la structure (CH 2) n - N 3 ( Figure 2). Par la suite, l'AAP modifiée réagit avec le dérivé RGD-azoture par CuAAC clic réaction 15-17 (Figure 3). L'utilisation d'un cuivre (I) catalyseur conduit à d'importantes améliorations tant dans la vitesse de réaction et la régiosélectivité. La réaction CuAAC est largement utilisé dans la synthèse organique et en science polymère. Elle combine une efficacité élevée et une grande tolérance aux groupes fonctionnels, et il est affecté par l'utilisation de solvants organiques. Une sélectivité élevée, un temps de réaction rapide et une procédure de purification simple , permettent l'obtention de polymères en étoile, des copolymères séquencés ou des chaînes de greffage des fragments souhaités 18. Cette stratégie de clic permet de modifier des polymères après polymérisation pour personnaliser les propriétés physicochimiques selon l'application biochimique final. Les conditions expérimentales sont facilement reproductibles CuAAC (la réaction est insensible à l'eau, tandis que l'oxydation du cuivre peut se produire très peu), et la nature detriazole formé assure la stabilité du produit. L'utilisation du métal de cuivre peut être considéré comme un point critique en raison de ses effets toxiques potentiels sur les cellules et dans le micro-environnement biologique, mais la dialyse est utilisée comme méthode de purification pour permettre l'élimination complète des résidus catalytiques. Enfin, PAA modifié RGD est utilisé dans la synthèse de l' hydrogel (figure 4) et les propriétés physicochimiques des réseaux résultants sont étudiés, afin de vérifier la fonctionnalité potentielle de ces systèmes comme des cellules ou des médicaments porteurs.
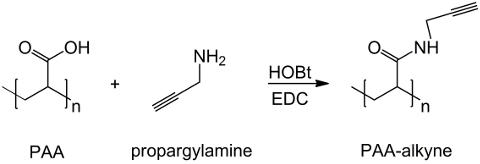
Figure 1: PAA modifié la synthèse des alcyne Un schéma de PAA fonctionnalisation avec le groupe alcyne;. "n" indique les monomères avec un groupe carboxyle réagissant avec propargylamine. S'il vous plaît cliquer ici pour voirune version plus grande de cette figure.

Figure 2:.. RGD-azoture synthèse La synthèse du dérivé RGD-azoture S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3: Cliquez sur le schéma de réaction de clic réaction entre un dérivé RGD-azoture et alcyne-PAA.. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4: Hydrogel synthesis. RGD fonctionnalisé procédure de synthèse d'hydrogel. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Remarque: Les produits chimiques sont utilisés tels que reçus. RGD linéaire est acheté, mais il peut être préparé par synthèse peptidique en phase solide Fmoc - type 16,19. Les solvants sont de qualité analytique. La dialyse nécessite l'utilisation d' une membrane avec une Mp de coupure égal à 3500 Da. Les composés synthétisés sont caractérisés par les spectres 1 H - RMN enregistré sur un spectromètre à 400 MHz en utilisant du chloroforme (CDCl 3) ou d' oxyde de deutérium (D 2 O) en tant que solvants, et les déplacements chimiques sont rapportés en valeurs S en parties par million. En outre, les hydrogels sont soumis à une analyse FT-IR en utilisant une technique KBr de granulés et de leur caractérisation physique implique des études de gélification évalués en utilisant le tube à essai inversé à 37 ° C.
1. Synthèse du chlorure de 4-1 Azidobutanoyl
- Dissoudre 500 mg d'acide 4-azidobutanoic (3,90 mmol) dans 10 ml de dichlorométhane et 0,5 ml de diméthylformamide.
- On refroidit la solution à 0 ° C,, En utilisant un bain de glace.
- Ajouter 505 pl de chlorure d'oxalyle (5,85 mmol) dans 5 ml de dichlorométhane et on ajoute lentement goutte à goutte au système réactionnel, tout en agitant.
- Au bout de 1 h à 0 ° C en utilisant un bain de glace, le retour à la température ambiante.
- On élimine le solvant sous pression réduite en utilisant un évaporateur rotatif.
- Caractériser le produit obtenu par spectroscopie 1 H-RMN, la dissolution de l'échantillon dans CDCl 3 16.
2. Synthèse de RGD-azoture Derivative 2
- Dissoudre 50 mg de RGD (0,145 mmol) dans 1 ml de 1 M de NaOH.
- Dissoudre 24 mg de 1 (0,16 mmol) dans 2 ml de tétrahydrofuranne.
- Ajouter toute la solution RGD à la solution 1 , goutte à goutte , à 0 ° C en utilisant un bain de glace.
- Retour à la température ambiante et agitation pendant une nuit.
- Ajouter 1 ml de 1 M HCl.
- On élimine le solvant sous pression réduite en utilisant un évaporateur rotatif.
- Caractériser l'obtained produit par spectroscopie 1 H-RMN, la dissolution de l'échantillon dans D 2 O 16.
3. PAA Acétylène Modification 3
- Dissoudre 200 mg de 35% p / p de la solution de PAA (2,8 mmol) dans 15 ml d'eau distillée.
- Ajouter 15,4 mg de chlorhydrate de propargylamine (0,20 mmol).
- Dissoudre 42,8 mg d'hydrate de 1-hydroxybenzotriazole (HOBt, 0,28 mmol) dans 14 ml d'un mélange 1: 1 v / v d'acétonitrile: solution d'eau distillée en chauffant à 50 ° C.
- Ajouter la totalité de la solution de HOBt à la solution de PAA à la température ambiante.
- Ajouter 53,6 mg de ethyldimethylaminopropylcarbodiimide (EDC, 0,28 mmol) au mélange réactionnel.
- En utilisant du HCl 1 M pour ajuster le pH à 5,5 et on agite le système réactionnel pendant une nuit à température ambiante.
- Dialyser la solution. Dissoudre 11,2 g de chlorure de sodium dans 2 litres d'eau distillée, puis ajouter 0,2 ml de 37% p / p de HCl. Dialyser la solution en utilisant une membrane avec un M w coupure de 3,5 kDa.
- Perform dialyse pendant trois jours. Changer la solution de dialyse par jour avec 2 litres d'eau distillée fraîchement préparée contenant 0,2 ml de 37% p / p de HCl.
- Conserver la solution finale à -80 ° C. Lyophiliser dans un lyophilisateur selon les protocoles du fabricant.
- Caractériser le polymère fonctionnalisé par spectroscopie 1 H-RMN, la dissolution de l'échantillon dans D 2 O 16.
4. Synthèse du PAA-RGD Polymer 4
- Dissoudre 78 mg de PAA modifié alcyne 3 (1,083 mmol) dans 10 ml d'eau distillée.
- Dissoudre 25 mg du dérivé azoture 2 RGD (0,0722 mmol) dans 5 ml de tétrahydrofuranne.
- Ajouter toute la solution RGD à la solution polymère.
- Ajouter 2,2 mg d'iodure de cuivre (0,0116 mmol) et 2,2 mg d'ascorbate de sodium (0,0111 mmol).
- Reflux le mélange résultant pendant une nuit à 60 ° C, sous agitation.
- On refroidit le mélange à 25 ° C.
- Dialyze la solution. Dissoudre 11,2 g de chlorure de sodium dans 2 litres d'eau distillée, puis ajouter 0,2 ml de 37% p / p de HCl. Dialyser la solution en utilisant une membrane avec un M w coupure de 3,5 kDa.
- Effectuer une dialyse pendant trois jours. Changer la solution de dialyse par jour avec 2 litres d'eau distillée fraîchement préparée contenant 0,2 ml de 37% p / p de HCl.
- Conserver la solution finale à -80 ° C. Lyophiliser dans un lyophilisateur selon les protocoles du fabricant.
- Caractériser le produit obtenu par spectroscopie 1 H-RMN, la dissolution de l'échantillon dans D 2 O 16.
5. RGD fonctionnalisés Hydrogel Synthèse
- Préparer le PBS. Dissoudre 645 mg de sel de PBS dans 50 ml d'eau distillée.
- Mélanger 40 mg de carbomère et de 10 mg de PAA fonctionnalisés 4 dans 9 ml de PBS (étape 5.1), à la température ambiante, jusqu'à dissolution complète (30 minutes).
- Ajouter 400 mg de PEG à la solution et maintenir l'agitation pendant 45 min.
- Arrêtez l'agitation et permettre au système de se contenter de 30 min.
- Utiliser NaOH 1 N pour ajuster le pH à 7,4.
- 5 ml du mélange obtenu, on ajoute 25 mg de poudre d'agarose.
- Irradier le système avec un rayonnement micro-onde à 500 W jusqu'à ce que l'ébullition, pendant une durée généralement comprise entre 30 s et 1 min, et chauffer électromagnétiquement jusqu'à 80 ° C.
- Laisser le mélange est exposé à la température ambiante jusqu'à ce que sa température tombe à 50 ° C et on ajoute 5 ml de PBS (étape 5.1), afin d'obtenir une solution à un rapport 1: 1 volumétrique.
- Préparer multipuits 12 cylindres en acier de la plaque contenant un diamètre de 1,1 cm.
- Prendre des aliquotes de 500 ul de la solution et placez-les dans chacun des cylindres en acier.
- Laisser au repos pendant 45 min jusqu'à ce que la gélification complète du système.
- Retirez les cylindres utilisant une pince en acier inoxydable pour obtenir les hydrogels.
6. Chargement des outils thérapeutiques (médicaments ou cellules)
- Répétez steps 5.1-5.7.
- Lorsque le mélange (déjà à l'état sol) atteint 37 ° C, ajouter 5 ml de la solution contenant la solution de médicament ou de la culture cellulaire désirée, afin d'obtenir un système final à un rapport 1: 1 volumétrique.
- Répétez les étapes 05.09 à 05.12 pour obtenir des réseaux polymères avec biocomposés physiquement piégées dans le gel.
7. Hydrogel Caractérisation
- Analyse FT-IR
- Après la formation de gel, faire tremper un des hydrogels synthétisées dans 2,5 ml d'eau distillée pendant 24 heures.
- Retirez les milieux aqueux où hydrogel est immergée et congelez-sec avec N2 liquide.
- Laminé l'échantillon d'hydrogel selon la technique de pastille de KBr.
- Ajouter une spatule pleine de KBr dans un mortier en agate. Prenez une petite quantité d'échantillon d'hydrogel (environ 0,1-2% du montant KBr, ou juste assez pour couvrir la pointe de la spatule) et mélanger avec la poudre KBr.
- Broyer le mélange jusqu'à ce que la poudre est fine et homogène.
- Utilisez le kit de pastille de KBr pour former le culot IR. Appuyez sur la poudre à l'aide d'une presse manuelle de laboratoire: pendant 3 min à la capacité de pression égale à 5 tonnes, puis pendant 3 min à la capacité de pression de 10 tonnes.
- Relâchez la pression pour obtenir le culot final comme homogène et transparente en apparence. Insérez la pastille dans le porte-échantillon d'IR et d' exécuter le spectre 16.
- Des études de gélification
- Remplir 2 ml microtube avec 900 pi de PBS et équilibrer à 37 ° C.
- Ajouter 100 ul de la solution de polymère préparée pour former l'hydrogel et incuber à 37 ° C.
- Inversez le tube et observer si le gel coule à 1, 2, 5, 10 et 20 min. Enregistrer l'heure à laquelle le gel ne coule pas comme le temps de gélification.
Access restricted. Please log in or start a trial to view this content.
Résultats
Le dérivé PAA alcyne est efficacement synthétisé à partir de l' acide polyacrylique et propargylamine, comme le montre la figure 1 , où n étiquettes les monomères dont les groupes carboxyle réagir avec l'amine. L'identité du produit est confirmée par spectroscopie de 1H-RMN. La figure 5 montre le spectre de 1H-RMN de PAA modifiés par triple liaison.
Access restricted. Please log in or start a trial to view this content.
Discussion
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
Remerciements
Les auteurs tiennent à remercier le professeur Maurizio Masi à une discussion fructueuse et Miss Chiara Allegretti pour l'édition de langue. La recherche des auteurs est soutenu par Bando Giovani Ricercatori 2010 (Ministero della Salute GR-2010- 2312573).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
Références
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon