Method Article
Transferencia de giro Saturación Diferencia RMN (MSITS RMN): Una nueva herramienta para obtener los parámetros cinéticos de los procesos de intercambio químico
En este artículo
Resumen
A detailed protocol describing the SSTD NMR method is presented here to help new users apply this new method to obtain the kinetic parameters of their own systems undergoing chemical exchange.
Resumen
Este protocolo detallado se describe el nuevo la transferencia de espín Saturación Diferencia Nuclear protocolo de resonancia magnética (RMN SSTD), recientemente desarrollado en nuestro grupo a los procesos de intercambio químico mutua in situ que son difíciles de analizar por métodos tradicionales estudiar. Como su nombre indica, este método combina el método de la vuelta de saturación de transferencia utilizado para moléculas pequeñas, con la diferencia de transferencia de saturación método (ETS) RMN empleado para el estudio de las interacciones proteína-ligando, mediante la medición de transferencia de saturación de espín transitoria a lo largo de aumentar los tiempos de saturación (build curvas -up) en moléculas orgánicas pequeñas y organometálicos sometidos a intercambio químico.
Las ventajas de este método sobre los ya existentes son: no hay necesidad de llegar a la coalescencia de las señales de intercambio; el método se puede aplicar siempre que una señal de los sitios de intercambio se aísla; no hay necesidad de medir T 1 o llegar a la saturación en estado estacionario; VA tasa constantelues se miden directamente, y los valores de T1 se obtienen en el mismo experimento, usando sólo un conjunto de experimentos.
Para probar el método, hemos estudiado la dinámica de la rotación impedida de N, N -dimethylamides, para los que está disponible la cantidad de datos para la comparación. Los parámetros termodinámicos obtenidos usando MSITS son muy similares a los reportados (técnicas de transferencia de spin-saturación y análisis de forma lineal). El método se puede aplicar a los sustratos más difíciles que no pueden ser estudiados por los métodos anteriores.
Prevemos que el experimental sencillo de configurar y la amplia aplicabilidad del método a una gran variedad de sustratos a hacer de este una técnica común entre los químicos orgánicos y organometálicos sin una amplia experiencia en RMN.
Introducción
intercambio químico comúnmente se refiere a cualquier proceso intermolecular o intramolecular en la que un núcleo se mueve desde un ambiente a otro en el que sus parámetros de RMN (desplazamiento químico, de acoplamiento escalar, acoplamiento dipolar, velocidad de relajación) difieren. Hay numerosos ejemplos de intercambio químico en las moléculas orgánicas y organometálicos (por ejemplo, barreras de rotación en biarilos, barreras de mover de un tirón en el anillo y el equilibrio conformacional, inversión de nitrógeno, de unión a ligando, de intercambio de ligandos degenerado y tautomerización). 1-3 El tipo de cambio químico se relaciona con la termodinámica de la barrera del proceso de cambio, y por lo tanto su estudio es de importancia crucial para entender la dinámica molecular de estos sistemas.
El signo clásico de intercambio dinámico de RMN es un cambio dramático en la línea-forma de las señales de RMN como los cambios de temperatura. A bajas temperaturas, el proceso es lento y dos desplazamientos químicos distintos se obserVed. A altas temperaturas, las dos señales se combinan en una señal, que se conoce como "coalescencia". A temperaturas intermedias, las señales se vuelven muy amplio. Esta sensibilidad del espectro de NMR de intercambio químico hace NMR un método muy poderoso para estudiar la dinámica de las moléculas en solución. Dos métodos se han empleado principalmente en el estudio de procesos dinámicos en la solución:. Análisis línea forma, 4-7 y saturación giro experimentos de transferencia 8-9 Además, es también digno de mención el método 10 y la transferencia de FIICCh inversión de programa 11 para la extracción directa de las constantes de velocidad, que son un enfoque relativamente eficiente para mediciones de cambio en los sistemas simples. Aunque estos métodos dan muy buenos resultados en la mayoría de los casos, que, sin embargo, tienen una serie de inconvenientes. La principal desventaja del análisis línea forma es las altas temperaturas necesarias para llegar a la coalescencia en algunas muestras. 12 Los principales aspectos a considerar cuando se carrying fuera de espín experimentos de transferencia de saturación son: los tiempos de saturación muy largos requeridos para alcanzar la constante de transferencia de saturación de estado entre los sitios de intercambio, y la necesidad de determinar la constante de tiempo de relajación longitudinal, T 1, que puede ser difícil si hay una superposición de diferentes señales en la región de estudio. 13
Como parte de nuestras investigaciones en los mecanismos organometálicos, 14-16 nuestro grupo está estudiando el Comportamiento variable de complejos de platino-aleno en solución. Esta es una tarea compleja que implica al menos tres procesos diferentes, siendo uno de ellos el intercambio π-cara o rotación del metal alrededor de uno de los ejes de aleno. Nos encontramos con que la normalidad experimentos VT y técnicas de análisis de línea de forma que se han empleado antes en sistemas similares, 17-19 no eran adecuados en nuestro estudio, debido a una rotación muy lenta en nuestro complejo de platino-aleno que hizo que la temperatura de fusión de la signales de interés más alta que la temperatura de descomposición del complejo.
Para superar esta limitación, hemos desarrollado y recientemente informó de un nuevo protocolo de RMN (MSITS RMN) para estudiar los procesos de intercambio químico mutua in situ. 20 Como el nombre sugiere que este método combina el método de la vuelta de saturación de transferencia utilizado para moléculas pequeñas, con el transferencia de saturación Diferencia método de RMN emplea para el estudio de las interacciones proteína-ligando, 21-24 mediante la medición de la saturación de transferencia de espín transitoria a lo largo de aumentar los tiempos de saturación (acumulación curvas) en pequeñas moléculas se someten a intercambio químico.
Con este nuevo método (SSTD NMR) hemos demostrado que podemos obtener los parámetros cinéticos de intercambio químico intramolecular en moléculas orgánicas y organometálicos pequeño, con algunas ventajas adicionales sobre los métodos tradicionales: no es necesaria la coalescencia de las señales, por lo que un rango de temperatura más flexible puede ser usadoen el estudio; la superposición de señales no interfiere, aunque al menos una de las resonancias que intercambian deben ser aislados; no hay necesidad de medir T 1 o llegar a la saturación en estado estacionario; valores de las constantes de velocidad se miden directamente y los valores de T 1 se obtienen en el mismo experimento, con sólo un conjunto de experimentos. Otra ventaja notable de la metodología SSTD RMN es que, en contraste con forma lineal de análisis, la determinación de las constantes de velocidad cinética no está limitado por el aumento de las temperaturas de coalescencia asociados con altos campos magnéticos. Por lo tanto, nuestra metodología es entonces muy bien apropiado para ambos campos magnéticos de baja y alta. Este artículo está pensado para ayudar a los nuevos usuarios a aplicar este nuevo método para sus propios sistemas de someterse a intercambio químico, y describe la preparación de muestras, dispositivo experimental, adquisición de datos, y un ejemplo de procesamiento y análisis de datos en una molécula orgánica simple.
Protocolo
Precaución: Por favor, consulte a todas las hojas de datos de seguridad de materiales pertinentes (MSDS) antes de usar.
1. Preparación de la muestra de RMN
- Pesar 5 mg de N, N-dimetilacetamida, añadir a un tubo de RMN apropiado para bajas temperaturas y disolver en 0,6 ml de tolueno d 8.
2. Configuración de RMN Experimental 25
- NOE Spectra Adquisición
- Realizar un experimento de una sola dimensión NOE (Efecto Overhauser nuclear). 26
NOTA: efectos NOE pueden suceder a cualquier temperatura. A un espectro NOE dimensiones irradiar la señal que se irradia en el experimento MSITS RMN, se registró a -40 ° C para asegurarse de que la transferencia de la rotación y la magnetización de la muestra usada aquí se redujo al mínimo, por lo que el NOE, si existe, predominarían y ser medido en este experimento. Idealmente, los efectos NOE entre los dos núcleos intercambio de Should no estar presente para evitar interferencias con el método MSITS.
- Realizar un experimento de una sola dimensión NOE (Efecto Overhauser nuclear). 26
- MSITS RMN experimentos de instalación
- Insertar la muestra en el imán por primera ej escribir en la línea de comandos del software para activar el flujo de aire. Luego, se coloca la muestra en la parte superior del imán y luego escriba ij. Espere hasta que la muestra se encuentra dentro del imán.
- Una vez que la muestra está en la edte imán, escriba la línea de comandos. Cambiar la temperatura a la primera temperatura seleccionada para llevar a cabo el experimento (295,5 K en este caso). Permita que la muestra a estabilizar a la temperatura elegida durante al menos 20 min.
- Realizar un experimento 1D 1 H-RMN de la muestra.
- Crear un nuevo conjunto de datos de un experimento de RMN de 1H. Para esto haga clic en Archivo / Nuevo y el nombre del nuevo experimento.
- Escribir secuencialmente y la espera de la orden anterior a fin: cerradura, atma, topshim, getprosol y RGA.
- escriba zg para adquirir el experimento de protones. Una vez que se termine el tipo EFP y apk de transformada de Fourier y ajustar la fase.
- Crear un nuevo conjunto de datos de, por ejemplo, un experimento de RMN de 1H. Para esto haga clic en Archivo / Nuevo y el nombre del nuevo experimento.
- En este nuevo conjunto de datos, escriba RPAR en la línea de comandos. Seleccione uno de los "STDDIFF" conjuntos de parámetros de la lista, por ejemplo STDDIFFESGP, y haga clic en "leer" y luego "leer todos" (Figura 1). Como alternativa, hacerlo escribiendo STDDIFFESGP RPAR todos.
NOTA: El experimento se puede realizar con esta secuencia de pulsos. Sin embargo, el programa de impulsos utilizado en nuestro experimento fue STDDIFF. - Para seleccionar la secuencia de pulsos STDDIFF, haga clic en el botón con tres puntos en la línea PULPROG (Figuras 2 y 3).
- Antes de llevar a cabo el experimento de RMN MSITS, calibrar el 1 H 90 ° Puls durose (p1). Para este propósito, asegúrese de que la muestra está en el imán a la temperatura deseada (paso 2.2.2). Llene pulsecal en la línea de comandos y copiar el valor del impulso de 90 ° en la mayor potencia (PL1 = -1 dB en este caso), es decir, el que da el impulso más corta (Figura 4).
- Introducir los valores para el pulso duro calibrado en el experimento. Tipo getprosol 1H (valor de p1 obtenidos en el paso 2.2.7) (valor para PL1) (Figura 5).
- Establecer la longitud del pulso en forma. Tipo de p13 e introducir un valor de 50.000 microsegundos (Figura 6).
- Establecer la forma del pulso selectivo. Para ello, vaya a la energía y haga clic en el botón "Editar ..." al lado de la forma (Figura 7). Ir al pulso 13 en forma y elija: Gaus 1.1000 (Figura 8).
- Ajuste la intensidad del impulso selectiva (SP13). Use un valor adecuado, es decir, , En este sistema entre 40 a 60 dB (correspondiente a una intensidad de campo de aproximadamente 120 Hz) (Figura 8). Las intensidades de campo excesivas pueden conducir a efectos de saturación inaceptables. 27-29
NOTA: 50 dB fue óptima en nuestro caso. Tener en cuenta que esta es una escala de atenuación, por lo que el menor es el valor más alto es el poder de la radiofrecuencia. Como corresponde a la cascada de Gauss saturar, que se aplica por mucho tiempo (varios segundos), SP13 no debe ir por debajo de 40 dB (si es necesario, consulte las especificaciones del instrumento, como pulsos largos a alta potencia podrían dañar el probehead). En nuestra experiencia de 41-61 dB por encima de la atenuación de la fuerza 1 H 90 ° pulso (-1 dB en este trabajo) funciona bien. Trate de seleccionar siempre la máxima atenuación posible, que conduzcan a nivel de saturación similar. - Escriba ns y ponerlo a 8 y, ds y la puso a 4.
3. una RMN de Adquisición de Datosd Procesamiento de 25
- MSITS RMN Adquisición Experimento
- Abra el experimento de RMN 1H realizado en el paso 2.2.3 para comprobar que la señal que va a ser irradiada es. Para ello, busque el experimento en el navegador de software, haga clic derecho en el conjunto de datos y haga clic en "Visualizar en una nueva ventana".
- Desplazar el cursor hasta el centro de la señal para irradiar y anote el desplazamiento químico en ppm. Seleccione la anchura espectral que será utilizado en el experimento.
NOTA: En este caso, la señal que será irradiada está en 2,17 ppm, y la anchura espectral utilizada fue 1,46 ppm. Asegúrese de que no hay corrección del desplazamiento químico se utiliza la frecuencia o la irradiación se puede ajustar de forma incorrecta. - Ir al experimento de RMN MSITS creado previamente con la configuración mencionada en el apartado 2.2.
- Crear una lista con las frecuencias de la irradiación. Para ello, escriba fq2list en la línea de comandos y seleccione una lista existente.
- Editar la listade las frecuencias de radiación, incluyendo los datos siguientes en las 3 primeras filas (Figura 9): Fila 1. P (indica que los siguientes datos sean en ppm); Fila 2 de frecuencia de la señal que se va a irradiar en ppm, según se mide en el punto 3.1.. 1; Fila 3,40 ppm (una frecuencia que está lejos de las señales de 1 h de compuesto de modo que la irradiación en esa frecuencia no afecta a los espectros).
- Guardar la lista con un nuevo nombre y escriba fq2list en la línea de comandos y seleccione la lista que acaba de crear.
- Para centrar el experimento en las señales bajo estudio, el tipo O1P y seleccione como el centro de la experiencia del desplazamiento químico de la señal que va a ser irradiada.
- Tipo sw para seleccionar la anchura espectral (1,46 ppm en este caso, pero cualquier otra anchura espectral puede ser elegido).
NOTA: Si el tiempo de adquisición obtenido después de cambiar el ancho espectral es demasiado largo (que introducirá más ruido en los espectros) que can ser ajustados escribiendo AQ para proporcionar la resolución deseada Decadencia de Inducción Libre (FID) (FIDRES, 0,25 Hz en este caso). - Elija el valor de la interscan retraso de relajación D1. Asegúrese de que por lo menos es de 1 a 5 veces el valor de la T 1 de los más lentos relajante protón.
NOTA: La fijamos hasta 40 segundos, que es el más largo tiempo de saturación (D20) en el experimento. De esta manera, todos los experimentos se mantenga el mismo total "por barrido" de tiempo (tiempo de retardo de saturación + + + pulsos tiempo de adquisición). - Escriba D1 y ponerlo a 40 seg.
- Ajuste el primer valor para el tiempo de saturación escribiendo D20 y se establece a 40 seg. Determinar la ganancia del receptor (rg) de forma automática escribiendo RGA.
- Cree el siguiente experimento escribiendo iexpno. Escriba D20 y seleccione un tiempo de saturación de 20 segundos en este experimento. Escriba RGA para determinar de forma automática RG.
- repetir el último paso para la D20 = 10, 5, 2,5, 1,25, 0,625, 0,3 seg.
- Una vez creados todos los experimentos, abrir el primero y en el tipo multizg línea de comandos y especificar el número de experimentos, 8 en este caso (es decir, multizg 8).
- Procesamiento Experimento MSITS RMN
- Abra la PROCNO 1 (número de proceso) de EXPNO 1 (número de experimento) del conjunto (el que tiene el mayor tiempo de saturación).
- En el tipo de línea de comandos lb y establecer el valor de 1,5.
NOTA: Para obtener espectros con muy altas relaciones de señal a ruido este valor podría ser disminuida; inversamente, podría aumentarse para experimentos ruidosos, si la resolución espectral no se ve afectada seriamente. - En el efp tipo de línea de comandos y el proceso FID # = 1 (espectro "en resonancia") en PROCNO = 2 (Figura 10).
- Corregir la fase del experimento haciendo clic en la corrección de fase b interactivoutton y guardarlo como un experimento 2D. Guardar y salir (Figura 11).
- Tipo 1 representante en la línea de comandos para ir a la PROCNO 1.
- En el efp tipo de línea de comandos y el proceso FID # = 2 (espectro "fuera de resonancia") en PROCNO = 3 (Figura 12).
- En el comando .md tipo de línea y luego rep 2 para mostrar una ventana de visualización múltiple con ambos espectros procesados: 2 (el que tiene la señal en el medio saturada) y 3 (aquel en el que se aplicó el tren de pulsos de saturación a 40 ppm ) (Figura 13).
- Haga clic en el botón con un signo delta (Figura 13) para calcular los espectros de diferencia y guardarlo en PROCNO 4. Salga de la ventana de visualización múltiple.
- Seleccione un intervalo de integración para la señal de la izquierda (la señal en el que se observó la transferencia de saturación debido al proceso de intercambio químico). Siempre integrar la misma región en PROCNO 3 y 4 PROCNO.
NOTA: El rango de integración utilizado en este experimento era 2.55 - 2.67 ppm. - Una vez integrado, vaya a la pestaña "Integrales" en cada uno de los experimentos y copiar el valor de "Integral [ABS]" (Figura 14).
- Divida la integral en PROCNO 4 por la integral en PROCNO 3. Que es el valor de SSTD η para un tiempo de saturación de 40 seg (η SSTD = centrifugado Saturación parámetro Diferencia Transfer). 21
- Repetir el procedimiento para el resto de los experimentos con diferentes tiempos de saturación.
4. Análisis de Datos 30
- El análisis de los datos para obtener los parámetros cinéticos
- Colocar los valores obtenidos MSITS eta frente al tiempo de saturación. 21
- Realizar un ajuste exponencial para ajustar las curvas obtenidas con la ecuación
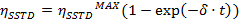

 =
= 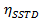 en el tiempo de saturación muy largo
en el tiempo de saturación muy largo
t = tiempo - Calcular los valores de η MSITS MAX y δ y los utilizan para calcular los valores de las constantes de velocidad (k) y los tiempos de relajación (T 1A) de acuerdo con las siguientes ecuaciones:

T 1A = constante de tiempo de relajación longitudinal de giro A
k = mutua de constante intercambio de velocidad cinética- Obtener la constante de velocidad cinética por:
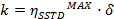
- Obtener la constante de velocidad cinética por:
- Eyring Parcela para obtener los parámetros termodinámicos
- En la parcela (k / T) frente a 1 / T (T = temperatura absoluta), utilizando los valores de las vacas tasas de tics a diferentes temperaturas.
- Realizar un ajuste lineal para ajustar los datos obtenidos a la ecuación de Eyring:
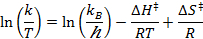
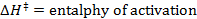
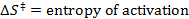
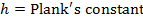
R = constante de los gases
k B = constante de Boltzmann
T = temperatura absoluta - Calcular los parámetros termodinámicos? H? S ≠ y ≠.
- Calcular los valores de E A (298) y Delta G ≠ (298) usando las siguientes ecuaciones:
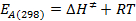
s / ftp_upload / 54499 / 54499eq13.jpg "/>
Resultados
La técnica SSTD NMR se aplicó para el cálculo de los parámetros cinéticos de la rotación del enlace amida de N, N-dimetilacetamida. 21 Este es un ejemplo simple para la que los datos extensos para la comparación se pueden encontrar en la literatura. 31
La rotación impedida alrededor del enlace amida, debido al carácter parcial de doble enlace en la forma de resonancia, que diferencia a ambos grupos metilo en dos señales en los espectros de 1 H-NMR (2,61 y 2,17 ppm a 22,5 ° C). La saturación de la vuelta de la señal del grupo metilo en 2,17 ppm (Me B) conduce a la desaparición de su señal en el H RMN 1. Tras la saturación de Me B, la transferencia de saturación para el otro grupo metilo (Me A) debido al proceso de rotación interna pueden ser observados por una disminución de la intensidad 1 H en la señal en 2,61 ppm. el magnitude de esta disminución dependerá del tiempo de saturación. La Figura 15 muestra la 1 H espectros de RMN de la dimetilacetamida N, N a 22,5 ° C, y las expansiones mostrar los espectros sin (a) y con (b) la saturación de la metilo grupo en 2,17 ppm, así como el espectro de diferencia (c), que se utiliza para calcular los valores de SSTD η. El factor η SSTD se calcula dividiendo el valor de la integral de Me A en el espectro de RMN SSTD (c) por el valor de la integral de la Me A en los espectros (a), como se explica en el protocolo. Los valores obtenidos de MSITS η para cada tiempo de saturación a diferentes temperaturas se recogen en la Tabla 1. La trama de los valores obtenidos de η MSITS frente al tiempo de saturación dio curvas exponenciales en los que se alcanzó una meseta en los momentos de mayor saturación. Para una cierta temperatura, el ajuste exponencial de la curva permite el cálculo de la tasaconstante (k) y el tiempo de relajación de la 1 H de la señal medida (T 1A) (Figura 16). La figura 17 muestra todas las curvas obtenidas junto con el k y valores 1A T obtenido en los ajustes.
Por último, la gráfica de ln (k / T) frente a 1 / T y el ajuste a la ecuación de Eyring (Figura 18) se utilizaron para calcular la entalpía y entropía de activación. Los parámetros de activación determinó que se muestran en la Tabla 2, junto con los parámetros previamente comunicados calculados utilizando diferentes metodologías.
Como se puede observar en la Tabla 2, los valores de los parámetros de activación obtenidos con la técnica de la vuelta de saturación de transferencia Diferencia (SSTD NMR) están en excelente acuerdo con los datos publicados con otras técnicas, tales como RMN o SSTanálisis de forma de la línea. La amplia gama de valores reportados para? S ‡ es debido a la dificultad en la medición de este parámetro con técnicas de RMN. 31 En cuanto al resto de los parámetros de activación, los valores obtenidos con este método son no sólo muy similares a los que ya se ha informado pero también más precisa, ya que nuestros errores (SD) son más pequeñas en todos los casos.
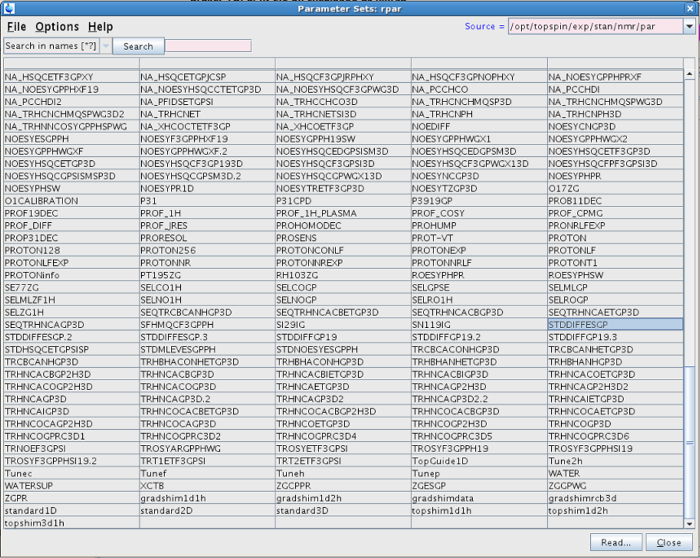
Figura 1: Lista de los experimentos después de escribir RPAR. La figura muestra los diferentes juegos de parámetros entre los cuales se debe seleccionar STDDIFFESGP. Por favor, haga clic aquí para ver una versión más grande de esta figura.
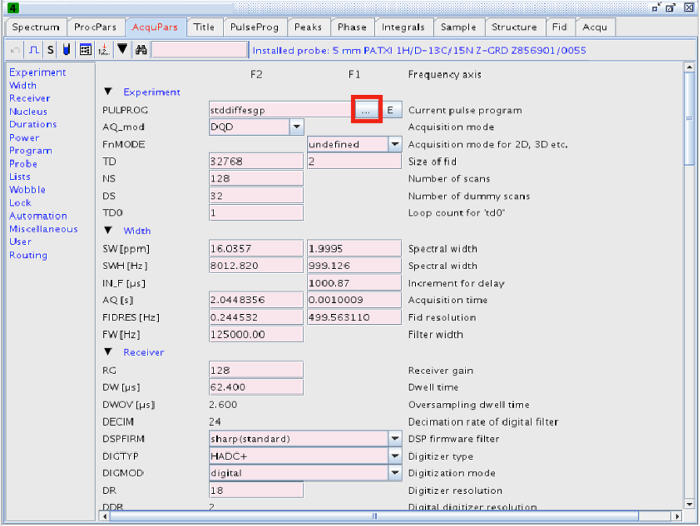
Figura 2:.. Los parámetros de adquisición el botón resaltado en un cuadrado rojo conduce a una lista de los diferentes programas de pulso Haga clic aquí para ver una versión más grande de esta figura.
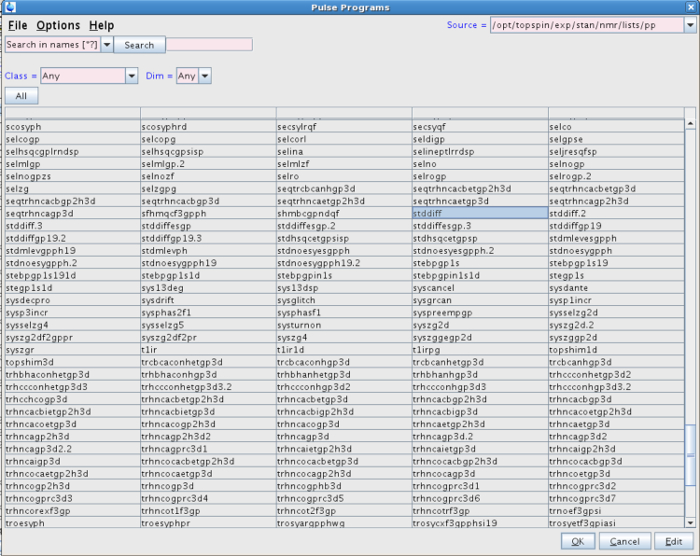
Figura 3:.. Lista de programas de pulso La figura muestra el programa de impulsos seleccionado en el experimento (STDDIFF) Por favor, haga clic aquí para ver una versión más grande de esta figura.
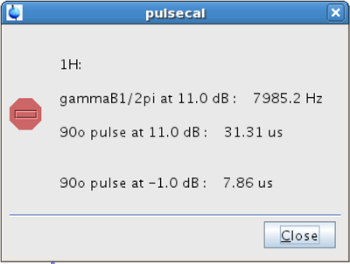
Figura 4: Ventana emergente apareció después de la calibración 90 ° pulso La figura muestra los valores de la calibración y 90. # 176; pulso en diferentes niveles de potencia. Haga clic aquí para ver una versión más grande de esta figura.
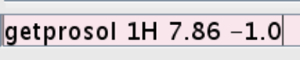
Figura 5:.. Captura de pantalla de la línea de comandos La figura muestra cómo introducir el valor del pulso duro calibrada favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 6:. Valor de la duración del pulso en forma de la figura se muestra cómo introducir el valor para la longitud del pulso en forma. g6large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 7:.. Los parámetros de adquisición La figura muestra los parámetros de potencia Haga clic aquí para ver una versión más grande de esta figura.
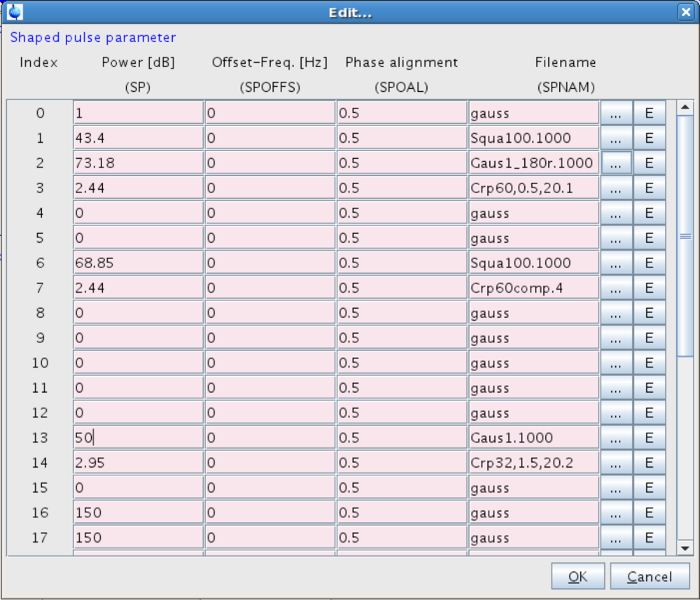
Figura 8:. Los parámetros para el pulso en forma Los valores para el pulso de forma serán introducidos en la línea 13. Haga clic aquí para ver una versión más grande de esta figura.
pload / 54499 / 54499fig9.jpg "/>
. Figura 9: Lista de frecuencias de irradiación La cifra incluye los datos siguientes en las 3 primeras filas: Fila 1. P (indica que los siguientes datos sean en ppm); Fila 2 de frecuencia de la señal que se va a irradiar en ppm, según se mide. en el apartado 3.1.1; Fila 3.40 ppm (una frecuencia que está lejos de las señales de 1H del compuesto por lo que la irradiación en esa frecuencia no afecta a los espectros). Por favor, haga clic aquí para ver una versión más grande de esta figura.
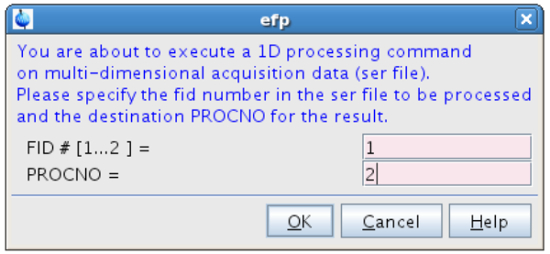
Figura 10:. El procesamiento de la primera FID La figura muestra la ventana emergente que aparece después de escribir EFP. nk "> Haga clic aquí para ver una versión más grande de esta figura.
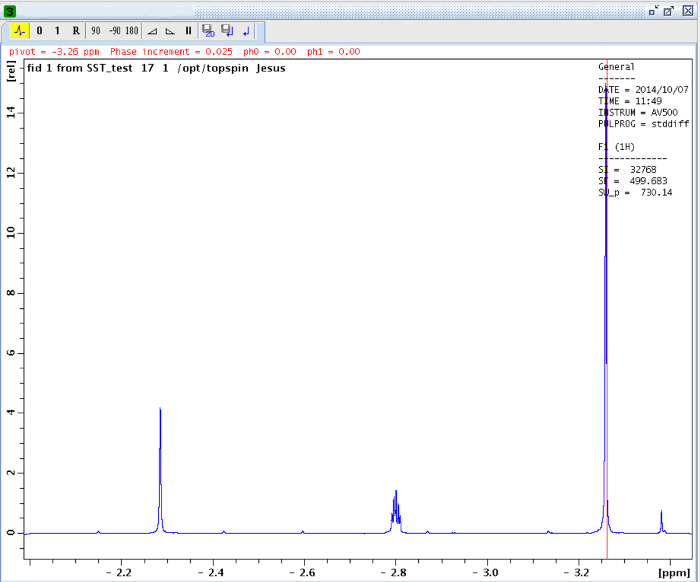
Figura 11:.. Corrección de fase Captura de pantalla de la ventana para la corrección de fase manual de Haga clic aquí para ver una versión más grande de esta figura.
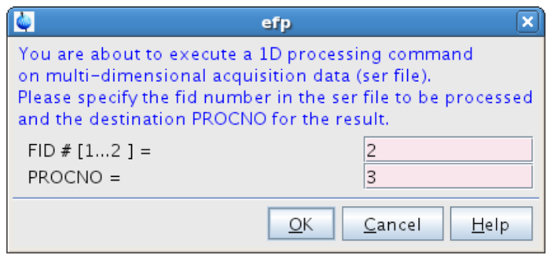
Figura 12:. Procesamiento de la segunda FID La figura muestra la ventana emergente que aparece después de escribir efp. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Figura 13 "src =" / files / ftp_upload / 54499 / 54499fig13.jpg "/>
Figura 13: pantalla múltiple de espectros 2 y 3. El botón resaltado en un cuadrado rojo es la de calcular los espectros de diferencia. Por favor, haga clic aquí para ver una versión más grande de esta figura.
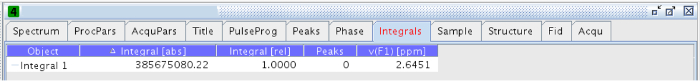
Figura 14:.. Pestaña Integrales La figura muestra los valores de las integrales absolutas y relativas favor, haga clic aquí para ver una versión más grande de esta figura.
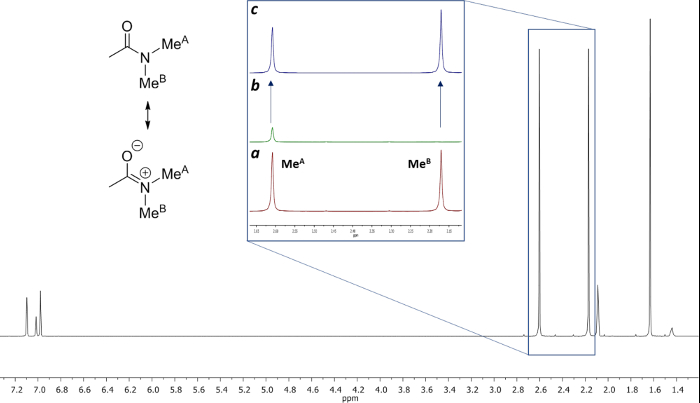
Figura 15: Estructura y 1 g> H NMR de N, N-dimetilacetamida a 22,5 ° C en tolueno-d 8. (a) 1 expansión H NMR de la región de 2,13 a 2,66 ppm antes de la irradiación. (B) Ampliación de la misma región después de la irradiación del grupo metilo a 2,17 ppm. (C) Espectro Diferencia [(a) - (b)]. Haga clic aquí para ver una versión más grande de esta figura.
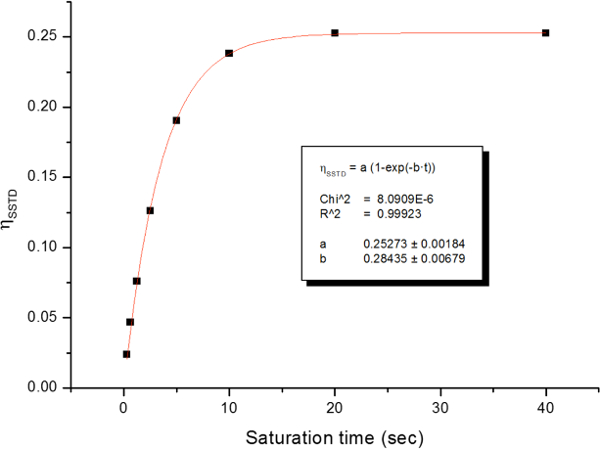
Figura 16: Ejemplo de la trama de MSITS η y su ajuste exponencial a 278 K. Reproducido de la información de apoyo de referencia 21 con permiso de la Royal Society of Chemistry.http://ecsource.jove.com/files/ftp_upload/54499/54499fig16large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
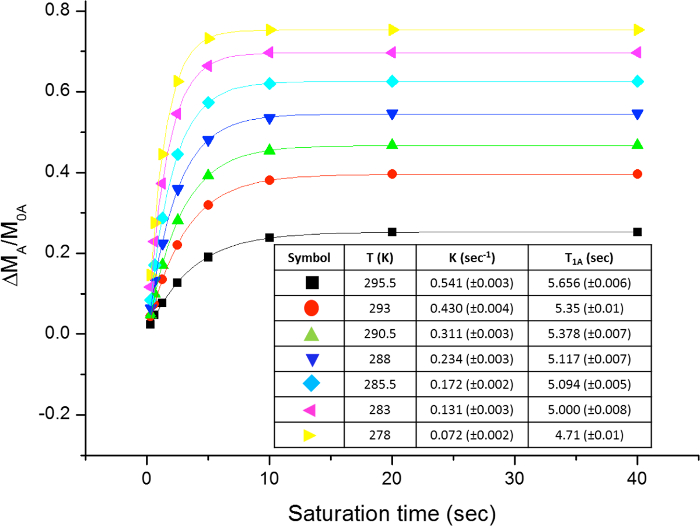
Figura 17: Diagramas de la η MSITS vs. tiempo de saturación a diferentes temperaturas. La figura muestra el diagrama de N, N-dimetilacetamida y la mesa con las constantes tasas obtenidas y los tiempos de relajación. Por favor, haga clic aquí para ver una versión más grande de esta figura.
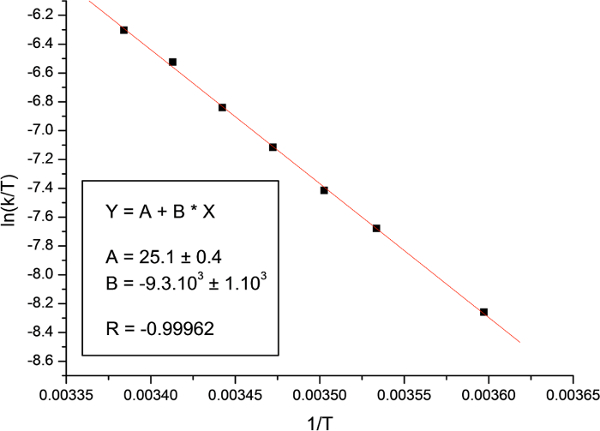
Figura 18:. Parcela Eyring La figura muestra el diagrama de N, N-dimetilacetamida. Haga clic aquí para ver una versión más grande de esta figura.
| t sat (seg) | η MSITS | η MSITS | η MSITS | η MSITS | η MSITS | η MSITS | η MSITS |
| (T = 278 K) | (T = 283 K) | (T = 285,5 K) | (T = 288 K) | (T = 290,5 K) | (T = 293 K) | (T = 295,5 K) | |
| 40 | 0.2526 | 0.3957 | 0.4671 | 0.5461 | 0,626 | 0.6969 | 0.7535 |
| 20 | 0.2526 | 0.3957 | 0.4671 | 0.5461 | 0,626 | 0.6969 | 0.7535 |
| 10 | 0.2383 | 0.3806 | 0.4537 | 0.5355 | 0.6199 | 0.6969 | 0.7535 |
| 5 | 0.1904 | 0.3193 | 0.3919 | 0,481 | 0.5734 | 0.6638 | 0.7318 |
| 2.5 | 0.1263 | 0.2204 | 0.2812 | 0.3589 | 0.4449 | 0.5461 | 0,626 |
| 1.25 | 0.0761 | 0.1353 | 0,171 | 0.2247 | 0.2868 | 0.3732 | 0.4449 |
| 0,625 | 0,0467 | 0.0739 | 0,099 | 0.1327 | 0,171 | 0.2291 | 0.2758 |
| 0,3 | 0.0238 | 0,044 | 0.0472 | 0,0644 | 0.0847 | 0.1169 | 0.1463 |
Tabla 1:. Los valores de SSTD η La tabla muestra los valores obtenidos en diferentes momentos de saturación de N, N-dimetilacetamida en el intervalo de temperaturas 278-295.5 K.
">? H ‡ (KJ mol -1)| Método | MSITS RMN | SST 31 RMN td> | Análisis de la línea en forma de | Análisis de la línea en forma de | Análisis de la línea en forma de |
| Parámetro | (Este trabajo) | (1 H NMR) 4 | (1 H NMR) 5 | (13C) 6 | |
| E bis (mol KJ-1) 298 | 79,7 ± 0,1 | 73,1 ± 1,4 | 70,5 ± 1,7 | 82,0 ± 1,3 | 79,5 ± 0,4 |
| 77,2 ± 0,1 | 70,6 ± 1,4 | 68 | 79,5 ± 0,4 | 76,6 ± 0,4 | |
| Delta S ‡ (J mol-1 K-1) | 11,5 ± 0,4 | -10.5 ± 5.0 | -15.0 ± 5.1 | 13 ± 8 | 3 ± 4 |
| ? G ‡ 298 (mol KJ -1) | 73,8 ± 0,1 | 73,7 ± 2,0 | 72.5 | 75,3 ± 0,4 | 75,7 ± 0,4 |
| Solvente | Tolman d 8 | Tolman d 8 | CCl4 | Acetona- d 6 | ordenado |
Tabla 2:. Parámetros de activación La tabla muestra los parámetros de activación para la rotación interna de N, N-dimetilacetamida obtenidos por el método de RMN SSTD en comparación con los mismos parámetros obtenidos utilizando diferentes métodos de RMN para el análisis de 4,5,6 Los errores en esta tabla. se refieren a errores de desviación estándar (SD). (Reproducido de la referencia 21 con permiso del Real Society de Química).
Discusión
One of the more obvious advantages of this methodology is that the rate constants and the relaxation time for a given temperature can be obtained with a single set of experiments, with a robust pulse sequence (the same used for STD experiments to study protein-ligand interactions, which is typically found within the available set of experiments from the spectrometer manufacturer). This simplifies the experimental setup since there is no need to measure T1 or reach steady state saturation. Besides, it is remarkable that this method does not depend on the magnet strength, as coalescence methods. On the other hand, the main limitation is that this technique cannot be applied to chemical exchange processes too fast or too slow, which would depend on the temperature range of the NMR machine or the solvents used.
This new technique for the calculation of kinetic parameters can be applied to a great variety of substrates and its applicability has already been demonstrated with some interesting molecules.21 The kinetic parameters of the 4-N,N-dimethylamido[2.2]paracyclophane, a challenging substrate in which the signal of one of the methyl groups of interest is overlapped with other signals from the molecule, were successfully calculated using SSTD NMR. Interestingly, this methodology can be applied as long as one of the signals of study is isolated. SSTD NMR is also a useful protocol for the calculation of kinetic parameters in molecules in which the coalescence temperature is so high that the molecule decomposes before reaching it. This is the case with PtCl2(dimethylallene)(pyridine), in which the methodology was successfully applied without the need of reaching coalescence. The choice of solvents and temperatures is critical to obtain good results, since the chemical exchange rates can vary significantly with these parameters. Moreover, in addition to the criteria in a normal NMR experiment, key steps in a SSTD NMR experiment are the selectivity of the irradiation as well as the temperature control. Both factors have to be precise to guarantee the success of the experiment.
The representative results presented here are for the kinetics of intramolecular chemical exchange, but the technique can also be applied to study the kinetics of intermolecular chemical exchange and also ligand exchange, common processes in the dynamic behavior of transition metal complexes.
Finally, providing a proper modification of the equations is made,32 this method could be extended to deal with multi-site exchange and unequal populations, as it has been done in former double resonance experiments,8-9 increasing the usefulness of this technique for the study of chemical exchange processes in challenging compounds.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
Funding by the University of East Anglia, the EPSRC (EP/L012855/1) and the EU (H2020-MSCA-IF-2014-EF-ST-658172) is gratefully acknowledged (MTQ).
Materiales
| Name | Company | Catalog Number | Comments |
| N,N-dimethylacetamide | Aldrich | 38840 | Acute toxicity |
| Toluene-d8 | Fluorochem | D-005 | Flammable and toxic |
| 500 MHz 7" Select Series NMR Tubes | GPE LTD | S-5-500-7 | |
| TopSpin 2.1 | TopSpin program, Bruker Corp., http://www.bruker.com/products/mr/nmr/nmr-software/software/topspin/ (2015). | ||
| Origin 6.0 | Origin 6.0 software, OriginLab Corp., http://originlab.com. | ||
| Bruker Avance III 500 MHz fitted with 5 mm broadband observed BBFOplus Z-gradient SmartProbeTM probe | Bruker Corp., http://www.bruker.com | ||
| Bruker Avance I 500 MHz Inverse Triple Resonance NMR spectrometer fitted with a 5 mm TXI Z-gradient probe | Bruker Corp., http://www.bruker.com | ||
| Ceramic Spinner standardbore shimsystems (5 mm) | Bruker Corp., http://www.bruker.com | H00804 |
Referencias
- Bain, A. D. Chemical Exchange in NMR. Prog. Nuc. Mag. Res. Spect. 43, 63-103 (2003).
- Bain, A. D. Chemical Exchange. Modern Magnetic Resonance. , 421-427 (2006).
- Bain, A. D. Chapter 2 - Chemical Exchange. Ann. Rep. NMR Spect. 63, 23-48 (2008).
- Reeves, L., Shaddick, R., Shaw, K. Nuclear Magnetic Resonance Studies of Multi-site Chemical Exchange. III. Hindered Rotation in Dimethylacetamide, Dimethyl Trifluoro-acetamide, and Dimethyl Benzamide. Can. J. Chem. 49, 3683-3691 (1971).
- Drakenberg, T., Dahlqvist, K., Forsen, S. Barrier to Internal Rotation in Amides. IV. N,N-Dimethylamides. Substituent and Solvent Effects. J. Phys. Chem. 76, 2178-2183 (1972).
- Fujiwara, F., Airoldi, C. Carbon-13 NMR Study of the Barrier to Internal Rotation of N,N-Dimethylacetamide in the Adduct with Antimony(III) Chloride. J. Phys. Chem. 88, 1640-1642 (1984).
- Gutowsky, H. S., Holm, C. H. Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides. J. Chem. Phys. 25, 1228-1234 (1956).
- Forsen, S., Hoffman, R. A. A New Method for the Study of Moderately Rapid Chemical Exchange Rates Employing Nuclear Magnetic Double Resonance. Acta Chem. Scand. 17, 1787-1788 (1963).
- Forsen, S., Hoffman, R. A. Study of Moderately Rapid Chemical Exchange Reactions by Means of Nuclear Magnetic Double Resonance. J. Chem. Phys. 39, 2892-2901 (1963).
- Williams, T. J., Kershaw, A. D., Li, V., Wu, X. An Inversion Recovery NMR Kinetics Experiment. J. Chem. Educ. 88, 665-669 (2011).
- Bain, A. D., Cramer, J. A. Slow Chemical Exchange in an Eight-Coordinated Bicentered Ruthenium Complex Studied by One-Dimensional Methods. Data Fitting and Error Analysis. J. Magn. Res., Series A. 118, 21-27 (1996).
- Sandstrom, J. . Dynamic NMR Spectroscopy. , (1982).
- Castanar, L., Nolis, P., Virgili, A., Parella, T. Measurement of T1/T2 Relaxation Times in Overlapped Regions from Homodecoupled 1H Singlet Signals. J. Magn. Reson. 244, 30-35 (2014).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. New Platinum-Catalysed Dihydroalkoxylation of Allenes. Adv. Synth. Catal. 352, 2189-2194 (2010).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. Platinum-Catalysed Bisindolylation of Allenes: A Complementary Alternative to Gold Catalysis. Chem. Eur. J. 18, 4499-4504 (2012).
- Hurtado-Rodrigo, C., Hoehne, S., Muñoz, M. P. A New Gold-Catalysed Azidation of Allenes. Chem. Comm. 50, 1494-1496 (2014).
- Vrieze, K., Volger, H. C., Gronert, M., Praat, A. P. Intramolecular Rearrangements in Platinum--Tetramethylallene Compounds as Influenced by Ligands Trans to the Allene Group. J. Organometal. Chem. 16, 19-22 (1969).
- Vrieze, K., Volger, H. C., Praat, A. P. Complexes of Allenes with Platinum (II) and Rhodium (I). J. Organometal. Chem. 21, 467-475 (1970).
- Brown, T. J., Sugie, A., Leed, M. G. D., Widenhoefer, R. A. Structures and Dynamic Solution Behavior of Cationic, Two-Coordinate Gold(I)-π-Allene Complexes. Chem. Eur. J. 18, 6959-6971 (2012).
- Yang, W., Hashmi, S. K. Mechanistic Insights into the Gold Chemistry of Allenes. Chem. Soc. Rev. 43, 2941-2955 (2014).
- Quiros, M. T., Angulo, J., Munoz, M. P. Kinetics of Intramolecular Chemical Exchange by Initial Growth Rates of Spin Saturation Transfer Difference Experiments (SSTD NMR). Chem. Commun. 51, 10222-10225 (2015).
- Mayer, M., Meyer, B. Characterization of Ligand Binding by Saturation Transfer Difference NMR Spectroscopy. Ang. Chem. Int. Ed. 38, 1784-1788 (1999).
- Angulo, J., Nieto, P. STD-NMR: Application to Transient Interactions Between Biomolecules - A Quantitative Approach. Eur. Biophys. J. 40, 1357-1369 (2011).
- Kemper, S., Patel, M. K., Errey, J. C., Davis, B. G., Jones, J. A., Claridge, T. D. W. Group Epitope Mapping Considering Relaxation of the Ligand (GEM-CRL): Including Longitudinal Relaxation Rates in the Analysis of Saturation Transfer Difference (STD) Experiments. J. Magn. Reson. 203, 1-10 (2010).
- Berger, S., Braun, S. . 200 and More NMR Experiments: A Practical Course. , (2004).
- Cutting, B., Shelke, S. V., Dragic, Z., Wagner, B., Gathje, H., Kelm, S., Ernst, B. Sensitivity Enhancement in Saturation Transfer Difference (STD) Experiments Through Optimized Excitation Schemes. Magn Reson Chem. 45, 720-724 (2007).
- Ley, N. B., Rowe, M. L., Williamson, R. A., Howard, M. J. Optimising Selective Excitation Pulses To Maximize Saturation Transfer Difference NMR Spectroscopy. RSC Adv. 4, 7347-7351 (2014).
- Antanasijevic, A., Ramirez, B., Caffrey, M. Comparison of the Sensitivities of WaterLOGSY and Saturation Transfer Difference NMR Experiments. J. Biomol. NMR. 60 (1), 37-44 (2014).
- Jarek, R. L., Flesher, R. J., Shin, S. K. Kinetics of Internal Rotation of N,N-Dimethylacetamide: A Spin-Saturation Transfer Experiment. J. Chem. Ed. 74, 978-982 (1997).
- Forsen, S., Hoffman, R. A. Exchange Rates by Nuclear Magnetic Multiple Resonance. III. Exchange Reactions in Systems with Several Nonequivalent Sites. J. Chem. Phys. 40, 1189-1196 (1964).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados