Method Article
Spin Transferência Saturação Diferença NMR (SSTD RMN): Uma nova ferramenta obter Kinetic Parâmetros de processos químicos de câmbio
Neste Artigo
Resumo
A detailed protocol describing the SSTD NMR method is presented here to help new users apply this new method to obtain the kinetic parameters of their own systems undergoing chemical exchange.
Resumo
Este protocolo detalhado descreve a nova transferência de spin Saturação Diferença Nuclear Magnetic Resonance protocolo (SSTD RMN), recentemente desenvolvido no nosso grupo para estudar processos de mútuo local de permuta química que são difíceis de analisar por métodos tradicionais. Tal como o nome sugere, este método combina o método da rotação Saturação de transferência utilizadas para as moléculas pequenas, com a transferência de saturação Diferença método (DST) RMN empregue para o estudo de interacções proteína-ligando, medindo a transferência de saturação rotação transiente juntamente aumentando os tempos de saturação (compilação curvas -up) em pequenas moléculas orgânicas e organometálicas submetidos a permuta química.
As vantagens deste método em relação às existentes são: não há necessidade de se chegar a coalescência dos sinais de troca; o método pode ser aplicado enquanto um sinal dos locais de troca é isolado; não há necessidade de medir a T 1 ou atingir a saturação em estado estacionário; va constante de velocidadelores são medidos directamente, e os valores de t 1 são obtidos na mesma experiência, utilizando apenas um conjunto de experiências.
Para testar o método, estudamos a dinâmica da rotação impedida de -dimethylamides N, N, para a qual está disponível a quantidade de dados para comparação. Os parâmetros termodinâmicos obtidos utilizando SSTD são muito semelhantes aos reportados (técnicas de transferência de spin-de saturação e de análise de linha-forma). O método pode ser aplicado a substratos mais difíceis que não podem ser estudadas através de métodos anteriores.
Prevemos que o experimental simples configurar e a ampla aplicabilidade do método para uma grande variedade de substratos vai fazer isso uma técnica comum entre os químicos orgânicos e organometálicos sem extensa experiência em RMN.
Introdução
permuta química geralmente refere-se a qualquer processo intermolecular ou intramolecular, em que um núcleo se move a partir de um ambiente para outro, em que os seus parâmetros de RMN (de desvio quimico, acoplamento escalar, acoplamento dipolar, taxa de relaxação) diferem. Existem numerosos exemplos de permuta química de moléculas orgânicas e organometálicas (por exemplo, barreiras rotativas, biarilos em barreiras lançando anel e equilíbrio conformacional, inversão de azoto, a ligação do ligando, de permuta de ligandos degenerada e tautomerização). 03/01 A taxa de troca química está relacionada com a termodinâmica da barreira do processo de troca e, portanto, seu estudo é de importância crucial para entender a dinâmica molecular desses sistemas.
O sinal clássico de troca dinâmica em NMR é uma mudança dramática na linha-forma dos sinais de RMN como as mudanças de temperatura. A baixas temperaturas, o processo é lento e dois desvios químicos são distintos observed. A altas temperaturas, os dois sinais de fundir-se um sinal, que é conhecido como "coalescência". A temperaturas intermédias, os sinais de tornar-se muito amplo. Esta sensibilidade do espectro de RMN de permuta química torna RMN um método muito eficiente para estudar a dinâmica de moléculas em solução. Dois métodos têm sido utilizados principalmente no estudo de processos dinâmicos em solução:. Análise linha forma, 4-7 e saturação de spin experiências de transferência 8-9 Além disso, também vale a pena mencionar o método 10 eo CIFIT programa de transferência de inversão 11 para a extração direta de constantes de velocidade, que são uma abordagem relativamente eficiente para medições de câmbio em sistemas simples. Embora estes métodos dão muito bons resultados na maioria dos casos, que, no entanto, têm uma série de inconvenientes. A principal desvantagem da análise line-forma é as altas temperaturas necessárias para atingir a coalescência em algumas amostras. 12 As principais questões a considerar quando se carrying a rotação experiências de transferência de saturação são: os longos tempos de saturação necessários para atingir a constante de transferência de saturação de estado entre os locais de troca, e a necessidade de determinar a longitudinal tempo de relaxamento constante, t 1, o qual pode ser difícil, se não existe sobreposição dos diferentes sinais na região de estudo 13.
Como parte das nossas investigações nos mecanismos organometálicos, 14-16 nosso grupo está a estudar o comportamento fluxional de complexos de platina-Allène em solução. Esta é uma tarefa complexa que envolve, pelo menos, três processos diferentes, sendo um deles a troca π-face ou rotação do metal em torno de um eixo das aleno. Encontramos que as experiências de VT e técnicas de análise de linha-forma que têm sido empregadas antes em sistemas similares normal, 17-19 não eram adequadas em nosso estudo, devido a uma rotação muito lenta no nosso complexo de platina-allene que fez a temperatura de coalescência do signais de juro superior à temperatura de decomposição do complexo.
A fim de superar esta limitação, desenvolvemos e informou recentemente um novo protocolo NMR (SSTD RMN) para estudar processos de mútua local de permuta química. 20 Como o nome sugere este método combina o método de rotação Saturação Transferência usado para pequenas moléculas, com a transferência de saturação Diferença método NMR empregada para o estudo das interações proteína-ligante, 21-24 medindo transitória rotação de transferência de saturação ao longo aumentando os tempos de saturação (build-up curvas) em pequenas moléculas submetidas a permuta química.
Com este novo método (SSTD RMN) que têm mostrado que se pode obter os parâmetros cinéticos de permuta química intramolecular em pequenas moléculas orgânicas e organometálicas com algumas vantagens adicionais em relação às abordagens tradicionais: não é necessária a coalescência dos sinais, de modo que uma gama de temperatura mais flexível pode ser usadono estudo; sinal de sobreposição não interfere, embora pelo menos uma das ressonâncias troca deve ser isolado; não há necessidade de medir a T 1 ou atingir a saturação em estado estacionário; os valores das constantes de velocidade são medidos directamente e os valores de t 1 são obtidos na mesma experiência, utilizando apenas um conjunto de experiências. Outra vantagem notável da metodologia SSTD RMN é que, em contraste com LineShape análise, a determinação das constantes de velocidade cinética não é limitado pelo aumento da temperatura de coalescência associados com elevados campos magnéticos. Assim, nossa metodologia é, então, muito bem apropriado para ambos os campos magnéticos de baixa e alta. Este artigo destina-se a ajudar os novos usuários aplicar este novo método para seus próprios sistemas passando por permuta química, e descreve a preparação da amostra, arranjo experimental, aquisição de dados, e um exemplo de processamento e análise de dados em uma molécula orgânica simples.
Protocolo
Cuidado: Por favor, consulte todas as folhas de dados de segurança pertinentes (MSDS) antes do uso.
1. Preparação da Amostra RMN
- Pesar 5 mg de N, N-dimetilacetamida, adicionar a um tubo de RMN adequado para baixas temperaturas e dissolver em 0,6 ml de tolueno-d 8.
Setup 2. RMN Experimental 25
- Aquisição Spectra NOE
- Realizar um experimento unidimensional NOE (efeito overhauser). 26
NOTA: efeitos NOE pode acontecer em qualquer temperatura. Um NOE um espectro dimensional irradiação do sinal que vai ser irradiada na experiência SSTD RMN foi registado à temperatura de -40 ° C para se certificar de que a transferência de rotação e a magnetização da amostra usado aqui foi minimizada e, portanto, o NOE, se existente, predominaria e ser medido neste experimento. Idealmente, os efeitos NOE entre os dois núcleos troca should não estar presente para evitar interferências com o método SSTD.
- Realizar um experimento unidimensional NOE (efeito overhauser). 26
- SSTD RMN Setup Experimentos
- Insira a amostra no ímã por primeira ej digitação na linha do software de comando para ligar o fluxo de ar. Em seguida, coloque a amostra no topo do ímã e em seguida, digite ij. Espere até que a amostra está dentro do ímã.
- Uma vez que a amostra está no ímã, tipo edte na linha de comando. Mudar a temperatura para a primeira temperatura seleccionada para realizar o experimento (295,5 K, neste caso). Deixe que a amostra de estabilizar à temperatura escolhida durante pelo menos 20 min.
- Executar uma experiência 1D 1 H-RMN na amostra.
- Criar um novo conjunto de dados de um experimento 1 H-RMN. Para isso, clique em Arquivo / Novo e nomeie o novo experimento.
- Digite sequencialmente e esperando o comando anterior ao fim: bloqueio, atma, topshim, getprosol e RGA.
- Digite zg para adquirir a experiência de protões. Uma vez que é terminado tipo EFP e apk a transformada de Fourier-lo e ajustar a fase.
- Criar um novo conjunto de dados de, por exemplo, um experimento 1 H RMN. Para isso, clique em Arquivo / Novo e nomeie o novo experimento.
- Neste novo conjunto de dados, digite rpar na linha de comando. Escolha um dos "STDDIFF" conjuntos de parâmetros da lista, por exemplo STDDIFFESGP, e clique em "ler" e, em seguida, "ler tudo" (Figura 1). Como alternativa, fazer isso digitando STDDIFFESGP rpar todos.
NOTA: O ensaio pode ser realizado com esta sequência de impulsos. No entanto, o programa de pulso utilizada em nosso experimento foi STDDIFF. - Para selecionar a sequência de impulsos STDDIFF, clique no botão com três pontos na linha PULPROG (Figuras 2 e 3).
- Antes de realizar o experimento SSTD RMN, calibrar o 1 H 90 ° puls rígidose (p1). Para este efeito, assegurar que a amostra está no íman à temperatura desejada (Passo 2.2.2). Tipo pulsecal na linha de comando e copiar o valor do impulso de 90 ° na parte superior de alimentação (PL1 = -1 dB, neste caso), ou seja, aquela que dá o pulso curto (Figura 4).
- Introduzir os valores para o pulso disco calibrado no experimento. Tipo getprosol 1H (valor para p1 obtidas no passo 2.2.7) (valor para pl1) (Figura 5).
- Definir o comprimento do impulso em forma. Tipo de p13 e introduzir um valor de 50,000 ms (Figura 6).
- Defina a forma de pulso seletivo. Para fazer isso, vá para o Poder e clique no botão "Editar ..." botão ao lado de forma (Figura 7). Ir para o pulso em forma de 13 e escolha: Gaus 1,1000 (Figura 8).
- Defina o poder do pulso seletiva (SP13). Configurá-lo para algo apropriado, ou seja, , Neste sistema entre 40-60 dB (correspondente a uma intensidade de campo de cerca de 120 Hz) (Figura 8). Intensidades de campo excessivas pode levar a efeitos de saturação inaceitáveis. 27-29
NOTA: 50 dB foi ideal em nosso caso. Levar em conta que isto é uma escala de atenuação, de modo que o menor valor da mais elevada a energia da radiofrequência. Pois corresponde à cascata Gaussian saturação, que é aplicado por muito tempo (alguns segundos), SP13 não deve ir abaixo de 40 dB (se necessário, consulte as especificações do instrumento, como pulsos longos com alto poder poderia danificar o probehead). Na nossa experiência 41-61 dB acima da atenuação do disco 1 H 90 ° pulso (-1 dB neste trabalho) funciona bem. Tente selecionar sempre o mais alto possível atenuação levando a nível de saturação similar. - Digite ns e configurá-lo para 8 e digitar ds e configurá-lo para 4.
3. Aquisição de Dados RMN umProcessamento d 25
- Aquisição Experiment SSTD NMR
- Abra o experimento 1 H NMR realizada no passo 2.2.3 para verificar onde o sinal de que vai ser irradiado é. Para isso, busca a experiência no navegador de software, clique direito no conjunto de dados e clique em "Exibir em uma nova janela".
- Mover a linha de cursor para o centro do sinal para irradiar e anotar o deslocamento químico em ppm. Seleccionar a largura espectral que irá ser utilizada na experiência.
NOTA: neste caso, o sinal que vai ser irradiada é de 2,17 ppm, e a largura espectral utilizada foi de 1,46 ppm. Garantir que nenhuma correção deslocamento químico é usado ou a frequência de irradiação pode ser definido incorretamente. - Ir para o experimento SSTD RMN previamente criado com a configuração mencionados na secção 2.2.
- Criar uma lista com as frequências de irradiação. Para isso, digite fq2list na linha de comando e selecione uma lista existente.
- Editar a listade frequências de irradiação incluindo os seguintes dados nas 3 primeiras linhas (Figura 9): Fileira 1. P (indica que os seguintes dados está em ppm); Row 2 Freqüência do sinal a ser irradiados em ppm, medido em 3.1.. 1; Fila 3,40 ppm (uma frequência que é medida a partir dos sinais 1H do composto de modo a irradiação em que a frequência não alterem o espectro).
- Salvar a lista com um novo nome e, em seguida, digite fq2list na linha de comando e selecione a lista recém-criada.
- Para centrar o experimento nos sinais sob estudo, e seleccione tipo o1p como o centro da experiência do desvio químico do sinal que vai ser irradiada.
- Tipo SW para seleccionar a largura espectral (1,46 ppm, neste caso, mas qualquer outra largura espectral pode ser escolhido).
NOTA: Se o tempo de aquisição obtido depois de mudar a largura espectral é muito longo (que irá introduzir mais ruído no espectro) que can ser ajustada digitando AQ para fornecer a resolução desejada Livre Indução de decaimento (FID) (FIDRES, 0,25 Hz, neste caso). - Escolha o valor para o InterScan D1 atraso relaxamento. Certifique-se de que ele é, pelo menos, 1 a 5 vezes o valor do T 1 do mais lento relaxante protões.
NOTA: Nós configurá-lo para 40 segundos, que é o tempo de saturação mais longa (D20) no experimento. Desta forma, todos os experimentos irá manter o mesmo total "por varredura" de tempo (atraso + saturação tempo + impulsos + tempo de aquisição). - Digite D1 e configurá-lo para 40 seg.
- Definir o primeiro valor para o tempo de saturação, digitando D20 e defini-la para 40 seg. Determine o ganho do receptor (rg) automaticamente digitando RGA.
- Criar o próximo experimento, digitando iexpno. Digite D20 e selecione um tempo de saturação de 20 seg neste experimento. Digite RGA para determinar automaticamente rg.
- Repita o último passo para D20 = 10, 5, 2,5, 1,25, 0,625, 0,3 seg.
- Uma vez que todas as experiências são criados, abra o primeiro e na linha de comando tipo multizg e especificar o número de experimentos, 8, neste caso (ou seja, multizg 8).
- Processamento Experiment SSTD NMR
- Abra o PROCNO 1 (número do processo) a partir EXPNO 1 (Número Experiment) do conjunto (aquele com o tempo de saturação superior).
- Na linha de comando tipo lb e defina o valor para 1,5.
NOTA: Para obter espectros com rácios muito elevados de sinal-para-ruído este valor poderia ser diminuído; Inversamente, ele poderia ser aumentada para experiências ruidosos, se a resolução espectral não é severamente afectados. - Na linha de comando tipo EFP eo processo FID # = 1 (espectro "on-ressonância") em PROCNO = 2 (Figura 10).
- Corrigir a fase do experimento, clicando a correção b fase interativautton e guardá-lo como uma experiência 2D. Salvar e sair (Figura 11).
- Tipo rep 1 na linha de comando para ir para o PROCNO 1.
- Na linha de comando tipo EFP eo processo FID # = 2 ( "off-ressonância" spectrum) em PROCNO = 3 (Figura 12).
- No comando linha de tipo Md e depois rep 2 para mostrar uma janela de exibição múltipla com dois espectros processados: 2 (aquele com o sinal no meio saturada) e 3 (aquele em que o trem de pulsos de saturação foi aplicado a 40 ppm ) (Figura 13).
- Clique no botão com o sinal delta (Figura 13) para calcular o espectro de diferença e salve-o em PROCNO 4. Saia da janela de exposição múltipla.
- Seleccionar um intervalo de integração do sinal do lado esquerdo (sinal, no qual vai ser observada a transferência de saturação devido ao processo de permuta química). Sempre integrar a mesma região em PROCNO 3 e 4 PROCNO.
NOTA: O intervalo de integração utilizado neste experimento foi de 2,55-2,67 ppm. - Uma vez integrado, vá para a aba "Integrais" em cada um dos experimentos e copiar o valor de "Integral [abs]" (Figura 14).
- Dividir o integral no PROCNO 4 pela integral em PROCNO 3. Isto é o valor de SSTD η para um tempo de saturação de 40 seg (= η SSTD rotação Saturação transferência de parâmetros Diferença). 21
- Repetir o procedimento para o restante das experiências com diferentes tempos de saturação.
4. Análise de Dados 30
- A análise dos dados para obter os parâmetros cinéticos
- Traçar os valores SSTD r | obtidos em relação ao tempo de saturação. 21
- Executar um ajuste exponencial para ajustar as curvas obtidas para a equação
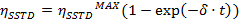

 =
= 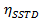 no tempo de saturação muito longo
no tempo de saturação muito longo
t = tempo - Calcular os valores de η SSTD MAX e δ e usá-los para calcular os valores das constantes de velocidade (k) e tempos de relaxamento (T 1A) de acordo com as seguintes equações:

T 1A = longitudinal constante de tempo de relaxamento de rotação A
k = mútua local constante de velocidade cinética de troca- Obter a constante de velocidade cinética por:
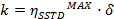
- Obter a constante de velocidade cinética por:
- Eyring Plot para obter os parâmetros termodinâmicos
- Lote ln (k / t) em função de 1 / T (T = temperatura absoluta), utilizando os valores da vacas taxas de tiques a diferentes temperaturas.
- Execute um ajuste linear para ajustar os dados obtidos com a equação de Eyring:
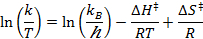
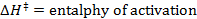
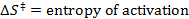
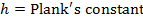
R = constante de gás
k B = constante de Boltzmann
T = temperatura absoluta - Calcule os parâmetros termodinâmicos AH ≠ e ≠ Ds.
- Calcular os valores para E A (298) e ΔG ≠ (298), utilizando as seguintes equações:
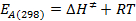
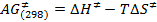
s / ftp_upload / 54499 / 54499eq13.jpg "/>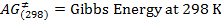
Resultados
A técnica SSTD RMN foi aplicado para o cálculo dos parâmetros cinéticos na rotação da ligação amida de N, N-dimetilacetamida. 21 Este é um exemplo simples, para o qual os dados extensos para comparação pode ser encontrada na literatura 31.
A rotação impedida em torno da ligação amida, devido ao carácter ligação dupla parcial sob a forma de ressonância, difere os dois grupos metilo em dois sinais no 1 H-RMN Os espectros (2,61 e 2,17 ppm a 22,5 ° C). Rotação saturação do sinal do grupo metilo a 2,17 ppm (Me B) conduz ao desaparecimento do seu sinal no RMN de 1H. Após a saturação de me B, transferência de saturação para o outro grupo metilo (Me A), devido ao processo de rotação interna pode ser observado por uma diminuição na intensidade de um H no sinal a 2,61 ppm. o magnitude diminuição do presente vai depender do tempo de saturação. A Figura 15 mostra o espectro de 1 H RMN do N-dimetilacetamida, N a 22,5 ° C, e as expansões mostram os espectros sem (a) e com (b) a saturação da metílico grupo a 2,17 ppm, assim como o espectro de diferença (C), utilizado para calcular os valores de SSTD η. O factor η SSTD é calculado dividindo o valor da integral de me uma no espectro de RMN SSTD (c) pelo valor do integral do Me Um espectros em (a), como explicado no protocolo. Os valores obtidos de SSTD η para cada tempo de saturação em diferentes temperaturas estão reunidos na Tabela 1. A trama dos valores obtidos de SSTD η em relação ao tempo de saturação deu curvas exponenciais em que um platô foi alcançado em momentos de saturação mais elevados. Para uma determinada temperatura, o ajuste exponencial da curva permite o cálculo da taxaconstante (k) e o tempo de relaxação do 1 H do sinal medido (t 1A) (Figura 16). A Figura 17 mostra todas as curvas obtidas, juntamente com a K e T 1A valores obtidos nos ajustes.
Finalmente, a representação gráfica de ln (k / t) em função de 1 / T e o ajuste para a equação de Eyring (Figura 18) foram utilizados para calcular a entalpia e entropia de activação. Os parâmetros de activação determinados são apresentados na Tabela 2, juntamente com os parâmetros previamente reportados, calculados usando diferentes metodologias.
Como pode ser observado na Tabela 2, os valores dos parâmetros de activação obtidas com a técnica de transferência da rotação Saturação Diferença (SSTD RMN) estão em concordância excelente com os dados relatados anteriormente usando outras técnicas, tais como a SST ou RMNanálise da forma de linha. A vasta gama de valores reportados para Ds ‡ é devido à dificuldade na medição deste parâmetro com técnicas de RMN. 31 Tal como para o resto dos parâmetros de activação, os valores obtidos com o nosso método não só são realmente semelhantes aos já relatados mas também mais exacto, uma vez que os erros (SD) são menores em todos os casos.
Figura 1: Lista de experiências depois de digitar rpar. A figura mostra os diferentes conjuntos de parâmetros entre os quais STDDIFFESGP devem ser selecionados. Por favor clique aqui para ver uma versão maior desta figura.
Figura 2:.. Parâmetros de aquisição O botão destacado em um quadrado vermelho leva a uma lista de diferentes programas de pulso Por favor clique aqui para ver uma versão maior desta figura.
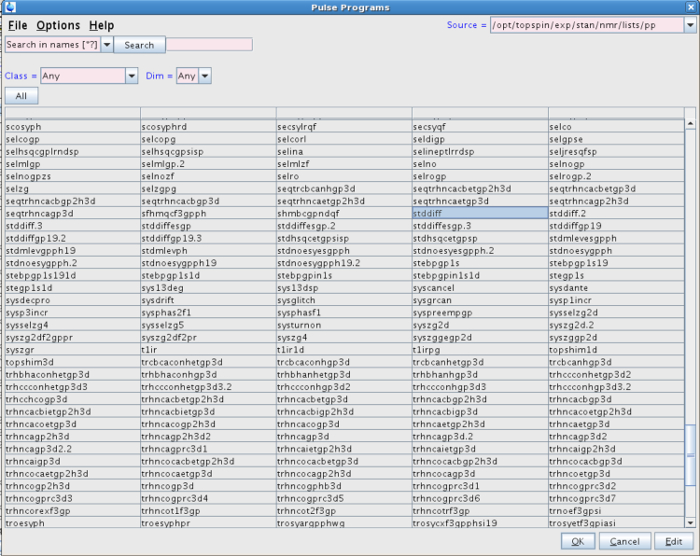
Figura 3:.. Lista de programas de pulso A figura mostra o programa de pulso selecionada no experimento (STDDIFF) Por favor clique aqui para ver uma versão maior desta figura.
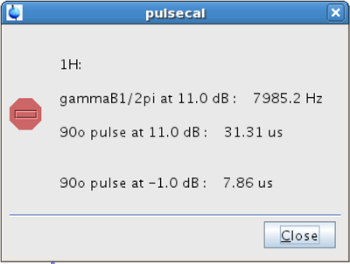
Figura 4: Pop-up janela apareceu após a calibração 90 ° pulso A figura mostra os valores da calibrada 90 &. # 176; pulso em diferentes níveis de potência. Por favor clique aqui para ver uma versão maior desta figura.
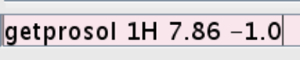
Figura 5:.. Imagem da linha de comando A figura mostra como introduzir o valor para o pulso dura calibrado Por favor clique aqui para ver uma versão maior desta figura.

Figura 6:. Valor para o comprimento do impulso em forma de A figura mostra como introduzir o valor para o comprimento do impulso em forma. g6large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 7:.. Parâmetros de aquisição A figura mostra os parâmetros de potência Por favor clique aqui para ver uma versão maior desta figura.
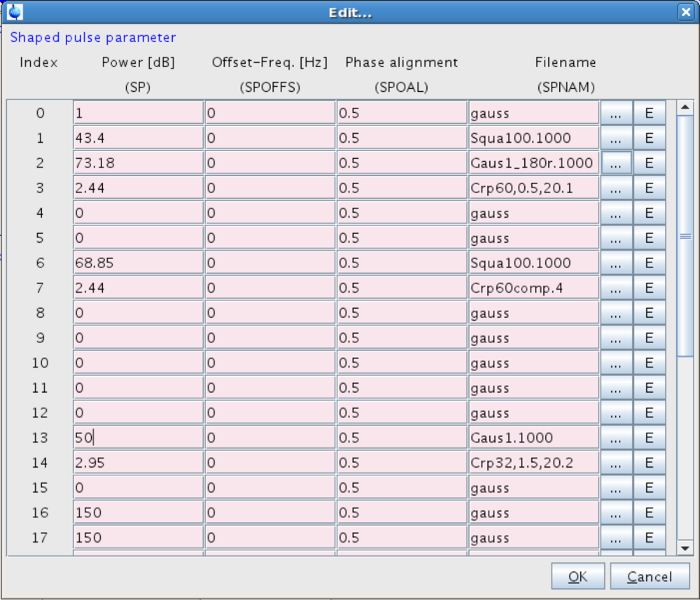
Figura 8:. Parâmetros para o pulso em forma Os valores para o pulso em forma será introduzido na linha 13. Por favor clique aqui para ver uma versão maior desta figura.
pload / 54499 / 54499fig9.jpg "/>
. Figura 9: Lista de frequências de irradiação O número inclui os seguintes dados nas 3 primeiras linhas: Linha 1. P (indica que os seguintes dados está em ppm); Row 2 Freqüência do sinal a ser irradiados em ppm, medida. em 3.1.1; Row 3,40 ppm (uma frequência que está longe de ser os sinais H 1 do composto de modo a irradiação em que a freqüência não afeta o espectro). Por favor clique aqui para ver uma versão maior desta figura.
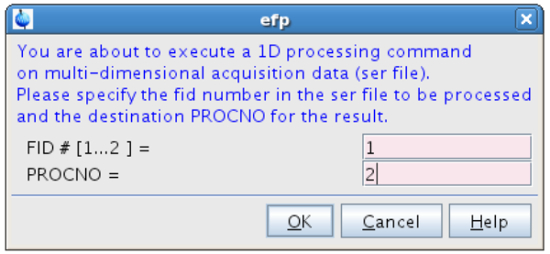
Figura 10:. Processamento do primeiro FID A figura mostra a janela pop-up que aparece depois de digitar efp. nk "> Por favor, clique aqui para ver uma versão maior desta figura.
Figura 11:.. Correção de fase Captura de tela mostrando a janela para a correção de fase Manual Por favor clique aqui para ver uma versão maior desta figura.
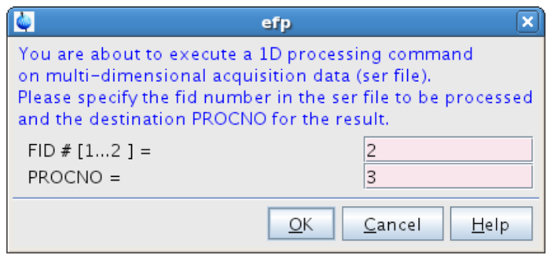
Figura 12:. Processamento do segundo FID A figura mostra a janela pop-up que aparece depois de digitar efp. Por favor clique aqui para ver uma versão maior desta figura.
Figura 13 "src =" / files / ftp_upload / 54499 / 54499fig13.jpg "/>
Figura 13: tela múltipla de espectros 2 e 3. O botão destacado em um quadrado vermelho é o único a calcular o espectro de diferença. Por favor clique aqui para ver uma versão maior desta figura.
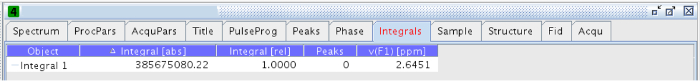
Figura 14:.. Guia Integrais A figura mostra os valores dos integrais absolutos e relativos Por favor clique aqui para ver uma versão maior desta figura.
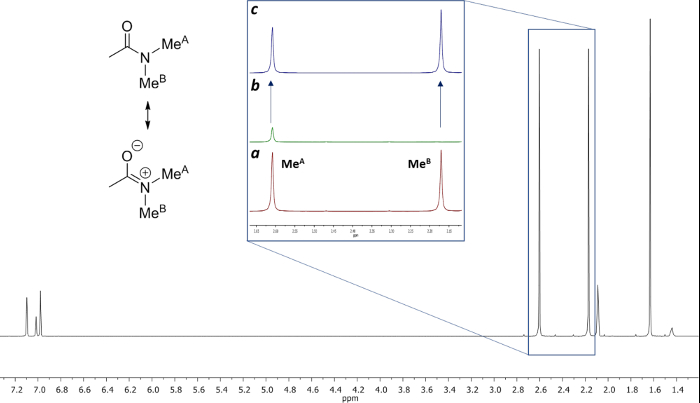
Figura 15: Estrutura e 1 g> H RMN Os espectros de N, N-dimetilacetamida a 22,5 ° C em tolueno-d 8. (a) RMN de 1H expansão da região 2,13-2,66 ppm antes da irradiação. (B) expansão da mesma região após a irradiação do grupo metilo a 2,17 ppm. (C) espectro de diferença [(a) - (b)]. Por favor clique aqui para ver uma versão maior desta figura.
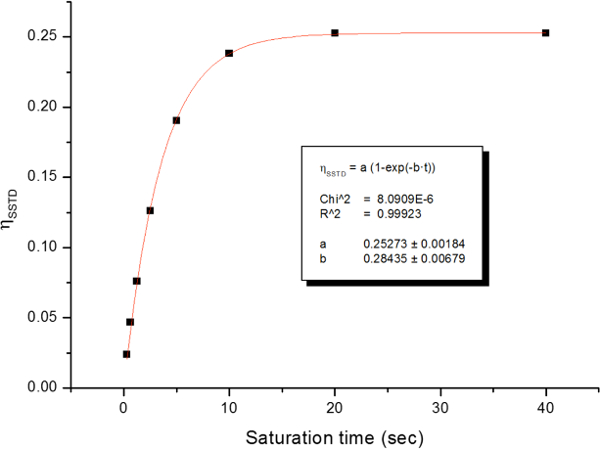
Figura 16: Exemplo do enredo da SSTD η e seu ajuste exponencial a 278 K. Reproduzido a partir da informação de suporte de referência 21 com permissão da Royal Society of Chemistry.http://ecsource.jove.com/files/ftp_upload/54499/54499fig16large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
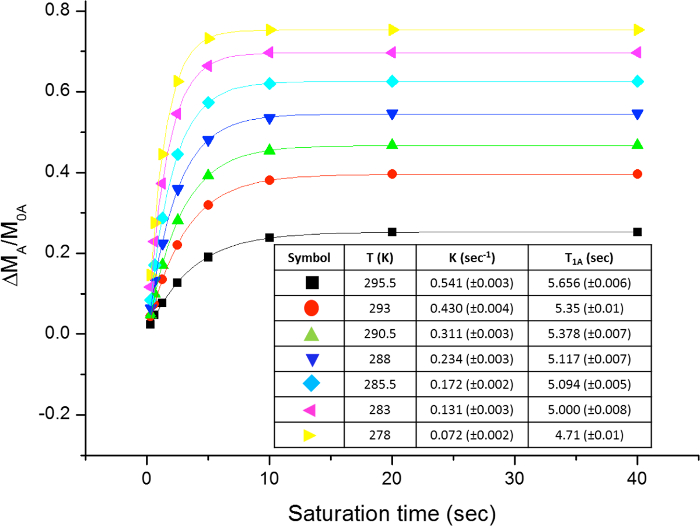
Figura 17: A parcela de η SSTD vs. tempo de saturação em diferentes temperaturas. A figura mostra o gráfico de N, N-dimetilacetamida e a tabela com as constantes taxas obtidas e tempos de relaxação. Por favor clique aqui para ver uma versão maior desta figura.
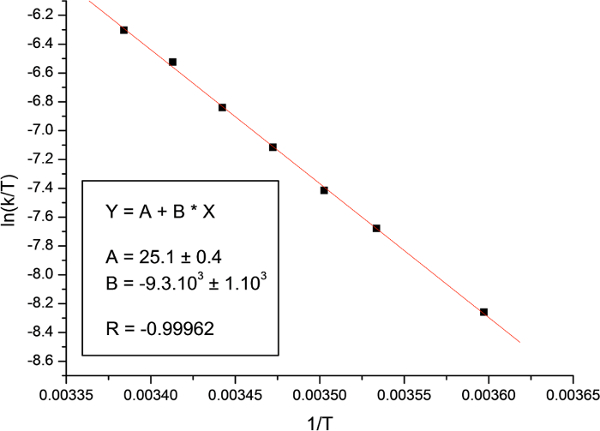
Figura 18:. Trama Eyring A figura mostra o gráfico de N, N-dimetilacetamida. Por favor clique aqui para ver uma versão maior desta figura.
| t sentou (seg) | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD |
| (T = 278 K) | (T = 283 K) | (T = 285,5 K) | (T = 288 K) | (T = 290,5 K) | (T = 293 K) | (T = 295,5 K) | |
| 40 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 20 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 10 | 0,2383 | 0,3806 | 0,4537 | 0,5355 | 0,6199 | 0,6969 | 0,7535 |
| 5 | 0,1904 | 0,3193 | 0,3919 | 0,481 | 0,5734 | 0,6638 | 0,7318 |
| 2.5 | 0,1263 | 0,2204 | 0,2812 | 0,3589 | 0,4449 | 0,5461 | 0,626 |
| 1,25 | 0,0761 | 0,1353 | 0,171 | 0,2247 | 0,2868 | 0,3732 | 0,4449 |
| 0,625 | 0,0467 | 0,0739 | 0,099 | 0,1327 | 0,171 | 0,2291 | 0,2758 |
| 0,3 | 0.0238 | 0,044 | 0,0472 | 0,0644 | 0,0847 | 0,1169 | 0,1463 |
Tabela 1:. Valores de SSTD η A tabela mostra os valores obtidos a diferentes tempos de saturação para a N, N- dimetilacetamida na gama de temperaturas 278-295.5 K.
AH ‡ (KJ mol -1)| Método | SSTD NMR | SST RMN 31 td> | Análise de linha-forma | Análise de linha-forma | Análise de linha-forma |
| Parâmetro | (Este trabalho) | (1H RMN) 4 | (1H RMN) 5 | (13 C RMN) 6 | |
| E um (KJ mol -1) 298 | 79,7 ± 0,1 | 73,1 ± 1,4 | 70,5 ± 1,7 | 82,0 ± 1,3 | 79,5 ± 0,4 |
| 77,2 ± 0,1 | 70,6 ± 1,4 | 68 | 79,5 ± 0,4 | 76,6 ± 0,4 | |
| Ds ‡ (J K -1 mol -1) | 11,5 ± 0,4 | -10.5 ± 5.0 | -15,0 ± 5.1 | 13 ± 8 | 3 ± 4 |
| ΔG ‡ 298 (kJ mol -1) | 73,8 ± 0,1 | 73,7 ± 2,0 | 72.5 | 75,3 ± 0,4 | 75,7 ± 0,4 |
| Solvente | Tol- d 8 | Tol- d 8 | CCl4 | Acetona-d 6 | puro |
Tabela 2:. Parâmetros de Activação A tabela mostra os parâmetros de activação para a rotação interna de N, N-dimetilacetamida obtida pelo método SSTD RMN comparados com os mesmos parâmetros obtidos usando os diferentes métodos de RMN para análise 4,5,6 Erros nesta tabela. referem-se a erros de desvio padrão (SD). (Reproduzido de referência 21 com permissão da Royal Society de Química).
Discussão
One of the more obvious advantages of this methodology is that the rate constants and the relaxation time for a given temperature can be obtained with a single set of experiments, with a robust pulse sequence (the same used for STD experiments to study protein-ligand interactions, which is typically found within the available set of experiments from the spectrometer manufacturer). This simplifies the experimental setup since there is no need to measure T1 or reach steady state saturation. Besides, it is remarkable that this method does not depend on the magnet strength, as coalescence methods. On the other hand, the main limitation is that this technique cannot be applied to chemical exchange processes too fast or too slow, which would depend on the temperature range of the NMR machine or the solvents used.
This new technique for the calculation of kinetic parameters can be applied to a great variety of substrates and its applicability has already been demonstrated with some interesting molecules.21 The kinetic parameters of the 4-N,N-dimethylamido[2.2]paracyclophane, a challenging substrate in which the signal of one of the methyl groups of interest is overlapped with other signals from the molecule, were successfully calculated using SSTD NMR. Interestingly, this methodology can be applied as long as one of the signals of study is isolated. SSTD NMR is also a useful protocol for the calculation of kinetic parameters in molecules in which the coalescence temperature is so high that the molecule decomposes before reaching it. This is the case with PtCl2(dimethylallene)(pyridine), in which the methodology was successfully applied without the need of reaching coalescence. The choice of solvents and temperatures is critical to obtain good results, since the chemical exchange rates can vary significantly with these parameters. Moreover, in addition to the criteria in a normal NMR experiment, key steps in a SSTD NMR experiment are the selectivity of the irradiation as well as the temperature control. Both factors have to be precise to guarantee the success of the experiment.
The representative results presented here are for the kinetics of intramolecular chemical exchange, but the technique can also be applied to study the kinetics of intermolecular chemical exchange and also ligand exchange, common processes in the dynamic behavior of transition metal complexes.
Finally, providing a proper modification of the equations is made,32 this method could be extended to deal with multi-site exchange and unequal populations, as it has been done in former double resonance experiments,8-9 increasing the usefulness of this technique for the study of chemical exchange processes in challenging compounds.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Funding by the University of East Anglia, the EPSRC (EP/L012855/1) and the EU (H2020-MSCA-IF-2014-EF-ST-658172) is gratefully acknowledged (MTQ).
Materiais
| Name | Company | Catalog Number | Comments |
| N,N-dimethylacetamide | Aldrich | 38840 | Acute toxicity |
| Toluene-d8 | Fluorochem | D-005 | Flammable and toxic |
| 500 MHz 7" Select Series NMR Tubes | GPE LTD | S-5-500-7 | |
| TopSpin 2.1 | TopSpin program, Bruker Corp., http://www.bruker.com/products/mr/nmr/nmr-software/software/topspin/ (2015). | ||
| Origin 6.0 | Origin 6.0 software, OriginLab Corp., http://originlab.com. | ||
| Bruker Avance III 500 MHz fitted with 5 mm broadband observed BBFOplus Z-gradient SmartProbeTM probe | Bruker Corp., http://www.bruker.com | ||
| Bruker Avance I 500 MHz Inverse Triple Resonance NMR spectrometer fitted with a 5 mm TXI Z-gradient probe | Bruker Corp., http://www.bruker.com | ||
| Ceramic Spinner standardbore shimsystems (5 mm) | Bruker Corp., http://www.bruker.com | H00804 |
Referências
- Bain, A. D. Chemical Exchange in NMR. Prog. Nuc. Mag. Res. Spect. 43, 63-103 (2003).
- Bain, A. D. Chemical Exchange. Modern Magnetic Resonance. , 421-427 (2006).
- Bain, A. D. Chapter 2 - Chemical Exchange. Ann. Rep. NMR Spect. 63, 23-48 (2008).
- Reeves, L., Shaddick, R., Shaw, K. Nuclear Magnetic Resonance Studies of Multi-site Chemical Exchange. III. Hindered Rotation in Dimethylacetamide, Dimethyl Trifluoro-acetamide, and Dimethyl Benzamide. Can. J. Chem. 49, 3683-3691 (1971).
- Drakenberg, T., Dahlqvist, K., Forsen, S. Barrier to Internal Rotation in Amides. IV. N,N-Dimethylamides. Substituent and Solvent Effects. J. Phys. Chem. 76, 2178-2183 (1972).
- Fujiwara, F., Airoldi, C. Carbon-13 NMR Study of the Barrier to Internal Rotation of N,N-Dimethylacetamide in the Adduct with Antimony(III) Chloride. J. Phys. Chem. 88, 1640-1642 (1984).
- Gutowsky, H. S., Holm, C. H. Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides. J. Chem. Phys. 25, 1228-1234 (1956).
- Forsen, S., Hoffman, R. A. A New Method for the Study of Moderately Rapid Chemical Exchange Rates Employing Nuclear Magnetic Double Resonance. Acta Chem. Scand. 17, 1787-1788 (1963).
- Forsen, S., Hoffman, R. A. Study of Moderately Rapid Chemical Exchange Reactions by Means of Nuclear Magnetic Double Resonance. J. Chem. Phys. 39, 2892-2901 (1963).
- Williams, T. J., Kershaw, A. D., Li, V., Wu, X. An Inversion Recovery NMR Kinetics Experiment. J. Chem. Educ. 88, 665-669 (2011).
- Bain, A. D., Cramer, J. A. Slow Chemical Exchange in an Eight-Coordinated Bicentered Ruthenium Complex Studied by One-Dimensional Methods. Data Fitting and Error Analysis. J. Magn. Res., Series A. 118, 21-27 (1996).
- Sandstrom, J. . Dynamic NMR Spectroscopy. , (1982).
- Castanar, L., Nolis, P., Virgili, A., Parella, T. Measurement of T1/T2 Relaxation Times in Overlapped Regions from Homodecoupled 1H Singlet Signals. J. Magn. Reson. 244, 30-35 (2014).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. New Platinum-Catalysed Dihydroalkoxylation of Allenes. Adv. Synth. Catal. 352, 2189-2194 (2010).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. Platinum-Catalysed Bisindolylation of Allenes: A Complementary Alternative to Gold Catalysis. Chem. Eur. J. 18, 4499-4504 (2012).
- Hurtado-Rodrigo, C., Hoehne, S., Muñoz, M. P. A New Gold-Catalysed Azidation of Allenes. Chem. Comm. 50, 1494-1496 (2014).
- Vrieze, K., Volger, H. C., Gronert, M., Praat, A. P. Intramolecular Rearrangements in Platinum--Tetramethylallene Compounds as Influenced by Ligands Trans to the Allene Group. J. Organometal. Chem. 16, 19-22 (1969).
- Vrieze, K., Volger, H. C., Praat, A. P. Complexes of Allenes with Platinum (II) and Rhodium (I). J. Organometal. Chem. 21, 467-475 (1970).
- Brown, T. J., Sugie, A., Leed, M. G. D., Widenhoefer, R. A. Structures and Dynamic Solution Behavior of Cationic, Two-Coordinate Gold(I)-π-Allene Complexes. Chem. Eur. J. 18, 6959-6971 (2012).
- Yang, W., Hashmi, S. K. Mechanistic Insights into the Gold Chemistry of Allenes. Chem. Soc. Rev. 43, 2941-2955 (2014).
- Quiros, M. T., Angulo, J., Munoz, M. P. Kinetics of Intramolecular Chemical Exchange by Initial Growth Rates of Spin Saturation Transfer Difference Experiments (SSTD NMR). Chem. Commun. 51, 10222-10225 (2015).
- Mayer, M., Meyer, B. Characterization of Ligand Binding by Saturation Transfer Difference NMR Spectroscopy. Ang. Chem. Int. Ed. 38, 1784-1788 (1999).
- Angulo, J., Nieto, P. STD-NMR: Application to Transient Interactions Between Biomolecules - A Quantitative Approach. Eur. Biophys. J. 40, 1357-1369 (2011).
- Kemper, S., Patel, M. K., Errey, J. C., Davis, B. G., Jones, J. A., Claridge, T. D. W. Group Epitope Mapping Considering Relaxation of the Ligand (GEM-CRL): Including Longitudinal Relaxation Rates in the Analysis of Saturation Transfer Difference (STD) Experiments. J. Magn. Reson. 203, 1-10 (2010).
- Berger, S., Braun, S. . 200 and More NMR Experiments: A Practical Course. , (2004).
- Cutting, B., Shelke, S. V., Dragic, Z., Wagner, B., Gathje, H., Kelm, S., Ernst, B. Sensitivity Enhancement in Saturation Transfer Difference (STD) Experiments Through Optimized Excitation Schemes. Magn Reson Chem. 45, 720-724 (2007).
- Ley, N. B., Rowe, M. L., Williamson, R. A., Howard, M. J. Optimising Selective Excitation Pulses To Maximize Saturation Transfer Difference NMR Spectroscopy. RSC Adv. 4, 7347-7351 (2014).
- Antanasijevic, A., Ramirez, B., Caffrey, M. Comparison of the Sensitivities of WaterLOGSY and Saturation Transfer Difference NMR Experiments. J. Biomol. NMR. 60 (1), 37-44 (2014).
- Jarek, R. L., Flesher, R. J., Shin, S. K. Kinetics of Internal Rotation of N,N-Dimethylacetamide: A Spin-Saturation Transfer Experiment. J. Chem. Ed. 74, 978-982 (1997).
- Forsen, S., Hoffman, R. A. Exchange Rates by Nuclear Magnetic Multiple Resonance. III. Exchange Reactions in Systems with Several Nonequivalent Sites. J. Chem. Phys. 40, 1189-1196 (1964).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados