Method Article
Spin Sättigungstransfer-Differenz-NMR (SSTD NMR): Ein neues Werkzeug zu erhalten kinetischen Parameter der chemischen Austauschprozesse
In diesem Artikel
Zusammenfassung
A detailed protocol describing the SSTD NMR method is presented here to help new users apply this new method to obtain the kinetic parameters of their own systems undergoing chemical exchange.
Zusammenfassung
Diese detaillierte Protokoll beschreibt die neue Spin Sättigungstransfer-Differenz Kernspinresonanz-Protokoll (SSTD NMR), die vor kurzem in unserer Gruppe entwickelten Verfahren der gegenseitigen Ort chemischen Austausch zu studieren, die schwer mit herkömmlichen Methoden zu analysieren. Wie der Name schon vermuten lässt, kombiniert diese Methode die Spin-Methode Sättigungstransfer für kleine Moleküle verwendet, mit dem Sättigungstransfer-Differenz (STD) NMR-Methode zur Untersuchung von Protein-Ligand-Interaktionen eingesetzt, durch transiente Spinsättigungstransfer Messung Sättigungszeiten entlang zunehmender (Build -up Kurven) in kleinen organischen und metallorganischen Moleküle chemischen Austausch unterzogen.
Vorteile dieses Verfahrens gegenüber existierenden sind: es besteht keine Notwendigkeit Koaleszenz der Austausch von Signalen zu erreichen; kann das Verfahren solange ein Signal der Austausch von Websites isoliert angewendet werden; besteht keine Notwendigkeit , T 1 oder eingeschwungenen Zustand erreichen die Sättigung zu messen; Geschwindigkeitskonstante vaLues werden direkt gemessen, und T & sub1 ; -Werte sind in dem gleichen Experiment unter Verwendung von nur einem Satz von Experimenten erhalten.
Um das Verfahren zu testen, haben wir die Dynamik der gehinderten Rotation von N, N -dimethylamides untersucht, für die viele Daten zum Vergleich zur Verfügung steht. Die thermodynamischen Parameter mit SSTD erhalten werden, sind sehr ähnlich zu den berichteten diejenigen (Spin-Sättigungstransfertechniken und Linienformanalyse). Das Verfahren kann auf anspruchsvollere Substrate aufgebracht werden, die nicht von früheren Verfahren untersucht werden können.
Wir sehen, dass die einfache experimentelle Aufbau und die breite Anwendbarkeit des Verfahrens auf eine große Vielfalt von Substraten wird dies eine übliche Technik unter ökologischen und Metallorganikern ohne umfangreiches Know-how in der NMR machen.
Einleitung
Chemische Austausch bezieht sich allgemein auf jede inter- oder intramolekularen Prozess, in dem ein Kern von einer Umgebung in eine andere bewegt, in der seine NMR-Parameter (chemische Verschiebung, skalare Kopplung, dipolaren Kopplung, Relaxationsrate) unterscheiden. Es gibt zahlreiche Beispiele von chemischen Austausch in der organischen und metallorganischen Moleküle (zB Rotationsbarrieren in Biarylen, Ring Spiegeln Barrieren und Konformationsgleichgewicht, Stickstoff Inversion, die Ligandenbindung, degenerierten Ligandenaustausch und Tautomerisierung). 1-3 Die chemische Wechselkurs wird im Zusammenhang mit die Thermodynamik der Barriere des Austauschprozesses und damit seine Studie ist von entscheidender Bedeutung, Molekulardynamik dieser Systeme zu verstehen.
Das klassische Zeichen des dynamischen Austausch in der NMR ist eine dramatische Veränderung in der Linienform der NMR-Signale, wie sich die Temperatur ändert. Bei niedrigen Temperaturen ist das Verfahren langsam und zwei unterschiedliche chemische Verschiebungen sind Beobachved. Bei hohen Temperaturen verschmelzen die beiden Signale zu einem Signal, das als "Koaleszenz" bekannt ist. Bei mittleren Temperaturen, werden die Signale sehr breit. Diese Empfindlichkeit des NMR-Spektrums zu chemischen Austausch macht NMR eine sehr leistungsfähige Methode, um die Dynamik von Molekülen in Lösung zu untersuchen. Zwei Methoden wurden bei der Untersuchung von dynamischen Prozessen in Lösung , die hauptsächlich verwendet. Linienformanalyse, 4-7 und Spinsättigungstransfer Experimente 8-9 Außerdem ist es auch erwähnenswert ist die Umkehrung Übertragungsverfahren 10 und das CIFIT Programm 11 für die direkte Extraktion von Geschwindigkeitskonstanten, die eine relativ effizienten Ansatz für den Austausch Messungen in einfachen Systemen sind. Obwohl diese Verfahren in den meisten Fällen sehr gute Ergebnisse liefern, sie haben jedoch eine Reihe von Nachteilen. Der Hauptnachteil der Linienformanalyse sind die hohen Temperaturen in einigen Proben zu erreichen Verschmelzen benötigt wird . 12 Die wichtigsten Fragen , wenn ca zu berücksichtigenrrying out Spinsättigungstransferexperimente sind: die sehr lange Sättigungszeiten erforderlich , um den stationären Zustand Sättigungstransfer zwischen den Austauschstellen zu erreichen, und die Notwendigkeit , die longitudinale Relaxationszeit, T 1, um zu bestimmen , was schwierig sein kann , wenn es eine Überlappung der verschieden ist Signale im Bereich der Studie. 13
Im Rahmen unserer Untersuchungen in organometallische Mechanismen ist 14-16 unsere Gruppe das fluktuierende Verhalten von Platin-Allenkomplexe in Lösung zu studieren. Dies ist eine komplexe Aufgabe, die mindestens drei verschiedene Prozesse beinhaltet, von denen die π-face wobei Austausch oder Drehung des Metalls um einen der Allenachse. Wir stießen auf, dass normale VT Experimente und Linienformanalysetechniken , die zuvor in ähnlichen Systemen verwendet wurden, 17-19 in unserer Studie nicht geeignet waren, aufgrund einer sehr langsamen Drehung in unserem Platin-Allen - Komplex, der die Koaleszenz Temperatur des aus signals von Interesse höher als die Temperatur der Zersetzung des Komplexes.
Um diese Einschränkung zu überwinden, die wir entwickelt und vor kurzem berichtet , ein neues NMR - Protokoll (SSTD NMR) Prozesse der gegenseitigen Ort chemischen Austausch zu studieren. 20 Wie der Name dieser Methode schlägt die Spin Sättigung Transfer - Methode für kleine Moleküle verwendet , kombiniert mit der Sattigungsubertragung Difference NMR - Methode für die Untersuchung von Protein-Ligand - Interaktionen eingesetzt, 21-24 durch transiente Spinsättigungstransfer Messung entlang Sättigungszeiten zu erhöhen (build-up - Kurven) in kleinen Molekülen chemische Austausch unterzogen.
Mit dieser neuen Methode (SSTD NMR) haben wir gezeigt, dass wir die kinetischen Parameter der intramolekularen chemischen Austausch in kleinen organischen und organometallischen Molekülen einige zusätzliche Vorteile gegenüber herkömmlichen Ansätzen erhalten: Koaleszenz der Signale nicht erforderlich ist, so dass ein flexibler Temperaturbereich kann verwendet werdenin der Studie; Signalüberlappung nicht stört, obwohl mindestens eine der Austausch Resonanzen getrennt werden sollte; besteht keine Notwendigkeit , T 1 oder eingeschwungenen Zustand erreichen die Sättigung zu messen; Geschwindigkeitskonstante Werte werden direkt und T & sub1 ; -Werte gemessen werden , in dem gleichen Experiment erhalten wurde , nur eine Reihe von Experimenten unter Verwendung von . Ein weiterer bemerkenswerter Vorteil der SSTD NMR Methodik ist, dass im Gegensatz zur Analyse Linienform, die Bestimmung der Kinetik Geschwindigkeitskonstanten nicht durch die Erhöhung der Koaleszenz Temperaturen mit hohen Magnetfeldern zugeordnet begrenzt. Somit ist unsere Methodik dann sehr gut für niedrige und hohe Magnetfelder angeeignet. Dieser Artikel soll neuen Benutzern zu helfen, diese neue Methode, um ihre eigenen Systeme unterziehen chemischen Austausch anzuwenden und beschreibt die Probenvorbereitung, Versuchsaufbau, Datenerfassung, und ein Beispiel für die Datenverarbeitung und Analyse in einem einfachen organischen Moleküls.
Protokoll
Achtung: Bitte konsultieren Sie alle relevanten Sicherheitsdatenblätter (MSDS) vor dem Gebrauch.
1. NMR-Probenvorbereitung
- Wiegen 5 mg N, N - Dimethylacetamid, in den ein NMR - Röhrchen geeignet für niedrige Temperaturen und lösen sich in 0,6 ml Toluol - d 8.
2. NMR Experimenteller Aufbau 25
- NOE Spectra Acquisition
- Führen Sie eine eindimensionale NOE (Nuclear - Overhauser - Effekt) Experiment. 26
HINWEIS: NOE-Effekte bei jeder Temperatur passieren kann. Eine eindimensionale NOE-Spektrum das Signal Bestrahlen, die in der SSTD NMR Experiment bestrahlt wird, bei -40 ° C wurde aufgezeichnet, um sicherzustellen, dass die Rotation und die Magnetisierungstransfer in der Probe hier verwendet wurde, minimiert und somit die NOE, falls vorhanden, würde vorherrschen und in diesem Experiment gemessen werden. Idealer shoul, NOE-Effekte zwischen den beiden Austauschkerned nicht vorhanden sein, Interferenzen mit dem SSTD Verfahren zu vermeiden.
- Führen Sie eine eindimensionale NOE (Nuclear - Overhauser - Effekt) Experiment. 26
- SSTD NMR-Experimente-Setup
- Legen Sie die Probe im Magneten durch erste Typisierung ej in der Befehlszeile der Software auf den Luftstrom einzuschalten. Dann legen Sie die Probe auf der Oberseite des Magneten und dann ij geben. Warten Sie, bis die Probe innerhalb des Magneten ist.
- Sobald die Probe im Magneten, Typ versehenes Werkzeug in der Befehlszeile. Ändern, um die Temperatur auf die erste ausgewählte Temperatur das Experiment durchzuführen (295,5 K in diesem Fall). Lassen Sie die Probe für mindestens 20 min bei der gewählten Temperatur zu stabilisieren.
- Durchführen einer 1D - 1 H-NMR - Experiment an der Probe.
- Erstellen Sie einen neuen Datensatz einer 1 H-NMR - Experiment. Dazu klicken Sie auf Datei / Neu und nennen Sie das neue Experiment.
- Geben Sie nacheinander und wartet auf den vorherigen Befehl zu beenden: lock, Atma, topshim, getprosol und RGA.
- Geben Sie zg das Proton Experiment zu erwerben. Sobald sie es verwandeln Typ EFP und apk Fourier beendet ist und die Phase einzustellen.
- Erstellen Sie einen neuen Datensatz von zum Beispiel ein 1 H - NMR - Experiment. Dazu klicken Sie auf Datei / Neu und nennen Sie das neue Experiment.
- In diesem neuen Datensatz, geben Sie in der Befehlszeile rpar. Wählen Sie eine der "STDDIFF" Parametersätze aus der Liste, zum Beispiel STDDIFFESGP, und klicken Sie auf "lesen" und dann "Alle" (Abbildung 1). Alternativ dazu tun dies , indem alle rpar STDDIFFESGP eingeben.
HINWEIS: Das Experiment kann mit dieser Impulsfolge durchgeführt werden. Jedoch verwendet das Impulsprogramm in unserem Experiment war STDDIFF. - Um die STDDIFF Pulssequenz auszuwählen, klicken Sie auf die Schaltfläche mit den drei Punkten in der PULPROG Linie (Abbildungen 2 und 3).
- Bevor die SSTD NMR - Experiment durchgeführt wird , kalibrieren 1 H 90 ° hart pulse (p1). Zu diesem Zweck ist sicherzustellen, dass die Probe in dem Magneten ist, bei der gewünschten Temperatur (Schritt 2.2.2). Geben Sie pulsecal in der Befehlszeile und kopieren Sie den Wert des 90 ° Impulses bei der höheren Leistung (PL1 = -1 dB in diesem Fall), dh derjenige, der den kürzesten Impuls (Abbildung 4) ergibt.
- Einzuführen, um die Werte für die kalibrierte Fest Impuls in dem Experiment. Typ getprosol 1H (Wert für p1 in Schritt 2.2.7) erhalten (Wert für PL1) (Abbildung 5).
- Stellen Sie die Länge des geformten Pulses. Typ p13 und stellen einen Wert von 50.000 & mgr; s (Abbildung 6).
- Stellen Sie den selektiven Pulsform. Um dies zu tun, zur Macht gehen und klicken Sie auf den "Bearbeiten ..." , um SHAPE (Abbildung 7). Gehen Sie auf die geformten Puls 13 und wählen: Gaus 1,1000 (Abbildung 8).
- Stellen Sie die selektive Impulsleistung (SP13). Setzen Sie ihn auf etwas angemessen, das heißt , Auf diesem System zwischen 40-60 dB (entsprechend einer Feldstärke von etwa 120 Hz) (Abbildung 8). Zu hohe Feldstärken können zu nicht akzeptablen Sättigungseffekten führen. 27-29
HINWEIS: 50 dB war optimal in unserem Fall. Berücksichtigen Sie, dass dies ein Dämpfungsskala, also je kleiner der Wert, desto höher die Leistung der Radiofrequenz. Wie es um die sättigenden Gaussian Kaskade entspricht, die für lange Zeit (mehrere Sekunden) angewendet wird, sollte SP13 nicht unter 40 dB gehen (falls nötig, konsultieren Sie die Gerätespezifikationen, so lange Pulse mit hoher Leistung die Probenkopf beschädigen könnte). Nach unserer Erfahrung 41-61 dB über die Abschwächung der harten 1 H 90 ° Impuls (-1 dB in dieser Arbeit) funktioniert gut. Versuchen Sie, immer die höchste Dämpfung auswählen möglich, die zu ähnlichen Sättigungsniveau. - Geben ns und setzen Sie ihn auf 8 und geben Sie ds und setzen Sie ihn auf 4.
3. NMR-Datenerfassung eind Verarbeitung 25
- SSTD NMR Experiment Acquisition
- Öffnen Sie die 1 H - NMR - Experiment durchgeführt , in Schritt 2.2.3 zu prüfen , wo das Signal , das ist bestrahlt wird. Dazu das Experiment in der Software-Browser suchen, klicken Sie rechts im Datensatz und klicken Sie auf "Anzeige in einem neuen Fenster".
- Bewegen Sie den Cursor-Linie in die Mitte des Signals zu bestrahlen und notieren Sie sich die chemische Verschiebung in ppm. Wählen Sie die spektrale Breite, die in dem Experiment verwendet.
HINWEIS: In diesem Fall wird das Signal, welches bestrahlt wird, ist bei 2,17 ppm, und die spektrale Breite verwendet wurde, war 1,46 ppm. Stellen Sie sicher, dass keine chemische Verschiebung Korrektur verwendet wird, oder die Bestrahlungsfrequenz kann falsch eingestellt. - Gehen Sie auf die zuvor erstellte SSTD NMR-Experiment mit dem in Abschnitt 2.2 genannten Einrichtung.
- Erstellen Sie eine Liste mit den Frequenzen der Bestrahlung. Dazu geben Sie in der Befehlszeile fq2list und eine bestehende Liste aus.
- Bearbeiten Sie die ListeBestrahlungsfrequenzen einschließlich der folgenden Daten in den drei ersten Reihen (Abbildung 9): Zeile 1. P (zeigt an, dass die folgenden Daten in ppm); Row 2 Frequenz des Signals in ppm bestrahlt werden, wie in 3.1 gemessen.. 1; Reihe 3,40 ppm (eine Frequenz , die weit von den 1 H - Signale der Verbindung ist , so dass die Bestrahlung in dieser Frequenz nicht die Spektren nicht beeinträchtigt).
- Speichern Sie die Liste mit einem neuen Namen und dann in der Befehlszeile eingeben fq2list und wählen Sie die Liste gerade erstellt haben .
- Zur Zentrierung das Experiment auf die Signale untersuchten Typ O1P und wählen Sie als das Zentrum des Experiments die chemische Verschiebung des Signals , das bestrahlt wird.
- Typ sw die spektrale Breite zu wählen (1,46 ppm in diesem Fall, aber auch jede andere spektrale Breite kann gewählt werden).
HINWEIS: Wenn die Erfassungszeit erhalten, nachdem die spektrale Breite zu ändern ist zu lang (die mehr Rauschen in den Spektren einführen wird) es can eingestellt werden , AQ , indem Sie den gewünschten freien Induktionszerfalls (FID) Auflösung (FIDRES, 0,25 Hz in diesem Fall) zu liefern. - Wählen Sie den Wert für die Inter Relaxationsdelay D1. Sicherzustellen , dass sie mindestens 1 bis 5 - fachen Wert der T 1 des langsamsten entspannend Proton.
HINWEIS: Wir setzen auf 40 sec auf, die die längste Sättigungszeit (D20) in dem Experiment ist. Auf diese Weise allen Versuchen halten die gleiche Gesamt "pro Scan" Zeit (Verzögerung + Sättigungszeit + Pulse + Erfassungszeit). - Typ D1 und setzen Sie ihn auf 40 sec.
- Stellen Sie den ersten Wert für die Sättigungszeit von D20 eingeben und es bis zu 40 Sekunden einstellen. Bestimmen Sie die Empfängerverstärkung (rg) automatisch durch RGA eingeben.
- Erstellen Sie das nächste Experiment , indem Sie iexpno. Typ D20 und eine Sättigungszeit von 20 sec in diesem Experiment aus. Typ RGA automatisch rg bestimmen.
- Wiederholen Sie den letzten Schritt für D20 = 10, 5, 2,5, 1,25, 0,625, 0,3 Sek.
- Nachdem alle Versuche erstellt werden, öffnen Sie die erste und in der Art multizg Befehlszeile und geben Sie die Anzahl der Versuche, 8 in diesem Fall (dh multizg 8).
- SSTD NMR Experiment Verarbeitung
- Öffnen Sie die PROCNO 1 (Prozessnummer) von EXPNO 1 (Experiment Nummer) des Satzes (die mit der höheren Sättigungszeit).
- In der Art lb Befehlszeile und den Wert auf 1,5 eingestellt.
HINWEIS: Bei Spektren mit sehr hohem Signal-zu-Rausch-Verhältnisse dieser Wert verringert werden kann; Umgekehrt könnte es für noisy Experimente erhöht werden, wenn die spektrale Auflösung nicht schwerwiegend beeinträchtigt wird. - In der Befehlszeile Typ EFP und Prozess FID # = 1 ( "on-Resonanz" Spektrum) in PROCNO = 2 (Abbildung 10).
- Korrigieren Sie die Phase des Experiments durch die interaktive Phasenkorrektur b klickenutton und sie als 2D-Experiment speichern. Speichern und Beenden (Abbildung 11).
- Typ rep 1 in der Befehlszeile zu dem PROCNO 1 zu gehen.
- In der Befehlszeile Typ EFP und Prozess FID # = 2 ( "off-Resonanz" Spektrum) in PROCNO = 3 (Abbildung 12).
- In der Befehlszeile Typ .md und dann 2 rep ein mehrere Anzeigefenster mit beiden verarbeiteten Spektren zeigen: 2 (der mit dem Signal in der Mitte gesättigt) und 3 (demjenigen , in dem der sättigenden Impulsfolge bei 40 ppm angewandt wurde ) (Abbildung 13).
- Klicken Sie auf die Schaltfläche mit einem Delta - Zeichen (Abbildung 13) , um den Differenzspektren zu berechnen und sie in PROCNO 4. Beenden Sie das mehrere Anzeigefenster speichern.
- Wählen Sie eine Integrationsbereich für das Signal auf der linken Seite (das Signal, in dem die Übertragung der Sättigung aufgrund der chemischen Austauschprozess wird beobachtet werden). Immer integrieren, um die Region in PROCNO 3 und PROCNO 4.
Hinweis: Der Bereich Integration in diesem Experiment verwendet wurde, 2,55-2,67 ppm. - Einmal integriert, gehen Sie auf die "Integrale" Reiter in jedem der Experimente , und kopieren Sie den Wert von "Integral [abs]" (Abbildung 14).
- Teilen Sie das Integral in PROCNO 4 durch das Integral in PROCNO 3. dass der Wert von η SSTD für eine Sättigungszeit von 40 sec (η SSTD = Spin Sättigungstransfer - Differenz - Parameter). 21
- Wiederholen des Verfahrens für den Rest der Versuche mit unterschiedlichen Sättigungszeiten.
4. Datenanalyse 30
- Die Analyse der Daten der kinetischen Parameter zu erhalten
- Zeichnen Sie die erhaltenen η SSTD Werte im Vergleich zum Sättigungszeit. 21
- Führen Sie eine exponentielle Anpassung der erhaltenen Kurven der Gleichung einzustellen
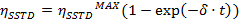

 =
= 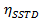 bei sehr langen Sättigungszeit
bei sehr langen Sättigungszeit
t = Zeit - Berechnen der Werte von η SSTD MAX und δ und nutzen sie die Werte der Geschwindigkeitskonstanten (k) und Relaxationszeiten (T 1A) gemäß den folgenden Gleichungen zu berechnen:

T1A = longitudinale Relaxationszeit Konstante von Spin A
k = gegenseitigen Ort-Austausch-Konstante kinetische Geschwindigkeit- Besorgen Sie sich die kinetische Geschwindigkeitskonstante von:
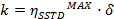
- Besorgen Sie sich die kinetische Geschwindigkeitskonstante von:
- Eyring Plot der thermodynamische Parameter zu erhalten
- Plot ln (k / T) gegen 1 / T (T = absolute Temperatur), die Werte des kine mit tic Raten bei verschiedenen Temperaturen.
- Führen Sie eine lineare Anpassung der Daten erhalten, um die Eyring-Gleichung anpassen:
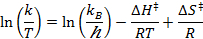
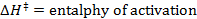
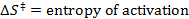
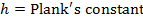
R = Gaskonstante
k B = Boltzmann - Konstante
T = absolute Temperatur - Berechnen Sie die thermodynamischen Parameter & Delta; H ≠ und & Delta; S ≠.
- Berechnen Sie die Werte für E A (298) und & Delta; G ≠ (298) unter Verwendung der folgenden Gleichungen:
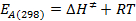
s / ftp_upload / 54499 / 54499eq13.jpg "/>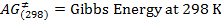
Ergebnisse
Die SSTD NMR - Technik zur Berechnung der kinetischen Parameter in der Rotation der Amidbindung von N, N - Dimethylacetamid angewendet wurde. 21 Dies ist ein einfaches Beispiel für die umfangreiche Vergleichsdaten können in der Literatur gefunden werden. 31
Die gehinderten Rotation um die Amidbindung, aufgrund der partiellen Doppelbindungscharakter in der Resonanzform unterscheidet beide Methylgruppen in zwei Signale in dem 1 H-NMR - Spektren (2,61 ppm und 2,17 bei 22,5 ° C). Spin Sättigung des Signals der Methylgruppe bei 2,17 ppm (Me B) führt zum Verschwinden seines Signals in den 1 H - NMR. Nach Sättigung der Me B, Übertragung der Sättigung zu der anderen Methylgruppe (Me A) aufgrund des Innendrehvorgang kann durch eine Abnahme der 1 H - Intensität in dem Signal bei 2,61 ppm beobachtet werden. Die magnitude dieser Abnahme hängt von der Sättigungszeit abhängen. Abbildung 15 das 1 H - NMR - Spektren des N, N - Dimethylacetamid bei 22,5 ° C zeigt, und die Dehnungen zeigen die Spektren ohne (a) und (b) eine Sättigung des Methyl Gruppe bei 2,17 ppm, sowie die Differenzspektrum (c), verwendet , um die Werte von η SSTD zu berechnen. Der η SSTD Faktor berechnet den Wert des Integral von Me A im SSTD NMR - Spektrum (c) durch den Wert des Integral der Me A in Spektren Teilen (a), wie im Protokoll erklärt. Die erhaltenen Werte von η SSTD für jede Sättigungszeit bei verschiedenen Temperaturen sind in Tabelle 1 gesammelt. Das Grundstück der erhaltenen Werte von η SSTD gegenüber dem Sättigungszeit gab exponentieller Kurven , in denen ein Plateau bei höheren Sättigungszeiten erreicht wurde. Für eine bestimmte Temperatur erlaubt die exponentielle Anpassung der Kurve auf die Berechnung der RateKonstante (k) und die Relaxationszeit des 1 H des gemessenen Signals (T 1A) (Abbildung 16). Abbildung 17 zeigt alle erhaltenen Kurven zusammen mit dem k und T 1A - Werte in den Passungen erhalten.
Schließlich wurden die Auftragung von ln (k / T) gegen 1 / T und der Anpassung an die Eyring - Gleichung (18) verwendet , um die Enthalpie und Entropie - Aktivierung zu berechnen. Die ermittelten Aktivierungsparameter sind in Tabelle 2 zusammen mit den zuvor berichteten Parameter gezeigt unterschiedlichen Methoden berechnet.
Wie die Werte der Aktivierungsparameter mit dem Spin Sättigungstransfer - Differenz - Technik (SSTD NMR) sind in ausgezeichneter Übereinstimmung mit den Daten , die zuvor erhalten in Tabelle 2 beobachtet werden , berichtet , andere Techniken, wie NMR oder SSTLinienformanalyse. Der breite Bereich von Werten für & Delta; S ‡ gemeldet ist aufgrund der Schwierigkeit bei der Messung dieses Parameters mit NMR - Techniken. 31 Wie für den Rest der Aktivierungsparameter, die Werte mit unserem Verfahren erhalten werden , nicht nur sehr ähnlich denen , die bereits berichtet sondern auch genauer, da unsere Fehler (SD) kleiner sind in allen Fällen.
Abbildung 1: Liste der Experimente nach rpar eingeben. Die Abbildung zeigt die verschiedenen Parametersätze unter denen STDDIFFESGP ausgewählt werden soll. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
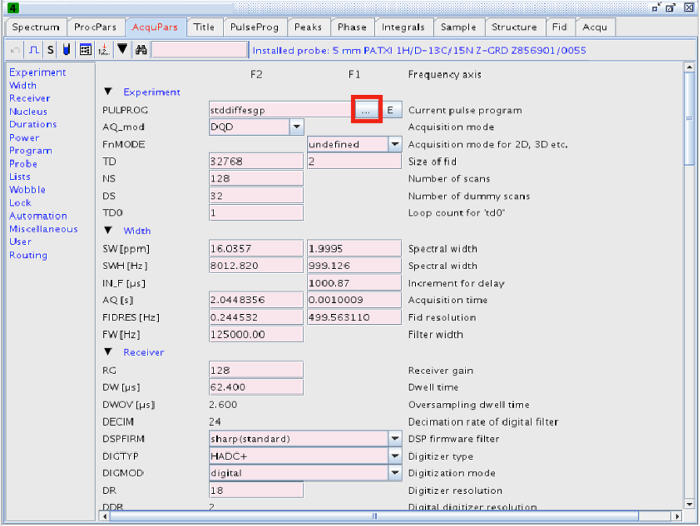
Abbildung 2:.. Erfassungsparameter Die Schaltfläche in einem roten Quadrat , um eine Liste der verschiedenen Pulsprogramme führt hervorgehoben Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
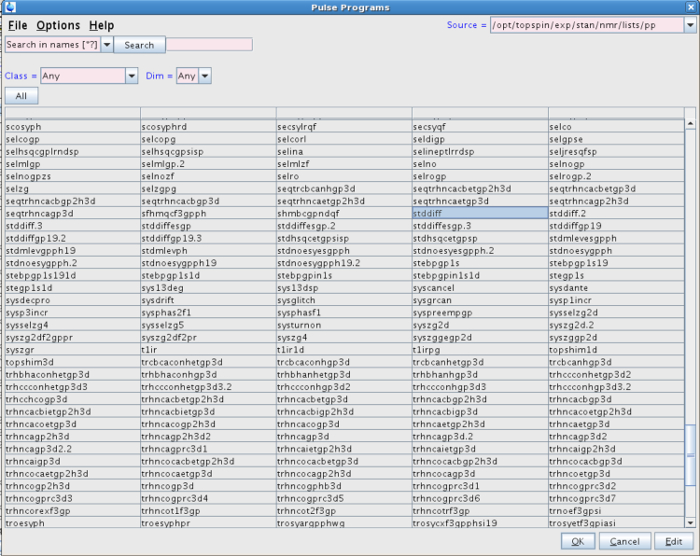
Abbildung 3:.. Liste der Pulsprogramme Die Abbildung zeigt die gewählte Impulsprogramm im Experiment (STDDIFF) Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
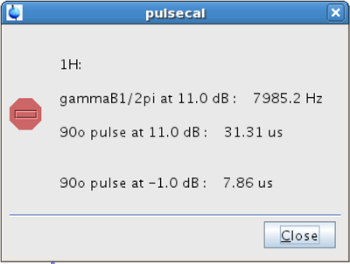
Abbildung 4: Pop-up - Fenster erscheint nach dem 90º - Impuls Kalibrierung Die Figur , die die Werte der kalibrierten zeigt 90 &. # 176; Puls bei unterschiedlichen Leistungspegeln. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
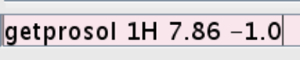
Abbildung 5:.. Screenshot von der Kommandozeile Die Abbildung zeigt , wie der Wert für den kalibrierten harten Puls einzuführen Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6:. Wert für die Länge des geformten Pulses Die Abbildung zeigt , wie der Wert für die Länge des geformten Pulses einzuführen. g6large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 7:.. Acquisition Parameter Die Abbildung zeigt die Leistungsparameter Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
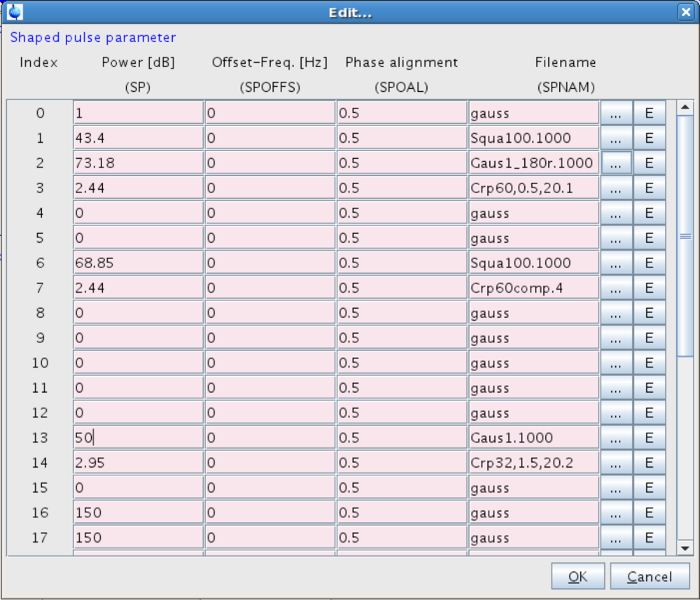
Abbildung 8:. Parameter für den geformten Puls Die Werte für die Form Impuls 13 in Leitung eingeführt werden Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
pload / 54499 / 54499fig9.jpg "/>
. Abbildung 9: Liste der Bestrahlungsfrequenzen Die Abbildung enthält die folgenden Daten in den drei ersten Zeilen: Zeile 1. P (zeigt an, dass die folgenden Daten in ppm); Row 2 Frequenz des Signals in ppm bestrahlt werden, gemessen. in 3.1.1; Row 3,40 ppm (eine Frequenz , die weit von den 1 H - Signale der Verbindung ist , so dass die Bestrahlung in dieser Frequenz nicht die Spektren nicht beeinflusst). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
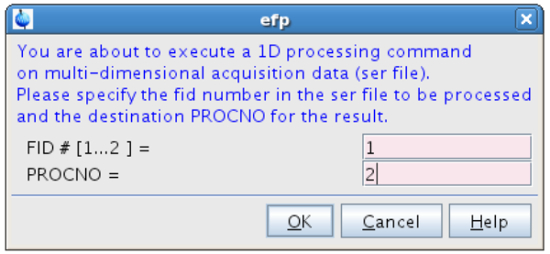
Abbildung 10:. Die Verarbeitung des ersten FID Die Abbildung zeigt die Pop - up - Fenster , das nach der Eingabe von efp erscheint. nk "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
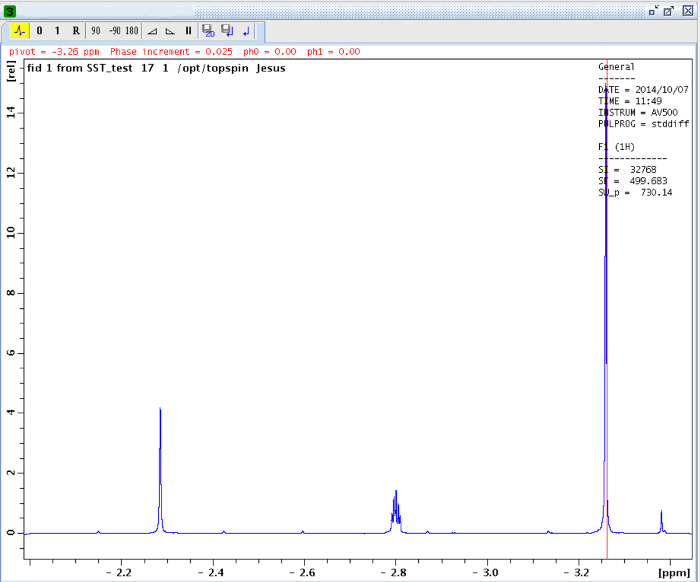
Abb . 11:. Die Phasenkorrektur Screenshot das Fenster für die manuelle Phasenkorrektur zeigt Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
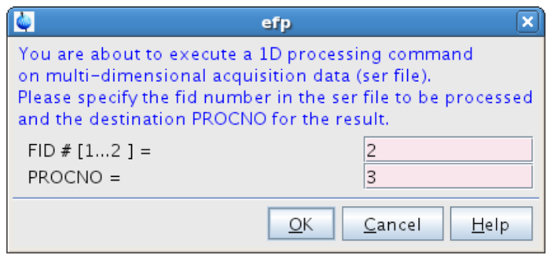
Abbildung 12:. Die Verarbeitung des zweiten FID Die Abbildung zeigt die Pop - up - Fenster , das efp nach der Eingabe angezeigt. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
13 "src =" / files / ftp_upload / 54499 / 54499fig13.jpg "/>
Abbildung 13: Mehrfachdarstellung von Spektren 2 und 3. Die Taste in einem roten Quadrat markiert ist derjenige , der die Differenzspektren zu berechnen. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
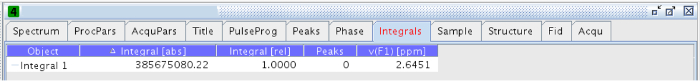
Abb . 14:. Integralen Registerkarte Die Abbildung zeigt die Werte der absoluten und relativen Integrale Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
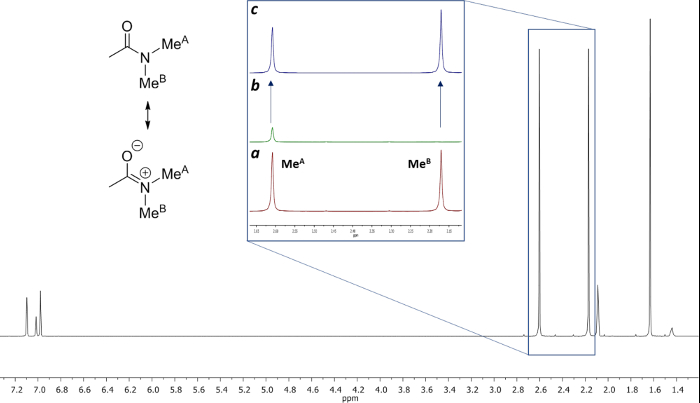
Abbildung 15: Aufbau und 1 g> H NMR Spektren von N, N - Dimethylacetamid bei 22,5 ° C in Toluol-d 8 (a) 1 H NMR Erweiterung des Bereichs von 2,13 bis 2,66 ppm vor der Bestrahlung. (B) Expansion des gleichen Bereichs nach der Bestrahlung der Methylgruppe bei 2,17 ppm. (C) Differenzspektrum [(a) - (b)]. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
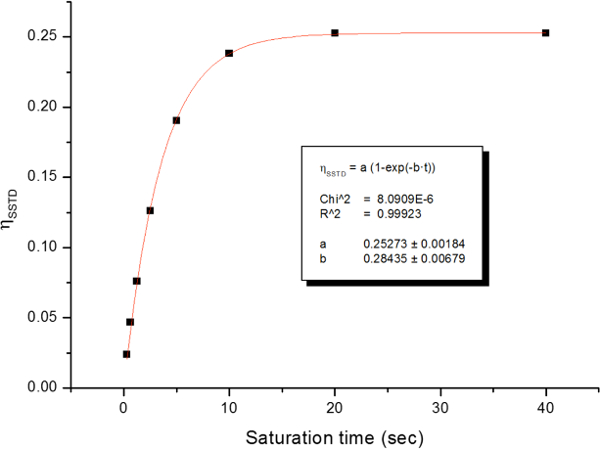
Abbildung 16: Beispiel für die Auftragung von η SSTD und seine Exponentialfit bei 278 K. Reproduziert von den Hintergrundinformationen von Referenz 21 mit Genehmigung der Royal Society of Chemistry.http://ecsource.jove.com/files/ftp_upload/54499/54499fig16large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
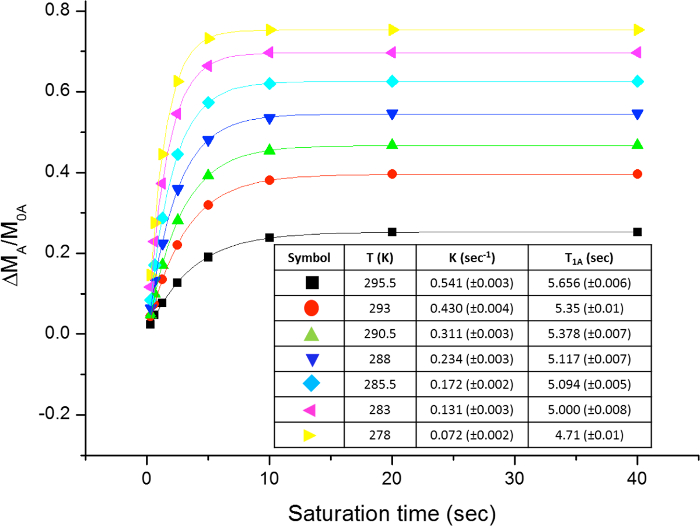
Abbildung 17: Grund η SSTD vs. Sättigungszeit bei verschiedenen Temperaturen. Die Abbildung zeigt das Diagramm für N, N - Dimethylacetamid und der Tabelle mit den erhaltenen Raten Konstanten und Relaxationszeiten. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
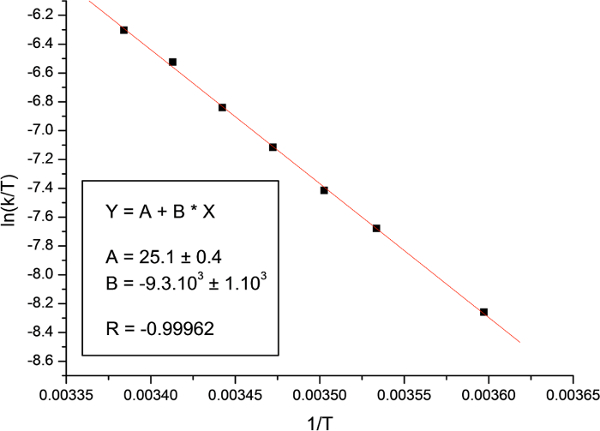
Abbildung 18:. Eyring Plot Die Abbildung zeigt das Diagramm für N, N - Dimethylacetamid. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| t saß (sec) | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD |
| (T = 278 K) | (T = 283 K) | (T = 285,5 K) | (T = 288 K) | (T = 290,5 K) | (T = 293 K) | (T = 295,5 K) | |
| 40 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 20 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 10 | 0,2383 | 0,3806 | 0,4537 | 0,5355 | 0,6199 | 0,6969 | 0,7535 |
| 5 | 0,1904 | 0,3193 | 0,3919 | 0,481 | 0,5734 | 0,6638 | 0,7318 |
| 2.5 | 0,1263 | 0,2204 | 0,2812 | 0,3589 | 0,4449 | 0,5461 | 0,626 |
| 1,25 | 0,0761 | 0,1353 | 0,171 | 0,2247 | 0,2868 | 0,3732 | 0,4449 |
| 0,625 | 0,0467 | 0,0739 | 0,099 | 0,1327 | 0,171 | 0,2291 | 0,2758 |
| 0,3 | 0,0238 | 0,044 | 0,0472 | 0,0644 | 0,0847 | 0,1169 | 0,1463 |
Tabelle 1:. Werte von η SSTD Die Tabelle zeigt die Werte bei verschiedenen Sättigungszeiten erhalten für N, N - Dimethylacetamid im Bereich von Temperaturen von 278 bis 295,5 K.
& Delta; H ‡ (kJ mol -1)| Methode | SSTD NMR | SST NMR 31 td> | Linienformanalyse | Linienformanalyse | Linienformanalyse |
| Parameter | (Diese Arbeit) | (1 H NMR) 4 | (1 H NMR) 5 | (13 C NMR) 6 | |
| E a 298 (kJ mol -1) | 79,7 ± 0,1 | 73,1 ± 1,4 | 70,5 ± 1,7 | 82,0 ± 1,3 | 79,5 ± 0,4 |
| 77,2 ± 0,1 | 70,6 ± 1,4 | 68 | 79,5 ± 0,4 | 76,6 ± 0,4 | |
| & Delta; S ‡ (J mol -1 K -1) | 11,5 ± 0,4 | -10,5 ± 5,0 | -15,0 ± 5,1 | 13 ± 8 | 3 ± 4 |
| & Delta; G ‡ 298 (kJ mol -1) | 73,8 ± 0,1 | 73,7 ± 2,0 | 720,5 | 75,3 ± 0,4 | 75,7 ± 0,4 |
| Lösungsmittel | Tol- d 8 | Tol- d 8 | CCl 4 | Aceton - d 6 | ordentlich |
Tabelle 2:. Aktivierungsparameter Die Tabelle zeigt die Aktivierungsparameter für die interne Rotation von N, N - Dimethylacetamid durch die SSTD NMR - Verfahren erhalten , verglichen mit den gleichen Parametern mit verschiedenen NMR - Methoden zur Analyse erhaltenen 4,5,6 Fehler in dieser Tabelle. beziehen sich auf die Standardabweichung Fehler (SD). (Wiedergabe aus Lit. 21 mit Genehmigung der Royal Society of Chemistry).
Diskussion
One of the more obvious advantages of this methodology is that the rate constants and the relaxation time for a given temperature can be obtained with a single set of experiments, with a robust pulse sequence (the same used for STD experiments to study protein-ligand interactions, which is typically found within the available set of experiments from the spectrometer manufacturer). This simplifies the experimental setup since there is no need to measure T1 or reach steady state saturation. Besides, it is remarkable that this method does not depend on the magnet strength, as coalescence methods. On the other hand, the main limitation is that this technique cannot be applied to chemical exchange processes too fast or too slow, which would depend on the temperature range of the NMR machine or the solvents used.
This new technique for the calculation of kinetic parameters can be applied to a great variety of substrates and its applicability has already been demonstrated with some interesting molecules.21 The kinetic parameters of the 4-N,N-dimethylamido[2.2]paracyclophane, a challenging substrate in which the signal of one of the methyl groups of interest is overlapped with other signals from the molecule, were successfully calculated using SSTD NMR. Interestingly, this methodology can be applied as long as one of the signals of study is isolated. SSTD NMR is also a useful protocol for the calculation of kinetic parameters in molecules in which the coalescence temperature is so high that the molecule decomposes before reaching it. This is the case with PtCl2(dimethylallene)(pyridine), in which the methodology was successfully applied without the need of reaching coalescence. The choice of solvents and temperatures is critical to obtain good results, since the chemical exchange rates can vary significantly with these parameters. Moreover, in addition to the criteria in a normal NMR experiment, key steps in a SSTD NMR experiment are the selectivity of the irradiation as well as the temperature control. Both factors have to be precise to guarantee the success of the experiment.
The representative results presented here are for the kinetics of intramolecular chemical exchange, but the technique can also be applied to study the kinetics of intermolecular chemical exchange and also ligand exchange, common processes in the dynamic behavior of transition metal complexes.
Finally, providing a proper modification of the equations is made,32 this method could be extended to deal with multi-site exchange and unequal populations, as it has been done in former double resonance experiments,8-9 increasing the usefulness of this technique for the study of chemical exchange processes in challenging compounds.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Funding by the University of East Anglia, the EPSRC (EP/L012855/1) and the EU (H2020-MSCA-IF-2014-EF-ST-658172) is gratefully acknowledged (MTQ).
Materialien
| Name | Company | Catalog Number | Comments |
| N,N-dimethylacetamide | Aldrich | 38840 | Acute toxicity |
| Toluene-d8 | Fluorochem | D-005 | Flammable and toxic |
| 500 MHz 7" Select Series NMR Tubes | GPE LTD | S-5-500-7 | |
| TopSpin 2.1 | TopSpin program, Bruker Corp., http://www.bruker.com/products/mr/nmr/nmr-software/software/topspin/ (2015). | ||
| Origin 6.0 | Origin 6.0 software, OriginLab Corp., http://originlab.com. | ||
| Bruker Avance III 500 MHz fitted with 5 mm broadband observed BBFOplus Z-gradient SmartProbeTM probe | Bruker Corp., http://www.bruker.com | ||
| Bruker Avance I 500 MHz Inverse Triple Resonance NMR spectrometer fitted with a 5 mm TXI Z-gradient probe | Bruker Corp., http://www.bruker.com | ||
| Ceramic Spinner standardbore shimsystems (5 mm) | Bruker Corp., http://www.bruker.com | H00804 |
Referenzen
- Bain, A. D. Chemical Exchange in NMR. Prog. Nuc. Mag. Res. Spect. 43, 63-103 (2003).
- Bain, A. D. Chemical Exchange. Modern Magnetic Resonance. , 421-427 (2006).
- Bain, A. D. Chapter 2 - Chemical Exchange. Ann. Rep. NMR Spect. 63, 23-48 (2008).
- Reeves, L., Shaddick, R., Shaw, K. Nuclear Magnetic Resonance Studies of Multi-site Chemical Exchange. III. Hindered Rotation in Dimethylacetamide, Dimethyl Trifluoro-acetamide, and Dimethyl Benzamide. Can. J. Chem. 49, 3683-3691 (1971).
- Drakenberg, T., Dahlqvist, K., Forsen, S. Barrier to Internal Rotation in Amides. IV. N,N-Dimethylamides. Substituent and Solvent Effects. J. Phys. Chem. 76, 2178-2183 (1972).
- Fujiwara, F., Airoldi, C. Carbon-13 NMR Study of the Barrier to Internal Rotation of N,N-Dimethylacetamide in the Adduct with Antimony(III) Chloride. J. Phys. Chem. 88, 1640-1642 (1984).
- Gutowsky, H. S., Holm, C. H. Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides. J. Chem. Phys. 25, 1228-1234 (1956).
- Forsen, S., Hoffman, R. A. A New Method for the Study of Moderately Rapid Chemical Exchange Rates Employing Nuclear Magnetic Double Resonance. Acta Chem. Scand. 17, 1787-1788 (1963).
- Forsen, S., Hoffman, R. A. Study of Moderately Rapid Chemical Exchange Reactions by Means of Nuclear Magnetic Double Resonance. J. Chem. Phys. 39, 2892-2901 (1963).
- Williams, T. J., Kershaw, A. D., Li, V., Wu, X. An Inversion Recovery NMR Kinetics Experiment. J. Chem. Educ. 88, 665-669 (2011).
- Bain, A. D., Cramer, J. A. Slow Chemical Exchange in an Eight-Coordinated Bicentered Ruthenium Complex Studied by One-Dimensional Methods. Data Fitting and Error Analysis. J. Magn. Res., Series A. 118, 21-27 (1996).
- Sandstrom, J. . Dynamic NMR Spectroscopy. , (1982).
- Castanar, L., Nolis, P., Virgili, A., Parella, T. Measurement of T1/T2 Relaxation Times in Overlapped Regions from Homodecoupled 1H Singlet Signals. J. Magn. Reson. 244, 30-35 (2014).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. New Platinum-Catalysed Dihydroalkoxylation of Allenes. Adv. Synth. Catal. 352, 2189-2194 (2010).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. Platinum-Catalysed Bisindolylation of Allenes: A Complementary Alternative to Gold Catalysis. Chem. Eur. J. 18, 4499-4504 (2012).
- Hurtado-Rodrigo, C., Hoehne, S., Muñoz, M. P. A New Gold-Catalysed Azidation of Allenes. Chem. Comm. 50, 1494-1496 (2014).
- Vrieze, K., Volger, H. C., Gronert, M., Praat, A. P. Intramolecular Rearrangements in Platinum--Tetramethylallene Compounds as Influenced by Ligands Trans to the Allene Group. J. Organometal. Chem. 16, 19-22 (1969).
- Vrieze, K., Volger, H. C., Praat, A. P. Complexes of Allenes with Platinum (II) and Rhodium (I). J. Organometal. Chem. 21, 467-475 (1970).
- Brown, T. J., Sugie, A., Leed, M. G. D., Widenhoefer, R. A. Structures and Dynamic Solution Behavior of Cationic, Two-Coordinate Gold(I)-π-Allene Complexes. Chem. Eur. J. 18, 6959-6971 (2012).
- Yang, W., Hashmi, S. K. Mechanistic Insights into the Gold Chemistry of Allenes. Chem. Soc. Rev. 43, 2941-2955 (2014).
- Quiros, M. T., Angulo, J., Munoz, M. P. Kinetics of Intramolecular Chemical Exchange by Initial Growth Rates of Spin Saturation Transfer Difference Experiments (SSTD NMR). Chem. Commun. 51, 10222-10225 (2015).
- Mayer, M., Meyer, B. Characterization of Ligand Binding by Saturation Transfer Difference NMR Spectroscopy. Ang. Chem. Int. Ed. 38, 1784-1788 (1999).
- Angulo, J., Nieto, P. STD-NMR: Application to Transient Interactions Between Biomolecules - A Quantitative Approach. Eur. Biophys. J. 40, 1357-1369 (2011).
- Kemper, S., Patel, M. K., Errey, J. C., Davis, B. G., Jones, J. A., Claridge, T. D. W. Group Epitope Mapping Considering Relaxation of the Ligand (GEM-CRL): Including Longitudinal Relaxation Rates in the Analysis of Saturation Transfer Difference (STD) Experiments. J. Magn. Reson. 203, 1-10 (2010).
- Berger, S., Braun, S. . 200 and More NMR Experiments: A Practical Course. , (2004).
- Cutting, B., Shelke, S. V., Dragic, Z., Wagner, B., Gathje, H., Kelm, S., Ernst, B. Sensitivity Enhancement in Saturation Transfer Difference (STD) Experiments Through Optimized Excitation Schemes. Magn Reson Chem. 45, 720-724 (2007).
- Ley, N. B., Rowe, M. L., Williamson, R. A., Howard, M. J. Optimising Selective Excitation Pulses To Maximize Saturation Transfer Difference NMR Spectroscopy. RSC Adv. 4, 7347-7351 (2014).
- Antanasijevic, A., Ramirez, B., Caffrey, M. Comparison of the Sensitivities of WaterLOGSY and Saturation Transfer Difference NMR Experiments. J. Biomol. NMR. 60 (1), 37-44 (2014).
- Jarek, R. L., Flesher, R. J., Shin, S. K. Kinetics of Internal Rotation of N,N-Dimethylacetamide: A Spin-Saturation Transfer Experiment. J. Chem. Ed. 74, 978-982 (1997).
- Forsen, S., Hoffman, R. A. Exchange Rates by Nuclear Magnetic Multiple Resonance. III. Exchange Reactions in Systems with Several Nonequivalent Sites. J. Chem. Phys. 40, 1189-1196 (1964).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten