Method Article
Spin saturazione Transfer Difference NMR (SSTD NMR): Un nuovo strumento per ottenere Kinetic parametri di processi a scambio chimico
In questo articolo
Riepilogo
A detailed protocol describing the SSTD NMR method is presented here to help new users apply this new method to obtain the kinetic parameters of their own systems undergoing chemical exchange.
Abstract
Questo protocollo dettagliato descrive la nuova rotazione di saturazione Transfer Difference magnetica nucleare protocollo Resonance (SSTD NMR), recentemente messo a punto nel nostro gruppo per studiare i processi di reciproco loco scambio chimico che sono difficili da analizzare con i metodi tradizionali. Come suggerisce il nome, questo metodo combina il metodo Spin Saturation Transfer utilizzato per piccole molecole, con la saturazione Transfer Difference metodo (STD) NMR impiegato per lo studio di interazioni proteina-ligando, misurando transitoria trasferimento centrifuga saturazione lungo aumentando i tempi di saturazione (generazione curve -up) in piccole molecole organiche e organometallici sottoposti a scambio chimico.
I vantaggi di questo metodo rispetto quelli esistenti sono: non c'è necessità di raggiungere coalescenza dei segnali scambio; il metodo può essere applicato finché un segnale dei siti scambio è isolato; non vi è alcuna necessità di misurare T 1 o raggiungere la saturazione stato stazionario; tasso va costantelues vengono misurati direttamente, e valori T 1 sono ottenuti nello stesso esperimento, utilizzando un solo set di esperimenti.
Per testare il metodo, abbiamo studiato la dinamica della rotazione ostacolata di N, N -dimethylamides, per il quale è disponibile più dati per il confronto. I parametri termodinamici ottenuti usando SSTD sono molto simili a quelli riportati (tecniche di trasferimento spin-saturazione e analisi-linea figura). Il metodo può essere applicato a substrati più difficili che non possono essere studiati con metodi precedenti.
Prevediamo che il semplice set up sperimentale e l'ampia applicabilità del metodo per una grande varietà di substrati renderemo questa una tecnica comune tra i chimici organici ed organometallici senza una vasta esperienza in NMR.
Introduzione
scambio Chemical si riferisce comunemente a qualsiasi processo intermolecolare o intramolecolare in cui un nucleo si muove da un ambiente ad un altro, in cui i parametri NMR (chemical shift, accoppiamento scalare, accoppiamento dipolare, indice di rilassamento) differiscono. Ci sono numerosi esempi di scambio chimico di molecole organiche e organometallici (ad esempio, le barriere rotazionali in biaryls, anello di barriere flipping e l'equilibrio conformazionale, inversione di azoto, ligando, degenerata scambio ligando e tautomerizzazione). 1-3 Il tasso di cambio è legato alla chimica la termodinamica della barriera del processo di scambio, e quindi il suo studio è di importanza cruciale per comprendere le dinamiche molecolari di questi sistemi.
Il classico segno di scambio dinamico in NMR è un drastico cambiamento nella line-forma dei segnali NMR al variare della temperatura. A basse temperature, il processo è lento e due distinte spostamenti chimici sono osserved. A temperature elevate, i due segnali si fondono in un unico segnale, che è conosciuto come "coalescenza". A temperature intermedie, i segnali diventano molto ampio. Questa sensibilità dello spettro NMR di scambio chimico rende NMR un metodo molto potente per studiare la dinamica di molecole in soluzione. Due metodi sono stati impiegati principalmente nello studio dei processi dinamici in soluzione:. Analisi forma di linea, 4-7 e saturazione centrifuga esperimenti di trasferimento 8-9 Inoltre, è anche opportuno ricordare il metodo 10 e la CIFIT trasferimento di inversione programma 11 per l'estrazione diretta di costanti di velocità, che sono un approccio relativamente efficiente per le misure di scambio in sistemi semplici. Sebbene questi metodi forniscono risultati molto buoni nella maggior parte dei casi, tuttavia, presentano numerosi inconvenienti. Lo svantaggio principale dell'analisi forma linea è le alte temperature necessarie per raggiungere coalescenza in alcuni campioni. 12 I principali problemi da considerare quando carrying out di spin esperimenti di trasferimento di saturazione sono: i tempi di saturazione molto lunghi necessari per raggiungere il trasferimento di saturazione stato stazionario tra i siti scambio, e la necessità di determinare il tempo di rilassamento longitudinale costante, T 1, che può essere difficile se non vi è sovrapposizione di diversa segnali nella regione di studio. 13
Come parte delle nostre indagini nei meccanismi organometallici, 14-16 il nostro gruppo sta studiando il comportamento fluxional di complessi di platino-Allene in soluzione. Questo è un compito complesso che coinvolge almeno tre processi diversi, uno dei quali è lo scambio π faccia o rotazione del metallo intorno uno dell'asse Allene. Abbiamo incontrato che normale esperimenti VT e tecniche di analisi a forma di linea che sono state impiegate prima in sistemi simili, 17-19 non erano adatti nel nostro studio, grazie ad una rotazione molto lenta nel nostro complesso platino allene che ha reso la temperatura della coalescenza signali di interesse superiore alla temperatura di decomposizione del complesso.
Per superare questa limitazione, abbiamo sviluppato e recentemente riportato un nuovo protocollo NMR (SSTD NMR) per studiare i processi di reciproco loco scambio chimico. 20 Come suggerisce il nome questo metodo combina il metodo di Spin saturazione di trasferimento utilizzato per piccole molecole, con la Saturation transfer Difference metodo NMR impiegato per lo studio di interazioni proteina-ligando, 21-24 misurando transitoria centrifuga trasferimento di saturazione lungo aumentando i tempi di saturazione (curve build-up) in piccole molecole in fase di scambio chimico.
Con questo nuovo metodo (SSTD NMR) abbiamo dimostrato che siamo in grado di ottenere i parametri cinetici di scambio chimico intramolecolare in piccole molecole organiche e organometallici con alcuni ulteriori vantaggi rispetto agli approcci tradizionali: coalescenza dei segnali non è necessario, quindi un intervallo di temperatura più flessibile può essere utilizzatanello studio; segnale di sovrapposizione non interferisce, anche se almeno una delle risonanze scambio devono essere isolati; non vi è alcuna necessità di misurare T 1 o raggiungere la saturazione stato stazionario; tassi valori costanti vengono misurati direttamente e valori T 1 sono ottenuti nello stesso esperimento, utilizzando un solo set di esperimenti. Un altro notevole vantaggio della metodologia SSTD NMR è che, a differenza LineShape analisi, la determinazione delle costanti cinetiche tasso non è limitata dall'aumento delle temperature coalescenza associati con alti campi magnetici. Così, la nostra metodologia è quindi molto ben appropriato per entrambi i campi magnetici a bassa e alta. Questo articolo ha lo scopo di aiutare i nuovi utenti di applicare questo nuovo metodo per i propri sistemi in fase di scambio chimico, e descrive la preparazione del campione, insieme sperimentale su, l'acquisizione dei dati, e un esempio di elaborazione e l'analisi dei dati in una semplice molecola organica.
Protocollo
Attenzione: Si prega di consultare tutte le schede di sicurezza materiale pertinente (MSDS) prima dell'uso.
1. Preparazione del campione NMR
- Pesare 5 mg di N, N -dimethylacetamide, aggiungere ad un tubo NMR appropriato per basse temperature e sciogliere in 0,6 ml di toluene d 8.
Setup 2. NMR sperimentale 25
- NOE Spectra Acquisizione
- Eseguire un dimensionale NOE (Nuclear Overhauser Effect) esperimento di uno. 26
NOTA: Gli effetti NOE possono accadere a qualsiasi temperatura. A uno spettro dimensionale NOE irradiando il segnale che sarà irradiato nell'esperimento SSTD NMR, è stata registrata a -40 ° C per assicurarsi che il trasferimento di rotazione e la magnetizzazione del campione utilizzato qui è stato minimizzato, e quindi il NOE, se esistente, sarebbe predominano ed essere misurata in questo esperimento. Idealmente, gli effetti NOE tra i due nuclei si scambiano ShoulNon d essere presente per evitare interferenze con il metodo SSTD.
- Eseguire un dimensionale NOE (Nuclear Overhauser Effect) esperimento di uno. 26
- SSTD NMR esperimenti Setup
- Inserire il campione nel magnete da prima ej a digitare nella riga di comando del software per attivare il flusso d'aria. Poi, mettere il campione sulla parte superiore del magnete e quindi digitare ij. Attendere fino a quando il campione è all'interno del magnete.
- Una volta che il campione è nel magnete, tipo edte nella linea di comando. Cambiare la temperatura alla prima temperatura selezionata per condurre l'esperimento (295,5 K in questo caso). Sia il campione stabilizzi alla temperatura prescelta per almeno 20 min.
- Eseguire 1D 1 esperimento H-NMR sul campione.
- Creare un nuovo set di dati di un esperimento 1 H-NMR. Per questo fare clic su File / Nuovo e assegnare un nome al nuovo esperimento.
- Digitare in sequenza e in attesa del comando precedente alla fine: serratura, Atma, topshim, getprosol e RGA.
- Tipo zg di acquisire l'esperimento protone. Una volta che è finito tipo EFP e apk a trasformata di Fourier e regolare la fase.
- Creare un nuovo set di dati, ad esempio, un esperimento 1 H NMR. Per questo fare clic su File / Nuovo e assegnare un nome al nuovo esperimento.
- In questo nuovo set di dati, digitare rpar nella riga di comando. Selezionare uno dei "STDDIFF" set di parametri dalla lista, ad esempio STDDIFFESGP, e fare clic su "leggere" e poi "leggere tutti" (Figura 1). In alternativa, farlo digitando STDDIFFESGP rpar tutti.
NOTA: L'esperimento può essere eseguita con la sequenza di impulsi. Tuttavia, il programma di impulso utilizzato nel nostro esperimento è stato STDDIFF. - Per selezionare la sequenza di impulsi STDDIFF, fare clic sul pulsante con i tre puntini nella linea PULPROG (figure 2 e 3).
- Prima di effettuare l'esperimento SSTD NMR, calibrare il 1 H 90 ° puls durie (p1). A tale scopo, assicurare che il campione è nel magnete alla temperatura desiderata (Fase 2.2.2). Inserire pulsecal nella linea di comando e copiare il valore dell'impulso di 90 ° al maggiore potenza (pl1 = -1 dB in questo caso), cioè, quella che dà l'impulso breve (Figura 4).
- Introdurre i valori per l'impulso rigido calibrato nell'esperimento. Tipo getprosol 1H (rapporto qualità-p1 ottenuto nel passaggio 2.2.7) (rapporto qualità-PL1) (Figura 5).
- Impostare la lunghezza dell'impulso sagomato. Tipo p13 ed introdurre un valore di 50.000 msec (Figura 6).
- Impostare la forma dell'impulso selettivo. Per fare questo, andare al potere e fare clic sul pulsante "Modifica ..." accanto alla forma (Figura 7). Vai a forma di impulsi 13 e scegliere: Gaus 1.1000 (Figura 8).
- Impostare la potenza dell'impulso selettivo (SP13). Impostare a qualcosa di appropriato, vale a dire , Su questo sistema tra 40-60 dB (corrispondente ad un'intensità di campo di circa 120 Hz) (Figura 8). Intensità di campo eccessivi possono portare ad effetti di saturazione inaccettabili. 27-29
NOTA: 50 dB era ottimale nel nostro caso. Tener conto che questa è una scala di attenuazione, quindi minore è il valore maggiore è la potenza della radiofrequenza. Come corrisponde alla saturazione cascade gaussiana, che viene applicata per lungo tempo (alcuni secondi), SP13 non deve scendere al di sotto di 40 dB (se necessario, consultare le specifiche dello strumento, purché impulsi ad alta potenza potrebbero danneggiare il probehead). Nella nostra esperienza 41-61 dB al di sopra della attenuazione del disco 1 H 90 ° impulso (-1 dB in questo lavoro) funziona bene. Provare a selezionare sempre la massima attenuazione possibile portando a simile livello di saturazione. - Digitare ns e impostarlo a 8 e digitare il ds e impostarlo su 4.
3. Acquisizione dati NMR und Processing 25
- SSTD NMR Esperimento di acquisizione
- Aprire l'esperimento 1 H NMR eseguita in fase 2.2.3 per controllare dove il segnale che verrà irradiato è. Per questo, cercare l'esperimento nel browser software, fare clic destro nel set di dati e fare clic su "Visualizza in una nuova finestra".
- Spostare la linea cursore al centro del segnale di irradiare e scrivere il chemical shift in ppm. Selezionare la larghezza spettrale che verrà utilizzato nell'esperimento.
NOTA: In questo caso, il segnale che viene irradiata è a 2.17 ppm, e la larghezza spettrale utilizzato era 1,46 ppm. Assicurarsi che nessuna correzione spostamento chimico viene utilizzato o la frequenza di irradiazione può essere impostata in modo non corretto. - Vai esperimento SSTD NMR precedentemente creato con la messa a punto di cui al punto 2.2.
- Creare un elenco con le frequenze di irradiazione. Per questo, digitare fq2list nella riga di comando e selezionare un elenco esistente.
- Modificare l'elencodi frequenze irradiazione inclusi i seguenti dati nelle prime 3 righe (Figura 9): Row 1. P (indica che i seguenti dati è in ppm); Row 2 frequenza del segnale da irradiare in ppm, come misurato in 3.1.. 1; Row 3.40 ppm (una frequenza che è lontano dalle 1 segnali H del composto così l'irradiazione in quella frequenza non influisce spettri).
- Salvare la lista con un nuovo nome e quindi digitare fq2list nella riga di comando e selezionare l'elenco appena creato.
- Per centrare l'esperimento sui segnali in fase di studio, tipo O1P e selezionare come centro dell'esperimento chemical shift del segnale che sarà irradiato.
- Tipo sw per selezionare la larghezza spettrale (1.46 ppm in questo caso, ma qualsiasi altra larghezza spettrale può essere scelto).
NOTA: Se il tempo di acquisizione ottenuto dopo aver cambiato la larghezza spettrale è troppo lungo (che introdurrà più rumore negli spettri) è can essere regolata digitando AQ per fornire la risoluzione desiderata Induction Decay libero (FID) (FIDRES, 0.25 Hz in questo caso). - Scegliere il valore per il InterScan D1 ritardo relax. Assicurarsi che è almeno 1 a 5 volte il valore della T 1 del più lento rilassante protone.
NOTA: Abbiamo impostato fino a 40 sec, che è il tempo di saturazione più lungo (D20) nell'esperimento. In questo modo tutti gli esperimenti non mancherà di tenere lo stesso tempo totale "per scansione" (ritardo + saturazione tempo + impulsi + tempo di acquisizione). - Tipo D1 e impostarlo a 40 sec.
- Impostare il primo valore per il tempo di saturazione digitando D20 e impostarla a 40 sec. Determinare il guadagno del ricevitore (RG) automaticamente digitando RGA.
- Creare il prossimo esperimento digitando iexpno. Tipo D20 e selezionare il tempo di saturazione di 20 sec in questo esperimento. Digitare RGA per determinare automaticamente rg.
- Ripetere l'ultimo passaggio per D20 = 10, 5, 2.5, 1.25, 0.625, 0,3 sec.
- Una volta creati tutti gli esperimenti, aprire il primo e nel tipo multizg riga di comando e specificare il numero di esperimenti, 8 in questo caso (cioè, multizg 8).
- SSTD NMR Experiment Processing
- Aprire il PROCNO 1 (numero di processo) da EXPNO 1 (Numero Experiment) del set (quello con il tempo di saturazione più elevata).
- Nel tipo lb riga di comando e impostare il valore a 1,5.
NOTA: per gli spettri con rapporti molto elevati segnale-rumore di questo valore potrebbe essere diminuita; inversamente, potrebbe essere aumentata per esperimenti rumorosi, se la risoluzione spettrale non è interessato gravemente. - Nel tipo CEAF linea di comando e processo FID # = 1 (spettro "a risonanza") nel PROCNO = 2 (Figura 10).
- Correggere la fase dell'esperimento facendo clic sulla correzione di fase b Interactiveutton e salvarlo come un esperimento 2D. Salvare e uscire (Figura 11).
- Tipo rep 1 nella riga di comando per andare al PROCNO 1.
- Nel tipo CEAF linea di comando e processo FID # = 2 (spettro "off-risonanza") al PROCNO = 3 (Figura 12).
- Nel comando tipo di linea .md quindi rep 2 per mostrare una finestra di visualizzazione multipla con entrambi gli spettri trasformati: 2 (quello con il segnale nel mezzo saturo) e 3 (quello in cui il treno di impulsi di saturazione è stato applicato a 40 ppm ) (Figura 13).
- Fare clic sul pulsante con un segno delta (Figura 13) per calcolare gli spettri differenza e salvarlo in PROCNO 4. Uscire dalla finestra di visualizzazione multipla.
- Selezionare un intervallo di integrazione del segnale sulla sinistra (il segnale in cui si osserverà il trasferimento di saturazione dovuta al processo di scambio chimico). integrare sempre la stessa regione in PROCNO 3 e 4 PROCNO.
Nota: L'intervallo di integrazione utilizzato in questo esperimento è stato 2,55-2,67 ppm. - Una volta integrato, vai alla scheda "integrali" in ciascuna delle sperimentazioni e copiare il valore di "Integrale [abs]" (Figura 14).
- Dividere l'integrale in PROCNO 4 dall'integrale in PROCNO 3. Che è il valore di η SSTD per un tempo di saturazione di 40 sec (η SSTD = Spin Saturazione trasferimento dei parametri Difference). 21
- Ripetere la procedura per il resto degli esperimenti con diversi tempi di saturazione.
4. Analisi dei dati 30
- L'analisi dei dati per ottenere i parametri cinetici
- Tracciare i valori SSTD η ottenuti rispetto al tempo di saturazione. 21
- Eseguire una misura esponenziale per regolare le curve ottenute all'equazione
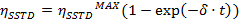

 =
= 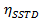 in fase di saturazione molto lungo
in fase di saturazione molto lungo
t = tempo - Calcolare i valori di η SSTD MAX e δ e utilizzarli per calcolare i valori delle costanti di velocità (k) e tempi di rilassamento T (1A) secondo le seguenti equazioni:

T 1A = longitudinale costante di tempo di rilassamento spin A
k = reciproco loco costante il tasso di cambio cinetica- Ottenere la costante di velocità cinetica da:
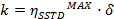
- Ottenere la costante di velocità cinetica da:
- Eyring Plot per ottenere i parametri termodinamici
- Ln Plot (k / T) rispetto a 1 / T (T = temperatura assoluta), utilizzando i valori di vacche tassi di tic a temperature diverse.
- Eseguire una misura lineare, per regolare i dati ottenuti per l'equazione Eyring:
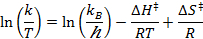
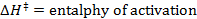
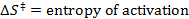
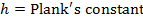
R = costante dei gas
k B = costante di Boltzmann
T = temperatura assoluta - Calcolare i parametri termodinamici d H ≠ e ΔS ≠.
- Calcolare i valori di E A (298) e DeltaG ≠ (298) con le seguenti equazioni:
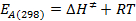
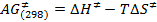
s / ftp_upload / 54499 / 54499eq13.jpg "/>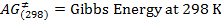
Risultati
La tecnica SSTD NMR è stata applicata per il calcolo dei parametri cinetici nella rotazione dell'ammide legame di N, N -dimethylacetamide. 21 Questo è un semplice esempio di cui numerosi dati di confronto possono essere trovati in letteratura. 31
La rotazione ostacolato intorno al legame ammidico, a causa del carattere doppio legame parziale in forma di risonanza, distingue due gruppi metilici in due segnali in 1 H-NMR (2,61 e 2,17 ppm a 22,5 ° C). Saturazione Spin del segnale del gruppo metilico a 2.17 ppm (Me B) porta alla scomparsa del suo segnale in 1 H NMR. Dopo saturazione Me B, trasferimento di saturazione per l'altro gruppo metilico (Me A) a causa del processo di rotazione interna può essere osservato da una diminuzione dell'intensità 1 H nel segnale a 2.61 ppm. il magnitude di questa diminuzione dipende dal tempo di saturazione. La Figura 15 mostra l'spettri 1 H NMR del -dimethylacetamide N, N a 22,5 ° C, e le espansioni visualizza spettri colpo (a) e (b) la saturazione del metil gruppo a 2.17 ppm, così come lo spettro differenza (c), utilizzato per calcolare i valori di η SSTD. Il fattore η SSTD è calcolato dividendo il valore dell'integrale di Me A nello spettro SSTD NMR (c) per il valore dell'integrale del Me A in spettri (a), come spiegato nel protocollo. I valori ottenuti di η SSTD per ciascun tempo di saturazione a diverse temperature sono raccolti nella tabella 1. La trama dei valori ottenuti di η SSTD rispetto al tempo di saturazione ha dato curve esponenziali in cui un altopiano è stato raggiunto in tempi di saturazione superiori. Per una certa temperatura, la misura esponenziale della curva permette il calcolo del tassocostante (k) ed il tempo di rilassamento del 1 H del segnale misurato (T 1A) (Figura 16). Figura 17 mostra le curve ottenute con il k e valori 1A T ottenute negli attacchi.
Infine, la trama di ln (k / T) rispetto a 1 / T e l'adattamento all'equazione Eyring (Figura 18) sono stati usati per calcolare l'entalpia e l'entropia di attivazione. I parametri di attivazione rilevati vengono mostrati nella Tabella 2, unitamente ai parametri precedentemente segnalati, calcolate utilizzando diverse metodologie.
Come si può osservare nella Tabella 2, i valori dei parametri di attivazione ottenuti con la tecnica Spin Saturation Transfer Difference (SSTD NMR) sono in eccellente accordo con i dati riportati in precedenza con altre tecniche, come SST NMR oanalisi forma di linea. L'ampia gamma di valori riportati per ΔS ‡ è dovuto alla difficoltà nella misurazione di questo parametro con tecniche NMR. 31 Per quanto riguarda il resto dei parametri di attivazione, i valori ottenuti con il nostro metodo non solo sono molto simili a quelle già presentate ma anche più precisi, dal momento che i nostri errori (SD) sono più piccoli in tutti i casi.
Figura 1: Elenco degli esperimenti dopo aver digitato rpar. La figura mostra i diversi set di parametri tra i quali deve essere selezionata STDDIFFESGP. Clicca qui per vedere una versione più grande di questa figura.
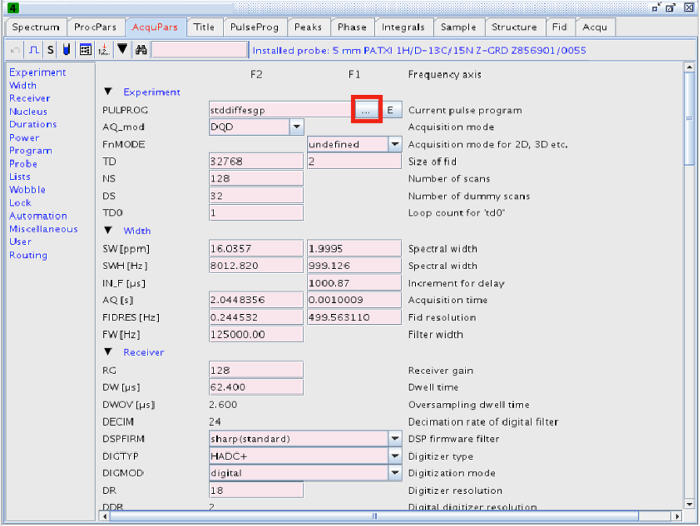
Figura 2:.. Parametri di acquisizione il pulsante evidenziato in un quadrato rosso porta ad un elenco dei diversi programmi di impulso Cliccate qui per vedere una versione più grande di questa figura.
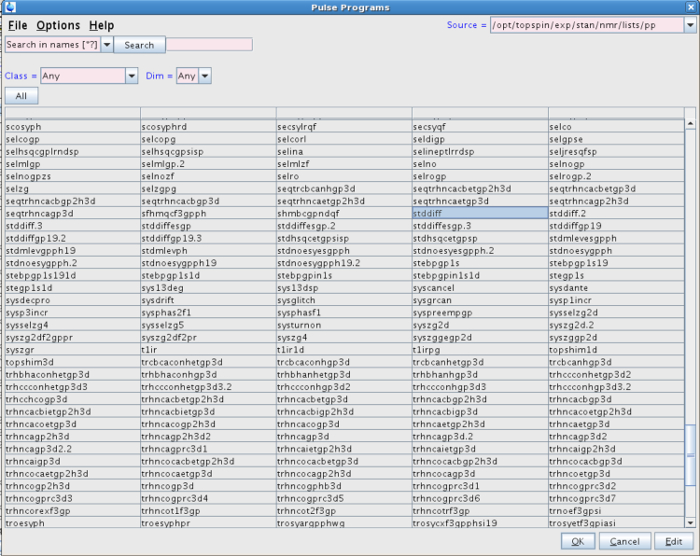
Figura 3:.. Elenco dei programmi di impulsi La figura mostra il programma selezionato impulso nell'esperimento (STDDIFF) Si prega di cliccare qui per vedere una versione più grande di questa figura.
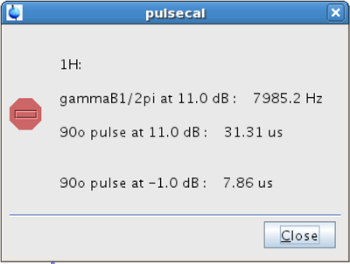
Figura 4: Pop-up finestra è apparso dopo la calibrazione 90 ° impulsi La figura mostra i valori della calibrato 90 &. # 176; impulso a diversi livelli di potenza. Cliccate qui per vedere una versione più grande di questa figura.
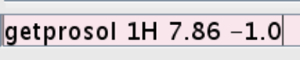
Figura 5:.. Schermata della riga di comando La figura mostra come introdurre il valore per l'impulso dura calibrata prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 6:. Valore per la lunghezza dell'impulso sagomato La figura mostra come introdurre il valore per la durata dell'impulso sagomato. g6large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 7:.. Parametri di acquisizione La figura mostra i parametri di potenza Cliccate qui per vedere una versione più grande di questa figura.
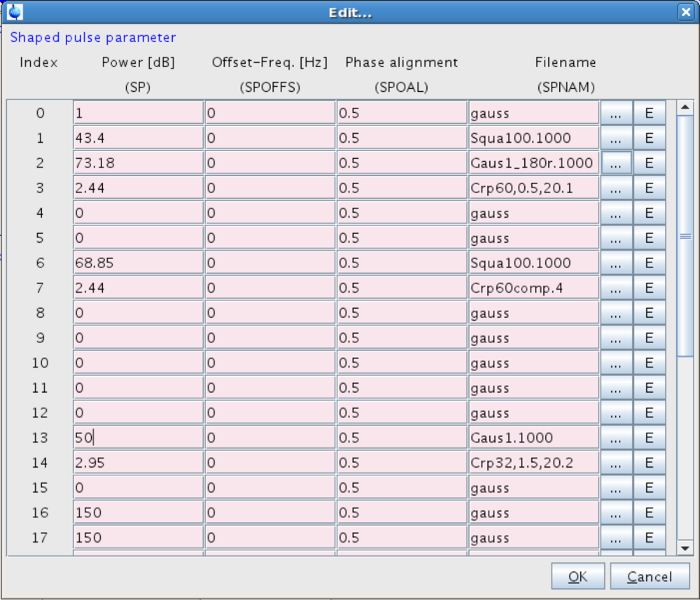
Figura 8:. Parametri per il polso a forma di I valori per il polso a forma di saranno introdotti in linea 13. Clicca qui per vedere una versione più grande di questa figura.
PLOAD / 54499 / 54499fig9.jpg "/>
. Figura 9: Elenco delle frequenze di irradiazione La figura comprende i seguenti dati nelle prime 3 righe: riga 1. P (indica che i seguenti dati è in ppm); Row 2 frequenza del segnale da irradiare in ppm, come misurato. in 3.1.1; Row 3,40 ppm (una frequenza che è lontano dalle 1 segnali H del composto così l'irradiazione in quella frequenza non influenza gli spettri). Clicca qui per vedere una versione più grande di questa figura.
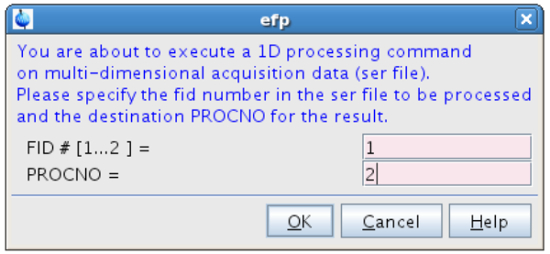
Figura 10:. L'elaborazione del primo FID La figura mostra la finestra pop-up che compare dopo aver digitato EFP. nk "> Clicca qui per vedere una versione più grande di questa figura.
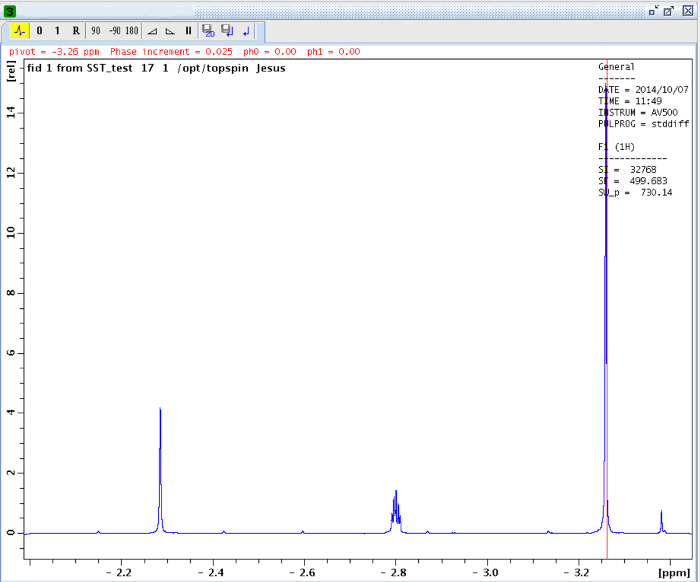
Figura 11:.. Correzione di fase Schermata mostra la finestra per la correzione di fase manuale Si prega di cliccare qui per vedere una versione più grande di questa figura.
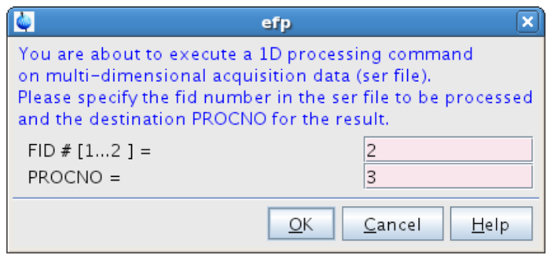
Figura 12:. L'elaborazione del secondo FID La figura mostra la finestra pop-up che compare dopo aver digitato EFP. Clicca qui per vedere una versione più grande di questa figura.
Figura 13 "src =" / files / ftp_upload / 54499 / 54499fig13.jpg "/>
Figura 13: visualizzazione multipla di spettri 2 e 3. Il pulsante evidenziato in un quadrato rosso è quello di calcolare gli spettri differenza. Si prega di cliccare qui per vedere una versione più grande di questa figura.
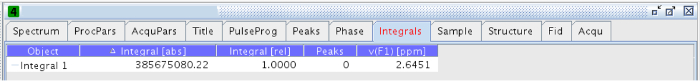
Figura 14:. Tab. Integrali La figura mostra i valori degli integrali assoluti e relativi prega di cliccare qui per vedere una versione più grande di questa figura.
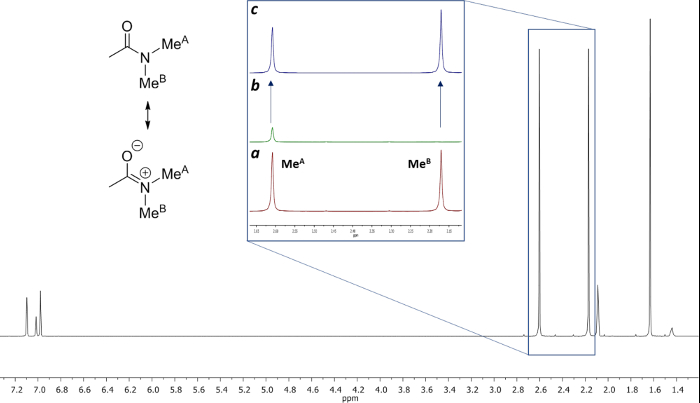
Figura 15: Struttura e 1 g> H NMR di N, N -dimethylacetamide a 22,5 ° C in toluene-d 8 (a) 1 H NMR espansione della regione dal 2.13 al 2.66 ppm prima dell'irraggiamento. (B) di espansione della stessa regione dopo irradiazione del gruppo metilico a 2.17 ppm. (C) spettro Differenza [(a) - (b)]. Si prega di cliccare qui per vedere una versione più grande di questa figura.
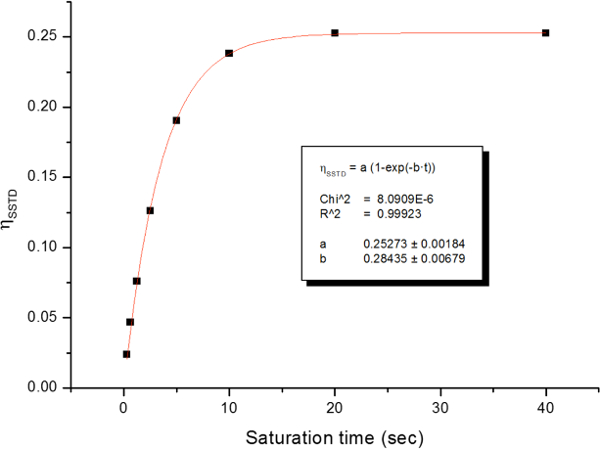
Figura 16: Esempio della trama di SSTD η e la sua forma esponenziale a 278 K. Riprodotto dalle informazioni di supporto di riferimento 21 con il permesso della Royal Society of Chemistry.http://ecsource.jove.com/files/ftp_upload/54499/54499fig16large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
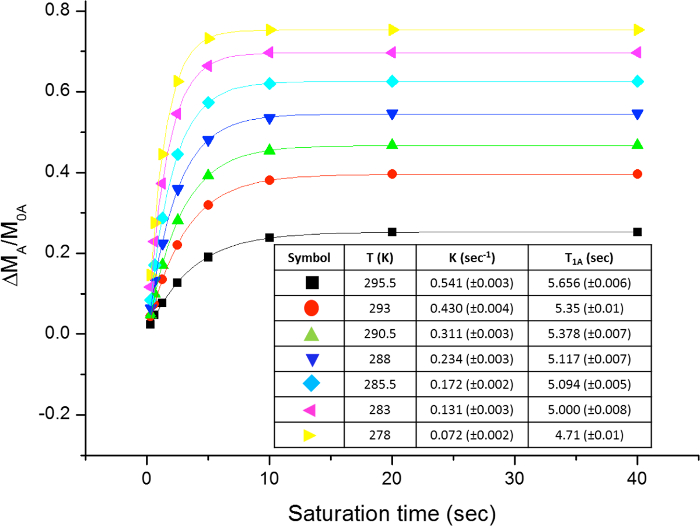
Figura 17: Piazzole di η SSTD vs. tempo di saturazione a diverse temperature. La figura mostra la trama di N, N -dimethylacetamide e la tabella con i tassi costanti ottenuti e tempi di rilassamento. Clicca qui per vedere una versione più grande di questa figura.
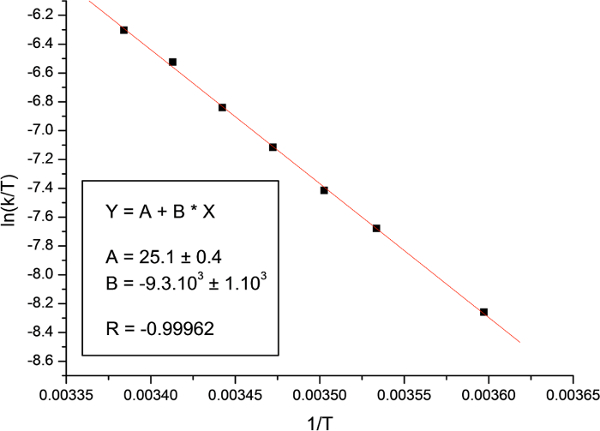
Figura 18:. Trama Eyring La figura mostra la trama di N, N -dimethylacetamide. Clicca qui per vedere una versione più grande di questa figura.
| t Sat (sec) | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD | η SSTD |
| (T = 278 K) | (T = 283 K) | (T = 285.5 K) | (T = 288 K) | (T = 290.5 K) | (T = 293 K) | (T = 295.5 K) | |
| 40 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 20 | 0,2526 | 0,3957 | 0,4671 | 0,5461 | 0,626 | 0,6969 | 0,7535 |
| 10 | 0,2383 | 0,3806 | 0,4537 | 0,5355 | 0,6199 | 0,6969 | 0,7535 |
| 5 | 0,1904 | 0,3193 | 0,3919 | 0.481 | 0,5734 | 0,6638 | 0,7318 |
| 2.5 | 0,1263 | 0,2204 | 0,2812 | 0,3589 | 0,4449 | 0,5461 | 0,626 |
| 1.25 | 0,0761 | 0,1353 | 0,171 | 0,2247 | 0,2868 | 0,3732 | 0,4449 |
| 0,625 | 0,0467 | 0,0739 | 0,099 | 0,1327 | 0,171 | 0,2291 | 0,2758 |
| 0.3 | 0,0238 | 0.044 | 0,0472 | 0,0644 | 0,0847 | 0,1169 | 0,1463 |
Tabella 1:. I valori di η SSTD La tabella mostra i valori ottenuti in diversi momenti di saturazione per la N, N -dimethylacetamide nella gamma di temperature 278-295.5 K.
d H ‡ (KJ mol -1)| metodo | SSTD NMR | SST NMR 31 td> | Analisi line-forma | Analisi line-forma | Analisi line-forma |
| Parametro | (Questo lavoro) | (1 H NMR) 4 | (1 H NMR) 5 | (13 C NMR) 6 | |
| E bis (mol KJ -1) 298 | 79,7 ± 0,1 | 73.1 ± 1.4 | 70.5 ± 1.7 | 82.0 ± 1.3 | 79.5 ± 0.4 |
| 77.2 ± 0.1 | 70.6 ± 1.4 | 68 | 79.5 ± 0.4 | 76.6 ± 0.4 | |
| ΔS ‡ (J mol -1 K -1) | 11.5 ± 0.4 | -10.5 ± 5.0 | -15.0 ± 5.1 | 13 ± 8 | 3 ± 4 |
| DeltaG ‡ 298 (KJ mol -1) | 73.8 ± 0.1 | 73.7 ± 2.0 | 72.5 | 75.3 ± 0.4 | 75.7 ± 0.4 |
| Solvente | Tol- d 8 | Tol- d 8 | CCl 4 | Acetone- d 6 | pulito |
Tabella 2:. Parametri di attivazione La tabella riporta i parametri di attivazione per la rotazione interna N, N -dimethylacetamide ottenuti con il metodo SSTD NMR rispetto agli stessi parametri ottenuti utilizzando diversi metodi NMR per analisi 4,5,6 Errori in questa tabella. fare riferimento a errori di deviazione standard (SD). (Tratto da riferimento 21 con il permesso dal Royal Society di Chimica).
Discussione
One of the more obvious advantages of this methodology is that the rate constants and the relaxation time for a given temperature can be obtained with a single set of experiments, with a robust pulse sequence (the same used for STD experiments to study protein-ligand interactions, which is typically found within the available set of experiments from the spectrometer manufacturer). This simplifies the experimental setup since there is no need to measure T1 or reach steady state saturation. Besides, it is remarkable that this method does not depend on the magnet strength, as coalescence methods. On the other hand, the main limitation is that this technique cannot be applied to chemical exchange processes too fast or too slow, which would depend on the temperature range of the NMR machine or the solvents used.
This new technique for the calculation of kinetic parameters can be applied to a great variety of substrates and its applicability has already been demonstrated with some interesting molecules.21 The kinetic parameters of the 4-N,N-dimethylamido[2.2]paracyclophane, a challenging substrate in which the signal of one of the methyl groups of interest is overlapped with other signals from the molecule, were successfully calculated using SSTD NMR. Interestingly, this methodology can be applied as long as one of the signals of study is isolated. SSTD NMR is also a useful protocol for the calculation of kinetic parameters in molecules in which the coalescence temperature is so high that the molecule decomposes before reaching it. This is the case with PtCl2(dimethylallene)(pyridine), in which the methodology was successfully applied without the need of reaching coalescence. The choice of solvents and temperatures is critical to obtain good results, since the chemical exchange rates can vary significantly with these parameters. Moreover, in addition to the criteria in a normal NMR experiment, key steps in a SSTD NMR experiment are the selectivity of the irradiation as well as the temperature control. Both factors have to be precise to guarantee the success of the experiment.
The representative results presented here are for the kinetics of intramolecular chemical exchange, but the technique can also be applied to study the kinetics of intermolecular chemical exchange and also ligand exchange, common processes in the dynamic behavior of transition metal complexes.
Finally, providing a proper modification of the equations is made,32 this method could be extended to deal with multi-site exchange and unequal populations, as it has been done in former double resonance experiments,8-9 increasing the usefulness of this technique for the study of chemical exchange processes in challenging compounds.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
Funding by the University of East Anglia, the EPSRC (EP/L012855/1) and the EU (H2020-MSCA-IF-2014-EF-ST-658172) is gratefully acknowledged (MTQ).
Materiali
| Name | Company | Catalog Number | Comments |
| N,N-dimethylacetamide | Aldrich | 38840 | Acute toxicity |
| Toluene-d8 | Fluorochem | D-005 | Flammable and toxic |
| 500 MHz 7" Select Series NMR Tubes | GPE LTD | S-5-500-7 | |
| TopSpin 2.1 | TopSpin program, Bruker Corp., http://www.bruker.com/products/mr/nmr/nmr-software/software/topspin/ (2015). | ||
| Origin 6.0 | Origin 6.0 software, OriginLab Corp., http://originlab.com. | ||
| Bruker Avance III 500 MHz fitted with 5 mm broadband observed BBFOplus Z-gradient SmartProbeTM probe | Bruker Corp., http://www.bruker.com | ||
| Bruker Avance I 500 MHz Inverse Triple Resonance NMR spectrometer fitted with a 5 mm TXI Z-gradient probe | Bruker Corp., http://www.bruker.com | ||
| Ceramic Spinner standardbore shimsystems (5 mm) | Bruker Corp., http://www.bruker.com | H00804 |
Riferimenti
- Bain, A. D. Chemical Exchange in NMR. Prog. Nuc. Mag. Res. Spect. 43, 63-103 (2003).
- Bain, A. D. Chemical Exchange. Modern Magnetic Resonance. , 421-427 (2006).
- Bain, A. D. Chapter 2 - Chemical Exchange. Ann. Rep. NMR Spect. 63, 23-48 (2008).
- Reeves, L., Shaddick, R., Shaw, K. Nuclear Magnetic Resonance Studies of Multi-site Chemical Exchange. III. Hindered Rotation in Dimethylacetamide, Dimethyl Trifluoro-acetamide, and Dimethyl Benzamide. Can. J. Chem. 49, 3683-3691 (1971).
- Drakenberg, T., Dahlqvist, K., Forsen, S. Barrier to Internal Rotation in Amides. IV. N,N-Dimethylamides. Substituent and Solvent Effects. J. Phys. Chem. 76, 2178-2183 (1972).
- Fujiwara, F., Airoldi, C. Carbon-13 NMR Study of the Barrier to Internal Rotation of N,N-Dimethylacetamide in the Adduct with Antimony(III) Chloride. J. Phys. Chem. 88, 1640-1642 (1984).
- Gutowsky, H. S., Holm, C. H. Rate Processes and Nuclear Magnetic Resonance Spectra. II. Hindered Internal Rotation of Amides. J. Chem. Phys. 25, 1228-1234 (1956).
- Forsen, S., Hoffman, R. A. A New Method for the Study of Moderately Rapid Chemical Exchange Rates Employing Nuclear Magnetic Double Resonance. Acta Chem. Scand. 17, 1787-1788 (1963).
- Forsen, S., Hoffman, R. A. Study of Moderately Rapid Chemical Exchange Reactions by Means of Nuclear Magnetic Double Resonance. J. Chem. Phys. 39, 2892-2901 (1963).
- Williams, T. J., Kershaw, A. D., Li, V., Wu, X. An Inversion Recovery NMR Kinetics Experiment. J. Chem. Educ. 88, 665-669 (2011).
- Bain, A. D., Cramer, J. A. Slow Chemical Exchange in an Eight-Coordinated Bicentered Ruthenium Complex Studied by One-Dimensional Methods. Data Fitting and Error Analysis. J. Magn. Res., Series A. 118, 21-27 (1996).
- Sandstrom, J. . Dynamic NMR Spectroscopy. , (1982).
- Castanar, L., Nolis, P., Virgili, A., Parella, T. Measurement of T1/T2 Relaxation Times in Overlapped Regions from Homodecoupled 1H Singlet Signals. J. Magn. Reson. 244, 30-35 (2014).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. New Platinum-Catalysed Dihydroalkoxylation of Allenes. Adv. Synth. Catal. 352, 2189-2194 (2010).
- Muñoz, M. P., de la Torre, M. C., Sierra, M. A. Platinum-Catalysed Bisindolylation of Allenes: A Complementary Alternative to Gold Catalysis. Chem. Eur. J. 18, 4499-4504 (2012).
- Hurtado-Rodrigo, C., Hoehne, S., Muñoz, M. P. A New Gold-Catalysed Azidation of Allenes. Chem. Comm. 50, 1494-1496 (2014).
- Vrieze, K., Volger, H. C., Gronert, M., Praat, A. P. Intramolecular Rearrangements in Platinum--Tetramethylallene Compounds as Influenced by Ligands Trans to the Allene Group. J. Organometal. Chem. 16, 19-22 (1969).
- Vrieze, K., Volger, H. C., Praat, A. P. Complexes of Allenes with Platinum (II) and Rhodium (I). J. Organometal. Chem. 21, 467-475 (1970).
- Brown, T. J., Sugie, A., Leed, M. G. D., Widenhoefer, R. A. Structures and Dynamic Solution Behavior of Cationic, Two-Coordinate Gold(I)-π-Allene Complexes. Chem. Eur. J. 18, 6959-6971 (2012).
- Yang, W., Hashmi, S. K. Mechanistic Insights into the Gold Chemistry of Allenes. Chem. Soc. Rev. 43, 2941-2955 (2014).
- Quiros, M. T., Angulo, J., Munoz, M. P. Kinetics of Intramolecular Chemical Exchange by Initial Growth Rates of Spin Saturation Transfer Difference Experiments (SSTD NMR). Chem. Commun. 51, 10222-10225 (2015).
- Mayer, M., Meyer, B. Characterization of Ligand Binding by Saturation Transfer Difference NMR Spectroscopy. Ang. Chem. Int. Ed. 38, 1784-1788 (1999).
- Angulo, J., Nieto, P. STD-NMR: Application to Transient Interactions Between Biomolecules - A Quantitative Approach. Eur. Biophys. J. 40, 1357-1369 (2011).
- Kemper, S., Patel, M. K., Errey, J. C., Davis, B. G., Jones, J. A., Claridge, T. D. W. Group Epitope Mapping Considering Relaxation of the Ligand (GEM-CRL): Including Longitudinal Relaxation Rates in the Analysis of Saturation Transfer Difference (STD) Experiments. J. Magn. Reson. 203, 1-10 (2010).
- Berger, S., Braun, S. . 200 and More NMR Experiments: A Practical Course. , (2004).
- Cutting, B., Shelke, S. V., Dragic, Z., Wagner, B., Gathje, H., Kelm, S., Ernst, B. Sensitivity Enhancement in Saturation Transfer Difference (STD) Experiments Through Optimized Excitation Schemes. Magn Reson Chem. 45, 720-724 (2007).
- Ley, N. B., Rowe, M. L., Williamson, R. A., Howard, M. J. Optimising Selective Excitation Pulses To Maximize Saturation Transfer Difference NMR Spectroscopy. RSC Adv. 4, 7347-7351 (2014).
- Antanasijevic, A., Ramirez, B., Caffrey, M. Comparison of the Sensitivities of WaterLOGSY and Saturation Transfer Difference NMR Experiments. J. Biomol. NMR. 60 (1), 37-44 (2014).
- Jarek, R. L., Flesher, R. J., Shin, S. K. Kinetics of Internal Rotation of N,N-Dimethylacetamide: A Spin-Saturation Transfer Experiment. J. Chem. Ed. 74, 978-982 (1997).
- Forsen, S., Hoffman, R. A. Exchange Rates by Nuclear Magnetic Multiple Resonance. III. Exchange Reactions in Systems with Several Nonequivalent Sites. J. Chem. Phys. 40, 1189-1196 (1964).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon