Method Article
Imaging G acoplados a proteínas mediada por el receptor de quimiotaxis y sus eventos de señalización en células HL60 neutrófilos como
En este artículo
Resumen
ensayos de quimiotaxis visuales son esenciales para una mejor comprensión de cómo las células eucariotas controlar la migración de células direccional quimioatrayente mediada. A continuación, se describen los métodos detallados para: 1) en tiempo real, monitoreo de alta resolución de múltiples ensayos de quimiotaxis, y 2) visualizar simultáneamente el gradiente quimioatrayente y la dinámica espacio-temporal de los acontecimientos en las células HL60 neutrófilos como señalización.
Resumen
Eukaryotic cells sense and move towards a chemoattractant gradient, a cellular process referred as chemotaxis. Chemotaxis plays critical roles in many physiological processes, such as embryogenesis, neuron patterning, metastasis of cancer cells, recruitment of neutrophils to sites of inflammation, and the development of the model organism Dictyostelium discoideum. Eukaryotic cells sense chemo-attractants using G protein-coupled receptors. Visual chemotaxis assays are essential for a better understanding of how eukaryotic cells control chemoattractant-mediated directional cell migration. Here, we describe detailed methods for: 1) real-time, high-resolution monitoring of multiple chemotaxis assays, and 2) simultaneously visualizing the chemoattractant gradient and the spatiotemporal dynamics of signaling events in neutrophil-like HL60 cells.
Introducción
Las células eucariotas detectan y se mueven hacia la concentración más alta dentro de un gradiente quimioatrayente, un proceso celular que se refiere como la quimiotaxis. Quimiotaxis juega un papel crítico en muchos procesos fisiológicos, tales como la embriogénesis 1, neurona patrón 2, la metástasis de las células cancerosas 3, el reclutamiento de neutrófilos a sitios de inflamación 4, y el desarrollo del modelo de organismo Dictyostelium discoideum 5. En general, las células eucariotas detectan quimioatrayentes utilizando receptores 5 acoplados a la proteína G. El compromiso de los cebos químicos con estos receptores promueve la disociación de las proteínas G heterotrimeric Gα y Gβγ, que a su vez activan las vías de transducción de señales que regulan en última instancia, la organización espacio-temporal del citoesqueleto de actina para impulsar la migración celular 5-9.
Los biólogos celulares han estado desarrollando y mejorando chemotaxes ensayos para examinar cómo G receptor acoplado a proteína (GPCR) de señalización que medie dirigen la migración celular. La cámara o la migración transwell ensayo Boyden fue desarrollado en 1960 por Boyden 10. El ensayo funciona creando un gradiente de compuestos quimioatrayentes entre dos pozos que están separados por una membrana microporosa. Su simplicidad y facilidad de uso lo convierten en el ensayo de quimiotaxis más utilizado hasta la fecha. Sin embargo, el ensayo no permite que el proceso de migración de las células a ser visualizada. La cámara Zigmond es el primer dispositivo de microfluidos visual que permite una clara imagen de la migración celular en un cubreobjetos a través de una constricción estrecha hacia un quimioatrayente fuente 11. Dunn 12 y 13 Insall modificar y mejorar la alta resolución y la capacidad de imagen a largo plazo del ensayo de quimiotaxis de cámara Zigmond. Debido a las características altamente predecibles, difusión dominante del flujo de fluidos, microfluídica ha sido el suministro de soluciones para la próxima Generatien ensayos de quimiotaxis, como EZ-TAXIScan (un dispositivo de análisis de la movilidad celular).
Con la estabilidad del gradiente asegurado, el dispositivo permite seis quimiotaxis ensayos que se lleven a cabo simultáneamente (Figura 1A). En contraste con los gradientes direccionalmente fijos generados en los diversos ensayos de cámara por encima de, el ensayo de aguja o micropipeta desarrollado por Guenther Gerisch genera un gradiente con una fuente móvil 14. En el ensayo, quimioatrayente se libera de una micropipeta móvil para generar un gradiente estable. Con este ensayo de aguja, los investigadores encontraron que las células generan diferentes seudópodos con características fundamentalmente diferentes. La aplicación de la microscopía de fluorescencia, hemos sido capaces de visualizar el gradiente para facilitar su medición cuantitativa largo de 15. En este estudio, se describen los métodos detallados para la preparación de células HL60 quimiotáctico (leucemia promielocítica humana), monitoreo de forma simultánea múltiples ASSA quimiotaxisys con el dispositivo de análisis de la movilidad celular, y la visualización de la dinámica espacio-temporales de GPCR mediada de moléculas de señalización, tales como la proteína quinasa D1 en células vivas individuales en respuesta a los estímulos quimiotácticos visibles, espaciotemporalmente controlable. Nuestros métodos avanzados de imágenes pueden ser aplicados a los estudios generales de quimiotaxis, y son especialmente adecuados para sistemas de células de mamíferos.
Protocolo
1. Cultivo y diferenciación de neutrófilos humanos-como las células HL60
- Preparar RPMI (Roswell Park Memorial Institute) 1640 medio de cultivo que contiene RPMI 1640, 10% (v / v) de suero bovino fetal (FBS), piruvato de sodio 0,1 mM, y HEPES 25 mM (ácido 4- (2-hidroxietil) -1 ácido -piperazineethanesulfonic). Calentar el medio de cultivo RPMI 1640 a 37 ° C.
- El uso de un hemocitómetro determinar la densidad celular de las células HL60 para asegurarse de que las células están en la etapa de crecimiento en fase logarítmica.
NOTA: Las células son por lo general en la fase de registro en el tercer día después de los pases. La densidad de células en fase de registro es por lo general 6-8 x 10 5 células / ml. La densidad celular requerida para comenzar una nueva cultura es de aproximadamente 1,5 x 10 5 células / ml.
NOTA: Por ejemplo, para un nuevo cultivo de 10 ml en un matraz plano T-75, si la densidad celular de células en fase log es de 6 x 10 5 células / ml, a continuación, 2,5 ml de células en fase log (6 x 10 5 ) se diluye hasta 1,5 x 10 5 células / ml en 10 ml nueva cultura. Para hacer un volumen final de 10 ml de cultivo, se añade 7,5 ml de RPMI 1640 medio de cultivo. - Coloque el volumen calculado de calentamiento medio de cultivo RPMI 1640 en un matraz plana. Para un cultivo en matraz plana T-75, el volumen total del cultivo de células es de 10 ml.
- Añadir el volumen calculado de las células HL60 fase logarítmica de crecimiento en el matraz plana para llegar a una densidad celular de 1,5 x 10 5 células / ml.
- Se incuban las células a 37 ° C en una incubadora humidificada con 5% de CO2.
NOTA: El tiempo de duplicación de HL60 es casi 24 horas. - Passage las células con RPMI 1640 medio de cultivo cada 2-3 días. Es importante que la densidad celular de las células HL60 nunca excede de 1,5 x 10 6 células / ml y el paso de células no más de 2 meses dura.
- Diferenciar las células HL60 5 días antes de los experimentos.
NOTA: RPMI 1640 medio de diferenciación contiene RPMI 1640, 10% (v / v) de suero bovino fetal (FBS), piruvato de sodio 0,1 mM, 25 mM HEPES, y 1,3% de sulfóxido de dimetilo (DMSO). En otras palabras, es 1,3% de DMSO en RPMI 1640 medio de cultivo.- Para diferenciar las células HL60, pre-calentar el medio de cultivo RPMI 1640 a 37 ° C. Añadir el medio de cultivo RPMI 1640 tibia en un matraz plana.
- Para una 10 ml de cultivo final diferenciación de HL60, añadir 130 ul DMSO directamente al medio de cultivo RPMI 1640 en el matraz plana mientras se agita el matraz para que el DMSO se diluye rápidamente por el medio de cultivo RPMI 1640.
- Añadir células HL60 en fase logarítmica a una densidad final de células de 1,5 x 10 5 células / ml en un 10 ml de medio RPMI 1640 final de la diferenciación. Cultivar las células HL60 en RPMI 1640 medio de diferenciación a 37 ° C en un incubador humidificado con 5% de CO 2 durante 5 días.
2. recubrimiento de la superficie de la cubierta de cristal de la Cámara 4well
- Tome la botella de solución al 2% de gelatina de stock de la nevera, limpiarla con etanol al 70%, y lo coloca en el capó. Tcopo de 1 ml de solución al 2% de gelatina de valores y devolver la solución de gelatina de remanentes al refrigerador inmediatamente.
- Deje que la solución de gelatina para licuar completamente a 37 ° C y una pipeta a fondo. Diluir la solución de gelatina de la 2% con solución salina equilibrada de 9 ml pre-calentado 1x Hanks (HBSS) tampón para una concentración final de 0,2% de gelatina.
- Añadir 0,5 ml o 2 ml de gelatina al 0,2% en HBSS para los dos pozos medio de una cámara de 4 pocillos o una cámara de 1-bien con una cubierta de vidrio en la parte inferior, respectivamente. Inclinar las placas en varias direcciones, de manera que el líquido cubre toda la superficie.
- Colocar las placas en una incubadora a 37ºC. Las placas estarán listos para su uso en 1 hora. Pueden ser utilizados para un máximo de 5 días. Justo antes de la siembra de células, eliminar la solución de gelatina a partir de las cámaras de 4 pocillos o 1-así.
3. Ensayo de quimiotaxis El uso de análisis de la movilidad de dispositivos
- Preparar y calentar RPMI 1640 que muere de hambre, que es RPMImedio que contiene piruvato de sodio 0,1 mM (opcional) y HEPES 25 mM.
- Preparar 100 l de 100 nM de fMLP (N-formilmetionil-leucil-fenilalanina) en RPMI 1640 medio muerto de hambre.
- Preparar 3 ml de 1% de albúmina de suero bovino (BSA) / medio RPMI 1640 que contiene 1% de BSA en medio RPMI 1640 y 10 ml de 0,1% de BSA / RPMI 1640 medio de hambre.
- Escudo un cubreobjetos cuadrado 22 mm y una movilidad de células chip de dispositivo de análisis de 5 micras con recién preparada BSA 1% / medio RPMI 1640 durante 1 hora a RT.
- Montar el Titular Utilizando el siguiente procedimiento:
- Coloque la base del soporte con las palancas en la posición vertical de manera que las palancas se pueden inclinar hacia el usuario. Aplicar solución de etanol al 70% a la superficie de la copa 41 mm. limpie con cuidado las superficies con un trapo, teniendo cuidado de no rayarlos.
- Inserte el 41 mm de vidrio en la base de soporte. Ponga el cubreobjetos cuadrada recubierta con BSA de 22 mm en la parte superior del vidrio de 41 mm en la base de soporte.
NOTA: El cuadrado recubierto coverslip entre el 41 mm de vidrio y el chip permite la quimiotaxis de que se produzca en el sustrato de la superficie de revestimiento. - Inserte la junta tórica (pequeño) en la parte inferior de la carcasa de oblea, y montar la carcasa de oblea en la base de soporte con el orificio elíptico en la parte trasera. Tire el nivel interno de la base de soporte hacia delante a la posición horizontal para bloquear la carcasa de oblea en su posición.
- Blow el polvo del interior de la carcasa de oblea con un limpiador de aire. Añadir 4 ml de 0,1% de BSA / medio RPMI 1640 en el alojamiento de la oblea.
- Montar el chip de dispositivo de análisis de la movilidad celular recubierta con BSA en el centro de la carcasa de oblea con la cara hacia abajo estructural en contacto con el vidrio.
NOTA: que el chip tiene que ser insertado con la marca de posicionamiento (el agujero en la parte superior del chip) en la parte trasera. - Coloque la junta de goma a la parte inferior de la abrazadera de la oblea mediante el ajuste de los dos salientes de la junta de goma en los agujeros.
- Montar la junta tórica (grande) enla parte superior de la carcasa de oblea. Montar la abrazadera de la oblea con el agujero del sensor en la parte trasera. Tire de la palanca exterior de la base de la carcasa hacia delante a la posición horizontal para bloquear la abrazadera de la oblea en su lugar.
- Después de montar el soporte, coloque la parte inferior del soporte de la caja de luz para confirmar que no haya burbujas de aire en los pozos. Si se detectan burbujas de aire, eliminarlos utilizando la jeringa de plástico suministrada equipado con una punta de carga de muestra.
- Retire la tapa y poner el conjunto sobre la placa en la parte superior de la unidad de dispositivo de análisis de la movilidad celular. Coloque el bloque del sensor al soporte.
- Preparar células HL60 para Ensayo de quimiotaxis
- Calcular la densidad celular de las células HL60 diferenciadas con un hemocitómetro. Después de 5 días de diferenciación, la densidad celular es de alrededor de 1,0 x 10 6 células / ml.
- Calcular el volumen final de las células HL60 a una densidad celular final de 2 x 10 6 células / ml. Por ejemplo, si la densidad celular de lacélulas HL60 diferenciadas es de 1,0 x 10 6 células / ml, luego 10 ml de células HL60 diferenciadas se resuspendieron con 5 ml de 0,1% de BSA / medio RPMI 1640 para llegar a 2 x 10 6 células / ml.
- Centrifugar las células HL60 diferenciadas en 200 xg durante 5 min a TA. Eliminar el sobrenadante y resuspender las células con el volumen calculado de 0,1% de BSA / medio RPMI 1640 en el paso 3.6.2) a una densidad celular final de 2 x 10 6 células / ml.
- Poner en marcha la unidad de dispositivo de análisis de la movilidad celular y el PC para la adquisición de imágenes. Conectar el dispositivo al ordenador. Encienda el dispositivo de análisis de la movilidad celular. Encienda el PC.
- Puesta en marcha de Análisis de Movilidad Device Software.
- Observe 5 paneles de control: las imágenes de la cámara, calentador, disparo, memo, y de la cámara.
- En el panel de control de imagen de la cámara, utilice "línea horizontal" o "línea vertical" para ajustar la posición del soporte / vista en tiempo real para centrar la cámara en el panel de imagen de la cámara.
- En el panel de control de la cámara, seleccione CH1 a CH6 para mover la cámara al canal definido. Para centrar los campos de vista de un canal, haga clic en "Mover L" o "Mover R" para ajustar la coordenada X de la cámara y centrar la posición de la cámara en horizontal.
- Ajuste la coordenada y de la cámara girando el mando de posición en el panel frontal de la unidad de dispositivo de análisis de la movilidad celular para ajustar verticalmente la imagen para centrar la pantalla.
- En el panel de control del calentador, establezca el "temp titular" a 37,0 ° C y la "temperatura de la placa" a 39 ° C. Haga clic en "Heat" para comenzar el calentamiento. También haga clic en "soporte" para controlar la temperatura con el sensor térmico conectado al soporte.
- En el panel de tiro, introduzca "15 s" en "Intervalo" y "30 minutos" en el "tiempo" para los intervalos y la duración del ensayo de quimiotaxis. Marque "calentador desde el final del rodaje" por razones de seguridad. Designar una destination de las imágenes almacenadas.
- En el panel de notas, de entrada los detalles de los experimentos, como la línea celular utilizada, si es o no se aplicó el tratamiento, y la concentración de quimioatrayentes aplican.
- Confirmar la posición central de todos los canales que se utilizarán en los experimentos, y repetir el ajuste de todos los canales, si es necesario.
- Inyectar y alinear las células de la siguiente manera:
- Retire la memoria intermedia del soporte, y sacar 8 l de tampón desde el tercer pozo de la parte superior de cada canal.
- Utilice una jeringa para inyectar 2 l de células en el segundo bien en el mismo canal mientras que el control de la pantalla en tiempo real para controlar el número de células y el flujo durante la inyección. Después de que las células están bien alineados, añadirá inmediatamente las 8 l de tampón de espalda. Repetir el mismo procedimiento para los otros canales (Figura 1B).
- Añadir 2 ml de tampón de vuelta a su titular, y añadir 1 l 100 nM fMLP para el tercer pozo de la parte superior. Iniciar la adquisición de imágenes y guardar los datos. Analizar los datos obtenidos utilizando la imagen de software de rastreo 9 (Figura 2).
4. Transfección con la electroporación
- Diferenciar las células HL60 5 días antes del experimento tal como se describe en la Sección 1. Escudo de 4 pocillos o 1-cámaras, así como se indica en la Sección 2.
- Preparar y cálido medio de recuperación de la electroporación RPMI 1640, que contiene RPMI 1640, 20% (v / v) FBS, piruvato sódico 0,1 mM, y HEPES 25 mM, a 37 ° C.
- Justo antes de comenzar el experimento de transfección, añadir ya sea 300 l o 3 ml de medio de cultivo RPMI 1640 en los pocillos de las cámaras de 4 pocillos o 1 pocillos pre-recubiertos, respectivamente.
- Se incuban las cámaras en un humidificado 37 ° C incubadora con 5% de CO 2. Utilizar estas cámaras inmediatamente o almacenar en la incubadora para su uso futuro (dos semanas).
- Contar la densidad celular de la HL6 diferenciada0 células con un hemocitómetro.
NOTA: La densidad celular alcanza a menudo aproximadamente 1,0 x 10 6 células / ml. La densidad celular superior a 3,0 x 10 6 células / ml, por lo general da la eficacia de transfección indeseable. Como las células HL60 son células en suspensión, no se requiere resuspensión. - Centrifugar las células a 200 xg durante 5 min a TA. Eliminar el sobrenadante y resuspender 2 x 10 6 células HL60 en 100 l de reactivo de transfección.
- Añadir 4 g de plásmido GFP-PKD1 9 en la mezcla de 100 l de las células y los reactivos de transfección y mezclar suavemente y en profundidad. Añadir la mezcla en la cubeta proporcionada.
- Seleccionar el programa pre-establecido por el fabricante para la línea celular de leucocitos humanos y realizar la electroporación.
NOTA: La información adicional está disponible en la web del fabricante. - Después de la electroporación, inmediatamente y suavemente agregar pre-calentado 500 l RPMI 6140 medio de recuperación de la electroporación a las células, ytransferir suavemente las células de la cubeta a un tubo de 1,6 ml con las pipetas de plástico proporcionados.
- Se incuban las células durante 30 min en un humidificado 37 ° C incubadora con 5% de CO 2. Seed 100 l o 500 l de células en un pocillo de una 4-pozo o una cámara de 1-bien, respectivamente.
- Añadir RPMI 1640 medio de cultivo a un volumen final de 1 ml o 4 ml a ese mismo pocillo de una 4-pozo o una cámara de 1-bien, respectivamente. Se incuban las células en una incubadora humidificada C 37 ° con 5% de CO2 durante 3 hr. Pre-caliente RPMI 1640 muriendo de 37 ° C.
- Con una pipeta de 1 ml, retire con cuidado 0,8 ml o 3 ml de medio RPMI 1640 la cultura del pozo de una cámara de 4 pocillos o una cámara de 1-bueno, respectivamente. Ser suave y evitar succionar las células HL60 adheridas.
NOTA: Las células HL60 crecen y se diferencian en los medios de suspensión. Después de ser diferenciados o con ciertos tratamientos, las células HL60 se adhieren al sustrato recubierto con polilisina, colágeno, gelatina, o fifibronectina. - Añadir 0,8 ml o 3 ml de medio RPMI 1640 hambrientas en el pozo de una cámara de 4 pocillos o 1-bien, respectivamente. Espere 1 hora.
NOTA: En este punto, las células están listas para experimentos de imagen 9.
5. Control de GPCR mediada translocación de membrana de PKD1 por Multi-canal de Microscopía fluorescente
- Preparar una mezcla fresca de 100 nM de fMLP y 1 mg / ml Alexa 594 en RPMI 1640 medio de hambre como estímulos.
NOTA: La mezcla de fMLP y Alexa 594 necesita ser recién hecho para asegurar la máxima eficacia. - Monte una cámara de 4 pocillos sembrada con células más de una lente de aceite de 40X.
- Ajuste el microscopio de fluorescencia en la configuración multicanal de la siguiente manera:
- Ajuste el canal verde de emisión (500-530 nm) para GFP-etiquetados PKD1, el canal de emisión roja (580-620 nm) para quimioatrayente fMLP (Alexa 594), y el canal de luz transmitida para identificar células HL60 adheridas.
- Iniciar la adquisición "en vivo" yoptimizar las condiciones de adquisición de los tres canales:
- Ajustar entre la intensidad y la potencia del láser para los tres canales para reducir al mínimo fotoblanqueador por un período de formación de imágenes más tiempo.
- Si es necesario, promedio cada 2 a 4 marcos para disminuir la relación de ruido de fondo para una mejor calidad de las imágenes. Use un intervalo de 1 segundo.
- Búsqueda para adherir las células que expresan fuerte PKD1-GFP en la vista del canal GFP y DIC (contraste diferencial de interferencia). Las células adheridas son morfológicamente plana y no se mueven rápidamente.
- Después de identificar que se adhieren las células HL60 que expresa altamente GFP-PKD1, optimizar la condición de adquisición mediante la reducción de la potencia del láser, mientras que el aumento de la ganancia del detector para cada canal para reducir el fotoblanqueador para formación de imágenes a largo plazo (Figura 3A).
- Tomar hasta 100 l de solución de fMLP / Alexa 594 con una pipeta de 200 l y dejar de lado. Seleccione la "adquisición de lapso de tiempo" y establecer los intervalos a2 segundos y el número de fotogramas para adquirir el 100.
NOTA: los intervalos y número de fotogramas para adquirir dependen del propósito de los experimentos. 1-2 intervalos seg y 100 tramas se utilizan a menudo para los experimentos de imagen, como en la Figura 3. Para la migración de las células lentamente, intervalos más largos son necesarios para la formación de imágenes a largo plazo. Por el contrario, para migrar rápidamente las células, se requieren intervalos más cortos para observar los detalles continuas de la migración celular. - tomar con cuidado la tapa de una cámara de 4 pocillos de manera que no se cambia la posición de la cámara. Iniciar la adquisición de inmediato y adquirir 3-5 imágenes de las células no estimuladas, mientras que el posicionamiento de la pipeta 200 l directamente sobre las células utilizando el punto de luz láser como guía.
- Pipeta de la mezcla de fMLP / Alexa 594 sobre las células van a tomar imágenes con una rápida y homogénea del flujo y terminar el juego completo de adquisición de lapso de tiempo. Un nombre y guardar los datos que va a ser sometido a más análisis de datos.
6. Las células Imaging Chemotaxing en estímulos visibles y controlables quimioatrayente
- Usando una micropipeta de 10 l consejos e inyección, rellenar una micropipeta con 30 l de mezcla de fMLP y Alexa594 recién preparados.
- Coloque la micropipeta a un soporte micropipeta montado en la parte superior de una platina del microscopio y conectar el tubo a la unidad de suministro de presión, un aparato que proporciona una presión constante para liberar solución de fMLP / Alexa594 de la micropipeta para generar un gradiente constante.
- Abra el suministro de presión y ajustar la presión de compensación (Pc) a 70 hPa.
- Montar un cubreobjetos 1-así de cámara sembrada con células HL60 que expresan GFP-PKD1 sobre una lente de aceite de 40X en un microscopio confocal o su equivalente microscopio de fluorescencia.
- adquisición fijado en el modo de canal en la siguiente configuración: canal verde (500-530 nm) para PKD1 GFP-etiquetados; canal rojo (580-620 nm) para quimioatrayente fMLP (Alexa594); y transmitted canal de luz para identificar células HL60 adheridas.
- Iniciar la adquisición "en vivo" y optimizar las condiciones de adquisición de los tres canales: ajustar la intensidad de cada canal para el análisis cuantitativo de los datos de imagen; poner a punto entre la intensidad y la potencia del láser para los tres canales para obtener imágenes con la mejor calidad y minimizar la foto-blanqueador. Si es necesario, un promedio de cada 2 a 4 marcos para una mejor calidad de imagen. Utilizamos generalmente un intervalo de 1 segundo.
- Iniciar la adquisición "en vivo" y la búsqueda de la adhesión de células que expresan fuerte PKD1-GFP en la vista de la GFP y los canales de transmisión de luz. El uso de la óptica de campo claro, centro de la micropipeta en el campo central de visión (Figura 4A) con el fin de visualizar el gradiente de fMLP y las células HL60 adheridas que expresan GFP-PKD1.
- Seleccionar la adquisición de lapso de tiempo y establecer los intervalos a intervalos de 2 seg y el número de fotogramas para adquirir el 100.
NOTA: Después de recoger cada time serie de lapso de tiempo, el nombre y guardar los datos que va a ser sometido a más análisis de datos.
Resultados
de formación de imágenes simultánea de quimiotaxis de múltiples células HL60 usando dispositivo de análisis de la movilidad celular
Con base en el principio de la microfluídica 16, el fabricante ha proporcionado los perfiles simulados de gradientes: un gradiente se genera dentro de 1 min, estabilizado dentro de 5 min, y se mantuvo durante 2 hr. Los perfiles altamente predecibles de los gradientes estables generados por microfluídica permiten múltiples quimiotaxis ensayos que se lleven a cabo simultáneamente. En el presente estudio, se observaron tres ensayos de quimiotaxis simultáneas (Figura 2A y Película 1). Se encontró que las células HL60 comenzaron inmediatamente después de la chemotaxing quimioatrayente fue inyectado en el pozo del cebo químico, y mantuvimos chemotaxing en un camino recto para el 60 minutos después, en consonancia con los resultados de la simulación para la estabilidad de la pendiente. Trazando el camino recorrido y la morfologíade las células permite mediciones cuantitativas y la posterior comparación de los comportamientos de quimiotaxis utilizando un índice de quimiotaxis, que incluye la longitud total de la ruta, la velocidad, la direccionalidad, y la redondez de las células (Figura 2B). longitud total de la ruta es la suma de las longitudes de los segmentos de línea que conectan los centroides de la ruta de acceso. La velocidad se obtiene dividiendo la longitud total de la ruta por el tiempo. Direccionalidad se mide hacia arriba y se define como: (coordenada Y del final de la ruta menos coordenada Y del principio) dividido por la longitud total de la ruta. Esto le da a 1.0 para un objeto que se mueve directamente hacia arriba. La redondez de la célula es una medida (en porcentaje) de la eficiencia con una cantidad dada de perímetro encierra zona. Un círculo tiene el área más grande para cualquier perímetro dado y tiene un parámetro de redondez de 100%. Una línea recta no encierra ninguna zona y tiene un parámetro de redondez de 0%. Mostramos el comportamiento quimiotaxis medido cuantitativamente como se describe por los parámetros seleccionados de quimiotaxis(Figura 2C).
Monitoreo de PKD localización subcelular en las células HL60 en virtud de un estímulo espaciotemporalmente visible y controlable fMLP
Es un gran avance técnico que aplican la etiqueta fluorescente y la estimulación quimiotáctica controlable para un sistema experimental. Históricamente, se ha aplicado ya sea estimulación homogénea (también llamado uniforme) o la estimulación de gradiente para observar la respuesta de células y comportamientos. Sin embargo, la estimulación "a ciegas" no sólo no proporciona ninguna información sobre la forma espacio-temporal del estímulo llega a las células, sino que también pone en duda cualquier observación "anormales" de la respuesta celular a la estimulación, simplemente porque no vemos el estímulo. Hemos demostrado previamente que el colorante fluorescente (Alexa594) se puede aplicar con quimioatrayente para establecer una relación lineal entre la concentración de quimioatrayente ymonitored intensidad colorante fluorescente 15. Con una configuración de adquisición de la proteína verde fluorescente (GFP), una emisión roja de tinte fluorescente (Alexa594), y la luz transmitida, somos capaces de controlar las células que se adhieren, la aplicación del estímulo y la respuesta de las células a los estímulos (Figura 3A). La proteína quinasa D es una familia de serina / treonina quinasas que desempeñan papeles esenciales en la migración celular dirigida 9,17. En respuesta a uniformemente fMLP (rojo) estimulación aplicada, células HL60 mediar un robusto translocación de membrana de GFP marcada con la proteína quinasa D1 (verde) (Figura 3B y la película 2). En un gradiente de fMLP (rojo) (Figura 4A), las células HL60 reclutan activamente PKD1 al borde de ataque (Figura 4B y la película 3). Un cierre para la comparación de la localización subcelular de GFP en el saliente del borde de ataque indica que PKD1 se localiza en la parte trasera del borde de ataque (Figura 4C).
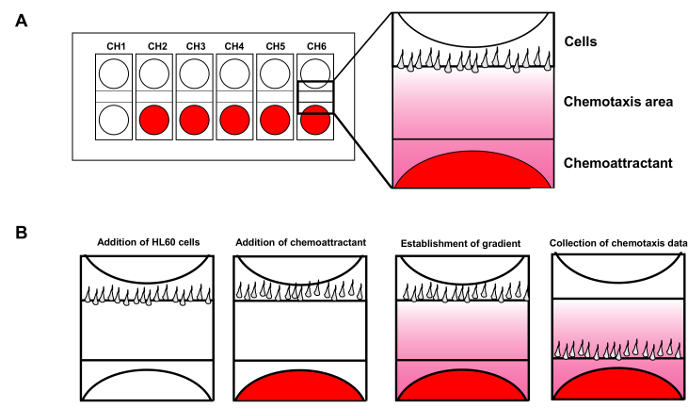
Figura 1. Cell dispositivo de análisis de la movilidad permite hasta 6 ensayos de quimiotaxis simultáneas. (A) Esquema muestra el diseño de un chip de dispositivo de análisis de la movilidad celular para la supervisión simultánea de 6 ensayos de quimiotaxis independientes. shows rojas quimioatrayente añadieron a los pocillos. (B) La introducción de las células HL60 a los pocillos de células, mientras que el cebo químico se difunde para establecer un gradiente de fMLP constante. Por favor, haga clic aquí para ver una versión más grande de esta figura.
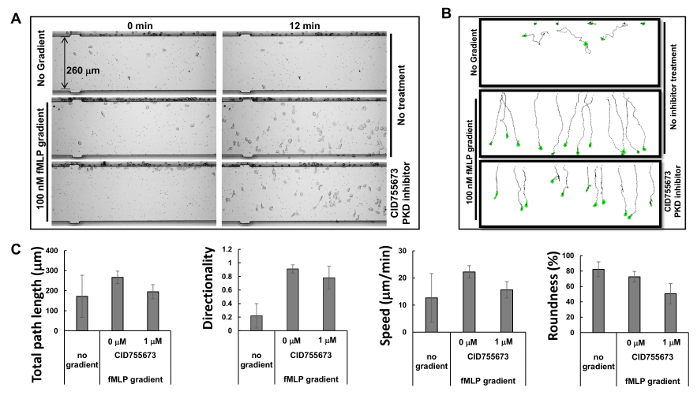
Figura 2. Visualización simultánea de múltiples ensayos de quimiotaxis con células HL60. (A ) Montaje muestra imágenes del ensayo de quimiotaxis dispositivo de análisis de la movilidad celular para examinar los efectos inhibitorios de los inhibidores de PKD-específicas sobre la quimiotaxis en los momentos de 0 y 12 min después de la aplicación del gradiente. quimiotáctica células HL60 se pre-tratados con inhibidor de PKD CID755673 1 M durante 30 min. Se dejó que las células HL60 con o sin el tratamiento de inhibidor de PKD a chemotax en cualquiera de 100 nM de fMLP gradientes de 12 min RPMI1640 medio de hambre o. (B) Esquema muestra la longitud del camino recorrido y la morfología de las células HL60 trazadas. (C) Cuantificación de la quimiotaxis como la longitud total de la ruta, la velocidad, la direccionalidad, y redondez. La media ± SD se muestra; n = 10, 12, o 11 para ningún gradiente, gradiente fMLP sin tratamiento CID755673, fMLP y el tratamiento con el tratamiento CID755673, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.
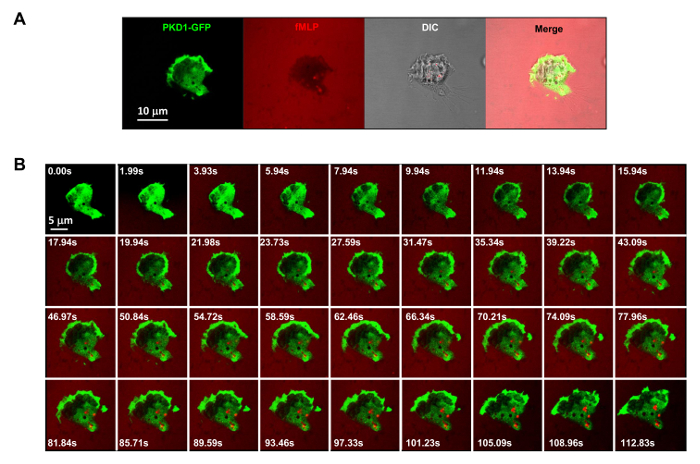
Figura 3. GPCR mediada robusto translocación de membrana de PKD1 en respuesta a estímulos fMLP uniformemente aplicados. (A) el seguimiento de multicanal de PKD1-GFP (verde), quimioatrayente (fMLP 1 M mezcló con 0,1 g / ml de colorante fluorescente Alexa 594, rojo) y DIC (contraste de interferencia diferencial) para identificar las células HL60 se adhieren en un pocillo de una cámara de 4well recubierta con gelatina al 0,2% en medio RPMI 1640. Barra de escala = 10 micras. (B) Montaje muestra que uniformemente aplicada fMLP (rojo) induce la translocación de la membrana sólida de PKD1-GFP (verde). Por favor, haga clic aquí para ver una versión más grande de esta figura.
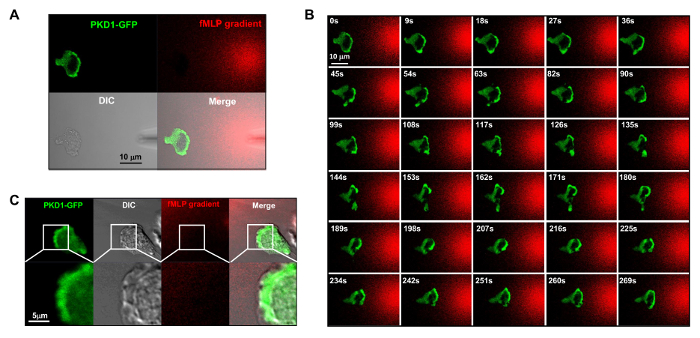
figure 4. Líder de localización borde de PKD1 en chemotaxing células HL60. configuración del modo de adquisición (A) Canal facilita la visualización del gradiente de fMLP y la dinámica espacio-temporales de PKD1. En A - C, las células HL60 expresan transitoriamente PKD1 GFP-etiquetados; para visualizar el gradiente de fMLP generado a partir de una micropipeta (DIC), 100 nM de fMLP (rojo) se mezcló con 0,1 g / ml colorante fluorescente Alexa 594. (B) localización enriquecida de PKD1 en el borde delantero de la célula chemotaxing. Barra de escala = 10 micras. (C) las imágenes fusionadas muestran que PKD1 se localiza en la parte trasera del borde de ataque en las células HL60. Verde muestra PKD1 localización celular, y la imagen DIC muestra la zona que sobresale del borde de ataque. Barra de escala = 5 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En el presente estudio, se muestran dos ejemplos de ensayos de quimiotaxis: primero, el control simultáneo de múltiples ensayos de quimiotaxis por el dispositivo de análisis de la movilidad celular; y en segundo lugar, la visualización del gradiente quimioatrayente y la dinámica espacio-temporal de los acontecimientos en las mismas células en tiempo real de señalización.
dispositivo de análisis de la movilidad de la célula para múltiples ensayos de quimiotaxis simultáneas
En el presente estudio, hemos introducido un protocolo detallado para realizar múltiples ensayos de quimiotaxis simultánea utilizando un dispositivo de análisis de la movilidad celular. Este dispositivo permite al usuario observar el comportamiento de la quimiotaxis celular con una lente objetivo de 10X en la observación de campo claro convencional. Debido a las características de difusión-dominante del flujo de fluido, el dispositivo de análisis de la movilidad celular genera, gradientes estables altamente predecibles y permite que hasta seis ensayos de quimiotaxis para ser llevado a cabo de forma simultánea. Los pasos críticos del protocolo sonpara obtener gradientes fiables y alinear las células en la línea de terraza. El usuario debe seguir estrictamente las instrucciones del fabricante para el conjunto del portador y la inyección de quimioatrayentes y células. Las instrucciones detalladas están disponibles en línea. Comparado con los métodos de quimiotaxis alternativas 11-13,15, este dispositivo mejora significativamente la fiabilidad y la eficiencia de ensayos de quimiotaxis. Cuatro tamaños de chip de dispositivo de análisis de la movilidad de células en tamaños de 4, 5, 6, y 8 micras están disponibles para adaptarse a diferentes tipos y tamaños de células. Se encontró que un chip de la movilidad celular dispositivo de análisis de 4 o 5 micras es adecuado para el HL60 y D. discoideum células, que son alrededor de 10-15 micras de diámetro. Sin embargo, una limitación es que este dispositivo no es adecuado para todos los tipos de células. Hemos tenido poco éxito utilizando el ensayo de quimiotaxis dispositivo de análisis de la movilidad celular con células Raw267.4. La razón puede ser que las células Raw267.4 migran demasiado lentamente. El tiempo requerido para che eficientemotaxis de células Raw267.4 podría ser mucho más largo que el tiempo de un gradiente se mantiene por el dispositivo. En cambio, un ensayo de migración transwell funcionó bien para las células Raw267.4 9. Otra limitación es que la observación fluorescente no es posible con el dispositivo actual. Una dirección futura es monitorear imágenes fluorescentes con mayor aumento. Esto es posible con el dispositivo de análisis de la movilidad celular mejorada, que está equipado con detección fluorescente y una lente objetivo 100X. Además, el número de ensayos simultáneos también se incrementa a 12. Todas estas mejoras facilitan el rendimiento mejorado de ensayos de quimiotaxis y de la observación de la dinámica de subcelulares en la migración de células.
Alta eficiencia de transfección de las células HL60 para expresar la proteína proteína marcada con fluorescente
Las células HL60 son una línea celular de leucemia se dividen activamente y crecen en suspensión. Como se informó anteriormente 18-20, células HL60 son resistentes a la gtransferencia eno. Tanto los lípidos y la transferencia de genes electroporación se han probado, y se obtuvo una mayor eficiencia de la transfección con la electroporación, tal como se describe en detalle en la sección 4. La obtención de una alta viabilidad después de la electroporación es fundamental para obtener una alta eficiencia de transfección debido a los graves daños que resulta de la electroporación. Posteriormente, se requiere un manejo cuidadoso y gentil celular, sobre todo después de la electroporación. Todos los medios de comunicación tienen que ser pre-calentado y añadió suavemente a las células en alguna medida después de la electroporación. También es fundamental para reducir al mínimo el tiempo de exposición de las células al reactivo de electroporación. Para evitar la muerte celular, después de la electroporación, RPMI 1640 medio de recuperación de la electroporación se debe añadir a las células inmediatamente. Se encontró que el 20% de FBS en el medio de recuperación da una tasa de recuperación de células mucho más alto que 10% de FBS. Después de la electroporación, la incubación en medio RPMI 1640 de recuperación de electroporación para 30 min es crítica para una mayor viabilidad y transfeccióneficiencia. Para aumentar aún más la eficiencia de la transfección, que también se utiliza 4 ADN plasmídico g por transfección, que es casi dos veces la cantidad de plásmido recomendado por el fabricante.
Hay dos grandes limitaciones en la transfección electroporación: la transitoriedad de la expresión de la proteína y el límite de número de células (2 x 10 6 células por transfección). En las células no diferenciadas, la expresión es detectable sólo durante el primer par de divisiones celulares, ya que el plásmido vector se diluye a la mitad después de cada división celular. Por El HL60 diferenciadas células sobreviven no más de 48 horas. Como resultado, cualquier experimento requiere transfecciones frescas 6 hr antes del experimento. El número de células para una electroporación simplemente cumple el requisito mínimo para cualquier ensayos bioquímicos. A los efectos del uso repetitivo o gran cantidad, se recomienda encarecidamente que se estableció una línea de células HL60 no diferenciada que forma estable expresa la proteína de interés WHIch ha sido etiquetado con una proteína fluorescente por un vector viral, si un vector viral está disponible o se puede construir.
Divulgaciones
The authors declare no competing financial interest for this work.
Agradecimientos
This work is supported by the intramural fund of NIAID, NIH.
Materiales
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium GlutaMAX | Life technologies | 61870-036 | |
| Sodium pyruvate | Thermo Fisher Scietific | 11360-070 | |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| 1 M HEPES sterile solution, pH 7.3 | Quality Biological Inc. | A611-J848-06 | |
| Penicillin streptomycin solution | Fisher Scientific | 15140122 | |
| NucleofectorTM 2b | Lonza | AAB-1001 | |
| AmaxaTM Cell Line NucleofectorTM Kit V including NucleofectorTM Solution, Singe use pipettes, AmaxaTM certified 100 ml aluminum electrode cuvettes | Lonza | VCA-1003 | |
| Lab-Tek chambered #1.0 Borosilicate Coverglass | Nalge Nunc International Inc | 155383 | |
| 2% Gelatin solution | Sigma-Aldrich | G1393 | |
| Fibronectin | Sigma-Aldrich | F1141 | |
| HBSS (Hanks’ Balanced Salt Solution) | Life technologies | 14025-076 | |
| Bovine serum albumin | Sigma-Aldrich | A3803 | |
| Single well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155361 | |
| Four-well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155383 | |
| Alexa 594 | Thermo Fisher Scientific | A-10438 | |
| fMLP | Sigma -Aldrich | F3506-5MG | |
| Cover glass thickness (2) 22 mm x 22 mm | Corning | 2855-22 | |
| EZ-TAXIScan | Effector Cell Institute, Inc. | MIC-1001 | |
| EZ-TAXIScan chip (5 mm) | Effector Cell Institute, Inc. | EZT-F01-5 | |
| 1701RN 10 μl syringe | Hamilton | 80030 | |
| Femtotips II Injection tips | Eppendorf | 5242956003 | |
| Femtotips II | Eppendorf | 930000043 | |
| TransferMan NK2, including motor module, X head with angle adjuster, and Positioning aids. | Eppendorf | 5188900056 | |
| DIAS software | Solltech Inc. | ||
| LSM 780 META or equivalent confocal microscope with a 40X 1.3 NA or 60X 1.4 NA oil DIC Plan-Neofluar objective lens | Carl Zeiss |
Referencias
- Pocha, S. M., Montell, D. J. Cellular and molecular mechanisms of single and collective cell migrations in Drosophila: themes and variations. Annual review of genetics. 48, 295-318 (2014).
- Wen, Z., Zheng, J. Q. Directional guidance of nerve growth cones. Current opinion in neurobiology. 16, 52-58 (2006).
- Bravo-Cordero, J. J., Hodgson, L., Condeelis, J. Directed cell invasion and migration during metastasis. Current opinion in cell biology. 24, 277-283 (2012).
- Zigmond, S. H. Chemotaxis by polymorphonuclear leukocytes. The Journal of cell biology. 77, 269-287 (1978).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, receptors and human disease. Cytokine. 44, 1-8 (2008).
- Dong, X., et al. P-Rex1 is a primary Rac2 guanine nucleotide exchange factor in mouse neutrophils. Current biology : CB. 15, 1874-1879 (2005).
- Li, Z., et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell. 114, 215-227 (2003).
- Van Haastert, P. J., Devreotes, P. N. Chemotaxis: signalling the way forward. Nature reviews: Molecular cell biology. 5, 626-634 (2004).
- Xu, X., et al. GPCR-Mediated PLCbetagamma/PKCbeta/PKD Signaling Pathway Regulates the Cofilin Phosphatase Slingshot 2 in Neutrophil Chemotaxis. Mol Biol Cell. , (2015).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of experimental medicine. 115, 453-466 (1962).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of cell biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of cell science. 99 (Pt4), 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PloS one. 5, e15309(2010).
- Bozzaro, S., Fisher, P. R., Loomis, W., Satir, P., Segall, J. E. Guenther Gerisch and Dictyostelium, the microbial model for ameboid motility and multicellular morphogenesis. Trends in cell biology. 14, 585-588 (2004).
- Xu, X., Jin, T. Imaging G-protein coupled receptor (GPCR)-mediated signaling events that control chemotaxis of Dictyostelium discoideum. Journal of visualized experiments : JoVE. , (2011).
- Lin, F., et al. Generation of dynamic temporal and spatial concentration gradients using microfluidic devices. Lab Chip. 4, 164-167 (2004).
- Eiseler, T., et al. Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology. 11, 545-556 (2009).
- Roddie, P. H., Paterson, T., Turner, M. L. Gene transfer to primary acute myeloid leukaemia blasts and myeloid leukaemia cell lines. Cytokines Cell Mol Ther. 6, 127-134 (2000).
- Schakowski, F., et al. Novel non-viral method for transfection of primary leukemia cells and cell lines. Genet Vaccines Ther. 2, 1(2004).
- Uchida, E., Mizuguchi, H., Ishii-Watabe, A., Hayakawa, T. Comparison of the efficiency and safety of non-viral vector-mediated gene transfer into a wide range of human cells. Biol Pharm Bull. 25, 891-897 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados