Method Article
Imaging G Protein-gekoppelten Rezeptor-vermittelte Chemotaxis und seine Signalereignisse in Neutrophilen-like HL60-Zellen
In diesem Artikel
Zusammenfassung
Visual-Chemotaxis-Assays sind für ein besseres Verständnis, wie eukaryotische Zellen steuern chemoattractant vermittelten Richtungszellmigration. Hier beschreiben wir detaillierte Methoden für: 1) in Echtzeit, hochauflösende Überwachung mehrerer Chemotaxis-Assays und 2) gleichzeitig die chemische Lockstoffe Gradienten zu visualisieren und die räumlich-zeitliche Dynamik der Ereignisse in Neutrophilen wie HL60-Zellen signalisiert.
Zusammenfassung
Eukaryotic cells sense and move towards a chemoattractant gradient, a cellular process referred as chemotaxis. Chemotaxis plays critical roles in many physiological processes, such as embryogenesis, neuron patterning, metastasis of cancer cells, recruitment of neutrophils to sites of inflammation, and the development of the model organism Dictyostelium discoideum. Eukaryotic cells sense chemo-attractants using G protein-coupled receptors. Visual chemotaxis assays are essential for a better understanding of how eukaryotic cells control chemoattractant-mediated directional cell migration. Here, we describe detailed methods for: 1) real-time, high-resolution monitoring of multiple chemotaxis assays, and 2) simultaneously visualizing the chemoattractant gradient and the spatiotemporal dynamics of signaling events in neutrophil-like HL60 cells.
Einleitung
Eukaryotischen Zellen erfassen und innerhalb eines chemische Lockstoffe Gradienten in Richtung der höheren Konzentration zu bewegen, ein zellulärer Prozess bezeichnet als Chemotaxis. Chemotaxis spielt eine entscheidende Rolle bei vielen physiologischen Prozessen, wie der Embryonalentwicklung 1, Neuron Musterung 2, Metastasierung von Krebszellen 3, die Rekrutierung von Neutrophilen an Entzündungsstellen 4 und die Entwicklung des Modellorganismus Dictyostelium discoideum 5. Im allgemeinen Sinn eukaryotischen Zellen unter Verwendung Chemoattraktoren G - Protein-gekoppelten Rezeptoren 5. Der Eingriff der Chemoattraktoren mit diesen Rezeptoren fördert die Dissoziation der heterotrimeren G - Proteine G & agr; und Gβγ, die stromabwärts Signaltransduktionswege aktivieren wiederum die letztendlich die räumlich - zeitliche Organisation der Aktin - Zytoskelett regulieren 5-9 Zellmigration zu treiben.
Zellbiologen haben die Entwicklung und die Verbesserung der chemotaxAssays ist zu prüfen, wie G-Protein-gekoppelten Rezeptor (GPCR) Signalisierungs mediates Zellmigration gerichtet. Die Boyden - Kammer oder Transwell - Migrationstest wurde 1960 von Boyden 10 entwickelt. Der Test arbeitet mit einem Gradienten von chemoattractant Verbindungen zwischen zwei Vertiefungen zu schaffen, die durch eine mikroporöse Membran getrennt sind. Seine Einfachheit und Benutzerfreundlichkeit machen es die am häufigsten verwendete Chemotaxis-Assay auf dem Laufenden. Allerdings ist der Test nicht die Migration Prozess der Zellen ermöglichen, visualisiert werden. Die Zigmond Kammer ist das erste visuelle Mikrofluidik - Vorrichtung , die auf einem Deckglas über eine Engstelle in Richtung einer Quelle chemische Lockstoffe 11 freie Darstellung der Zellmigration ermöglicht. Dunn 12 und Insall 13 modifiziert und verbessert , um die hochauflösenden und Langzeitabbildungsfähigkeit der Kammer - Chemotaxis - Assay Zigmond. Wegen der in hohem Maße vorhersehbar, diffusions dominanten Eigenschaften der Fluidströmung, Mikrofluidik hat Lösungen für die nächste Generati Bereitstellungauf Chemotaxis-Assays wie EZ-TAXIScan (eine Zellmobilität Analysegerät).
Mit der Stabilität des Gradienten gewährleistet ist , ermöglicht die Vorrichtung sechs Chemotaxis - Assays gleichzeitig durchgeführt werden (1A). Im Gegensatz zu den oben in den verschiedenen Kammer Assays erzeugten Gradienten richtungs fixiert, entwickelt sich die Nadel oder Mikropipette Assay von Guenther Gerisch einen Gradienten mit einer beweglichen Quelle 14. In dem Assay chemoattractant wird von einem beweglichen Mikropipette freigesetzt einen stabilen Gradienten zu erzeugen. Mit dieser Nadel-Test, fanden die Forscher heraus, dass verschiedene Zellen Pseudopoden fundamental unterschiedlichen Eigenschaften erzeugen. Die Anwendung der Fluoreszenzmikroskopie konnten wir den Gradienten zu visualisieren ihre quantitative Messung im gesamten 15 zu erleichtern. In dieser Studie beschreiben wir detailliert Verfahren zur Herstellung von chemotaktischen HL60 (Mensch Promyelozytenleukämie-Zellen), gleichzeitig mehrere Chemotaxis ASSA Überwachungsys mit der Zellmobilitätsanalysegerät, und Visualisieren der GPCR-vermittelten räumlich-zeitliche Dynamik der Signalmoleküle wie Protein-Kinase-D1 in einzelnen lebenden Zellen in Reaktion auf sichtbares, räumlich-zeitlich steuerbare chemoattractant Reize. Unsere fortschrittliche Bildgebungsverfahren können auf allgemeine Studien Chemotaxis angewendet werden und eignen sich besonders für Säugetierzellsysteme.
Protokoll
1. Kultur und Differenzierung von humanen neutrophilen artigen HL60-Zellen
- Bereiten RPMI (Roswell Park Memorial Institute) 1640-Kulturmedium, das RPMI 1640-Medium enthält, 10% (v / v) fötalem Rinderserum (FBS), 0,1 mM Natriumpyruvat und 25 mM HEPES (4- (2-hydroxyethyl) -1 -piperazineethanesulfonic Säure). Wärmen Sie das RPMI 1640 Kulturmedium auf 37 ° C.
- die Zelldichte von HL60-Zellen unter Verwendung einer Zählkammer bestimmen, sind die Zellen in der log-Phase Wachstumsphase, um sicherzustellen.
HINWEIS: Die Zellen sind in der Regel in der log-Phase am dritten Tag nach der Passagierung. Die Dichte der log-Phasen - Zellen ist in der Regel 6-8 x 10 5 Zellen / ml. Die Zelldichte eine neue Kultur zu starten , erforderlich ist etwa 1,5 x 10 5 Zellen / ml.
HINWEIS: Zum Beispiel, für ein 10 ml neue Kultur in einem T-75 Flachkolben, wenn die Zelldichte von log-Phasen - Zellen ist 6 x 10 5 Zellen / ml, dann mit 2,5 ml der log-Phasen - Zellen (6 x 10 & sup5 ; ) in 10 m bis 1,5 x 10 5 Zellen / ml verdünntl neue Kultur. Auf ein Endvolumen von 10 ml Kultur bilden, 7,5 ml RPMI 1640 Kulturmedium zugesetzt wird. - Legen Sie das berechnete Volumen von warmem RPMI 1640 Kulturmedium in einen flachen Kolben. Für eine T-75-Kolben Flach Kultur, ist das Gesamtvolumen der Zellkultur 10 ml.
- Die berechnete Volumen der log-Phase wachsen HL60 Zellen in die Flachkolben mit einer Zelldichte von 1,5 x 10 5 Zellen / ml zu erreichen.
- Inkubieren der Zellen bei 37 ° C in einem befeuchteten Inkubator mit 5% CO 2.
HINWEIS: Die Verdopplungszeit von HL60 ist fast 24 Stunden. - Passage die Zellen mit RPMI 1640 Kulturmedium alle 2-3 Tage. Es ist wichtig , dass die Zelldichte der HL60 Zellen nie 1,5 x 10 6 Zellen / ml übersteigt , und die Zellpassage dauert nicht länger als 2 Monate.
- Differenzieren Sie die HL60-Zellen 5 Tage vor den Experimenten.
HINWEIS: RPMI 1640 Differenzierungsmedium enthält RPMI-1640-Medium, 10% (v / v) fötalem Rinderserum (FBS), 0,1 mM Natriumpyruvat, 25 mM HEPES und 1,3% Dimethylsulfoxid (DMSO). Mit anderen Worten ist es 1,3% DMSO in RPMI 1640-Kulturmedium.- Auf HL60-Zellen, pre-warm das RPMI 1640-Kulturmedium auf 37 ° C unterscheiden. In den warmen RPMI 1640 Kulturmedium in einen flachen Kolben.
- Für eine endgültige 10 ml HL60 Differenzierungskultur, fügen 130 ul DMSO direkt mit dem RPMI 1640-Kulturmedium in den flachen Kolben, während der Kolben wirbelnde, so dass die DMSO schnell von der RPMI 1640-Kulturmedium verdünnt.
- Hinzufügen log-Phasen - HL60 - Zellen bis zu einer endgültigen Zelldichte von 1,5 x 10 5 Zellen / ml in einem endgültigen 10 ml RPMI 1640 Differenzierungsmedium. Kultur die HL60 - Zellen in RPMI 1640 Differenzierungsmedium bei 37 ° C in einem befeuchteten Inkubator mit 5% CO 2 für 5 Tage.
2. Die Beschichtung der Abdeckung Glasoberfläche der 4well Kammer
- Nehmen Sie die Flasche 2% Gelatine-Stammlösung aus dem Kühlschrank, reinigen Sie es mit 70% Ethanol, und legen Sie es in der Haube. Take 1 ml 2% Gelatine-Stammlösung und sofort wieder die verbleibende Gelatine-Stammlösung zu den Kühlschrank stellen.
- Erlauben die Gelatinelösung vollständig bei 37 ° C verflüssigen und es gründlich pipettieren. Verdünnen Sie die 2% Gelatine-Stammlösung mit 9 ml vorgewärmten 1x Hanks 'ausgeglichener Salzlösung (HBSS) Puffer auf eine Endkonzentration von 0,2% Gelatine.
- 0,5 ml oder 2 ml 0,2% Gelatine in HBSS zu den beiden mittleren Vertiefungen einer 4-Well-Kammer oder einer 1-well Kammer mit einem Deckglas in der unteren, respectively. Kippen Sie die Platten in mehrere Richtungen, so dass die Flüssigkeit die gesamte Fläche abdeckt.
- Legen Sie die Platten in einem 37 ° C Inkubator. Die Platten werden für den Einsatz in 1 Stunde fertig sein. Sie können bis zu 5 Tagen verwendet werden. Kurz bevor Zellen Impfen die Gelatinelösung aus den 4-gut oder 1-Well-Kammern zu entfernen.
3. Chemotaxis-Assay unter Verwendung der Zelle Mobility Analysegerät
- Bereiten Sie und wärmen RPMI 1640 hungernde Medium, das RPMI istMedium 0,1 mM Natriumpyruvat (optional) und 25 mM HEPES enthält.
- Bereiten Sie 100 ul 100 nM fMLP (N-Formylmethionyl-Leucyl-Phenylalanin) in RPMI 1640-Medium am Verhungern.
- Vorbereitung 3 ml 1% Rinderserumalbumin (BSA) / RPMI 1640 Medium, das enthält 1% BSA in RPMI 1640 Medium hungern und 10 ml 0,1% BSA / RPMI-1640-Medium.
- Mantel ein 22 mm quadratische Deckglas und eine 5 & mgr; m Zellbeweglichkeitsanalyse Vorrichtungschip mit frisch hergestellten 1% BSA / RPMI 1640-Medium für 1 Stunde bei RT.
- Montieren Sie den Halter mit dem folgenden Verfahren:
- Positionieren Sie die Halterbasis mit den Hebel in der vertikalen Position, so dass die Hebel in Richtung des Benutzers kippen kann. Anwenden 70% Ethanol-Lösung auf die Oberfläche der 41 mm-Glas. Wischen Sie vorsichtig die Oberflächen mit einem Wischtuch, kümmert sich nicht um sie zu kratzen.
- Legen Sie die 41 mm Glas in die Halterbasis. Setzen Sie die BSA-beschichtete 22 mm im Quadrat Deckglas auf der Oberseite des 41 mm Glas in der Halterbasis.
HINWEIS: Das beschichtete Quadrat coverslip zwischen 41 mm Glas und dem Chip ermöglicht die Chemotaxis auf dem Substrat der Beschichtungsoberfläche auftreten. - Setzen Sie den O-Ring (klein) in den Boden des Wafers Gehäuse, und montieren Sie den Wafergehäuse in die Halterbasis mit der elliptischen Loch auf der Rückseite. Ziehen Sie den inneren Ebene des Halters nach vorne, in die horizontale Position des Wafers Gehäuse in Position zu verriegeln.
- Schlag den Staub aus dem Inneren des Wafers Gehäuse mit einem Luft duster. 4 ml 0,1% BSA / RPMI-1640-Medium in den Wafer-Gehäuse.
- Montieren Sie die BSA-beschichteten Zellmobilität Analysegerät-Chip in der Mitte des Wafers Gehäuse mit der Strukturseite nach unten in Kontakt mit dem Glas.
HINWEIS: Dass der Chip mit der Positionsmarkierung eingefügt werden muss (das Loch in der Oberseite des Chips) auf der Rückseite. - Affix die Gummidichtung an der Unterseite der Waferklemme durch Einpassen der zwei Vorsprünge an der Gummidichtung in die Löcher.
- Montieren Sie den O-Ring (groß) aufdie Oberseite des Wafergehäuses. Montieren Sie die Waferklemme mit dem Sensorloch auf der Rückseite. Ziehen Sie den äußeren Hebel des Gehäusebodens nach vorn in die horizontale Position der Waferklemme in Position zu verriegeln.
- Nachdem die Halterung Montage, legen Sie den Boden des Halters auf den Lichtkasten, um zu bestätigen, dass es in den Vertiefungen keine Luftblasen sind. Wenn Luftblasen erkannt werden, entfernen sie den mitgelieferten Plastikspritze mit einer Probenladespitze angebracht werden.
- Entfernen Sie die Abdeckung und setzen Sie die Montage auf die Platte auf der Oberseite der Zellmobilität Analysegerät Einheit. Befestigen Sie den Sensorblock an der Halterung.
- Bereiten Sie HL60 Zellen für die Chemotaxis-Assay:
- Berechnen der Zelldichte der differenzierten HL60-Zellen mit einem Hämozytometer. Nach 5 Tagen der Differenzierung ist die Zelldichte etwa 1,0 × 10 6 Zellen / ml.
- Berechne den Endvolumen von HL60 - Zellen bei einer endgültigen Zelldichte von 2 x 10 6 Zellen / ml. wenn die Zelldichte der beispielsweisedifferenzierten HL60 - Zellen 1,0 x 10 6 Zellen / ml, dann 10 ml von differenzierten HL60 - Zellen werden mit 5 ml 0,1% BSA / RPMI 1640 Medium resuspendiert werden , um zu erreichen , 2 x 10 6 Zellen / ml.
- Zentrifuge differenzierten HL60-Zellen bei 200 xg für 5 min bei RT. Entfernen des Überstandes und Resuspendieren der Zellen mit dem berechneten Volumen von 0,1% BSA / RPMI - 1640 - Medium in Schritt 3.6.2) bis zu einer endgültigen Zelldichte von 2 x 10 6 Zellen / ml.
- Starten Sie die Zelle Mobilitätsanalyse Geräteeinheit und PC zur Bildaufnahme. Schließen Sie das Gerät an den PC. Schalten Sie die Zellmobilität Analysegerät. Schalten Sie den PC.
- Starten Sie die Zelle Mobility Analysis Device Software Up.
- Beobachten 5 Bedienfelder: Kamera, Heizung, Schießen, Memo und Kamerabilder.
- Auf dem Kamerabild Bedienfeld verwenden "Horizontale Linie" oder "vertikale Linie" der Halter- / Ansicht Position in Echtzeit einzustellen, um die Kamera im Kamerabild-Panel zu zentrieren.
- Auf der Kamera-Bedienfeld, wählen Sie CH1 bis CH6 die Kamera in den definierten Kanal zu bewegen. Um die Ansicht Felder eines Kanalmitte, klicken Sie auf "Move L" oder "R Move" einstellen die X-Koordinate der Kamera und in der Mitte die Position der Kamera horizontal.
- Stellen Sie die Y-Koordinate der Kamera durch Drehen der Position Knopf auf der Vorderseite der Zelle Mobilitätsanalyse Vorrichtungseinheit das Bild vertikal passen Sie den Bildschirm zu zentrieren.
- Auf der Heizung Bedienfeld, stellen Sie den "Halter temp" auf 37,0 ° C und die "Platte temp" bis 39 ° C. Klicken Sie auf "Heat" Heizen zu beginnen. klicken Sie auf "Besitzer" Auch, um die Temperatur zu steuern, die thermische Sensor mit dem Halter verbunden werden.
- Auf der Schießtafel "15 sec" auf "Intervall" und "30 min" auf "Time" für die Intervalle und die Dauer des Chemotaxis-Test ein. Check "Heizung am Ende der Dreharbeiten aus" aus Sicherheitsgründen. Bestimmen Sie einen destination für die gespeicherten Bilder.
- Auf der Memo-Panel, geben Sie die Besonderheiten der Experimente, wie Zelllinie verwendet wird, ob die Behandlung angewendet wurde, und die Konzentration des Chemolockstoffe angewendet.
- Bestätigen die Mittelstellung aller der Kanäle, die in den Experimenten verwendet wird, und wiederholen Sie die Einstellung für alle Kanäle, wenn nötig.
- Spritzen und ausrichten Zellen wie folgt:
- Entfernen Sie den Puffer aus der Halterung, und nehmen Sie 8 ul Puffer aus dem dritten und von oben für jeden Kanal.
- Verwenden einer Spritze 2 ul Zellen in die zweite Wanne in dem gleichen Kanal zu injizieren, während der Bildschirm im Echtzeit-Überwachung der Zellzahl zu steuern, und während der Einspritzung fließen. Nachdem die Zellen gut ausgerichtet sind, sofort die 8 ul Puffer wieder hinzufügen. Wiederholen Sie den Vorgang für die anderen Kanäle (Abbildung 1B).
- 2 ml zurück auf den Halter Puffer und fügen 1 ul 100 nM fMLP mit dem dritten und von der Spitze. Starten Sie die Bildaufnahme und die Daten zu speichern. Analysieren Sie die Bild erhaltenen Daten unter Verwendung von Protokollsoftware 9 (Abbildung 2).
4. Transfektion mit Elektroporation
- Differenzieren HL60-Zellen 5 Tage vor dem Experiment wie in Abschnitt 1. Mantel 4-gut oder 1-well Kammern beschrieben, wie in Abschnitt 2 angewiesen.
- Vorbereitung und warmem RPMI 1640 Elektroporation Rückgewinnungsmedium, das RPMI 1640-Medium enthält, 20% (v / v) FBS, 0,1 mM Natriumpyruvat und 25 mM HEPES, auf 37 ° C.
- Unmittelbar vor dem Transfektionsexperiment beginnend, fügen entweder 300 & mgr; l oder 3 ml RPMI 1640-Kulturmedium in die Vertiefungen der vorbeschichteten 4-Well oder 1-well Kammern, respectively.
- Inkubieren der Kammern in einer befeuchteten 37 ° C - Inkubator mit 5% CO 2. Verwenden Sie diese Kammern sofort oder lagern in den Inkubator für die zukünftige Verwendung (zwei Wochen).
- Zählen Sie die Zelldichte des differenzierten HL60-Zellen mit einem Hämozytometer.
HINWEIS: Die Zelldichte erreicht oft etwa 1,0 x 10 6 Zellen / ml. Zelldichte von mehr als 3,0 x 10 6 Zellen / ml ergibt in der Regel unerwünschte Transfektionseffizienz. Da HL60 Zellen Suspensionszellen sind, wird keine erneute Suspension erforderlich. - Zentrifugieren der Zellen bei 200 xg für 5 min bei RT. Entfernen des Überstandes und Resuspendieren 2 x 10 6 HL60 - Zellen in 100 & mgr; l Transfektionsreagenz.
- In 4 ug GFP-PKD1 Plasmid 9 in die 100 & mgr; l Mischung von Zellen und Transfektionsreagenzien und sanft und gründlich mischen. Fügen Sie die Mischung in die Küvette zur Verfügung gestellt.
- Wählen Sie den voreingestellten Programm des Herstellers für die Human-Leukozyten-Zelllinie und führen Sie die Elektroporation.
Hinweis: Weitere Informationen von der Website des Herstellers verfügbar ist. - Nach der Elektroporation sofort und sanft hinzufügen vorgewärmten 500 ul RPMI 6140 Elektroporation Recovery-Medium zu den Zellen, undsanft übertragen die Zellen aus der Küvette auf ein 1,6 ml Röhrchen mit den Kunststoffpipetten vorgesehen.
- Inkubieren der Zellen für 30 min in einer befeuchteten 37 ° C - Inkubator mit 5% CO 2. Seed 100 ul oder 500 ul Zellen in einer Vertiefung einer 4-Well-oder 1-well Kammer, respectively.
- Hinzufügen RPMI 1640-Kulturmedium auf ein Endvolumen von 1 ml oder 4 ml dieser gleichen Vertiefung einer 4-Well-oder 1-well Kammer, respectively. Inkubieren der Zellen in einem befeuchteten 37 ° C - Inkubator mit 5% CO 2 für 3 Stunden. Vorwärmen RPMI 1640 hungernde Medium auf 37 ° C.
- Verwendung einer 1 ml Pipette vorsichtig entfernen 0,8 ml oder 3 ml RPMI 1640-Kulturmedium aus der Vertiefung einer 4-Well-Kammer oder einer 1-well Kammer, respectively. Seien Sie sanft und vermeiden anhaftenden HL60 Zellen Absaugen.
HINWEIS: HL60 Zellen wachsen und werden in Suspensionsmedien unterschieden. Nach oder bei bestimmten Behandlungen unterschieden werden, sich HL60-Zellen an das Substrat mit Polylysin beschichtet, Kollagen, Gelatine oder fibronectin. - Hinzufügen 0,8 ml oder 3 ml RPMI-1640-Medium in die Vertiefung einer 4-Well-oder 1-well Kammer hungern, respectively. Warten Sie 1 Stunde.
HINWEIS: An dieser Stelle sind die Zellen bereit für die Bildgebung Experimente 9.
5. Monitoring GPCR-vermittelte Membrantranslokation von PKD1 durch Multi-Kanal-Fluoreszenz-Mikroskopie
- Eine frische Mischung aus 100 nM fMLP und 1 ug / ml Alexa 594 in RPMI 1640 hungernde Medium als Stimuli.
HINWEIS: Die Mischung von fMLP und Alexa 594 Bedürfnisse frisch gemacht werden maximale Wirksamkeit zu gewährleisten. - Hängen Sie eine 4-Well-Kammer ausgesät mit Zellen über einen 40X Öl-Objektiv.
- Stellen Sie das Fluoreszenzmikroskop in der Mehrkanal-Konfiguration wie folgt:
- Stellen Sie den grünen Emissionskanal (500-530 nm) für GFP-markierten PKD1, rot Emissionskanal (580-620 nm) für chemische Lockstoffe fMLP (Alexa 594) und Durchlichtkanal zur Identifizierung von anhaftenden HL60-Zellen.
- Starten Sie "live" Erwerb unddie Aufnahmebedingungen der drei Kanäle zu optimieren:
- Feinabstimmung zwischen Intensität und Laserleistung für alle drei Kanäle Photobleichmittel für einen längeren Zeitraum von Abbildungs zu minimieren.
- Falls erforderlich, im Durchschnitt alle 2 bis 4 Rahmen der Hintergrund-Rausch-Verhältnis für eine bessere Qualität der Bilder zu verringern. Verwenden Sie ein 1 sec Intervall.
- Suche nach Zellen, die zum Ausdruck bringen starke PKD1-GFP in der Ansicht des GFP und DIC (Differential-Interferenz-Kontrast) Kanal haften. Adhärenten Zellen sind morphologisch flach und nicht schnell bewegen.
- Nach der Identifizierung anhaftenden HL60 - Zellen , die hoch express GFP-PKD1, durch Erniedrigen der Laserleistung der Erfassungsbedingung optimieren , während die Detektorverstärkung für jeden Kanal die Erhöhung der Photobleichmittel für die Langzeit imaging (3A) zu verringern.
- Nehmen Sie 100 ul fMLP / Alexa 594-Lösung mit einem 200 & mgr; l Pipettierer und beiseite stellen. Wählen Sie den "Zeitrafferaufnahme" und legen Sie die Intervalle2 sec und die Anzahl der Frames 100 zu erwerben.
HINWEIS: die Intervalle und die Anzahl von Rahmen, hängen von dem Zweck der Experimente zu erwerben. 1-2 sec Intervallen und 100 Frames werden häufig für die Bildgebung Experimente verwendet, wie in 3. Für langsam Zellen migrieren, längere Intervalle sind notwendig für die Langzeitbildgebung. Im Gegensatz dazu ist für die Zellen schnell wandernde, kürzere Intervalle werden zur Beobachtung der kontinuierlichen Einzelheiten der Zellmigration erforderlich. - ausziehen vorsichtig den Deckel eines 4-Well-Kammer, so dass die Position der Kammer nicht verändert wird. Starten Sie Erwerb sofort und erwerben 3-5 Bilder der nicht-stimulierten Zellen, während die Positionierung der 200 ul Pipettierer direkt über die Zellen, die die Stelle des Laserlichts als Leitfaden.
- Pipette die fMLP / Alexa 594-Mischung über die Zellen mit einem schnellen abzubildende und sogar fließen und den kompletten Satz der Zeitraffer-Akquisition beenden. Name und die Daten speichern, die zur weiteren Datenanalyse unterzogen werden.
6. Imaging Chemotaxing Zellen in Sicht- und Steuerbare Chemo-Lockstoff Stimuli
- Mit einem 10 & mgr; l micropipetter und Injektionsspitzen, Verfüllung einer Mikropipette mit 30 ul frisch zubereitete Mischung von fMLP und Alexa594.
- Bringen Sie die Mikropipette zu einer Mikropipette Halter montiert auf einem Mikroskoptisch und schließen Sie den Schlauch an den Druckversorgungseinheit, eine Vorrichtung, die einen konstanten Druck liefert fMLP / Alexa594-Lösung aus der Mikropipette zu lösen einen stetigen Gradienten zu erzeugen.
- Schalten Sie die Druckversorgung und stellen Sie den Kompensationsdruck (Pc) bis 70 hPa.
- Montieren Sie einen 1-well chambered Deck ausgesät mit HL60-Zellen, die PKD1-GFP über einen 40X Öl-Objektiv auf einem konfokalen Mikroskop oder dessen Äquivalent Fluoreszenzmikroskop.
- Stellen Akquisition im Channel-Modus in folgender Konfiguration: Grün-Kanal (500-530 nm) für GFP-markierten PKD1; Rot-Kanal (580-620 nm) für chemische Lockstoffe fMLP (Alexa594); und transLichtkanal mitted zum Ankleben HL60-Zellen zu identifizieren.
- Starten Sie "live" Erwerb und zur Optimierung der Erfassungsbedingungen für die drei Kanäle: passen Sie die Intensität der einzelnen Kanäle für die quantitative Analyse von Bilddaten; Feinabstimmung zwischen Intensität und Laserleistung für alle drei Kanäle Bilder mit der besten Qualität zu erhalten und das Photobleichmittel zu minimieren. Falls erforderlich, durchschnittlich alle 2 bis 4 Rahmen für eine bessere Bildqualität. Wir verwenden in der Regel ein 1 sec Intervall.
- Starten Sie "live" Erwerb und die Suche nach anhaftenden Zellen, die starke PKD1-GFP in der Ansicht des GFP und Durchlichtkanäle exprimieren. Mit Hellfeld - Optik, in der Mitte der Mikropipette im Zentrum Feld (4A), um die fMLP - Gradienten und die anhaftenden HL60 - Zellen, die PKD1-GFP zu visualisieren.
- Wählen Sie Zeitraffer Erwerb und die Intervalle bis 2 Sekunden-Intervallen und die Anzahl der Bilder auf 100 zu erwerben.
HINWEIS: Nach jeder t sammelnime-lapse-Serie, den Namen und die Daten speichern, die zur weiteren Datenanalyse unterzogen werden.
Ergebnisse
Gleichzeitige Darstellung von Chemotaxis von mehreren HL60-Zellen Zellmobilität Analysegerät mit
Basierend auf dem Prinzip der Mikrofluidik 16 hat der Hersteller simulierten Profile von Gradienten vorgesehen: ein Gradient innerhalb von 1 min erzeugt wird, stabilisiert innerhalb von 5 min, und über 2 h gehalten. Die in hohem Maße vorhersehbar Profile der stabilen Gradienten von Microfluidics erzeugt können mehrere Chemotaxis-Assays gleichzeitig durchgeführt werden. In der vorliegenden Studie beobachteten wir drei simultane Chemotaxis - Assays (2A und Film 1). Wir fanden, daß HL60-Zellen begonnen chemotaxing unmittelbar nach dem Chemoattraktans in die Vertiefung des chemoattractant injiziert wurde, und in einem geraden Weg für die folgenden 60 min, in Übereinstimmung mit den Simulationsergebnissen für Gradienten Stabilität chemotaxing. Verfolgen des Fahrwegs und Morphologieder Zellen ermöglicht quantitative Messungen und anschließenden Vergleich der Chemotaxis Verhaltensweisen einen Index verwenden , die Chemotaxis gesamte Weglänge, Geschwindigkeit, Direktionalität und Rundheit der Zellen (2B) enthält. Gesamtpfadlänge ist die Summe der Längen der Liniensegmente, die Zentroide des Pfades verbinden. Die Geschwindigkeit wird durch Dividieren der Gesamtpfadlänge durch die Zeit erhalten. Direktionalität gemessen nach oben und ist definiert als: (Y des Endes des Wegkoordinate minus Y-Koordinate des Anfanges) dividiert durch Gesamtpfadlänge. Dies ergibt 1,0 für ein Objekt direkt nach oben zu bewegen. Die Rundheit der Zelle ist ein Maß (in Prozent), wie effizient eine gegebene Menge Umfang umschließt Bereich. Ein Kreis hat die größte Fläche für jeden gegebenen Umfang und hat einen Rundheitsparameter von 100%. Eine gerade Linie umschließt keinen Bereich und hat einen Rundheitsparameter von 0%. Wir zeigen die quantitativ Chemotaxis Verhalten gemessen, wie durch die ausgewählten Parameter beschrieben Chemotaxis(Abbildung 2C).
Überwachung PKD subzelluläre Lokalisierung in HL60 Zellen unter einem räumlich-zeitlich sichtbar und kontrollierbar fMLP Reiz
fluoreszenzmarkierte und steuerbare chemische Lockstoffe Stimulation zu einem experimentellen System Es ist ein großer technischer Fortschritt anzuwenden. Historisch gesehen, haben wir entweder homogen (auch als Uniform) Stimulation oder Gradienten Stimulation zu beobachten Zellantwort und Verhaltensweisen angewendet. Doch "blind" Stimulation bietet nicht nur keine Raum-Zeit-Informationen darüber, wie der Reiz in die Zellen gelangt, aber auch Zweifel an irgendwelchen "abnormal" Beobachtungen von Zellantwort auf Stimulation, einfach deshalb, weil wir den Reiz nicht sehen. Wir haben früher, dass Fluoreszenzfarbstoff (Alexa594) gezeigt, kann mit chemoattractant angewendet werden, um eine lineare Beziehung zwischen chemoattractant Konzentration aufzubauen und monitored Fluoreszenzfarbstoff Intensität 15. Mit einer Erfassungskonfiguration des grün fluoreszierenden Proteins (GFP), eine rote Emission von fluoreszierendem Farbstoff (Alexa594) und Durchlicht, können wir die anhaftenden Zellen, um die Anwendung des Reizes und die Zellreaktion auf den Reiz zu überwachen (Fig 3A). Die Proteinkinase D ist eine Familie von Serin / Threonin - Kinasen, die 9,17 wesentliche Rolle in der gerichteten Zellmigration spielen. In Reaktion auf gleichmäßig angelegten fMLP (rot) Stimulation vermitteln HL60 - Zellen eine robuste Membran Translokation von GFP-markiertem Protein kinase D1 (grün) (Figur 3B und Film 2). In einem fMLP - Gradienten (rot) (4A), HL60 - Zellen PKD1 an der Vorderkante (4B und Movie 3) aktiv rekrutieren. Ein genauer Vergleich der subzellulären Lokalisation von GFP in dem Vorsprung der vorderen Kante zeigt an, dass PKD1 an der Rückseite der Vorderkante lokalisiert (4C).
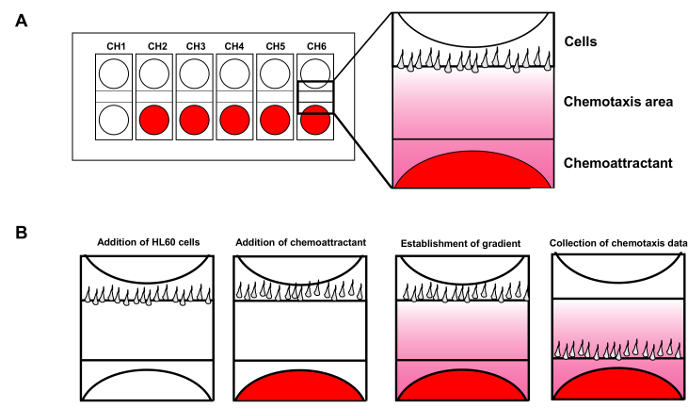
Figure 1. Zellmobilitätsanalysevorrichtung ermöglicht bis 6 simultanen Chemotaxis - Assays auf. (A) Schema zeigt den Aufbau einer Zelle Mobilitätsanalysevorrichtung Chip zur gleichzeitigen Überwachung von 6 unabhängigen Chemotaxis - Assays. Red zeigt chemoattractant in die Vertiefungen gegeben. (B) Einführung von HL60 - Zellen in die Vertiefungen von Zellen , während die chemische Lockstoffe einen stetigen fMLP Gradienten zu etablieren diffundiert. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
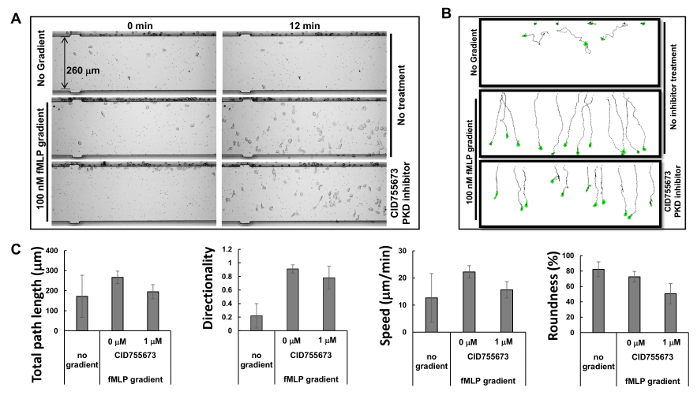
Abbildung 2. Die gleichzeitige Überwachung mehrerer Assays mit Chemotaxis HL60 - Zellen. (A ) Montage zeigt Bilder der Zellmobilität Analysegerät Chemotaxis-Assay die hemmende Wirkung von PKD-spezifischen Inhibitoren auf die Chemotaxis zu Zeiten von 0 und 12 Minuten nach der Steigung Anwendung zu untersuchen. Chemotaktische HL60-Zellen wurden für 30 min mit PKD-Inhibitor 1 uM CID755673 vorbehandelt. HL60-Zellen mit oder ohne Behandlung von PKD-Inhibitor wurde erlaubt in entweder für 12 min RPMI1640 Verhungern Medium oder 100 nM fMLP Gradienten chemotax. (B) Schema zeigt die Lauflänge und Morphologie verfolgt HL60 - Zellen. (C) Quantifizierung der Chemotaxis als Gesamtpfadlänge, Geschwindigkeit, Direktionalität und Rundheit. Mittelwert ± SD dargestellt ist; n = 10, 12 oder 11 ohne Steigung, fMLP Gradienten ohne CID755673 Behandlung und fMLP Behandlung mit CID755673 Behandlung sind. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
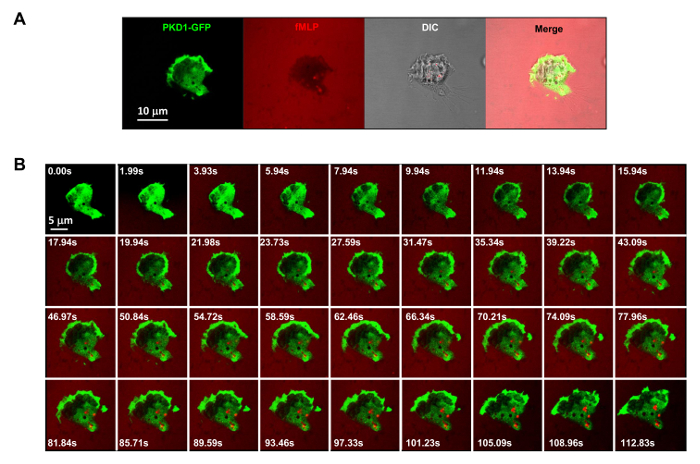
Abbildung 3. GPCR-vermittelte robust Membran Translokation von PKD1 in Reaktion auf die gleichförmig angelegten Stimuli fMLP. (A) Mehrkanal - Überwachung von PKD1-GFP (grün), chemoattractant (1 & mgr; M fMLP , gemischt mit 0,1 & mgr; g / ml Fluoreszenzfarbstoff Alexa 594, rot) und DIC (Differential-Interferenz-Kontrast) die anhaftenden HL60-Zellen in einer Vertiefung einer 4well Kammer mit 0,2% Gelatine in RPMI 1640-Medium beschichtet zu identifizieren. Maßstabsbalken = 10 & mgr; m. (B) Montage zeigt , dass einheitlich zur Anwendung fMLP (rot) robuste Membran - Translokation von PKD1-GFP induziert (grün). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
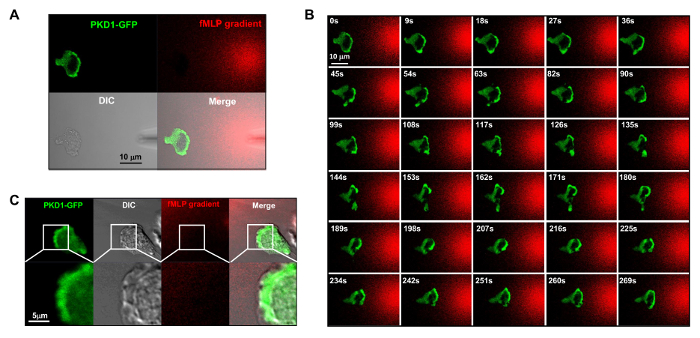
figure 4. Die Vorderkante Lokalisierung von PKD1 in HL60 Zellen chemotaxing. (A) Channel - Modus Erwerb Konfiguration erleichtert die Visualisierung des fMLP - Gradienten und die räumlich - zeitliche Dynamik von PKD1. In A - C, transient HL60 - Zellen exprimiert GFP-markierten PKD1; die fMLP - Gradienten von einer Mikropipette (DIC), 100 nM fMLP (rot) wurde mit 0,1 & mgr; g / ml Fluoreszenzfarbstoff Alexa 594. (B) Angereichertes Lokalisierung von PKD1 an der Vorderkante der Zelle chemotaxing vermischt erzeugt zu visualisieren. Maßstabsbalken = 10 & mgr; m. (C) Zusammengefügt Bilder zeigen , dass PKD1 an der Rückseite der Vorderkante lokalisiert in HL60 - Zellen. Grün zeigt PKD1 zelluläre Lokalisation und der DIC Bild zeigt die vorstehende Fläche von der Vorderkante. Maßstabsbalken = 5 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
In der vorliegenden Studie zeigen wir zwei Beispiele von Chemotaxis-Assays: erstens gleichzeitige Überwachung mehrerer Chemotaxis Assays von der Mobilitätsanalysevorrichtung Zelle; und zweitens, die Visualisierung des chemoattractant Gradienten und die räumlich-zeitliche Dynamik der Ereignisse in den gleichen Zellen in Echtzeit zu signalisieren.
Zellmobilität Analysegerät für mehrere gleichzeitige Assays Chemotaxis
In der vorliegenden Studie haben wir ein detailliertes Protokoll mehrere gleichzeitige Assays Chemotaxis unter Verwendung einer Zellmobilität Analysegerät durchzuführen. Dieses Gerät ermöglicht dem Benutzer, zelluläre Chemotaxis Verhalten mit einem 10fach Objektiv in herkömmlichen Hellfeld-Beobachtung zu beobachten. Aufgrund der diffusions dominanten Eigenschaften der Fluidströmung, die Zellmobilitätsanalysevorrichtung erzeugt in hohem Maße vorhersehbar, stabile Gradienten und ermöglicht bis sechs Chemotaxis-Assays gleichzeitig miteinander durchgeführt werden. Die kritischen Schritte des Protokolls sindzuverlässige Gradienten zu erhalten und die Zellen auf der Terrasse Linie auszurichten. Der Benutzer sollte streng den Anweisungen des Herstellers für die Halterungsanordnung und die Injektion von Chemoattraktoren und Zellen folgen. Detaillierte Anleitungen sind auch online verfügbar. Im Vergleich zu alternativen Methoden Chemotaxis 11-13,15, verbessert diese Vorrichtung erheblich die Zuverlässigkeit und Effizienz der Chemotaxis - Assays. Vier Größen von Zellmobilität Analysegerät Chip in den Größen von 4, 5, 6 und 8 & mgr; m zur Verfügung stehen verschiedene Typen und Größen von Zellen aufzunehmen. Wir fanden heraus , dass eine 4 oder 5 & mgr; m Zellmobilität Analysegerät Chip für den HL60 und D. geeignet ist discoideum Zellen, die etwa 10-15 & mgr; m im Durchmesser sind. Eine Einschränkung ist jedoch, dass diese Vorrichtung für alle Arten von Zellen geeignet ist. Wir hatten wenig Erfolg die Zellmobilität Analysegerät Chemotaxis-Assay mit Raw267.4 Zellen. Der Grund dafür kann sein, dass Raw267.4 Zellen zu langsam wandern. Die Zeit für eine effiziente che erforderlichmotaxis von Raw267.4 Zellen möglicherweise viel länger als die Zeit ist ein Gradient von der Vorrichtung gehalten wird. Stattdessen arbeitete ein Transwell - Migrationstest gut für Raw267.4 Zellen 9. Eine weitere Einschränkung ist, dass Fluoreszenzbeobachtung nicht möglich, mit dem aktuellen Gerät ist. Eine zukünftige Richtung ist Fluoreszenz-Bildgebung mit höherer Vergrößerung zu überwachen. Dies ist möglich mit der verbesserten Zellmobilitätsanalysevorrichtung, die mit Fluoreszenzdetektion und einer 100X Objektivlinse ausgestattet ist. All diese Verbesserungen ermöglichen den verbesserten Durchsatz von Chemotaxis-Assays und die Beobachtung von subzellulären Dynamik in migrierenden Zellen Außerdem wird die Anzahl der gleichzeitigen Assays auch auf 12 erhöht.
Hohe Transfektionseffizienz von HL60-Zellen fluorescent protein-markiertes Protein zu exprimieren
HL60-Zellen sind eine aktive Leukämiezelllinie zu teilen und in Suspension wachsen. Wie bereits 18-20 berichtet, sind HL60 - Zellen resistent gegen gEn-Transfer. Sowohl Lipid und Elektroporation Gentransfer wurden getestet und höhere Transfektionseffizienz wurde mit Elektroporation erhalten, wie dies im Detail in Abschnitt 4 beschrieben, eine hohe Lebensfähigkeit nach der Elektroporation zu erhalten ist entscheidend für den Erhalt der hohen Transfektionseffizienz aufgrund der schweren Schäden, die durch Elektroporation führt. Anschließend gründliche und schonende Handhabung von Zellen erforderlich sind, vor allem nach der Elektroporation. Alle Medien müssen die Zellen in beliebigen Schritten nach der Elektroporation vorgewärmten und vorsichtig hinzugefügt werden. Es ist auch kritisch, um die Belichtungszeit der Zellen an die Elektroporation Reagenz zu minimieren. Um den Zelltod, nach der Elektroporation, RPMI 1640 Elektroporation Recovery-Medium muss sofort zu den Zellen gegeben werden, zu vermeiden. Wir fanden heraus, dass 20% FBS in der Wiederherstellungsmedium, das eine viel höhere Zellgewinnungsrate als 10% FBS gibt. Nach der Elektroporation, die Inkubation in RPMI 1640 Elektroporation Recovery-Medium für 30 min ist für eine größere Lebensfähigkeit kritisch und TransfektionEffizienz. Um weiter die Transfektionseffizienz zu erhöhen, verwendeten wir auch 4 & mgr; g Plasmid-DNA pro Transfektion, die fast das Doppelte Menge von Plasmid ist vom Hersteller empfohlen.
Es gibt zwei Haupteinschränkungen auf Elektroporation Transfektion: Die transiency der Proteinexpression und die Zellzahl Grenze (2 x 10 6 Zellen pro Transfektion). In undifferenzierten Zellen ist die Expression während der ersten paar Zellteilungen nur detektierbar, da der Vektor Plasmid um die Hälfte nach jeder Zellteilung verdünnt wird. Für die differenzierten HL60-Zellen überleben nicht mehr als 48 Stunden. Infolgedessen erfordert jeder Versuch frisch Transfektionen 6 Stunden vor dem Experiment. Die Zellzahl für eine Elektroporation erfüllt lediglich die Mindestanforderung für alle biochemischen Assays. Für die Zwecke der wiederholten Verwendung oder große Menge, wird dringend empfohlen, dass eine undifferenzierte HL60-Zelllinie hergestellt werden, die stabil das Protein von Interesse WHI drücktch wurde mit einem fluoreszierenden Protein, das von einem viralen Vektor markiert, wenn ein viraler Vektor verfügbar ist, oder kann aufgebaut sein.
Offenlegungen
The authors declare no competing financial interest for this work.
Danksagungen
This work is supported by the intramural fund of NIAID, NIH.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium GlutaMAX | Life technologies | 61870-036 | |
| Sodium pyruvate | Thermo Fisher Scietific | 11360-070 | |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| 1M HEPES sterile solution, pH7.3 | Quality Biological Inc. | A611-J848-06 | |
| Penicillin streptomycin solution | Fisher Scientific | 15140122 | |
| NucleofectorTM 2b | Lonza | AAB-1001 | |
| AmaxaTM Cell Line NucleofectorTM Kit V including NucleofectorTM Solution, Singe use pipettes, AmaxaTM certified 100 ml aluminum electrode cuvettes | Lonza | VCA-1003 | |
| Lab-Tek chambered #1.0 Borosilicate Coverglass | Nalge Nunc International Inc | 155383 | |
| 2 % Gelatin solution | Sigma-Aldrich | G1393 | |
| Fibronectin | Sigma-Aldrich | F1141 | |
| HBSS (Hanks’ Balanced Salt Solution) | Life technologies | 14025-076 | |
| Bovine serum albumin | Sigma-Aldrich | A3803 | |
| Single well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155361 | |
| Four-well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155383 | |
| Alexa 594 | Thermo Fisher Scientific | A-10438 | |
| fMLP | Sigma -Aldrich | F3506-5MG | |
| Cover glass thickness 2 22 x 22 mm | Corning | 2855-22 | |
| EZ-TAXIScan | Effector Cell Institute, Inc. | MIC-1001 | |
| EZ-TAXIScan chip (5 mm) | Effector Cell Institute, Inc. | EZT-F01-5 | |
| 1701RN 10ul syringe | Hamilton | 80030 | |
| Femtotips II Injection tips | Eppendorf | 5242956003 | |
| Femtotips II | Eppendorf | 930000043 | |
| TransferMan NK2, including motor module, X head with angle adjuster, and Positioning aids. | Eppendorf | 5188900056 | |
| DIAS software | Solltech Inc. | ||
| LSM 780 META or equivalent confocal microscope with a 40X 1.3 NA or 60X 1.4 NA oil DIC Plan-Neofluar objective lens | Carl Zeiss |
Referenzen
- Pocha, S. M., Montell, D. J. Cellular and molecular mechanisms of single and collective cell migrations in Drosophila: themes and variations. Annual review of genetics. 48, 295-318 (2014).
- Wen, Z., Zheng, J. Q. Directional guidance of nerve growth cones. Current opinion in neurobiology. 16, 52-58 (2006).
- Bravo-Cordero, J. J., Hodgson, L., Condeelis, J. Directed cell invasion and migration during metastasis. Current opinion in cell biology. 24, 277-283 (2012).
- Zigmond, S. H. Chemotaxis by polymorphonuclear leukocytes. The Journal of cell biology. 77, 269-287 (1978).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, receptors and human disease. Cytokine. 44, 1-8 (2008).
- Dong, X., et al. P-Rex1 is a primary Rac2 guanine nucleotide exchange factor in mouse neutrophils. Current biology : CB. 15, 1874-1879 (2005).
- Li, Z., et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell. 114, 215-227 (2003).
- Van Haastert, P. J., Devreotes, P. N. Chemotaxis: signalling the way forward. Nature reviews: Molecular cell biology. 5, 626-634 (2004).
- Xu, X., et al. GPCR-Mediated PLCbetagamma/PKCbeta/PKD Signaling Pathway Regulates the Cofilin Phosphatase Slingshot 2 in Neutrophil Chemotaxis. Mol Biol Cell. , (2015).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of experimental medicine. 115, 453-466 (1962).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of cell biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of cell science. 99 (Pt4), 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PloS one. 5, e15309 (2010).
- Bozzaro, S., Fisher, P. R., Loomis, W., Satir, P., Segall, J. E. Guenther Gerisch and Dictyostelium, the microbial model for ameboid motility and multicellular morphogenesis. Trends in cell biology. 14, 585-588 (2004).
- Xu, X., Jin, T. Imaging G-protein coupled receptor (GPCR)-mediated signaling events that control chemotaxis of Dictyostelium discoideum. Journal of visualized experiments : JoVE. , (2011).
- Lin, F., et al. Generation of dynamic temporal and spatial concentration gradients using microfluidic devices. Lab Chip. 4, 164-167 (2004).
- Eiseler, T., et al. Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology. 11, 545-556 (2009).
- Roddie, P. H., Paterson, T., Turner, M. L. Gene transfer to primary acute myeloid leukaemia blasts and myeloid leukaemia cell lines. Cytokines Cell Mol Ther. 6, 127-134 (2000).
- Schakowski, F., et al. Novel non-viral method for transfection of primary leukemia cells and cell lines. Genet Vaccines Ther. 2, 1 (2004).
- Uchida, E., Mizuguchi, H., Ishii-Watabe, A., Hayakawa, T. Comparison of the efficiency and safety of non-viral vector-mediated gene transfer into a wide range of human cells. Biol Pharm Bull. 25, 891-897 (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten