Method Article
Обработки изображений G-белком рецептор-опосредованный хемотаксис и его сигнальных событий в нейтрофилами как клетки HL60
В этой статье
Резюме
Анализы Визуальные хемотаксиса имеют важное значение для лучшего понимания того, как эукариотические клетки контролируют хемоаттрактантных опосредованную миграцию направленной клеток. Здесь мы описываем подробные методы: 1) в режиме реального времени, мониторинга высокого разрешения множественных анализов хемотаксиса, и 2) одновременно, визуализирующих градиент хемоаттрактантных и пространственно-временной динамики сигнальных событий в нейтрофилами как HL60 клеток.
Аннотация
Eukaryotic cells sense and move towards a chemoattractant gradient, a cellular process referred as chemotaxis. Chemotaxis plays critical roles in many physiological processes, such as embryogenesis, neuron patterning, metastasis of cancer cells, recruitment of neutrophils to sites of inflammation, and the development of the model organism Dictyostelium discoideum. Eukaryotic cells sense chemo-attractants using G protein-coupled receptors. Visual chemotaxis assays are essential for a better understanding of how eukaryotic cells control chemoattractant-mediated directional cell migration. Here, we describe detailed methods for: 1) real-time, high-resolution monitoring of multiple chemotaxis assays, and 2) simultaneously visualizing the chemoattractant gradient and the spatiotemporal dynamics of signaling events in neutrophil-like HL60 cells.
Введение
Эукариотические клетки смысл и двигаться в сторону более высокой концентрации в градиенте хемокина, клеточный процесс называют как хемотаксис. Хемотаксиса играет решающую роль во многих физиологических процессах, таких как эмбриогенез 1, Neuron кучность 2, метастазировании раковых клеток 3, рекрутингом нейтрофилов к местам воспаления 4, а также развитие модельного организма Dictyostelium discoideum 5. В целом, эукариотические клетки чувствуют хемоаттрактанты с использованием G-белком рецепторов 5. Зацепление хемоаттрактанты с этими рецепторами способствует диссоциации Гетеротримерный G белков Gα и Gβγ, которые , в свою очередь , активируют вниз по течению пути передачи сигнала , что , в конечном счете регулируют пространственно - временную организацию актинового цитоскелета , чтобы управлять клеточной миграции 5-9.
Клеточные биологи развитие и совершенствование chemotaxэто анализы, чтобы исследовать, как G-белком рецептор (GPCR) сигнализации опосредует направленной миграции клеток. Камера или миграции Transwell анализа Бойден был разработан в 1960 году Бойден 10. Анализ работает путем создания градиента хемоаттрактантной соединений между двумя ямами, разделенными микропористой мембраны. Его простота и удобство в использовании делают его наиболее широко используемым хемотаксис анализа на сегодняшний день. Тем не менее, этот анализ не включает процесс мигрирующей клеток для визуализации. Камера Zigmond является первым визуальным Микрожидкостных устройство , которое позволяет четкое изображение миграции клеток на покровное через узкую сужением в сторону источника хемоаттрактанту 11. Dunn 12 и Insall 13 модифицирована и улучшена с высокой разрешающей способностью и возможностью долгосрочной обработки изображений в камере хемотаксиса анализа Zigmond. Из-за высокой предсказуемыми, диффузионно-доминантный характеристик течения жидкости, микрофлюидики было предоставление решений для следующего generatiна хемотаксиса, такие как EZ-TAXIScan (анализ устройства подвижности клеток).
При устойчивости градиента обеспечивается, устройство позволяет шесть хемотаксиса , чтобы проводить одновременно (рис 1А). В отличие от фиксированных направленно градиентов , генерируемых в различных камерных анализах выше, игла или микропипетки анализ , разработанный Гюнтера Gerisch создает градиент с подвижным источником 14. В анализе, хемоаттрактантной высвобождается из подвижной микропипетки, чтобы генерировать стабильный градиент. С помощью этой иглы анализа, исследователи обнаружили, что разные клетки вырабатывают ложноножки с принципиально различными характеристиками. Применение флуоресцентной микроскопии, мы смогли визуализировать градиент , чтобы облегчить его количественное измерение на протяжении 15 лет . В данном исследовании мы описываем подробные методы подготовки хемотаксисную HL60 (человек промиелолейкозе) клеток, одновременно наблюдение за несколькими хемотаксис ASSAYS с анализом устройства подвижности клеток, а также визуализации GPCR-опосредованной пространственно-временные динамики сигнальных молекул, таких как протеинкиназа D1 в одиночных живых клетках в ответ на видимых, spatiotemporally управляемых хемоаттрактантной раздражители. Наши усовершенствованные методы визуализации могут быть применены к общим исследованиям хемотаксиса, и особенно хорошо подходят для систем клеток млекопитающих.
протокол
1. Культура и дифференциация человека нейтрофилы как клетки HL60
- Подготовка среды RPMI (Roswell Park Memorial Institute) 1640 культуральная среда, которая содержит RPMI 1640, 10% (об / об) фетальной бычьей сыворотки (FBS), 0,1 мМ пирувата натрия и 25 мМ HEPES (4- (2-гидроксиэтил) -1 -piperazineethanesulfonic кислота). Нагреть культуральной среды до 37 ° C RPMI 1640.
- С помощью гемоцитометра определить плотность клеток HL60 клеток, чтобы убедиться, что клетки находятся в стадии роста лог-фазы.
Примечание: Клетки, как правило, находятся в фазе журнала на третий день после пересева. Плотность логарифмически фазных клеток, как правило , 6-8 х 10 5 клеток / мл. Плотность клеток требуется , чтобы начать новую культуру составляет около 1,5 × 10 5 клеток / мл.
Примечание: Например, для 10 мл новой культуры в плоской колбе Т-75, если плотность клеток лог-фазе клеток 6 × 10 5 клеток / мл, затем 2,5 мл лог-фазе клеток (6 х 10 5 ) разбавляют до 1,5 × 10 5 клеток / мл в 10 мл новая культура. Для того, чтобы сделать окончательный объем 10 мл культуры, 7,5 мл RPMI 1640 культуральной среды добавляется. - Поместите расчетный объем теплой средой RPMI 1640 культуральной среды в плоскую колбу. Для Т-75 колбу плоской культуры, общий объем клеточной культуры, составляет 10 мл.
- Добавить расчетный объем лог-фазы растущих клеток HL60 в плоскую колбу для достижения плотности клеток 1,5 × 10 5 клеток / мл.
- Инкубируйте клетки при 37 ° С в увлажненном инкубаторе с 5% CO 2.
ПРИМЕЧАНИЕ: Время удвоения HL60 почти 24 часа в сутки. - Пассаж клетки с RPMI 1640 культуральной среды каждые 2-3 дня. Важно , чтобы плотность клеток из клеток HL60 никогда не превышает 1,5 × 10 6 клеток / мл , а клеточный проход длится не более 2 -х месяцев.
- Дифференцировать клетки HL60 за 5 дней до эксперимента.
Примечание: среда RPMI 1640 дифференцировка среда содержит RPMI 1640, 10% (об / об) фетальной бычьей сыворотки (FBS), 0,1 мМ пирувата натрия, 25 мМ HEPES, и 1,3% диметилсульфоксид (ДМСО). Другими словами, 1,3% ДМСО в среде RPMI 1640 культуральной среде.- Для того, чтобы дифференцировать клетки HL60, предварительно подогреть культуральной среды до 37 ° C RPMI 1640. Добавьте теплое RPMI 1640 культуральной среды в плоскую колбу.
- Для окончательного 10 мл HL60 культивирования для дифференцировки, добавить 130 уль ДМСО непосредственно в культуральной среде RPMI 1640. в плоской колбы в то время как закрученной колбу так, что ДМСО быстро разбавляются культуральной средой RPMI 1640..
- Добавить клетки логарифмически фазы HL60 до конечной плотности клеток 1,5 × 10 5 клеток / мл в конечном 10 мл среды RPMI 1640 дифференциации среды. Культуры клеток HL60 в RPMI 1640 дифференциации среды при 37 ° C в увлажненном инкубаторе с 5% CO 2 в течение 5 дней.
2. Покрытие крышки стеклянной поверхности 4well палаты
- Возьмите бутылку 2% желатина раствора из холодильника, очистить его с помощью 70% этанола, и поместить его в капот. Tаке 1 мл 2% раствора желатина и запас возвращают оставшийся желатин исходного раствора в холодильнике немедленно.
- Дайте раствору желатина полностью сжижать при температуре 37 ° C и пипеткой его тщательно. Развести 2% желатина маточного раствора сбалансированным солевым раствором 9 мл подогретого 1x Хэнкса (HBSS) буфером до конечной концентрации 0,2% желатина.
- Добавить 0,5 мл или 2 мл 0,2% желатина в HBSS до двух средних лунки 4-луночной камеры или 1-луночного камеры с покровным стеклом в нижней части, соответственно. Наклон пластины в нескольких направлениях таким образом, что жидкость покрывает всю площадь поверхности.
- Место пластин в 37 ° С инкубатор. Пластины будут готовы к использованию в 1 ч. Они могут быть использованы на срок до 5 дней. Непосредственно перед посевом клеток, удалите раствор желатина из 4-хорошо или 1-луночных камер.
3. Анализ хемотаксиса с помощью мобильного устройства Анализ мобильности
- Подготовить и прогреть RPMI 1640 голодали среда, которая является RPMIсреду, содержащую 0,1 мМ пирувата натрия (приобретается отдельно) и 25 мМ HEPES.
- Подготовить 100 мкл 100 нМ ФМЛФ (N-формилметионил-лейцил-фенилаланина) в среде RPMI 1640 голодали среды.
- Готовят 3 мл 1% бычьего сывороточного альбумина (БСА) / среде RPMI 1640 среде, содержащей 1% БСА в среде RPMI 1640 голодающим среды и 10 мл 0,1% БСА / RPMI 1640 среды.
- Покройте 22 мм квадратных покровного и 5 мкм подвижность клеток чип устройство анализа со свежеприготовленным 1% БСА / среде RPMI 1640, в течение 1 ч при комнатной температуре.
- Соберите держатель с помощью следующей процедуры:
- Установите держатель базы с рычагами в вертикальном положении так, чтобы рычаги может наклоняться в сторону пользователя. Применяют 70% -ный раствор этанола на поверхности 41 мм стекла. Тщательно протрите поверхность протереть, следя за тем, чтобы не поцарапать их.
- Вставьте 41 мм стекло в держатель основания. Поместите бычьим сывороточным альбумином с покрытием 22 мм квадратные покровное в верхней части 41 мм стекла в основании держателя.
Примечание: с покрытием квадрат сoverslip между 41 мм стекла и чип позволяет хемотаксис происходить на субстрате поверхности покрытия. - Вставьте уплотнительное кольцо (малый) в нижней части корпуса пластин и крепление корпуса пластины в основании держателя с эллиптическим отверстием в задней части. Вытащите внутренний уровень держателя основания вперед в горизонтальное положение, чтобы зафиксировать корпус пластины в нужном положении.
- Убирайте пыль из внутренней части корпуса пластин с воздушным тряпка. Добавляют 4 мл 0,1% БСА / RPMI 1640, в корпус пластины.
- Установите чип устройства анализа БСА с покрытием подвижность клеток в центре корпуса пластин со структурным время лицевой стороной вниз в контакте со стеклом.
ПРИМЕЧАНИЕ: Это чип должен быть вставлен с отметкой местоположения (отверстие в верхней части чипа) на задней панели. - Наклейте резиновую прокладку на нижней части зажима пластин путем подгонки два выступа на резиновую прокладку в отверстия.
- Установите уплотнительное кольцо (большой) нав верхней части корпуса пластины. Установите зажим пластины с датчиком отверстие в задней. Потяните наружный рычаг основания корпуса вперед до горизонтального положения, чтобы зафиксировать зажим пластины на месте.
- После сборки держателя, поместите нижнюю часть держателя на коробке света, чтобы подтвердить, что нет пузырьков воздуха в лунках. Если пузырьки воздуха обнаружены, удалите их с помощью прилагаемого пластикового шприца, снабженного образец наливного наконечника.
- Снимите крышку и поместите сборку на пластину на верхней части устройства, устройства анализа подвижности клеток. Прикрепите блок датчика к держателю.
- Подготовка клеток HL60 для хемотаксиса Пробирной:
- Вычислить плотность клеток дифференцированных клеток HL60 с помощью гемоцитометра. Через 5 суток дифференцировки, плотность клеток составляет приблизительно от 1,0 × 10 6 клеток / мл.
- Вычислить конечный объем HL60 клеток при конечной плотности клеток 2 х 10 6 клеток / мл. Например, если плотность клеток изДифференцированные клетки HL60 составляет 1,0 × 10 6 клеток / мл, затем 10 мл дифференцированных клеток HL60 будет повторно суспендируют с 5 мл 0,1% БСА / среде RPMI 1640 , чтобы достичь 2 х 10 6 клеток / мл.
- Центрифуга дифференцированы HL60 клеток при 200 мкг в течение 5 мин при комнатной температуре. Удалить супернатант и ресуспендирования клеток с расчетным объемом 0,1% БСА / среде RPMI 1640 , на этапе 3.6.2) до конечной плотности клеток 2 х 10 6 клеток / мл.
- Запустите установку устройства анализа подвижности клеток и ПК для получения изображения. Подключите устройство к компьютеру. Включите устройство анализа подвижности клеток. Включите компьютер.
- Запускают Cell Analysis Mobility Программное обеспечение устройств.
- Заметим, 5 панелей управления: камера, обогреватель, стрельба, памятки, и изображения с камер.
- На панели управления камерой изображения, используйте "Горизонтальная линия" или "Вертикальная линия" для регулировки положения держателя / просмотра в режиме реального времени к центру камеры на панели изображения камеры.
- На панели управления камеры, выберите CH1 к CH6 для перемещения камеры в определенном канале. Для центрирования полей зрения канала, нажмите кнопку "Move L" или "Переместить R", чтобы настроить X-координату камеры и центральное положение камеры по горизонтали.
- Отрегулируйте Y-координату камеры, повернув ручку положения на передней панели блока устройства анализа подвижности клеток вертикально настроить изображение по центру экрана.
- На панели управления отопителя, установите "держатель ТЕМП" до 37,0 ° С и "пластинчатый ТЕМП" до 39 ° C. Нажмите "Тепло", чтобы начать отопление. Также нажмите на кнопку "держатель" для регулирования температуры с помощью теплового датчика, подключаемого к держателю.
- На панели съемки, введите "15 сек" на "Интервал" и "30 минут" на "время" для интервалов и продолжительность анализа хемотаксиса. Проверьте "Обогреватель выключен в конце стрельбы" по соображениям безопасности. Назначают деstination для сохраненных изображений.
- На панели заметок, входные специфика экспериментов, таких как клеточная линия используется, был ли или не применяется лечение, а концентрация химио-аттрактантов применяется.
- Confirm центральное положение всех каналов, которые будут использованы в экспериментах, и повторить регулировку по всем каналам, если это необходимо.
- Вдохнуть и Выровнять ячейки следующим образом:
- Удалите буфер из держателя и вынуть 8 мкл буфера из третьей скважины от верхней части для каждого канала.
- Используйте шприц, чтобы впрыснуть 2 мкл клеток во вторую лунку в том же канале, контролируя при этом экран в режиме реального времени контролировать количество клеток и потока во время инъекции. После того, как клетки хорошо расположены, сразу же добавьте 8 мкл буфера обратно. Повторите ту же процедуру для других каналов (Рисунок 1В).
- Добавить 2 мл буфера обратно в держатель, и добавить 1 мкл 100 нМ FmЛП в третьей скважине сверху. Начало захвата изображения и сохранить данные. Анализ данных , полученных с помощью программного обеспечения изображения трассировку 9 (рисунок 2).
4. Трансфекция с электропорации
- Дифференцировать клетки HL60 за 5 дней до эксперимента, как описано в Разделе 1. Смазать 4-а или 1-а камеры, как указано в разделе 2.
- Подготовка и теплой средой RPMI 1640 восстановление электропорации среда, которая содержит RPMI 1640, 20% (об / об) FBS, 0,1 мМ пирувата натрия и 25 мМ HEPES, до 37 ° С.
- Непосредственно перед началом эксперимента трансфекции, либо добавить 300 мкл или 3 мл среды RPMI 1640 культуральной среды в лунки предварительно покрытых 4-хорошо или 1-луночных камер, соответственно.
- Инкубируйте камеры в увлажненной 37 ° C инкубаторе с 5% CO 2. Используйте эти камеры сразу или хранить в инкубаторе для дальнейшего использования (две недели).
- Подсчитайте плотность клеток дифференцированного HL60 клеток с помощью гемоцитометра.
ПРИМЕЧАНИЕ: Плотность клеток часто достигает около 1,0 × 10 6 клеток / мл. Плотность клеток больше , чем 3,0 × 10 6 клеток / мл , как правило , дает нежелательный эффективность трансфекции. Как HL60 клетки в суспензионной, не требуется взмучивания. - Центрифуга клетки при 200 мкг в течение 5 мин при комнатной температуре. Удалить супернатант и ресуспендируют 2 × 10 6 клеток HL60 в 100 мкл реагента для трансфекции.
- Добавьте 4 мкг GFP-PKD1 плазмиды 9 в 100 мкл смеси клеток и реагентов трансфекции и осторожно и тщательно перемешать. Добавьте смесь в кювету при условии.
- Выберите предварительно заданную программу изготовителя для линии лейкоциты клеток человека и выполнять электропорации.
ПРИМЕЧАНИЕ: Дополнительную информацию можно найти на веб-сайте производителя. - После электропорации, немедленно и осторожно добавляют предварительно нагретый 500 мкл RPMI 6140 восстановления электропорации среды к клеткам, иаккуратно перенести клетки из кюветы в 1,6 мл трубки с пластиковыми пипетками услуг.
- Инкубируйте клетки в течение 30 мин в увлажненной 37 ° C инкубаторе с 5% CO 2. Семенной 100 мкл или 500 мкл клеток в одну лунку 4-хорошо или патронник 1-луночного соответственно.
- Добавить RPMI 1640 культуральной среды до конечного объема 1 мл или 4 мл в той же самой лунке 4-колодца или камеры с 1-луночный, соответственно. Инкубируйте клетки в увлажненной 37 ° C инкубаторе с 5% CO 2 в течение 3 часов. Предварительно теплой RPMI 1640 голодали среднего до 37 ° C.
- С помощью пипетки 1 мл, осторожно удалить 0,8 мл или 3 мл RPMI 1640 культуральной среды из колодца в 4-луночные камеры или 1-луночного камеры, соответственно. Будьте нежны и избежать отсоса прилипшие клетки HL60.
Примечание: HL60 клетки растут и дифференцируются в суспензионной среды. После того, как дифференцированные или с определенными процедурами, HL60 клетки прилипают к субстрату с покрытием из полилизина, коллаген, желатин или фиbronectin. - Добавить 0,8 мл или 3 мл среды RPMI 1640 голодающим среды в лунку 4-а или 1-луночного камеры, соответственно. Подождите 1 час.
Примечание: На данный момент клетки готовы для проведения экспериментов с изображениями 9.
5. Мониторинг GPCR опосредованной мембраны транслокации PKD1 по многоканальному флуоресцентной микроскопии
- Приготовьте свежую смесь 100 нМ ФМЛФ и 1 мкг / мл Alexa 594 в среде RPMI 1640 голодающим среды в качестве стимулов.
ПРИМЕЧАНИЕ: Смесь FMLP и Alexa 594 потребности быть свежеприготовленной, чтобы обеспечить максимальную эффективность. - Смонтируйте один 4-хорошо камера засевали клетками над масляной линзой 40Х.
- Установите флуоресцентного микроскопа в многоканальной конфигурации следующим образом:
- Установите зеленый канал излучения (500-530 нм) для GFP-меченый PKD1, красный канал излучения (580-620 нм) для хемокина ФМЛФ (Alexa 594) и передается световой канал для определения прилипших клеток HL60.
- Старт "живой" приобретение иоптимизировать условия приобретения трех каналов:
- Точная настройка между интенсивностью и мощности лазера для всех трех каналов, чтобы свести к минимуму photobleach в течение более длительного периода обработки изображений.
- При необходимости, в среднем каждые 2 до 4 кадров, чтобы уменьшить соотношение фонового шума для улучшения качества изображений. Используйте интервал 1 сек.
- Поиск придерживаясь клеток, которые выражают сильную PKD1-GFP по мнению канала GFP и DIC (дифференциальный интерференционный контраст). Придерживаясь клетки морфологически плоские и не двигаться быстро.
- После идентификации прилипшие HL60 клетки , которые высоко выражают GFP-PKD1, оптимизирующие условия приобретения за счет снижения мощности лазера при одновременном увеличении коэффициента усиления детектора для каждого канала , чтобы уменьшить photobleach для долгосрочных изображений (рис 3А).
- Возьмите 100 мкл FMLP / Alexa 594 раствора с 200 мкл пипеткой и отложить в сторону. Выберите "приобретение замедленную" и установить интервалы в2 сек и количество кадров, чтобы приобрести до 100.
Примечание: периодичность и количество кадров для приобретения зависит от цели эксперимента. 1-2 - секундными интервалами и 100 кадров часто используются для экспериментов с изображениями, как показано на рисунке 3. Для медленно мигрирующие клетки, более длительные интервалы необходимы для долгосрочного визуализации. В противоположность этому, для быстро мигрирующих клеток, более короткие интервалы требуются для наблюдения непрерывных деталей миграции клеток. - Осторожно снять крышку камеры 4-а, так что положение камеры не меняется. Начало приобретения сразу и приобрести 3-5 изображений нестимулированных клеток во время размещения 200 мкл пипеттором непосредственно над клетками, используя пятно лазерного света в качестве ориентира.
- Пипетировать смесь FMLP / Alexa 594 над клетками изображаемого с быстрым и равномерный поток и завершить полный набор приобретения покадровой. Имя и сохранить данные, которые будут подвергнуты дальнейшему анализу данных.
- С помощью 10 мкл micropipetter и нагнетательных советы, засыпки микропипетки 30 мкл свежеприготовленной смеси ФМЛФ и Alexa594.
- Приложить микропипетки к держателю микропипетки, установленный на верхней части предметный столик микроскопа и подсоединить трубку к блоку подачи давления, устройство, которое обеспечивает постоянное давление, чтобы освободить раствор FMLP / Alexa594 из микропипетки, чтобы генерировать стабильный градиент.
- Включите подачу давления и установить давление компенсации (ПК) до 70 гПа.
- Смонтировать 1-хорошо камерные покровное, посеянных с HL60 клеток, экспрессирующих PKD1-GFP над масляной линзой 40X на конфокальной микроскопии или его эквивалент флуоресцентного микроскопа.
- Установить приобретение в режиме канала в следующей конфигурации: зеленый канал (500-530 нм) для GFP-меченый PKD1; красный канал (580-620 нм) для хемокина FMLP (Alexa594); и трансмыми световой канал для идентификации прилипших клеток HL60.
- Старт "живой" приобретение и оптимизировать условия приобретения для трех каналов: регулировка интенсивности каждого канала для количественного анализа данных изображения; подстроить между интенсивностью и мощности лазера для всех трех каналов для получения изображений с самым лучшим качеством и свести к минимуму фото-отбеливатель. При необходимости, в среднем каждые 2 до 4 кадров для лучшего качества изображения. Мы обычно используем интервал 1 сек.
- Старт "живой" приобретение и поиск придерживаясь клеток, которые выражают сильную PKD1-GFP в связи с GFP и передаваемых световых каналов. Использование светлого поля оптики, центр микропипетки в центре поля зрения (рис 4A) для того , чтобы визуализировать градиент FMLP и прилипшие HL60 клетки , экспрессирующие PKD1-GFP.
- Выберите приобретение замедленную и установить интервалы в 2-секундными интервалами и количеством кадров на приобретение до 100.
ПРИМЕЧАНИЕ: После сбора каждого тIME покадровой серии, имя и сохранить данные, которые будут подвергнуты дальнейшему анализу данных.
6. Клетки визуализации Chemotaxing в видимом и управляемому химио-аттрактант раздражители
Результаты
Одновременное отображение хемотаксиса нескольких клеток HL60 с помощью устройства анализа подвижности клеток
На основе принципа микрофлюидики 16, производитель предусмотрел смоделированные профили градиентов: градиент генерируется в течение 1 мин, стабилизированный в течение 5 мин, и поддерживали в течение 2 часов. Высококвалифицированные предсказуемые профили стабильных градиентов, генерируемых микрофлюидики позволяют нескольким хемотаксиса, чтобы проводить одновременно. В настоящем исследовании мы наблюдали три одновременных хемотаксиса (фиг.2А и Movie 1). Мы обнаружили, что HL60 клетки начали сразу же после того, как chemotaxing хемоаттрактантной вводили в лунку хемоаттрактанту, и держали chemotaxing в прямой путь для следующих 60 мин, что согласуется с результатами моделирования для градиента стабильности. Прослеживая путь перемещения и морфологииячеек позволяет количественных измерений и последующее сравнение хемотаксиса поведения с использованием индекса хемотаксиса , который включает в себя общую длину пути, скорость, направленность и округлость клеток (Фигура 2В). Общая длина пути есть сумма длин отрезков линии, соединяющей центры тяжести пути. Скорость получается путем деления общей длины пути к тому времени. Направленность измеряется вверх и определяется следующим образом: (Y-координата конца пути минус Y координата начала), деленное на общую длину пути. Это дает 1.0 для объекта, движущегося прямо вверх. Округлость клетки является мерой (в процентах) от того, насколько эффективно данное количество периметра ограничивающий область. Круг имеет самую большую область для любого заданного периметра и имеет округлость параметр 100%. Прямая линия не охватывает ни одна область и имеет округлость параметр 0%. Покажем, количественно измеряемую поведение хемотаксис, как описано выбранными параметрами хемотаксиса(Фиг.2С).
Мониторинг ДОК внутриклеточную локализацию в клетках HL60 под spatiotemporally видимого и контролируемого FMLP стимула
Это отличный технический прогресс, чтобы применить флуоресцентную метку и контролируемой стимуляции хемоаттрактантной к экспериментальной системе. Исторически сложилось, что мы применили либо однородный (также называется равномерным) стимуляции или градиент стимуляции для наблюдения клеточного ответа и поведения. Тем не менее, "слепой" стимуляция не только не обеспечивает пространственно-временную информацию о том, как стимул достигает клеток, но и ставит под сомнение любые "ненормальной" наблюдений клеточного ответа на стимуляцию, просто потому, что мы не видим стимул. Ранее мы показали, что флуоресцентный краситель (Alexa594) можно наносить с помощью хемоаттрактанту установить линейную зависимость между концентрацией хемокина и мonitored интенсивность флуоресцентного красителя 15. При конфигурации приобретения зеленого флуоресцентного белка (GFP), красное излучение флуоресцентного красителя (Alexa594) и проходящем свете, мы можем контролировать прилипшие клетки, применение стимула, и клеточный ответ на стимул (рис 3A). Протеинкиназы D представляет собой семейство серин / треонин киназ , которые играют существенную роль в направленной миграции клеток 9,17. В ответ на равномерно наносимые FMLP (красный) стимуляция, HL60 клетки опосредуют надежной мембранной транслокации GFP-меченый протеинкиназы D1 (зеленый) (рис 3B и Movie 2). В градиенте FMLP (красный) (рис 4а), HL60 клетки активно рекрутировать pKD1 к передней кромке (фиг.4В и Movie 3). Тщательное сравнение субклеточном локализации GFP в выступу передней кромки указывает на то, что PKD1 локализуется в задней части передней кромки (Рисунок 4C).
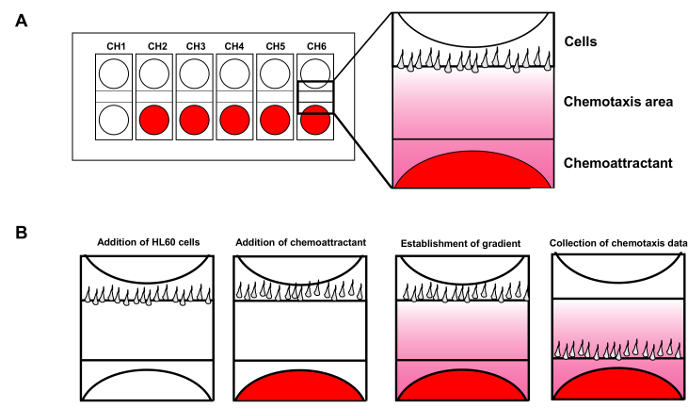
Рисунок 1. Мобильность Мобильные устройства анализа позволяет использовать до 6 одновременных хемотаксиса. (А) Схема показывает конструкцию анализа чипа устройства подвижности клеток для одновременного мониторинга 6 независимых хемотаксиса. Красные показывает хемоаттрактантной добавляют в лунки. (B) Введение HL60 клеток в лунки клеток в то время как хемоаттрактантной диффундирует создать устойчивый градиент FMLP. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
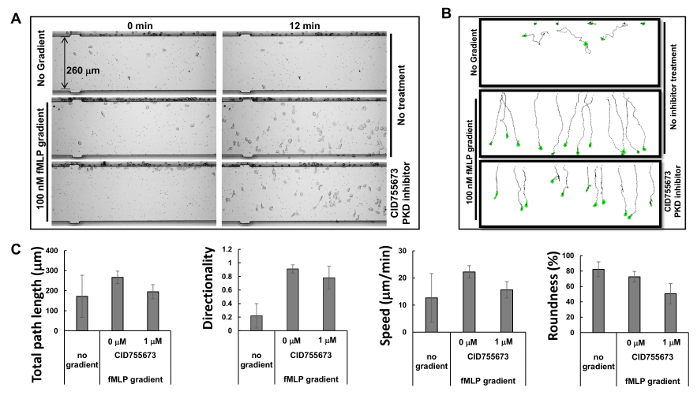
Рисунок 2. Одновременный мониторинг нескольких хемотаксиса с HL60 клеток. (A ) Montage показывает изображения подвижности клеток устройства анализа хемотаксиса анализа для изучения ингибирующие эффекты ПКД-специфических ингибиторов на хемотаксис в моменты 0 и 12 мин после применения градиента. Клетки Хемотаксический HL60 были предварительно обработаны ингибитором ДОК 1 мкМ CID755673 в течение 30 мин. HL60 клетки с добавлением или без лечения ингибитором ДОК было разрешено chemotax в любом RPMI1640 голодном среде или 100 нм FMLP градиентов в течение 12 мин. (B) Схема показывает путешествия длины пути и морфологии отслеживаемых HL60 клеток. (C) Количественный хемотаксиса как общая длина пути, скорость, направленность и округлости. Среднее ± SD показано; п = 10, 12, или 11 без всякой градиента, FMLP градиента без лечения CID755673 и лечение FMLP с лечением CID755673 соответственно. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
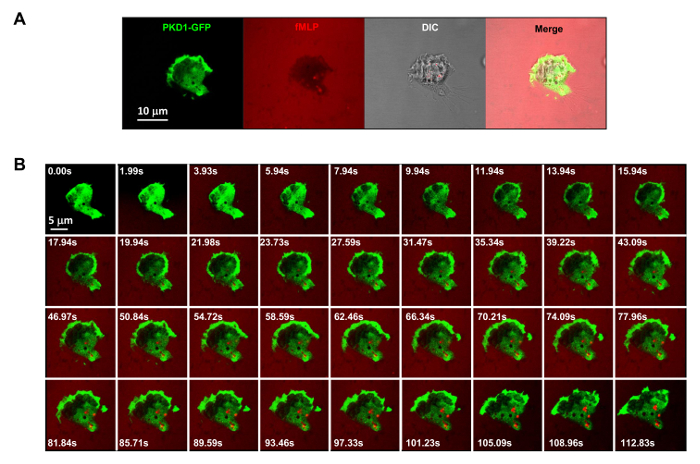
Рисунок 3. ХВГФ-опосредованной Надежная мембрана транслокацию PKD1 в ответ на раздражители , равномерно наносимые FMLP. (А) Многоканальный мониторинг pKD1-GFP (зеленый), хемоаттрактантной (1 мкМ FMLP смешивают с 0,1 мкг / мл флуоресцентного красителя Alexa 594, красный) , и ДВС-синдром (дифференциальный интерференционный контраст), чтобы определить, прилипшие клетки HL60 в лунку 4well камеры, покрытой 0,2% желатина в RPMI 1640 среде. Шкала бар = 10 мкм. (B) Montage показывает , что равномерно наносимые FMLP (красный) вызывает устойчивую мембранный транслокацию PKD1-GFP (зеленый). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
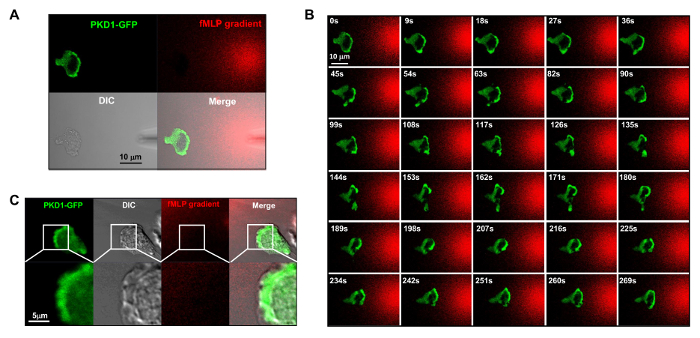
Figurе 4. Передний край локализация PKD1 в chemotaxing HL60 клеток. Конфигурация режима сбора (A) канала облегчает визуализацию градиента FMLP и пространственно - временные динамики PKD1. В А - С, HL60 клетки скоротечно выражали GFP-меченый PKD1; визуализировать градиент FMLP , генерируемого из микропипетки (DIC), 100 нМ ФМЛФ (красный) смешивают с 0,1 мкг / мл флуоресцентного красителя Alexa 594. (B) Enriched локализации PKD1 на переднем крае chemotaxing клетки. Шкала бар = 10 мкм. (C) Слитые изображения показывают , что PKD1 локализуется в задней части передней кромки в HL60 клетках. Зеленый показывает PKD1 клеточную локализацию, и ДИК изображение показывает выступающую область передней кромки. Шкала бар = 5 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В настоящем исследовании мы покажем два примера хемотаксиса: во-первых, одновременного мониторинга нескольких анализов хемотаксиса с помощью устройства анализа подвижности клеток; и во-вторых, визуализация градиента хемокина и пространственно-временной динамики сигнальных событий в одних и тех же клетках в режиме реального времени.
Устройство анализа подвижности клеток для нескольких одновременных хемотаксиса
В настоящем исследовании мы представили подробный протокол для выполнения анализа многократных проб одновременного хемотаксиса с использованием устройства для анализа подвижности клеток. Это устройство позволяет пользователю наблюдать сотовой поведения хемотаксис с 10-кратным объективом в обычном наблюдении светлого поля. Из-за диффузии доминирующих характеристик потока текучей среды, устройство анализа подвижности клеток создает весьма предсказуемые, стабильные градиенты и позволяет использовать до шести хемотаксиса, чтобы проводить одновременно. Критические шаги протокола являютсячтобы получить надежные градиенты и для выравнивания ячеек на линии террасе. Пользователь должен строго следовать инструкциям производителя по сборке держателя и инъекции хемоаттрактанты и клеток. Подробные инструкции также доступны в Интернете. По сравнению с альтернативными методами хемотаксиса 11-13,15, это устройство существенно повышает надежность и эффективность хемотаксиса. Четыре размера подвижности клеток анализа микросхеме устройства в размерах 4, 5, 6 и 8 мкм доступны для размещения различных типов и размеров ячеек. Мы обнаружили , что 4 или 5 мкм подвижность клеток чип устройство анализа пригоден для HL60 и D. discoideum клетки, которые составляют около 10-15 мкм в диаметре. Тем не менее, одно ограничение заключается в том, что данное устройство не подходит для всех типов клеток. Мы имели мало успеха, используя подвижность клеток устройства анализа хемотаксис анализа с клетками Raw267.4. Причина может заключаться в том, что Raw267.4 клетки мигрируют слишком медленно. Время, необходимое для эффективного Chemotaxis клеток Raw267.4 может быть гораздо больше, чем время, градиент поддерживается устройством. Вместо этого анализа Transwell миграции работала хорошо для Raw267.4 клеток 9. Другим ограничением является то, что флуоресцентный наблюдений не представляется возможным с текущим устройством. Будущее направление является мониторинг флуоресцентных изображений с большим увеличением. Это возможно с улучшенным устройством анализа подвижности клеток, которая снабжена флуоресцентной детекции и объектива 100X. Кроме того, количество одновременных анализов, также увеличивается до 12. Все эти усовершенствования облегчают повышенную пропускную способность хемотаксиса и наблюдение субклеточном динамики в мигрирующих клетках.
Высокая эффективность трансфекции клеток HL60, чтобы выразить флуоресцентный белок-меченый белок
HL60 клетки являются активно делящимися лейкоз клеточную линию и расти в суспензии. Как сообщалось ранее 18-20, HL60 клетки устойчивы к гена перевод. Жиро- и перенос генов электропорации были протестированы, и более высокая эффективность трансфекции была получена с электропорации, как описано подробно в разделе 4. Получение высокой жизнеспособности после электропорации имеет решающее значение для достижения высокой эффективности трансфекции, из-за серьезного повреждения, что является результатом электропорации. Впоследствии, тщательное и бережное обращение клеток необходимы, особенно после электропорации. Все средства массовой информации должны быть предварительно нагретом и осторожно добавляли к клеткам в любых шагов после электропорации. Также очень важно, чтобы свести к минимуму время экспозиции клеток к реагенту электропорации. Для того, чтобы избежать гибели клеток, после того, как электропорация, среда RPMI 1640 восстановление электропорации среда должна быть добавлена к клеткам немедленно. Мы обнаружили, что 20% FBS в среде восстановления дает гораздо более высокую скорость восстановления клеток, чем 10% FBS. После электропорации, инкубирование в среде RPMI 1640 электропорации среде восстановления в течение 30 мин имеет решающее значение для повышения жизнеспособности и трансфекциикоэффициент полезного действия. Для дальнейшего повышения эффективности трансфекции, мы также использовали 4 мкг плазмидной ДНК на трансфекцию, которая почти в два раза количество плазмиды рекомендованных производителем.
Существуют два основных ограничения на электропорации трансфекцией: The быстротечность экспрессии белка и предельное число клеток (2 × 10 6 клеток на трансфекции). В недифференцированных клеток, экспрессия обнаруживается только во время первых двух клеточных делений, так как вектор плазмиды разбавляют наполовину после каждого деления клеток. Для дифференцированных HL60 клетки не выживают не более 48 часов. В результате, любой эксперимент требует свежего трансфекциях 6 часов до эксперимента. Число клеток в течение одного электропорации просто соответствует минимальным требованиям для любых биохимических анализов. Для повторного использования или большого количества, настоятельно рекомендуется, чтобы недифференцированных клеток линии HL60 быть установлено, что стабильно выражает интерес белка WHIч помечены с помощью флуоресцентного белка с помощью вирусного вектора, если вирусный вектор доступен или может быть построена.
Раскрытие информации
The authors declare no competing financial interest for this work.
Благодарности
This work is supported by the intramural fund of NIAID, NIH.
Материалы
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium GlutaMAX | Life technologies | 61870-036 | |
| Sodium pyruvate | Thermo Fisher Scietific | 11360-070 | |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| 1M HEPES sterile solution, pH7.3 | Quality Biological Inc. | A611-J848-06 | |
| Penicillin streptomycin solution | Fisher Scientific | 15140122 | |
| NucleofectorTM 2b | Lonza | AAB-1001 | |
| AmaxaTM Cell Line NucleofectorTM Kit V including NucleofectorTM Solution, Singe use pipettes, AmaxaTM certified 100 ml aluminum electrode cuvettes | Lonza | VCA-1003 | |
| Lab-Tek chambered #1.0 Borosilicate Coverglass | Nalge Nunc International Inc | 155383 | |
| 2 % Gelatin solution | Sigma-Aldrich | G1393 | |
| Fibronectin | Sigma-Aldrich | F1141 | |
| HBSS (Hanks’ Balanced Salt Solution) | Life technologies | 14025-076 | |
| Bovine serum albumin | Sigma-Aldrich | A3803 | |
| Single well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155361 | |
| Four-well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155383 | |
| Alexa 594 | Thermo Fisher Scientific | A-10438 | |
| fMLP | Sigma -Aldrich | F3506-5MG | |
| Cover glass thickness 2 22 x 22 mm | Corning | 2855-22 | |
| EZ-TAXIScan | Effector Cell Institute, Inc. | MIC-1001 | |
| EZ-TAXIScan chip (5 mm) | Effector Cell Institute, Inc. | EZT-F01-5 | |
| 1701RN 10ul syringe | Hamilton | 80030 | |
| Femtotips II Injection tips | Eppendorf | 5242956003 | |
| Femtotips II | Eppendorf | 930000043 | |
| TransferMan NK2, including motor module, X head with angle adjuster, and Positioning aids. | Eppendorf | 5188900056 | |
| DIAS software | Solltech Inc. | ||
| LSM 780 META or equivalent confocal microscope with a 40X 1.3 NA or 60X 1.4 NA oil DIC Plan-Neofluar objective lens | Carl Zeiss |
Ссылки
- Pocha, S. M., Montell, D. J. Cellular and molecular mechanisms of single and collective cell migrations in Drosophila: themes and variations. Annual review of genetics. 48, 295-318 (2014).
- Wen, Z., Zheng, J. Q. Directional guidance of nerve growth cones. Current opinion in neurobiology. 16, 52-58 (2006).
- Bravo-Cordero, J. J., Hodgson, L., Condeelis, J. Directed cell invasion and migration during metastasis. Current opinion in cell biology. 24, 277-283 (2012).
- Zigmond, S. H. Chemotaxis by polymorphonuclear leukocytes. The Journal of cell biology. 77, 269-287 (1978).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, receptors and human disease. Cytokine. 44, 1-8 (2008).
- Dong, X., et al. P-Rex1 is a primary Rac2 guanine nucleotide exchange factor in mouse neutrophils. Current biology : CB. 15, 1874-1879 (2005).
- Li, Z., et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell. 114, 215-227 (2003).
- Van Haastert, P. J., Devreotes, P. N. Chemotaxis: signalling the way forward. Nature reviews: Molecular cell biology. 5, 626-634 (2004).
- Xu, X., et al. GPCR-Mediated PLCbetagamma/PKCbeta/PKD Signaling Pathway Regulates the Cofilin Phosphatase Slingshot 2 in Neutrophil Chemotaxis. Mol Biol Cell. , (2015).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of experimental medicine. 115, 453-466 (1962).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of cell biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of cell science. 99 (Pt4), 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PloS one. 5, e15309 (2010).
- Bozzaro, S., Fisher, P. R., Loomis, W., Satir, P., Segall, J. E. Guenther Gerisch and Dictyostelium, the microbial model for ameboid motility and multicellular morphogenesis. Trends in cell biology. 14, 585-588 (2004).
- Xu, X., Jin, T. Imaging G-protein coupled receptor (GPCR)-mediated signaling events that control chemotaxis of Dictyostelium discoideum. Journal of visualized experiments : JoVE. , (2011).
- Lin, F., et al. Generation of dynamic temporal and spatial concentration gradients using microfluidic devices. Lab Chip. 4, 164-167 (2004).
- Eiseler, T., et al. Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology. 11, 545-556 (2009).
- Roddie, P. H., Paterson, T., Turner, M. L. Gene transfer to primary acute myeloid leukaemia blasts and myeloid leukaemia cell lines. Cytokines Cell Mol Ther. 6, 127-134 (2000).
- Schakowski, F., et al. Novel non-viral method for transfection of primary leukemia cells and cell lines. Genet Vaccines Ther. 2, 1 (2004).
- Uchida, E., Mizuguchi, H., Ishii-Watabe, A., Hayakawa, T. Comparison of the efficiency and safety of non-viral vector-mediated gene transfer into a wide range of human cells. Biol Pharm Bull. 25, 891-897 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены