Method Article
Görüntüleme G Nötrofil gibi HL60 Hücreleri Kemotaksis ve Sinyal Olaylar Reseptör aracılı Protein-çiftli
Bu Makalede
Özet
Görsel kemotaksis deneyleri kemoatraktan aracılı yönlü hücre göçü nasıl kontrol ökaryotik hücreler daha iyi anlaşılması için gereklidir. 1) Gerçek zamanlı, çoklu kemotaksis deneyleri yüksek çözünürlüklü izleme ve 2) aynı anda kemoatraktan degrade görselleştirmek ve nötrofil gibi HL60 hücrelerinde sinyal olaylarının zamanmekansal dinamiği: Burada ayrıntılı yöntemler açıklanmaktadır.
Özet
Eukaryotic cells sense and move towards a chemoattractant gradient, a cellular process referred as chemotaxis. Chemotaxis plays critical roles in many physiological processes, such as embryogenesis, neuron patterning, metastasis of cancer cells, recruitment of neutrophils to sites of inflammation, and the development of the model organism Dictyostelium discoideum. Eukaryotic cells sense chemo-attractants using G protein-coupled receptors. Visual chemotaxis assays are essential for a better understanding of how eukaryotic cells control chemoattractant-mediated directional cell migration. Here, we describe detailed methods for: 1) real-time, high-resolution monitoring of multiple chemotaxis assays, and 2) simultaneously visualizing the chemoattractant gradient and the spatiotemporal dynamics of signaling events in neutrophil-like HL60 cells.
Giriş
Ökaryotik hücreler algılar ve bir kemoatraktan degrade içinde yüksek konsantrasyonda doğru hareket, bir hücresel süreç kemotaksis olarak anılacaktır. Kemotaksis örneğin embriyojenez 1, nöron desen 2, kanser hücrelerinin 3 metastazı, enflamasyon 4 sitelerine nötrofillerin alımına ve model organizma Dictyostelium discoideum 5 gelişimi gibi birçok fizyolojik işlemlerde önemli bir rol oynar. Genel olarak, ökaryotik hücreler G protein-eşli reseptör 5 kullanılarak kimyasal çekici anlamda. Bu reseptörler ile chemoattractants geçme da sonuç olarak hücre göçü 5-9 sürmek için aktin hücre iskeletinin uzaysal organizasyonu düzenleyen aşağı akış sinyal iletim yolunu aktive heterotrimeric G proteinleri Gα ve Gβγ, ayrışmasına teşvik etmektedir.
Hücre biyologları geliştirilmesi ve chemotax iyileştirilmesi olmuşturtahliller G-protein kenetli reseptör (GPCR) sinyal aracılık yapar, hücre göçü yönettiği nasıl incelemektir. Boyden odası veya Transwell göç tahlil Boyden 10 tarafından 1960 yılında geliştirilmiştir. Deney bir mikro-gözenekli membran ile ayrılmış, iki kuyu arasındaki kemoatraktan bileşiklerinin gradyanı oluşturarak çalışır. Sadeliği ve kullanım kolaylığı bugüne kadar en yaygın olarak kullanılan kemotaksi deneyi yapmak. Ancak, hücrelerin göç sürecini izin vermez tahlil görüntülenmiştir için. Zigmond odası bir kaynak kemoatraktan 11 doğru dar bir daralma karşısında bir lamel hücre göçü açık görüntüleme sağlayan ilk görsel mikroakışkan cihazdır. Dunn 12 ve Insall 13 modifiye ve Zigmond odası kemotaksis testin yüksek çözünürlüklü ve uzun süreli görüntüleme yeteneği gelişmiş. Çünkü sıvı akışının oldukça öngörülebilir, difüzyon baskın özellikleri, Mikroakiskan sonraki Generati için çözümler sunan olmuşturBu EZ-TAXIScan (hücre hareketliliği analiz cihazı) halinde kemotaksis deneyleri ile ilgili.
Sağlanmış degrade istikrar ile, cihaz altı kemotaksis deneyleri aynı anda (Şekil 1A) yürütülen sağlar. Yukarıda çeşitli oda deneylerde üretilen yönsel sabit gradyanlar aksine, Günter Gerisch tarafından geliştirilen bir iğne ya da mikropipet deneyi hareketli bir kaynak 14 gradyanı oluşturur. tahlilde, kemoatraktan stabil gradyanı oluşturmak için hareket edebilen bir mikropipet salınır. Bu iğne testi ile, araştırmacılar farklı hücreler temelde farklı özelliklere sahip psödopod üretmek bulundu. Floresan mikroskop uygulayarak, biz 15 boyunca nicel ölçümünü kolaylaştırmak için degrade görselleştirmek için başardık. Bu çalışmada, biz aynı anda birden fazla kemotaksis assa izleme kemotaktik HL60 (insan promiyelositik lösemi) hücrelerinin hazırlanması için ayrıntılı yöntemleri tarifHücre hareket analiz cihazı ve görünür, spatiotemporally kontrol kemo-çekici uyarıcıya tepki olarak bu tip bir tekli canlı hücrelerde protein kinaz D1 sinyal molekülleri GPCR aracılı uzaysal dinamikleri görselleştirme ys. Gelişmiş görüntüleme yöntemleri, genel kemotaksis çalışmaları uygulanır ve memeli hücre sistemleri için özellikle uygundurlar.
Protokol
1. Kültür ve İnsan Farklılaşma Nötrofil gibi HL60 Hücreleri
- Hazırlama RPMI (Roswell Park Memorial Institute) RPMI 1640 ortamı,% 10 (h / h) cenin sığır serumu (FBS), 0.1 mM sodyum piruvat içeren 1640 kültür ortamı ve 25 mM HEPES (4- (2-hidroksietil) -1 -piperazineethanesulfonic asit). 37 ° C'ye kadar bir RPMI 1640 kültür ortamı ısıtın.
- Bir hemasitometre kullanarak hücrelerin log-faz büyüme aşamasında olduğundan emin olmak için HL60 hücrelerinin hücre yoğunluğu belirlemek.
NOT: Hücreler Pasajlanması sonra üçüncü gününde log fazı genellikle. Log-faz hücrelerinin yoğunluğu genellikle 6-8 x 10 5 hücre / ml 'dir. Yeni bir kültürünü başlatmak için hücre yoğunluğu yaklaşık 1.5 x 10 5 hücre / ml 'dir.
Not: Örneğin, T-75, düz bir şişe içinde 10 mi, yeni kültür, log-faz hücrelerinin daha sonra hücre yoğunluğu 6 x 10 5 hücre / mi, log-faz hücrelerinin (2.5 mL 6 X 10 5 ise, ) 10 m 1.5 x 10 5 hücre / ml olacak şekilde seyreltilirl yeni kültür. 10 ml kültüre nihai bir hacim ilave edilir RPMI 1640 kültür ortamı içinde 7.5 ml yapmak için. - Düz bir şişeye ılık RPMI 1640 kültür ortamı hesaplanan hacim yerleştirin. T-75 düz bir şişe kültürü, hücre kültürü, toplam hacmi 10 ml'dir.
- 1.5 x 10 5 hücre / ml hücre yoğunluğuna ulaşmak için, düz bir şişeye log-faz artan HL60 hücrelerinin hesaplanan hacim.
- % 5 CO2 ile nemlendirilmiş bir kuluçka makinesi içinde 37 ° C'de inkübe hücreleri.
NOT: HL60 iki katına zaman neredeyse 24 saattir. - RPMI 1640 kültür ortam maddesi ile Geçiş hücreler her 2-3 günde. HL60 hücrelerinin hücre yoğunluğu asla 1.5 x 10 6 hücre / ml aşıyor ve hücre geçit artık 2 aydan sürer önemlidir.
- Deneylerde önce HL60 hücreleri 5 gün ayırt eder.
Not: RPMI 1640 farklılaştırma ortamı RPMI 1640 ortamı,% 10 (h / h) cenin sığır serumu (FBS), 0.1 mM sodyum piruvat, 25 mM lH içerirEPES ve% 1.3 dimetil sülfoksit (DMSO). Diğer bir deyişle, bu RPMI 1640 kültür ortamı içinde% 1.3 DMSO.- HL60 hücreleri ayırt etmek için, 37 ° C bir RPMI 1640 kültür ortamı önceden ısıtın. Düz balona sıcak RPMI 1640 kültür ortamı ekleyin.
- DMSO hızlı bir RPMI 1640 kültür ortamı ile seyreltildi, böylece balon dönen ise bir son 10 ml HL60 farklılaşma kültürü için, düz bir şişede RPMI 1640 kültür ortamı, doğrudan 130 ul DMSO ilave edin.
- Bir son 10 ml RPMI 1640 farklılaşma ortamı içinde 1.5 x 10 5 hücre / ml'lik bir nihai hücre yoğunluğu log-faz HL60 hücreleri ekleyin. Kültür, 5 gün boyunca% 5 CO2 ile nemlendirilmiş bir kuluçka makinesi içinde 37 ° C'de RPMI 1640 ortamı içinde farklılaşma HL60 hücreleri.
2. 4well Odası Kapak Cam Yüzey Kaplama
- , Buzdolabından% 2 jelatin stok solüsyonu şişe almak% 70 etanol ile temizleyin ve kaputu yerleştirin. TAKE 1 ml% 2 jelatin stok solüsyonu ve hemen buzdolabına kalan jelatin stok solüsyonu döner.
- jelatin çözeltisi tam 37 ° C'de sıvılaştırılması ve iyice pipet izin verin. 9 mi önceden ısıtılmış 1x Hanks dengeli tuz çözeltisi ile% 2'lik bir jelatin stok solüsyonu seyreltik (HBSS)% 0.2 jelatin son konsantrasyonu tampon.
- sırasıyla altındaki bir kapak camı ile 4 oyuklu odasının iki orta kuyu veya 1 oyuklu bölmeye HBSS içinde 0.5 ml ya da 2 ml% 0.2 jelatin ekleyin. Sıvı tüm yüzey alanını kaplayacak şekilde çeşitli yönlere plakaları eğin.
- 37 ° C inkübatör tabak yerleştirin. Plakalar 1 saat içinde kullanıma hazır olur. Bunlar en fazla 5 gün için de kullanılabilir. Sadece hücrelerin ekim önce, 4-iyi ya da 1-kuyu odalarından jelatin çözüm kaldırmak.
3. Kemotaksis Deneyi kullanılarak hücre hareketliliği Analiz Cihazı
- RPMI olduğunu hazırlayın ve sıcak RPMI 1640 açlıktan ortamı,0.1 mM sodyum piruvat (isteğe bağlı) ve 25 mM HEPES içeren ortam.
- orta açlıktan RPMI 1640 içinde, 100 nM fMLP (N-formilmetionil-lösil-fenilalanin), 100 ul hazırlayın.
- % 1 sığır serum albümini 3 ml (BSA) Hazırlama / RPMI ortamı ve% 0.1 BSA / RPMI 1640 ortamı 10 ml açlıktan RPMI 1640 içinde% 1 BSA içeren 1640 ortamı.
- Ceket 22 mm'lik kare lamel ve taze hazırlanmış% 1 BSA ile bir 5 mikron hücre hareketliliği analiz cihazı çip / RPMI 1640 ortamı oda sıcaklığında 1 saat karıştırıldı.
- Aşağıdaki prosedürü kullanarak Holder birleştirin:
- kolları kullanıcı doğru eğin, böylece dikey pozisyonda kolları ile tutucu tabanını yerleştirin. 41 mm'lik cam yüzeyine% 70 etanol çözeltisi uygulanır. Dikkatle çizmemeye özen bir silme ile yüzeyleri silin.
- tutucu üssü haline 41 mm cam yerleştirin. tutucu tabanında 41 mm cam üstünde BSA ile kaplanmış 22 mm kare lamel koyun.
NOT: Kaplanmış kare c41 mm cam ve yonga arasındaki overslip kemotaksis kaplama yüzeyinin alt tabaka oluşmasına izin verir. - gofret konut dibine O-halkayı (küçük) yerleştirin ve arkada eliptik delik olan tutucu üssü haline gofret konut monte edin. konumunda gofret konut kilitlemek için yatay pozisyonda ileri tutucu tabanının iç düzeyini çekin.
- bir hava silgi ile gofret yuvanın iç tozları üfleyin. Gofret yuva içine% 0.1 BSA / RPMI 1640 ortamı içinde 4 ml.
- aşağı cam ile temas yapısal yüzü ile gofret mahfazanın ortasında BSA ile kaplanmış hücre hareketliliği analiz cihazı çip monte edin.
NOT: çip arka konumlandırma işareti (çip üstünde delik) ile takılması gerekir bu. - deliklere lastik conta iki çıkıntılar takarak gofret kelepçe altına lastik conta yapıştırın.
- üzerine O-halkasını (büyük) monte edingofret konut üst. arka sensör delik ile gofret kelepçesini takın. yerine gofret kelepçe kilitlemek için yatay pozisyonda ileri konut tabanının dış kolunu çekin.
- tutucu montajından sonra, kuyularda hiçbir hava kabarcığı olduğunu doğrulamak için ışık kutusu üzerinde sahibinin alt yerleştirin. Hava kabarcıkları tespit edilirse, bir örnek yükleme ucu ile donatılmış verilen plastik şırınga kullanarak bunları kaldırın.
- Kapağı çıkarın ve hücre hareketliliği analiz cihazı ünitenin üstünde plaka üzerine montajını koydu. sahibine sensör bloğunu takın.
- Kemotaksis Deneyi için HL60 hücrelerinin hazırlanması:
- hemositometre ile Farklılaşmış HL60 hücreleri hücre yoğunluğu hesaplanır. Farklılaşma 5 gün sonra hücre yoğunluğu yaklaşık 1.0 x 10 6 hücre / ml 'dir.
- 2 x 10 6 hücre / ml nihai hücre yoğunluğu HL60 hücreleri son hacim hesaplanır. Örneğin, hücre yoğunluğuFarklılaşmış HL60 hücreleri, 1.0 x 10 6 hücre / o mi, Farklılaşmış HL60 hücreleri 10 mi, 2 x 10 6 hücre / ml ulaşmak için 5 mi% 0.1 BSA / RPMI 1640 ortamı ile yeniden süspansiyon haline getirilmiş olacaktır.
- Santrifüj 200'de HL60 hücreleri ayırt Oda sıcaklığında 5 dakika boyunca xg. % 0.1 BSA, hesaplanan hacmi ile hücrelerin Süpernatantı ve tekrar süspansiyon / 2 x 10 6 hücre / ml'lik bir nihai hücre yoğunluğu RPMI aşama 3.6.2 de 1640 ortamı).
- görüntü elde etmek için hücre hareketliliği analiz cihazı ünitesi ve PC başlatın. Üniteyi bilgisayara bağlayın. Hücre hareketlilik analizi aygıtı açın. Bilgisayarı açın.
- Hücre Hareketlilik Analizi Device Software Up başlayın.
- Kamera, ısıtıcı, çekim, not ve kamera görüntüleri: 5 kontrol panelleri gözlemleyin.
- Kamera görüntü kontrol panelinde, kamera görüntü panelinde kamera ortalamak için gerçek zamanlı olarak tutucu / görünüm konumunu ayarlamak için "Yatay çizgi" veya "Dikey çizgi" kullanın.
- Kamera kontrol panelinde, belirlenen kanala kamera taşımak için CH6 CH1 seçin. Bir kanalın görünüm alanlarını ortalamak için, kameranın X-koordinatı ve yatay kameranın konumunu ortalamak ayarlamak için "R Taşı", "Taşı L" tıklayın ya.
- Ayarlayın dikey ekran ortalamak için Görüntüyü ayarlamak için hücre hareketliliği analiz cihazı ünitenin ön panelindeki pozisyon düğmesini çevirerek kameranın Y koordinatı.
- Isıtıcı kontrol panelinde, 37.0 ° C "tutucu temp" ve 39 ° C "plaka sıcaklığı" olarak ayarlayın. Isıtma başlatmak için "Heat" tıklayın. Ayrıca tutucuya bağlı termal sensör kullanarak sıcaklığı kontrol etmek için "tutucu" tıklayın.
- Çekim panelinde, "Aralık" at "15 sn" ve aralıkları için "Time" de "30 dakika" ve kemotaksis testinde süresini girin. Kontrol güvenlik nedeniyle "çekim sonunda kapalı ısıtıcı". Bir DE belirtinsaklanan görüntüler için stination.
- Not panelinde, hücre hattı gibi deneylerin giriş özelliklerini, tedavi uygulandı olsun ya da olmasın, kullanılabilir ve kemo-cezbedici konsantrasyonu uygulanır.
- Deneylerde kullanılacak tüm kanallar merkezi konumda olması garantilenir ve gerekirse, tüm kanallar için ayarlamasını tekrarlayın.
- Enjekte edilir ve takip Hücreleri hizalayın:
- tutucudan tamponu çıkarın ve her bir kanal için üstten üçüncü gelen tampon 8 ul çıkar.
- Hücre sayısını kontrol etmek ve enjeksiyon esnasında akması için gerçek zamanlı olarak ekranda izleme sırasında aynı kanalda ikinci kuyuya hücre 2 ul enjekte etmek için bir şırınga kullanın. Hücreler güzel hizalanmış sonra, derhal tampon 8 ul geri ekleyin. Diğer kanallar (Şekil 1B) için de aynı işlemi tekrarlayın.
- geri sahibine tampon ml 2 ekleyin ve 1 ul 100 nM FM ekleyinüstten üçüncü oyuk LP. görüntü elde etme başlatın ve verileri kaydetmek. Görüntüyü yazılımını 9 izleme (Şekil 2) kullanılarak elde edilen verileri analiz edin.
Elektroporasyon 4. Transfeksiyon
- Bölüm 2'de belirtildiği gibi Bölüm 1. Kat 4-iyi ya da 1-kuyu odaları açıklandığı gibi deneyden önce HL60 hücreleri 5 gün ayırt eder.
- Hazırlama ve 37 ° C'de RPMI 1640 ortamı,% 20 (h / h) FBS, 0.1 mM sodyum piruvat, 25 mM HEPES içeren, sıcak RPMI 1640 elektroporasyon geri ortamı.
- Sağ transfeksiyon deney başlamadan önce, sırasıyla, önceden kaplanmış 4-iyi ya da 1-kuyu odaları kuyulara 300 ul veya 3 ml RPMI 1640 kültür ortamı ya ekleyin.
- % 5 CO2 ile nemlendirilmiş bir 37 ° C kuluçka makinesi içinde odaları inkübe edin. ileride kullanmak (iki hafta) inkübatöre hemen veya deposu bu odadan kullanın.
- farklılaşmış HL6 hücre yoğunluğu sayısıBir hemasitometre 0 hücreleri.
Not: Hücre yoğunluğu genellikle yaklaşık 1.0 x 10 6 hücre / ml'ye ulaştığı. Hücre yoğunluğu daha 3.0 x 10 6 hücre daha / ml genellikle istenmeyen transfeksiyon verimi sağlar. HL60 hücrelerinin süspansiyon hücreleri olduğu için, herhangi bir re-süspansiyon gereklidir. - 200 hücreleri santrifüj Oda sıcaklığında 5 dakika boyunca xg. Süpernatantı ve transfeksiyon reaktifi, 100 ul 2 x 10 6 HL60 hücreleri tekrar süspansiyon.
- Hücreleri ve transfeksiyon reaktifler 100 ul karışımı içine GFP-PKD1 plazmid 9 4 ug ekleyin ve hafifçe ve iyice karıştırın. sağlanan küvetin içine karışımı ekleyin.
- insan lökosit hücre hattı için üreticinin önceden ayarlanmış programı seçin ve elektroporasyon gerçekleştirin.
NOT: Daha fazla bilgi üreticisinin web sitesinden edinilebilir. - Elektroporasyondan sonra, hemen ve yavaşça ilave hücrelere 500 ul RPMI 6140 elektroporasyon kurtarma ortamı önceden ısıtılmış veyavaşça verilen plastik pipetler ile 1.6 ml tüp küvet hücreleri aktarın.
- % 5 CO2 ile nemlendirilmiş bir 37 ° C kuluçka makinesi içinde, 30 dakika boyunca inkübe hücreleri. Tohum 100 ul veya sırasıyla bir 4-kuyu kuyu veya 1-kuyu odasına, içine hücreleri 500 ul.
- sırasıyla 1 ml veya bir 4-kuyusunun aynı oyuğuna 4 ml'lik bir son hacim ya da 1-çukurlu odasına RPMI 1640 kültür ortamı. 3 saat,% 5 CO2 ile nemlendirilmiş bir 37 ° C kuluçka makinesi içinde hücreleri inkübe edin. Pre-sıcak RPMI 1640 açlıktan ortamı 37 ° C.
- 1 ml pipet kullanarak, yavaşça sırasıyla 4 oyuklu bölmenin oyuk ya da 1-çukurlu haznesinden RPMI 1640 kültür ortamı, 0.8 ml veya 3 ml çıkarın. Nazik olun ve yapışan HL60 hücreleri uzakta emme kaçının.
NOT: HL60 hücrelerin büyümesine ve süspansiyon medyada ayrılır. bazı tedaviler ile birlikte veya farklılaştırılmış sonra, HL60 hücrelerinin polilisin, kolajen, jelatin ya da fi ile kaplanmış alt tabaka bağlıbronectin. - sırasıyla 4-iyi ya da 1-de bölmenin kuyuya orta açlıktan 0.8 ml ya da RPMI 1640 3 ml ekleyin. 1 saat bekleyin.
NOT: Bu noktada hücreler görüntüleme deneyleri 9 için hazırdır.
5. İzleme GPCR aracılı Çok kanallı Floresan Mikroskobu PKD1 Membran Translokasyon
- uyaran olarak orta aç RPMI 1640 içinde 100 nM fMLP ve 1 ug / ml Alexa 594 taze bir karışım hazırlayın.
NOT: fMLP ve Alexa 594 ihtiyaçlar karışımı taze maksimum etkinlik sağlamak için yapılacaktır. - Dağı bir 4-iyi odasının 40X petrol lensin üzerinden hücreleri ile ekildi.
- Şöyledir olarak Çok Kanallı Yapılandırması Floresan Mikroskop ayarlayın:
- yapışan HL60 hücrelerinin tanımlanması için kemoatraktan fMLP için GFP etiketli PKD1, kırmızı emisyon kanalı (580-620 nm) (Alexa 594) yeşil emisyon kanalı (500-530 nm) ve iletilen ışık kanalı ayarlayın.
- Başlat "canlı" satın alma veÜç kanal toplama koşullarını optimize:
- Her üç kanal için yoğunluğu ve lazer gücü arasındaki ince ayar görüntüleme uzun bir süre için ışıkla ağartma en aza indirmek için.
- Gerekirse, görüntülerin daha iyi kalite için arka plan gürültü oranını azaltmak için her 2 ila 4 kare ortalama. 1 sn aralığı kullanın.
- GFP ve DIC (diferansiyel girişim kontrast) kanalın görünümünde güçlü PKD1-GFP ifade hücreleri yapıştırmak için arayın. Yapışan hücreler morfolojik düz ve hızlı hareket etmezler.
- Uzun vadeli görüntüleme (Şekil 3A) için ışıkla ağartma azaltmak için her bir kanal için dedektör kazancını artırırken yüksek ekspres GFP-PKD1, lazer gücünü düşürerek elde etme koşulunu optimize yapışan HL60 hücreleri belirlendikten sonra.
- 200 ul pipetter ile fMLP / Alexa 594 çözüm 100 ul alın ve bir kenara koyun. "Time-lapse edinimi" seçin ve aralıkları ayarlamak2 sn ve kare sayısı 100'e elde etmek.
NOT: aralıkları ve elde etmek için kare sayısı deneylerin amacı bağlıdır. 1-2 saniye aralıklarla 100 kare genellikle Şekil 3'de olduğu gibi, görüntüleme deneyleri için kullanılır. Yavaşça hücrelere taşımak için, uzun aralıklar uzun süreli görüntüleme için gereklidir. Bunun aksine, hücreleri hızla geçiş için, daha kısa aralıklarla hücre göçü sürekli ayrıntıları gözlemlemek için gereklidir. - Odanın konumu değişmez, böylece dikkatlice 4-iyi bir odasının kapağını çıkarmak. edinimi hemen başlayın ve bir rehber olarak lazer ışığının yerinde kullanarak hücreleri üzerinde doğrudan 200 ul pipetter konumlandırırken uyarılmamış hücrelerde 3-5 görüntüler elde.
- hücreleri üzerinde fMLP / Alexa 594 karışımı akış ve time-lapse edinimi komple set bitirmek bile hızlı ile görüntülenmiş ve varlık pipetle. Ad ve daha fazla veri analizine tabi olacak verileri kaydetmek.
Görünür ve Kontrol Edilebilir Kemo-cezbedici Uyaranların 6. Görüntüleme chemotaxing Hücreleri
- 10 ul Mikropipet ve enjeksiyon ipuçlarını kullanarak, taze fMLP ve Alexa594 karışımı hazırlanmış 30 ul bir mikropipet dolgu.
- , Istikrarlı bir degrade oluşturmak için mikropipet fMLP / Alexa594 çözümü serbest bırakmak için bir sabit basınç sağlayan bir cihaz, bir mikroskop sahne üstüne monte edilmiş bir mikropipet sahibine mikropipet takın ve basınç besleme ünitesine boru bağlayın.
- Basınç kaynağı açın ve 70 hPa tazminat basıncı (Pc) ayarlayın.
- konfokal mikroskop ya da ona eşdeğer floresan mikroskop 40X petrol lensin üzerinden PKD1-GFP ifade HL60 hücreleri ile seribaşı 1-iyi odacıklı lamel monte edin.
- Aşağıdaki konfigürasyonda kanal modunda ayarlanabilir edinimi: GFP etiketli PKD1 için yeşil kanal (500-530 nm); kemoatraktan fMLP (Alexa594) kırmızı kanalı (580-620 nm); ve transyapışan HL60 hücrelerin belirlenmesi için hafif kanal sunulmamış.
- "Canlı" satın alma başlatın ve üç kanal için satın alma koşulları optimize: görüntüleme verileri kantitatif analiz için her kanalın yoğunluklarını ayarlamak; Her üç kanal için yoğunluğu ve lazer gücü arasındaki ince ayar en kaliteli görüntü elde etmek ve fotoğraf çamaşır suyu en aza indirmek için. Gerekirse, daha iyi görüntü kalitesi için her 2 ila 4 kare ortalama. Biz genellikle bir 1 sn aralığı kullanınız.
- "Canlı" satın alma başlatın ve GFP görünümü ve iletilen ışık kanallarda güçlü PKD1-GFP ifade hücreleri yapıştırmak için arayın. FMLP degrade görselleştirmek için aydınlık alan optik, merkezi görünümünde (Şekil 4A) merkez alanında mikropipet kullanılarak ve PKD1-GFP ifade yapışan HL60 hücreleri.
- time-lapse edinimi seçmek ve 100 elde etmek 2 sn aralıklarla ve kare sayısı aralıklarını ayarlayın.
NOT: Her t topladıktan sonraime-lapse serisi, isim ve daha fazla veri analizine tabi olacak verileri kaydetmek.
Sonuçlar
Birden fazla HL60 hücrelerin kemotaksisi eş zamanlı görüntülenmesi hücre hareketlilik analizi cihazı kullanılarak
Bir gradyan 1 dakika içinde oluşturulan 5 dakika içinde stabilize ve 2 saat boyunca devam: Mikroakiskan 16 ilkesine dayanarak, üretici geçişlerini simüle profillerini sağlamıştır. Mikroakiskan tarafından üretilen kararlı geçişlerini son derece öngörülebilir profilleri birden fazla kemotaksis deneyleri aynı anda yapılmasını sağlar. Bu çalışmada, biz aynı anda üç kemotaksis deneyleri (Şekil 2A ve Film 1) gözlemledi. Biz kemoatraktan kemoakraktan kuyuya enjekte edildikten sonra HL60 hücrelerinin hemen chemotaxing başladı bulundu ve degrade istikrar için simülasyon sonuçları ile tutarlı takip eden 60 dakika boyunca düz bir yolda chemotaxing tuttu. seyahat yolu ve morfolojisi izlemehücrelerin nicel ölçüm ve hücreleri (Şekil 2B) 'nin toplam yol uzunluğuna, hız, yönlülük ve yuvarlaklık içeren bir kemotaksis dizini kullanarak kemotaksis davranışlarının daha sonra karşılaştırılmasını sağlar. Toplam yol uzunluğu yolunun sentroidler birleştiren hat kesimlerinin uzunlukları toplamıdır. Hız zaman toplam yol uzunluğuna bölünmesiyle elde edilir. toplam yol uzunluğuna bölünmesiyle (Y yolun sonuna koordinatı eksi Y başından koordinatı): Directionality yukarı ölçülür ve olarak tanımlanır. Bu doğrudan yukarı doğru hareket eden bir nesne için 1.0 veriyor. Hücrenin yuvarlaklığı çevre belirli bir miktarının açıklıktan kadar etkin (yüzde olarak) bir ölçüsüdür. Bir daire herhangi bir çevre için en büyük alana sahip ve% 100 yuvarlaklık parametresi vardır. Düz bir çizgi hiçbir alanı kapsayan ve% 0 bir yuvarlaklık parametresi vardır. Seçilen kemotaksi parametreleri tarafından açıklandığı gibi kantitatif ölçülen kemotaksi davranışı göstermek(Şekil 2C).
Bir spatiotemporally görebilir ve kontrol fMLP uyaran altında HL60 hücrelerinde PKD hücre içi lokalizasyonu izleme
Deneysel bir sisteme floresan etiketli uygulamak için büyük bir teknik ilerleme ve kontrol kemoatraktan stimülasyon olduğunu. Tarihsel olarak, hücre yanıtı ve davranışlarını gözlemlemek için homojen (diğer adıyla üniforma) stimülasyon ya da degrade stimülasyon ya uyguladık. Ancak, "kör" uyarılması teşvik hücrelerine ulaştığı konusunda hiçbir zamanmekansal bilgi sağlamakla kalmaz, aynı zamanda biz uyaran görmüyorum, çünkü stimülasyon hücre yanıtının herhangi bir "anormal" gözlemlere şüphelidir. Daha önce bu floresan boya (Alexa594) göstermiştir kemoatraktan konsantrasyonu ve m arasında doğrusal bir ilişki kurmak için kemoatraktan ile uygulanabilirgerdiricileriyle floresan boya yoğunluğu 15. Yeşil floresan proteini (GFP), floresan boya (Alexa594) ve aktarılan ışık kırmızı emisyonu bir alıcı konfigürasyonu ile, yapışan hücreler, uyarıcı uygulanmasını ve uyarıcı hücre yanıtını izlemek mümkün (Şekil Şekil 3A). Protein kinaz D yönlendirilmiş hücre migrasyonu 9,17 temel rol oynayan serin / treonin kinazlar ailesidir. Buna karşılık eşit bir şekilde uygulanan fMLP (kırmızı) stimülasyon, HL60 hücrelerinin GFP etiketli protein kinaz D1 (yeşil) sağlam bir membran translokasyonu (Şekil 3B ve Film 2) aracılık ettiği. Bir fMLP gradyanı (kırmızı) (Şekil 4A) olarak, HL60 hücreleri aktif ön kenarı (Şekil 4B ve Film 3) için PKD1 işe. ileri ucun çıkıntı GFP hücre içi lokalizasyonu yakın bir karşılaştırma PKD1 (hücum kenarı arkasındaki lokalize olduğunu gösterirŞekil 4C).
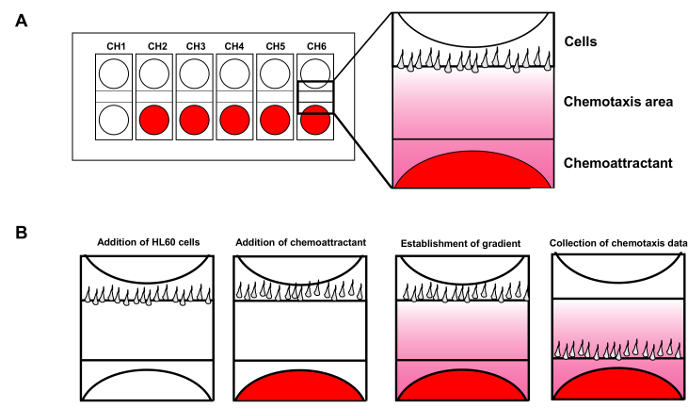
Şekil 1. Hücre hareketlilik analiz cihazı 6 eşzamanlı kemotaksis deneyleri izin verir. (A) Şema 6 bağımsız kemotaksis deneyleri eşzamanlı izlenmesi için bir hücre hareketliliği analiz cihazı çip tasarımını göstermektedir. Kırmızı gösterileri oyuklara ilave kemoatraktan. Hücrelerin kuyulara HL60 hücrelerinin (B) Giriş kemoatraktan sürekli fMLP degrade kurmak için yayılır iken. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
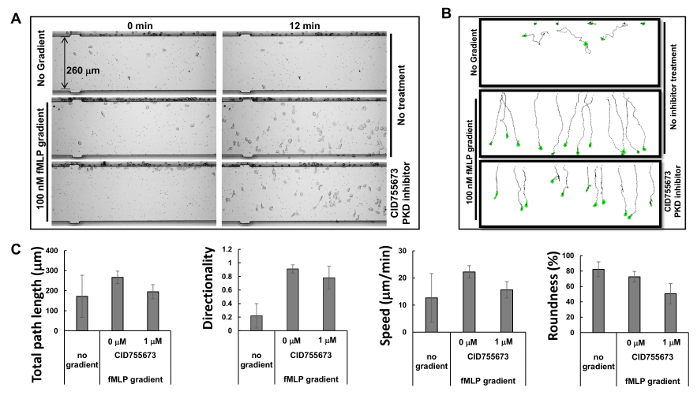
HL60 hücreleri ile çoklu kemotaksis deneyleri Şekil 2. Eşzamanlı izleme. (A ) Montaj hücre hareketliliği analiz cihazı kemotaksis testinde görüntüleri PKD özgü 0 zamanlarda kemotaksi üzerinde inhibitörleri ve degrade uygulamadan sonra 12 dakika inhibitör etkilerini incelemek gösterir. Kemotaktik HL60 hücrelerinin 30 dakika boyunca PKD önleyicisi 1 uM CID755673 ile ön muamele edilmiştir. veya PKD inhibitörünün tedavi olmadan HL60 hücrelerinin RPMI1640 açlıktan ortamı ya da 12 dakika süre ile, 100 nM fMLP gradyanları ya chemotax bırakılmıştır. (B) Şema takip HL60 hücrelerinin gezi yol uzunluğu ve şekil gösterir. Toplam yol uzunluğu, hız, yönlülük ve yuvarlaklık olarak kemotaksis (C) miktarının belirlenmesi. SD gösterilen ortalama ±; n = CID755673 tedavi ile hiçbir gradyan, fMLP degrade CID755673 tedavi olmadan ve fMLP tedavisi için 10, 12 ya da 11, sırasıyla. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
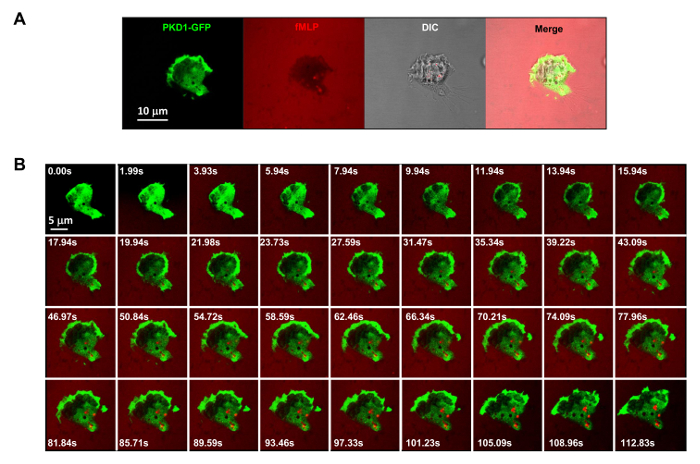
Şekil 3. muntazam uygulanan fMLP uyarıcıya tepki olarak PKD1 sağlam membran translokasyonu GPCR aracılı (A). PKD1-GFP (yeşil) çok kanallı izleme, kemoatraktan (1 uM fMLP 0.1 ug ile karıştırılır / ml fluoresan boya Alexa 594, kırmızı) ve DIC (diferansiyel-interferans-kontrast) RPMI 1640 ortamında% 0.2 jelatin ile kaplanmış bir 4well bölmesinin bir kuyuda yapışan HL60 hücreleri tanımlamak için. Ölçek çubuğu 10 mikron =. (B) Montaj eşit uygulamalı fMLP (kırmızı) PKD1-GFP (yeşil) sağlam membran translokasyonu uyardığını göstermektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
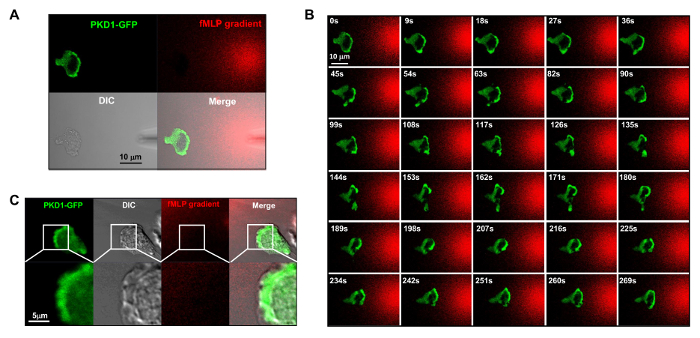
FigürHL60 hücreleri chemotaxing içinde PKD1 e 4. Öncü kenar yerelleştirme. (A) Kanal modu toplama yapılandırma fMLP degrade görselleştirme ve PKD1 uzaysal dinamiklerini kolaylaştırır. A - C, HL60 hücreleri geçici GFP etiketli PKD1 ifade; Mikropipet (DIC), 100 nM fMLP (Kırmızı) elde fMLP gradyanı görselleştirmek için 0.1 ug / ml fluoresan boya Alexa 594 (B) 'chemotaxing hücresi ön kenarında PKD1 zenginleştirilmiştir lokalizasyonu ile karıştırıldı. Ölçek çubuğu 10 mikron =. (C) birleştirilmiş ve görüntüler PKD1 HL60 hücrelerinde ileri ucun arka lokalize olduğunu göstermektedir. Yeşil PKD1 hücresel yerleşimi gösterir ve DIC görüntü ön kenarı çıkıntılı alanı gösterir. Ölçek çubuğu = 5 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Bu çalışmada, biz kemotaksis deneyleri iki örnek gösterir: hücre hareketliliği analiz cihazı ile çok sayıda kemotaksis deneyleri ilk eş zamanlı izleme; ve ikinci, kemoatraktan degrade görüntüleme ve gerçek zamanlı olarak aynı hücrelerde sinyal olaylarının uzaysal dinamikleri.
Aynı anda birden çok kemotaksis deneyleri için hücre hareketliliği analiz cihazı
Bu çalışmada, biz bir hücre hareketlilik analizi cihazı kullanılarak aynı anda birden çok kemotaksis analizleri gerçekleştirmek için ayrıntılı bir protokol tanıttı. Bu cihaz, kullanıcının, geleneksel parlak alan gözlem 10X objektif lens ile hücresel kemotaksis davranışlarını gözlemlemek için izin verir. Çünkü sıvı akışına difüzyon baskın özellikleri hücre hareketliliği analiz cihazı kolaylıkla tahmin edilebilir ve sabit bir geçişlerini oluşturan ve aynı zamanda gerçekleştirilebilir altı kemotaksis deneyleri izin verir. protokol kritik adımlarGüvenilir geçişlerini elde etmek ve teras hattında hücreleri hizalamak için. kullanıcı kesinlikle chemoattractants ve hücrelerin tutucu montaj ve enjeksiyon için üreticinin talimatlarını izlemelidir. Detaylı talimatlar da online olarak mevcuttur. Alternatif kemotaksis yöntemleri 11-13,15 ile karşılaştırıldığında, bu cihaz önemli derecede kemotaksis deneyleri etkinliğini ve güvenilirliğini artırır. ebatlarında hücre hareketlilik analiz cihazı çip dört boyutları 4, 5, 6, ve 8 mikron farklı tip ve hücrelerin boyutları karşılamak için kullanılabilir. Bir 4 ya da 5 mikron hücre hareketliliği analiz cihazı çip HL60 ve D için uygun olduğunu bulduk yaklaşık 10-15 um çapı olan discoideum hücreleri. Bununla birlikte, tek bir kısıtlama, bu cihaz, tüm hücre tipleri için uygun değildir olmasıdır. Biz Raw267.4 hücreleri ile hücre hareketliliği analiz cihazı kemotaksis testi kullanılarak küçük başarı vardı. nedeni Raw267.4 hücreleri çok yavaş göç olabilir. verimli che için gerekli süreRaw267.4 hücrelerinin motaxis gradyan cihazı tarafından tutulan bir süre daha uzun olabilir. Bunun yerine, bir Transwell göç tahlil Raw267.4 hücreleri 9 için çalıştı. Başka bir sınırlama floresan gözlem mevcut cihaz ile mümkün olmamasıdır. Bir gelecekteki yönünü daha yüksek büyütme ile floresan görüntüleme izlemektir. Bu floresan tespiti ve 100X objektif lens ile donatılmış gelişmiş hücre hareketlilik analizi cihazı ile mümkündür. Buna ek olarak, aynı anda deneylerin sayısı da Bütün bu gelişmeler kemotaksis deneyleri geliştirilmiş verim ve hücreleri göç eden hücre içi dinamiklerinin gözlemeyi kolaylaştırmak 12'ye artırılır.
HL60 hücrelerinin yüksek transfeksiyon verimi floresan protein etiketli proteini ifade etmek üzere
HL60 hücrelerinin aktif bir şekilde bölünmesi lösemi hücre hattı ve süspansiyon içinde büyür. Daha önce 18-20 bildirdiği gibi, HL60 hücrelerinin g dirençliene transferi. Hem yağ ve elektroporasyon gibi gen transferi test edilmiştir ve elektroporasyon çünkü sonra elektroporasyon kaynaklanan ciddi hasar yüksek transfeksiyon verimi elde etmek için kritik olan, yüksek canlılığı elde bölüm 4'de ayrıntılı olarak anlatıldığı gibi daha yüksek transfeksiyon verimi, elektroporasyon ile elde edilmiştir. Daha sonra, tam ve nazik hücre işleme, özellikle elektroporasyon sonra, gereklidir. Tüm ortam önceden ısıtılmış ve yavaşça Elektroporasyon işleminden sonra herhangi bir adımda hücrelere ilave olması gerekir. Ayrıca, elektroporasyon reaktif hücrelerin maruz kalma süresini en aza indirmek için önemlidir. Hücre ölümünü önlemek için, Elektroporasyon işleminden sonra RPMI 1640 elektroporasyon geri kazanım aracı, hemen hücrelere ilave edilmelidir. Bu geri kazanım ortamı içinde% 20 FBS,% 10 FBS çok daha yüksek bir hücre elde oranı verir bulundu. Elektroporasyondan sonra, 30 dakika süre ile RPMI 1640 elektroporasyon geri ortamında kuluçka daha canlılığı ve transfeksiyon için kritiktirverimlilik. daha da transfeksiyon verimini artırmak için, üretici tarafından tavsiye edilen plazmid neredeyse iki katı kadardır transfeksiyon başına 4 ug plazmit DNA kullanılır.
Protein ifade fanilik ve hücre sayısı sınırı (transfeksiyon başına 2 x 10 6 hücre): elektroporasyon transfeksiyon iki büyük sınırlamalar vardır. vektör plasmidi, her hücre bölünmesi sonrası yarıya seyreltilir yana farklılaşmamış hücreler, ekspresyon, sadece cep bölümleri ilk çift sırasında tespit edilebilir. farklılaşmış HL60 için hücreler fazla 48 saat hayatta. Bunun bir sonucu olarak, herhangi bir deneme, taze Transfeksiyonlar deney öncesinde 6 saat gerektirir. bir elektroporasyon için hücre sayısı sadece herhangi bir biyokimyasal deneyleri için asgari gereksinimi karşılar. tekrar kullanım veya büyük miktarda amaç için, güçlü bir şekilde farklılaşmamış HL60 hücre çizgisi kararlı bir şekilde ilgi WHI proteini eksprese tespit edilmesi önerilmektedirBir viral vektör, mevcut ya da imal edilebilir, eğer kanal, bir viral vektör ile floresan protein etiketlenmiş.
Açıklamalar
The authors declare no competing financial interest for this work.
Teşekkürler
This work is supported by the intramural fund of NIAID, NIH.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium GlutaMAX | Life technologies | 61870-036 | |
| Sodium pyruvate | Thermo Fisher Scietific | 11360-070 | |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| 1 M HEPES sterile solution, pH 7.3 | Quality Biological Inc. | A611-J848-06 | |
| Penicillin streptomycin solution | Fisher Scientific | 15140122 | |
| NucleofectorTM 2b | Lonza | AAB-1001 | |
| AmaxaTM Cell Line NucleofectorTM Kit V including NucleofectorTM Solution, Singe use pipettes, AmaxaTM certified 100 ml aluminum electrode cuvettes | Lonza | VCA-1003 | |
| Lab-Tek chambered #1.0 Borosilicate Coverglass | Nalge Nunc International Inc | 155383 | |
| 2% Gelatin solution | Sigma-Aldrich | G1393 | |
| Fibronectin | Sigma-Aldrich | F1141 | |
| HBSS (Hanks’ Balanced Salt Solution) | Life technologies | 14025-076 | |
| Bovine serum albumin | Sigma-Aldrich | A3803 | |
| Single well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155361 | |
| Four-well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155383 | |
| Alexa 594 | Thermo Fisher Scientific | A-10438 | |
| fMLP | Sigma -Aldrich | F3506-5MG | |
| Cover glass thickness (2) 22 mm x 22 mm | Corning | 2855-22 | |
| EZ-TAXIScan | Effector Cell Institute, Inc. | MIC-1001 | |
| EZ-TAXIScan chip (5 mm) | Effector Cell Institute, Inc. | EZT-F01-5 | |
| 1701RN 10 μl syringe | Hamilton | 80030 | |
| Femtotips II Injection tips | Eppendorf | 5242956003 | |
| Femtotips II | Eppendorf | 930000043 | |
| TransferMan NK2, including motor module, X head with angle adjuster, and Positioning aids. | Eppendorf | 5188900056 | |
| DIAS software | Solltech Inc. | ||
| LSM 780 META or equivalent confocal microscope with a 40X 1.3 NA or 60X 1.4 NA oil DIC Plan-Neofluar objective lens | Carl Zeiss |
Referanslar
- Pocha, S. M., Montell, D. J. Cellular and molecular mechanisms of single and collective cell migrations in Drosophila: themes and variations. Annual review of genetics. 48, 295-318 (2014).
- Wen, Z., Zheng, J. Q. Directional guidance of nerve growth cones. Current opinion in neurobiology. 16, 52-58 (2006).
- Bravo-Cordero, J. J., Hodgson, L., Condeelis, J. Directed cell invasion and migration during metastasis. Current opinion in cell biology. 24, 277-283 (2012).
- Zigmond, S. H. Chemotaxis by polymorphonuclear leukocytes. The Journal of cell biology. 77, 269-287 (1978).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, receptors and human disease. Cytokine. 44, 1-8 (2008).
- Dong, X., et al. P-Rex1 is a primary Rac2 guanine nucleotide exchange factor in mouse neutrophils. Current biology : CB. 15, 1874-1879 (2005).
- Li, Z., et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell. 114, 215-227 (2003).
- Van Haastert, P. J., Devreotes, P. N. Chemotaxis: signalling the way forward. Nature reviews: Molecular cell biology. 5, 626-634 (2004).
- Xu, X., et al. GPCR-Mediated PLCbetagamma/PKCbeta/PKD Signaling Pathway Regulates the Cofilin Phosphatase Slingshot 2 in Neutrophil Chemotaxis. Mol Biol Cell. , (2015).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of experimental medicine. 115, 453-466 (1962).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of cell biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of cell science. 99 (Pt4), 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PloS one. 5, e15309(2010).
- Bozzaro, S., Fisher, P. R., Loomis, W., Satir, P., Segall, J. E. Guenther Gerisch and Dictyostelium, the microbial model for ameboid motility and multicellular morphogenesis. Trends in cell biology. 14, 585-588 (2004).
- Xu, X., Jin, T. Imaging G-protein coupled receptor (GPCR)-mediated signaling events that control chemotaxis of Dictyostelium discoideum. Journal of visualized experiments : JoVE. , (2011).
- Lin, F., et al. Generation of dynamic temporal and spatial concentration gradients using microfluidic devices. Lab Chip. 4, 164-167 (2004).
- Eiseler, T., et al. Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology. 11, 545-556 (2009).
- Roddie, P. H., Paterson, T., Turner, M. L. Gene transfer to primary acute myeloid leukaemia blasts and myeloid leukaemia cell lines. Cytokines Cell Mol Ther. 6, 127-134 (2000).
- Schakowski, F., et al. Novel non-viral method for transfection of primary leukemia cells and cell lines. Genet Vaccines Ther. 2, 1(2004).
- Uchida, E., Mizuguchi, H., Ishii-Watabe, A., Hayakawa, T. Comparison of the efficiency and safety of non-viral vector-mediated gene transfer into a wide range of human cells. Biol Pharm Bull. 25, 891-897 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır