Method Article
Evaluación de la función bioenergética en las células endoteliales vasculares cerebrales
En este artículo
Resumen
mitocondrias de las células endoteliales son críticos para mantener la integridad-barrera hematoencefálica. Introducimos un protocolo para medir la función bioenergética en las células endoteliales vasculares cerebrales.
Resumen
La integridad de la barrera sangre-cerebro-barrera (BBB) es crítica para evitar la lesión cerebral. endotelial vascular cerebral células (CVE) son uno de los tipos de células que componen la acreditación; estas células tienen una demanda muy alta de energía, lo que requiere la función mitocondrial óptimo. En el caso de la enfermedad o lesión, la función mitocondrial en estas células puede ser alterada, lo que resulta en la enfermedad o la apertura de la BBB. En este manuscrito, presentamos un método para medir la función mitocondrial en células CVE mediante el uso de células intactas, enteros y un Bioanalyzer. Un ensayo de mito-estrés se utiliza para desafiar a las células que han sido perturbados, ya sea física o químicamente, y evaluar su función bioenergética. Además, este método también proporciona una forma útil para detectar nuevas terapias que tienen efectos directos sobre la función mitocondrial. Hemos optimizado la densidad celular necesario para producir tasas de consumo de oxígeno que permiten el cálculo de una variedad de para mitocondrialmetros, incluyendo la producción de ATP, la respiración máxima, y la capacidad disponible. También ponen de manifiesto la sensibilidad del ensayo mediante la demostración de que la introducción del microARN, miR-34a, conduce a una disminución pronunciada y detectable en la actividad mitocondrial. Mientras que los datos que se muestran en este trabajo se ha optimizado para la línea celular bEnd.3, también hemos optimizado el protocolo para las células CVE primarios, lo que sugiere la utilidad en modelos preclínicos y clínicos.
Introducción
Es un hecho ampliamente reconocido que la sangre-cerebro-barrera (BBB) formada por las células endoteliales vasculares cerebrales (CVE) tiene funciones muy distintas y únicas primordiales de la biología vascular. Estas células endoteliales usan mitocondrias para generar la mayor parte del suministro celular del trifosfato de adenosina (ATP) como una fuente de energía química. Además de proporcionar ATP para las células CVE, las mitocondrias regulan diversos procesos celulares en las células endoteliales vasculares, tales como celular de señalización 1-4, apoptosis 5, y el control del ciclo celular y el crecimiento celular 6. Desregulación de la función bioenergética mitocondrial en células CVE puede afectar a la biogénesis mitocondrial, lo que lleva al deterioro de la actividad del endotelio vascular, y exacerbar las enfermedades cerebrovasculares y enfermedades neurodegenerativas, por ejemplo, accidente cerebrovascular 7,8 y la enfermedad de Alzheimer (AD) 9. Hemos demostrado que los insultos a las células tras la exposición a CVE lipopolysacsacárido (LPS) altera la función mitocondrial en células CVE y empeorar los resultados de carrera 7. Terc-butilhidroquinona (TBHQ) aumenta la mortalidad accidente cerebrovascular al interferir con la fosforilación oxidativa en las células CVE 10. Por lo tanto, el modelo cuantitativo de la función bioenergética en las células CVE no sólo a los pilotos una serie de estudios relacionados con el mecanismo para el sistema nervioso central (SNC), sino que también ofrece un gran avance en la detección de drogas de productos terapéuticos dirigidos función mitocondrial en la biología vascular.
mitocondrias aisladas se han utilizado para medir la función bioenergética. Nos 7 y otras 11 han informado de las evaluaciones de la bioenergética celular en células intactas CVE mediante el uso de un Bioanalyzer flujo extracelular. El analizador proporciona la ventaja de evaluación bioenergética celular endógeno. Este ensayo sensible y consistente mide el metabolismo mitocondrial de las células CVE y se puede utilizar para evaluar el deterioro bioenergético por STImuli, investigar los mecanismos de vías de señalización mitocondrial, y las drogas de pantalla o tratamientos que afectan a la función mitocondrial en células CVE. La tasa de consumo de oxígeno (OCR) es registrada por el Bioanalyzer utilizando un enfoque de perfiles farmacológicos mediante la combinación del uso de cuatro disruptores mitocondriales: oligomicina, cianuro-4 (trifluorometoxi) carbonilo fenilhidrazona (FCCP), rotenona, y antimicina A. En este protocolo, detallamos un enfoque optimizado que permite la medición y el cálculo de los parámetros funcionales mitocondriales en células CVE, incluyendo respiración basal mitocondrial, la producción de ATP, de fugas de protones, la respiración máxima, y la capacidad respiratoria de repuesto, en un único ensayo.
Protocolo
NOTA: El esquema del protocolo se muestra en la Figura 1, que incluye una línea de tiempo de los procedimientos.
1. La cultura y el paso de las células CVE
- Células de cultivo CVE (células bEnd.3) en medio de crecimiento completo (alto contenido de glucosa de Dulbecco Modificado de Eagle Medium, DMEM) complementado con 10% de suero bovino fetal (FBS) y 1% de penicilina / estreptomicina en una T75 cm matraz de cultivo de tejido 2. Crecer a 37 ° C en una incubadora de CO2 al 5%.
- Retirar y desechar el medio de cultivo celular. Enjuagar la capa de células con solución de EDTA 0,25% de tripsina-0,03%, y a continuación, añadir 1 - 2 ml de solución de tripsina-EDTA al matraz y mantener el matraz a 37 ° C durante 3-5 min. Observar las células bajo un microscopio invertido hasta que se separa la capa de células. Añadir 10 ml de medio de cultivo completo y aspirar las células pipeteando suavemente.
- Decantar el fluido y las células en un tubo de centrífuga de 15 ml y centrifugado a 700 xg durante 5 min para eliminar restos celulares.
- Descartar el sobrenadante del tubo de centrífuga. Añadir 10 ml de medio de cultivo completo y volver a suspender el sedimento celular. Girar las células a 700 xg durante 5 min.
- Descartar el sobrenadante del tubo de centrífuga. Vuelva a suspender el sedimento celular en medio de crecimiento completo a una concentración de 2,0 x 10 5 células / ml (determinado por recuento usando un hemocitómetro; excluir las células muertas mediante tinción con azul de tripano).
NOTA: Las células descongeladas recién-son sub-cultivaron durante al menos 3 pasajes para los experimentos.
2. Semillas y tratar las células en placas de cultivo celular
- Se siembran las células en una placa de cultivo celular de flujo extracelular de 96 pocillos: 80 l / pocillo. Coloque la placa de cultivo celular a 37ºC en un incubador de CO2 al 5%. Nota: 16 × 10 3 células por pocillo se alcance el 60 - 80% de confluencia dentro de las 24 h.
- Si las células están siendo expuestos a una sustancia química, añadir los tratamientos una vez que las células están unidas a la placa inferior (8 - 24 h después de vertimbre).
NOTA: Para los experimentos de transfección, no añadir antibióticos en medio de crecimiento completo.
3. Evaluación de la función mitocondrial Usando el Bioanalyzer
- Antes del comienzo del ensayo, hidratar un cartucho de sensor de flujo extracelular con calibrante mediante la adición de 150 l de solución extracelular flujo calibrante a la placa y la incubación de O / N a 37 ° C sin CO 2.
- El uso de la estación de lavador de placas, cambiar el medio de cultivo celular en pH 7,0 extracelular flujo medio de ensayo. Se incuban las células a 37 ° C sin CO 2 durante 30 - 60 min.
- Preparar soluciones de trabajo de 8 oligomicina M, 4,5 M FCCP, rotenona 10 mM y 10 mM antimicina A en DMEM. Carga de 25 l de la solución madre en los puertos de inyección del cartucho: Puerto A, oligomicina; Puerto B, FCCP; El puerto C, rotenona y antimicina A con medio de ensayo de flujo extracelular. Implementar el protocolo de ensayo como se describe en la Tabla 1.
- Cargar el cartucho hidratado en el Bioanalyzer y realizar la calibración haciendo clic en el botón "Inicio". Después de la calibración, retire la placa inferior del cartucho y la carga de la placa de celda haciendo clic en el símbolo "Descargar Cartucho". Continuar el ensayo hasta el final de todas las mediciones.
- Abra el archivo de datos y obtener los valores de la velocidad de la Bioanalyzer. Exportar los datos a un archivo de hoja de cálculo.
4. Análisis de datos
NOTA: Los cálculos para los análisis de datos se formulan a continuación. Los valores se obtienen del instrumento Bioanalyzer como el OCR presenta en la Figura 2.
- Para el cálculo de la respiración basal, reste la respiración mitocondrial (no medidas 10 - 12) con respecto al valor basal (medida 3).
NOTA: la respiración basal = Basal - la respiración mitocondrial no ③ = Tasa - Tasa ⑩ ~ ⑫. - Para el cálculo de Producciones de ATPen, restar la vinculada respiración-ATP (mediciones de 4 - 6) a partir del valor basal (medición 3).
NOTA: la producción de ATP = Basal - ATP ligado a la respiración = Tasa ③ - Tasa ④ ~ ⑥. - Para calcular la respiración máxima, restar la respiración no mitocondrial (medidas 10 - 12) de la respiración máxima (medidas 7 - 9).
NOTA: la respiración máxima = máximo la respiración - la respiración mitocondrial no = Tasa ⑦ ⑨ ~ - ~ Tasa ⑩ ⑫. - Para calcular la capacidad de repuesto, restar el valor basal (medida 3) de la respiración máxima (mediciones 7 - 9).
NOTA: Spare capacidad de respiración máxima = - = Tasa Basal ⑦ ⑨ ~ - Tasa ③. - Para el cálculo de la fuga de protones, reste la respiración mitocondrial no (medida 10 - 12) de la vinculada respiración-ATP (medición 4).
NOTA: fugas de protones = ligada a la respiración ATP - no mitocondriasl = Tasa de respiración ④ - Tasa ⑩ ~ ⑫.
Resultados
Para evaluar la función bioenergética de las células CVE en respuesta al estrés oxidativo, elegimos el microvascular cerebral línea celular murina endotelios bEnd.3, que muestra las mismas características de barrera comparativas como las células endoteliales microvasculares cerebral primario 12. Dado que la cinética y la intensidad relativa de la respuesta se varían entre los diversos tipos de células, la primera serie de experimentos fueron diseñados para obtener niveles de OCR medibles mediante la identificación del número óptimo de células bEnd.3 para utilizar en el ensayo para el perfil metabólico, se muestra en la Figura 2. Después de la evaluación, los datos se cuantifican y se presenta en la Figura 3. respiración basal, la respiración máxima, y la capacidad respiratoria de repuesto mostró una respuesta proporcional con la densidad celular. Sin embargo, la producción de ATP disminuye cuando se seleccionaron 64 × 10 3 células por pocillo, lo que sugiere que el cultivo de células sobre-confluente esno es adecuado para este experimento. Las densidades celulares óptimas se producen entre 8-32 × 10 3 células por pocillo, en base a la respuesta a los disruptores mitocondriales.
Para los experimentos posteriores, se utilizó una densidad de siembra de 16 × 10 3 células por pocillo para permitir la detección óptima de los cambios en OCR. El uso de 16 × 10 3 células por pocillo, observamos las respuestas esperadas en OCR y demostramos que el microARN miR-34a reduce la función mitocondrial en células CVE (Figura 4). Hemos informado anteriormente de que el miR-34a reduce la fosforilación oxidativa en estas células 13. Los repetidos experimentos también mostraron que la respiración máxima y la capacidad de reserva se redujo significativamente por la sobreexpresión de miR-34a en CVEs a las 24 h después de la transfección, aunque la respiración basal, la producción de ATP, y la fuga de protones no tuvo cambios significativos (Figura 4) . Estos datosdemostrar la sensibilidad de la Bioanalyzer para detectar cambios en la función mitocondrial en CVEs.
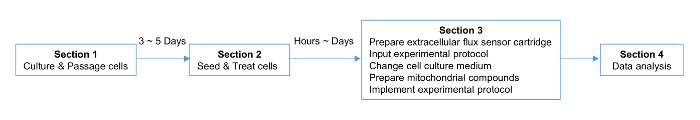
Figura 1. Planificación Estratégica para el experimento. El plazo para la célula, la placa, y la preparación del cartucho se indica. Haga clic aquí para ver una versión más grande de esta figura.
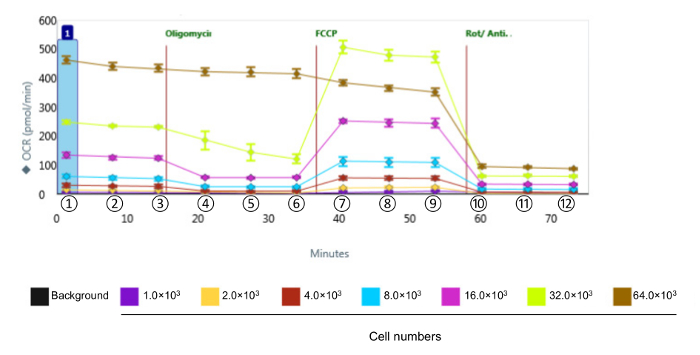
Figura 2. Representante de datos sin procesar de la función bioenergética en células CVE con diferentes densidades de células. Tasas de consumo de oxígeno se midieron en células CVE con diferentes densidades de células. Los datos representan la media ± SD (n = 5); OCR: Tasa de consumo de oxígeno; FCCP: carbonil cianuro-4- (trifluorometoxi) fenilhidrazona; Rot / Anti-A: rotenona y antimicina A. ①, ② y ③ indican respiración basal; ④, ⑤ y ⑥ indican ATP vinculado respiración; ⑦, ⑧ y ⑨ indicar máximo la respiración; ⑩, ⑪ y ⑫ indicar la respiración mitocondrial no. Haga clic aquí para ver una versión más grande de esta figura.
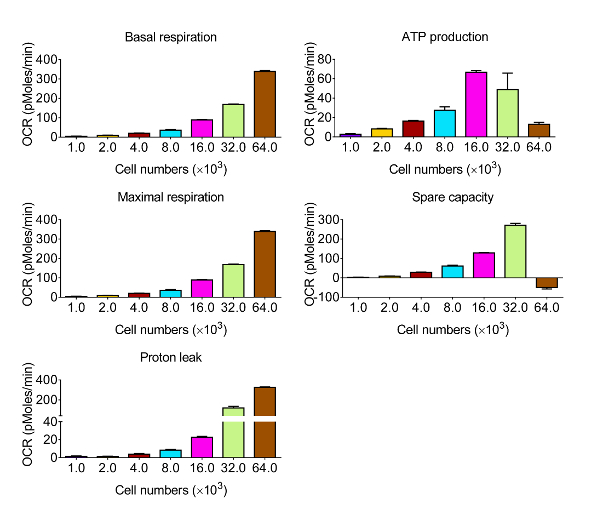
Figura 3. Los resultados representativos de la función bioenergética en células CVE con varias densidades celulares. Respiración basal, la producción de ATP, la respiración máxima, y la capacidad disponible se calculan a partir de los datos brutos generados por la bioenergética ensayo funcional en la figura 2, utilizando las fórmulas indicadas en la Sección 4 . Los datos representan la media ± SD (n = 5); OCR: Tasa de consumo de oxígeno. f = "http://ecsource.jove.com/files/ftp_upload/54847/54847fig3large.jpg" target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.
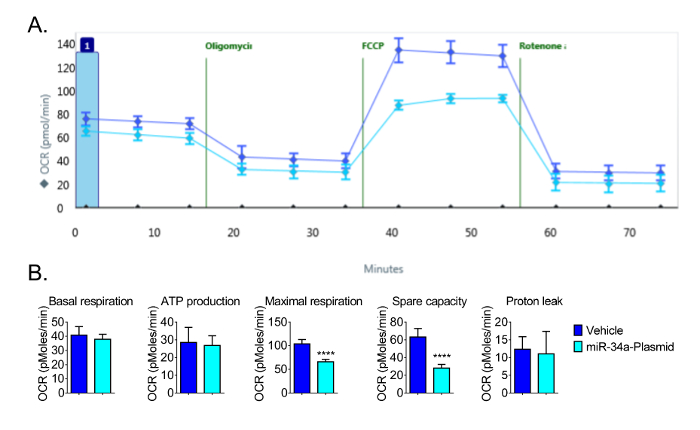
Figura 4: Los resultados representativos de la función bioenergética Disminución de miR-34a (A) Los datos en bruto de la función mitocondrial tras la sobreexpresión de miR-34a a las 24 h después de la transfección.. (B) la respiración basal, la producción de ATP, la respiración máxima, y la capacidad disponible se calcula a partir de los datos brutos generados por la bioenergética ensayo funcional en la Figura 4A; los parámetros se calculan según las fórmulas indicadas en la Sección 4. La sobreexpresión de miR-34a reduce la función mitocondrial en las células CVE a las 24 h después de la transfección. Los datos representan la media ± SD (n = 5); OCR: Tasa de consumo de oxígeno. ****, P <0,0001.archivos / ftp_upload / 54847 / 54847fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Tabla 1. El Protocolo de ejecución del instrumento.
Discusión
Este protocolo representa un método para evaluar el fenotipo de bioenergético en las células endoteliales vasculares cerebrales. Sirve como un ensayo básico para la evaluación mitocondrial de las células endoteliales, y es óptimo para los experimentos diseñados para investigar los mecanismos de los estímulos que puedan afectar a la vía de señalización mitocondrial en células CVE. También proporciona un método para el ensayo de agentes terapéuticos potenciales para enfermedades asociadas-BBB-interrupción.
Los pasos críticos dentro del Protocolo
bioanalyzers de flujo extracelulares tienen la capacidad de medir OCR en tiempo real. En este ensayo, la identificación de la densidad celular apropiada es crítica. Si la densidad celular está por debajo de 8 × 10 3 células por pocillo, el OCR basal es demasiado baja para ser analizados (Figura 2 y Figura 3); Si la densidad de las células está por encima de 32 × 10 3 células por pocillo, las células no responden a la oligomicina o treatme FCCPNTS (Figura 2 y Figura 3). La densidad celular óptima para esta línea celular en nuestro modelo experimental es de 16 × 10 3 células por pocillo, lo que demuestra resultados replicables y la sensibilidad a los estímulos 7 y tratamientos 10,14. Si se utiliza un Bioanalyzer de 24 pocillos, las nuevas titulaciones de la densidad celular serían necesarios para el ensayo.
Está documentado que los CVE tienen un gran volumen de mitocondrias en comparación con otras células endoteliales o tipos de tejidos 15,16, lo que sugiere la necesidad de una mayor producción de energía y un menor número de células para medir el metabolismo de la bioenergética. Hemos probado varios tipos de células endoteliales cerebrales, tales como primario y inmortalizado las células endoteliales cerebrovasculares murinos 7 y inmortalizado las células endoteliales vasculares cerebrales humanos (datos no publicados). Estas células requieren densidades de células similares para llegar a la aceptable OCR (OCR respiración basal dentro de los 40 - 160 pmol / min paraPlacas de 96 pocillos y el 50 - 400 pmol / min para placas de 24 pocillos), cuando se realizó el ensayo de la bioenergética. Kaczara y col. Informaron que mide el metabolismo bioenergético en las células endoteliales de vena umbilical humana (HUVEC), que utilizan una mayor densidad celular 17.
Nuestro grupo no evaluó células de los vasos de otros tejidos u órganos. En teoría, el Bioanalyzer podría ser utilizado en cualquier tipo de célula, pero requiere la optimización del ensayo para la densidad celular, medio de cultivo celular, y las condiciones de cultivo (algunas células específicas pueden requerir placas recubiertas para crecer bien). Se requiere que los experimentos se han completado para garantizar la tasa de OCR está dentro del rango aceptable. Si el OCR en las células endoteliales de otros órganos es inferior a los CVE de cerebros, el aumento de la densidad de las células puede ayudar a conseguir dentro de un rango aceptable de OCR. Por otra parte, si las células no están utilizando la fosforilación oxidativa como su principal fuente de energía, el Bioanalyzer podría no ser una optimal ensayo.
El Bioanalyzer permite la interrupción secuencial de la cadena de transporte de electrones, basado en el orden en que se aplican los reactivos. En primer lugar, se aplica oligomicina, que inhibe V Complejo mitocondrial (ATP sintasa). En segundo lugar, FCCP, un desacoplador de electrones, se aplica, lo que conduce a la interrupción del gradiente de protones. Por último, la rotenona y antimicina A, que inhibe mitocondrial complejos I y III, respectivamente, se aplican a llevar a una inhibición total del flujo de electrones. El orden de exposición al fármaco es esencial, ya que los fármacos bloquean la reacción específica cadena de transporte electrónico, y los cambios secuenciales se puede medir para reflejar la función mitocondrial.
Modificaciones y solución de problemas
Para evaluar la respuesta a los estímulos mitocondrial en las células CVE, se recomienda que los estímulos se aplican a las células después de que las células se adhieren a la parte inferior de placa de cultivo celular (ver la línea de tiempose muestra en la Figura 1; por lo general toma al menos 6 h). Para obtener resultados reproducibles por los tratamientos, es extremadamente importante para mantener la densidad celular constante. Si pretratamientos están diseñados antes de la siembra de células, la densidad celular para cada pre-tratamiento debe ser cuidadosamente medido, con exclusión de las células muertas de la siembra. Si la transfección se incluye en el diseño experimental, consulte protocolo de transfección del fabricante. Demostrada en los datos presentados en la Figura 4, miR-34a se transfectó en las células CVE utilizando un kit de lipofectamina de transfección, que requiere un medio de cultivo celular antibióticos libres y una prueba de mito-estrés para evaluar los cambios en la función metabólica con la sobreexpresión de miR-34a . Las dosis de plásmido también se pueden optimizar, tal como se publicó anteriormente 13. Otro cambio que se puede hacer con el protocolo está cambiando las concentraciones de los reactivos. Una curva de valoración de oligomicina, FCCP, y / o la rotenona y antimicina A puede ser completed.
Además, si este ensayo se utiliza para alto rendimiento análisis de diversos fármacos, se sugiere incluir un ensayo paralelo para medir la viabilidad celular y la proliferación celular, que fue descrito en nuestras publicaciones anteriores 7,13. Los valores de OCR se ven afectados significativamente por el número de células (Figuras 2 y 3), y los ensayos de proliferación celular y la viabilidad se benefician de la normalización de los datos. Sin embargo, la realización de estos ensayos son a discreción de cada laboratorio.
Limitaciones de la Técnica
La principal limitación de este protocolo es que sólo se utilizó un modelo in vitro de la cultura en la celda en el estudio. Actualmente, no hay ex vivo modelos disponibles o modelos animales que pueden hacer frente a la función mitocondrial de las células endoteliales. Se espera que los nuevos modelos a desarrollar para la evaluación de la función bioenergética in vivo e ex vivo en los estudios futuros.
Otra limitación es la extensión de las evaluaciones de barrera siguientes las medidas bioenergética. Los experimentos no se pueden realizar debido a que, en primer lugar, después de la finalización de las mediciones bioenergéticos, la viabilidad celular se disminuye después de la interrupción completa de la cadena de transporte de electrones; En segundo lugar, se requieren placas e insertos de cultivo de células específicas para detectar valores de bioenergética y no encajan insertos para las evaluaciones de barrera. Por lo tanto, no hay muchos ensayos funcionales que se pueden completar después el ensayo de la bioenergética. Sin embargo, se espera que los dispositivos especiales pueden ser desarrollados para llevar a cabo ensayos funcionales antes del ensayo de la bioenergética.
Importancia de la Técnica en Materia de Métodos Alternativos / Existentes
Las técnicas anteriores para evaluar la función mitocondrial necesario el aislamiento de las mitocondrias de las células 18. esta new técnica usando el Bioanalyzer permite la medición de la actividad mitocondrial en las células intactas, que conserva más del entorno celular de la evaluación de mitocondrias aisladas.
Las aplicaciones futuras o llegar después de dominar esta técnica
Este protocolo está diseñado y desarrollado para la línea celular bEnd.3, pero también es compatible con las células endoteliales vasculares cerebrales primarios (PCVE) 7 u otra endotelio, y lo hemos demostrado en nuestra publicación anterior utilizando células PCVE 7. Cuando se utilizan otros tipos de endotelio, puede ser necesario el recubrimiento de la placa de cultivo y el uso de factores de crecimiento. Sin embargo, se recomienda el ensayo de valoración de otros tipos de células también. Este protocolo ofrece un método general que se adoptará en la evaluación de la bioenergética de células CVE, y se puede aplicar aún más a los estudios mecanismo o respuestas terapéuticas de esta manera.
Divulgaciones
The authors declare no potential conflicts of interest with respect to the research, authorship, and/or publication of this article. Open Access fees for this article were provided by Agilent Technologies.
Agradecimientos
This work was supported by the following grants: AHA 16SDG31170008 to X.R. and NIH P20 GM109098, P01 AG027956, and U54 GM104942 to J.W.S.
Materiales
| Name | Company | Catalog Number | Comments |
| bEnd.3 cell line | ATCC | CRL-2299 | 25 - 30 passages |
| Dulbecco's Modified Eagle's Medium (DMEM) | ATCC | 30-2002 | |
| Fetal Bovine Serum | Atlanta Biologicals | S12450 | 10% final concentration |
| Penicillin/Steptomycin | Hyclone | SV30010 | 1×100 stocking |
| 0.25% trypsin, 0.03% EDTA solution | Corning | 25-053-CI | |
| Sodium pyruvate | Corning | 25-000-CI | 1.0 µM final concentration |
| Glucose | Sigma | CAS 50-99-7 | 25 mM final concentration |
| Oligomycin | Sigma | O4876 | 1.0 µM final concentration |
| Carbonilcyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | 0.5 µM final concentration |
| Rotenone | Sigma | R8875 | 1.0 µM final concentration |
| Antimycin A | Sigma | CAS 1397-94-0 | 1.0 µM final concentration |
| Plate wash station | Seahorse Bioscience | ||
| Extracellular flux bioanayzer | Seahorse Bioscience | XFe96 | |
| Extracellular flux cell culture plate | Seahorse Bioscience | 102416-100 | |
| Extracellular flux sensor cartridge | Seahorse Bioscience | 102416-100 | |
| Extracellular flux calibrant solution | Seahorse Bioscience | 100840-000 | |
| Extracellular flux assay medium | Seahorse Bioscience | 102365-100 | PH buffered prior to assay |
Referencias
- Quintero, M., Colombo, S. L., Godfrey, A., Moncada, S. Mitochondria as signaling organelles in the vascular endothelium. Proc Natl Acad Sci U S A. 103, 5379-5384 (2006).
- Liu, Y., Li, H., Bubolz, A. H., Zhang, D. X., Gutterman, D. D. Endothelial cytoskeletal elements are critical for flow-mediated dilation in human coronary arterioles. Med Biol Eng Comput. 46, 469-478 (2008).
- Al-Mehdi, A. B., et al. Perinuclear mitochondrial clustering creates an oxidant-rich nuclear domain required for hypoxia-induced transcription. Sci Signal. 5, ra47 (2012).
- Mironov, S. L., Ivannikov, M. V., Johansson, M. [Ca2+]i signaling between mitochondria and endoplasmic reticulum in neurons is regulated by microtubules. From mitochondrial permeability transition pore to Ca2+-induced Ca2+ release. J Biol Chem. 280, 715-721 (2005).
- Sutendra, G., et al. The role of Nogo and the mitochondria-endoplasmic reticulum unit in pulmonary hypertension. Sci Transl Med. 3, 88ra55 (2011).
- Mitra, K., Wunder, C., Roysam, B., Lin, G., Lippincott-Schwartz, J. A hyperfused mitochondrial state achieved at G1-S regulates cyclin E buildup and entry into S phase. Proc Natl Acad Sci U S A. 106, 11960-11965 (2009).
- Doll, D. N., et al. Mitochondrial crisis in cerebrovascular endothelial cells opens the blood-brain barrier. Stroke. 46, 1681-1689 (2015).
- Ren, X., Simpkins, J. W. Deciphering the Blood-Brain Barrier Damage in Stroke: Mitochondrial Mechanism. J Neuroinfect Dis. S2, e002 (2015).
- Pun, P. B., Lu, J., Moochhala, S. Involvement of ROS in BBB dysfunction. Free Radic Res. 43, 348-364 (2009).
- Sun, J., Hu, H., Ren, X., Simpkins, J. W. Tert-butylhydroquinone compromises survival in murine experimental stroke. Neurotoxicol Teratol. 54, 15-21 (2016).
- Modis, K., et al. Cellular bioenergetics is regulated by PARP1 under resting conditions and during oxidative stress. Biochem Pharmacol. 83, 633-643 (2012).
- Brown, R. C., Morris, A. P., O'Neil, R. G. Tight junction protein expression and barrier properties of immortalized mouse brain microvessel endothelial cells. Brain Res. 1130, 17-30 (2007).
- Bukeirat, M., et al. MiR-34a regulates blood-brain barrier permeability and mitochondrial function by targeting cytochrome c. J Cereb Blood Flow Metab. 36, 387-392 (2016).
- Hu, H., et al. Mitochondrial Impairment in Cerebrovascular Endothelial Cells is Involved in the Correlation between Body Temperature and Stroke Severity. Aging Dis. 7, 14-27 (2016).
- Oldendorf, W. H., Cornford, M. E., Brown, W. J. The large apparent work capability of the blood-brain barrier: a study of the mitochondrial content of capillary endothelial cells in brain and other tissues of the rat. Ann Neurol. 1, 409-417 (1977).
- Oldendorf, W. H., Brown, W. J. Greater number of capillary endothelial cell mitochondria in brain than in muscle. Proc Soc Exp Biol Med. 149, 736-738 (1975).
- Kaczara, P., et al. Carbon monoxide released by CORM-401 uncouples mitochondrial respiration and inhibits glycolysis in endothelial cells: A role for mitoBKCa channels. Biochim Biophys Acta. 1847, 1297-1309 (2015).
- Bharadwaj, M. S., et al. Preparation and respirometric assessment of mitochondria isolated from skeletal muscle tissue obtained by percutaneous needle biopsy. J Vis Exp. (96), e52350 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados