Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Análisis cinemático de la división celular y la expansión: La cuantificación de la base celular del crecimiento y el desarrollo en las zonas de muestreo
* Estos autores han contribuido por igual
En este artículo
Resumen
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Resumen
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Introducción
Análisis del crecimiento depende de un conjunto de herramientas que se utilizan comúnmente por los científicos para describir la planta de genotipo determinado las diferencias de crecimiento y / o respuestas fenotípicas a factores ambientales. Incluyen mediciones de tamaño y peso de la planta entera o un órgano y los cálculos de las tasas de crecimiento para explorar los mecanismos subyacentes de crecimiento. el crecimiento de órganos se determina por la división celular y la expansión a nivel celular. Por lo tanto, incluyendo la cuantificación de estos dos procesos en el crecimiento de los análisis es clave para entender las diferencias en el crecimiento conjunto de órganos 1. En consecuencia, es fundamental contar con una metodología adecuada para determinar los parámetros de crecimiento celular que es relativamente fácil de usar por los laboratorios no especializados.
Análisis cinemático ya se ha establecido como un enfoque que proporciona un marco de gran alcance para el desarrollo de modelos de crecimiento de órganos 2. La técnica ha sido optimizado para sistemas lineales,como las raíces de Arabidopsis thaliana y las hojas monocotiledóneas, sino también para sistemas no lineales, tales como hojas dicotiledóneas 3. Hoy en día, esta metodología se utiliza cada vez para estudiar cómo genéticos, hormonales, de desarrollo, y los factores ambientales influyen en la división celular y la expansión en varios órganos (Tabla 1). Por otra parte, también proporciona un marco para vincular los procesos celulares a sus regulaciones bioquímicos, moleculares y fisiológicos subyacentes (tabla 2), aunque las limitaciones pueden ser impuestas por el tamaño del órgano y la organización espacial de las técnicas que requieren una mayor cantidad de material vegetal (por ejemplo, metabolitos mediciones, proteómica, etc.).
Hojas monocotiledóneas, tales como el maíz (Zea mays) hoja, representan sistemas lineales en los que las células se mueven desde la base de la hoja hacia la punta, pasando secuencialmente a través de la zona de meristemas y la elongación para llegar a la madurazona. Esto hace que sea un sistema modelo ideal para los estudios cuantitativos de los patrones espaciales de crecimiento del 4. Por otra parte, las hojas del maíz tienen grandes zonas de crecimiento (meristemas y zona de elongación que abarcan varios centímetros 5) y ofrezcan posibilidades para estudios en otros niveles de organización. Esto permite la investigación de las (supuestas) mecanismos reguladores que controlan la división celular y la expansión, cuantificado por análisis cinemático a través de una serie de técnicas moleculares, las mediciones fisiológicas, y métodos de biología celular (Tabla 2).
A continuación, ofrecemos un protocolo para la realización de un análisis cinemático en las hojas de monocotiledóneas. En primer lugar, explicamos cómo llevar a cabo un análisis adecuado de tanto la división celular y elongación celular como una función de la posición a lo largo del eje de la hoja y la forma de calcular los parámetros cinemáticos. En segundo lugar, también muestran cómo se puede utilizar como base para el diseño de muestreo. A continuación, se discuten dos casos: de alta resolución de un muestreod centró toma de muestras, lo que permite la interpretación de datos mejorada y el ahorro de tiempo / dinero, respectivamente.
Tabla 1. Resumen de los análisis cinemático métodos para la cuantificación de la división celular y la expansión en varios órganos.
| Organo | referencia |
| hojas de monocotiledóneas | 16, 20, 21, 22 |
| puntas de las raíces | 2, 23, 24, 25, 26, 27, 28, 29 |
| hojas dicotiledóneas | 21, 30, 31 |
| disparar meristemo apical | 32 |
Tabla 1. Resumen de los análisis cinemático métodos para la cuantificación de la división celular y la expansión en varios órganos.
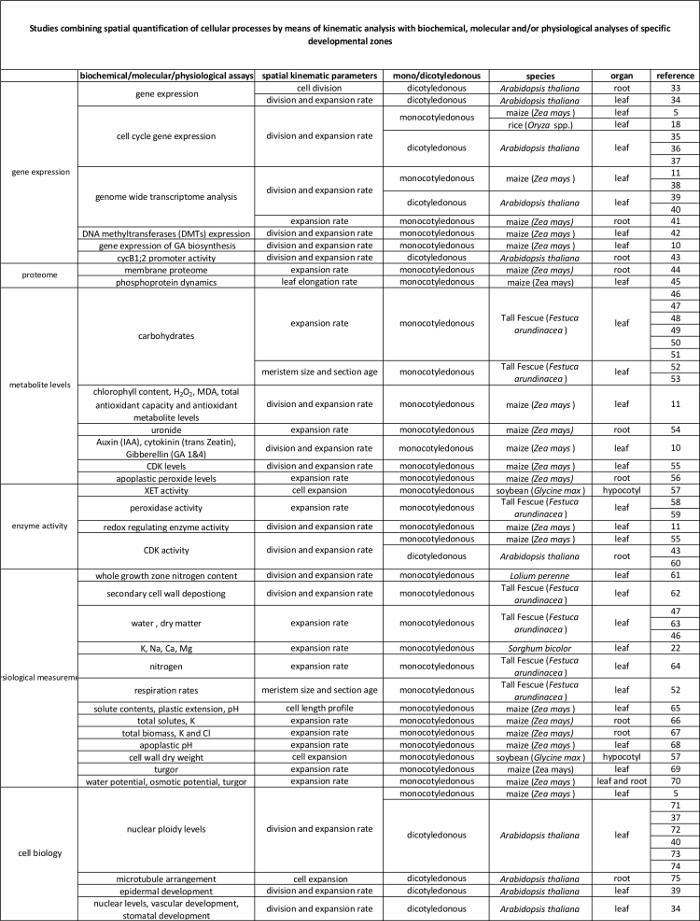
Tabla 2. Relación entre procesos celulares cuantificados por el análisis cinemático para su regulación a nivel molecular. Las referencias a diversos estudios que relacionan la cuantificación de los procesos celulares con los resultados de los ensayos bioquímicos y moleculares en distintas especies y órganos. Endotransglucosylase xiloglucano (XET), malondialdehído (MDA), quinasas dependientes de ciclina (CDK). Haga clic aquí para ver una versión más grande de esta tabla.
Protocolo
NOTA: La siguiente protocolo para el análisis cinemático sólo es válida para las hojas durante el crecimiento de estado estacionario. Esto implica una velocidad de alargamiento de la hoja estable y los patrones espaciales de longitud de la célula y la expansión en una hoja durante un período de varios días 6.
1. Crecimiento de las Plantas y mediciones de la hoja Elongación Rate (LER)
- Elija una hoja en el crecimiento de estado estacionario y una etapa de desarrollo de interés.
NOTA: Hay una diferencia entre el crecimiento de estado estacionario y el crecimiento repetitivo, lo que implica patrones espaciales similares en las hojas sucesivas sobre el mismo eje. Durante las primeras etapas de crecimiento de las plántulas, hojas sucesivas en general crecen cada vez más rápido debido al aumento del tamaño de la zona de crecimiento 7. Aunque algunas posiciones de las hojas superiores pueden tener un patrón de crecimiento similar 8, esto es una fase transitoria que puede ser afectada por los tratamientos bajo investigación. Por tanto, es importante comparar las líneas y tr eatments estrictamente en la misma posición de la hoja, a pesar de que puede estar desarrollando en un momento diferente. Incluso a una velocidad de elongación constante, el perfil de la tasa de crecimiento no es necesariamente la misma en las diferentes etapas de desarrollo. Por lo tanto, es importante analizar las hojas en la misma etapa de desarrollo 8, por lo general definido por el número de días después de la emergencia. - Para realizar un análisis cinemático completo de crecimiento de las hojas en monocotiledóneas, crecerá al menos 15 plantas para cada tratamiento y el genotipo bajo condiciones controladas en una cámara de crecimiento.
- En el momento de la hoja de interés aparece (la salida de la espiral de hojas circundantes), comenzar a medir la longitud de la hoja diaria con una regla hasta que la hoja está completamente expandido (Figura 1i). longitud de la hoja implica la longitud desde el nivel del suelo hasta la punta de la hoja. Tenga cuidado de no romper o dañar la hoja, ya que esto podría alterar su crecimiento.
re 1 "src =" / files / ftp_upload / 54887 / 54887fig1.jpg "/>
Figura 1:. Vista general esquemática de un análisis cinemático de hojas de maíz La hoja de interés se mide con una regla de tres días consecutivos para calcular la elongación de la hoja Rate (LER). A partir de entonces, la hoja se cosecha y un segmento de tres centímetros se utiliza para la determinación del tamaño de meristemo. Esto se hace mediante la medición de la longitud desde la base hasta la cifra mitótico más distal después de la tinción DAPI. (A) Los ejemplos de figuras de mitosis proliferativas y (B) mitosis formativos. Los primeros once centímetros de la base de la hoja en el otro lado de la mitad de la vena se utilizan para cortar diez segmentos de un centímetro para mediciones de la longitud de la célula. Estas mediciones proporcionan la base para crear el perfil de longitud de la célula, que sirve para determinar la longitud madura celular (l mat) y la longitud de las células que salen del meristemo (l div). los LER y l estera se utilizan para calcular la tasa de producción de células (P), mientras que l div y L mer se utilizan para calcular el número de células en el meristemo (mer N). A su vez, P y N mer se utilizan para calcular la tasa media de la división celular (D), que es la inversa de la duración del ciclo celular (T c). Las flechas del mismo color indican los parámetros que se utilizan para calcular el parámetro siguiente en estas flechas. Barras de escala = 40 m. Números romanos se utilizan para referirse a los procedimientos experimentales específicos descritos en el protocolo. Por favor, haga clic aquí para ver una versión más grande de esta figura.
2. La recolección
- En la etapa de desarrollo de interés (por ejemplo, el tercer día después de la emergencia), elija al menos cinco representativa plantes del lote en el que para llevar a cabo el análisis cinemático. Continuar midiendo el resto de las plantas, como se explica en el paso 1.3 para determinar la longitud de la hoja final.
- Cortar la parte por encima del suelo de la planta. Para mantener la parte meristemático intacta, corte lo más cerca posible a las raíces (Figura 1ii).
- A partir de las hojas exteriores, retire todas las hojas hasta la hoja de interés por ellos desenrollar suavemente uno por uno. Si es necesario, retire unos pocos milímetros adicionales de la base para separar las hojas. También quite las hojas del ápice y pequeñas encerradas por la hoja de interés (Figura 1III).
- Cortar un segmento de 3 cm, a partir de la base en un lado de mediados de la vena, y almacenarlo en un tubo de 1,5 ml de ensayo lleno de 3: 1 (v: v) de etanol absoluto: solución de ácido acético (PRECAUCIÓN: Use guantes) a 4 ° C durante 24 horas hasta varios meses (Figura 1iv). Este segmento posterior se utiliza para determinar la longitud del meristemo.
- Desde elotro lado de la vena, cortar un segmento de 11 cm de la base (Figura 1 v) y colocarlo en un tubo de 15 ml lleno de etanol absoluto a 4 ° C durante al menos 6 horas para eliminar pigmentos (Figura 1 vi).
NOTA: Más adelante, utilizar sólo los primeros 10 cm para determinar el perfil de longitud de la célula (ver Discusión). - Renovar el etanol absoluto para otra ronda de limpieza a 4 ° C durante al menos 24 horas (Figura 1vi).
- Por último, sustituir el etanol absoluto con ácido láctico puro (PRECAUCIÓN: usar guantes) para la limpieza y el almacenamiento a 4 ° C durante 24 h, o hasta su uso posterior (Figura 1vi).
3. Las mediciones de longitud de meristemas
- Preparar un tampón de enjuague que contiene 50 mM de cloruro de sodio (NaCl), 5 mM de ácido etilendiaminotetraacético (EDTA; PRECAUCIÓN: usar guantes) y 10 mM Tris (hidroximetil) aminometano-ácido clorhídrico (Tris-HCl, pH 7).
- Tome el segmento de 3 cm de la sección 2.4 y por loak en el buffer de 20 min (Figura 1vii).
- Mientras espera, utilizar el tampón de enjuague para preparar una solución de tinción 4 ', 6-diamidino-2-fenilindol (DAPI) de 1 g / ml, manteniéndolo en hielo y en la oscuridad.
- Tinción de los núcleos colocando el segmento de meristemo para 2-5 min en la solución de tinción DAPI. Trabajar en el hielo y en la oscuridad (Figura 1vii).
- Compruebe si hay señal de fluorescencia mediante el montaje de forma rápida el segmento en un vaso de microscopía y lo cubre con una cubierta de vidrio. Las células epidérmicas deben mostrar fluorescencia, mientras que las capas celulares subyacentes no debería.
- Si la tinción no es suficiente, poner el segmento de nuevo en la solución de tinción DAPI para algunos minutos adicionales.
- Para detener la tinción, montar los segmentos en una gota de disolución tampón de enjuague en un portaobjetos de microscopía y cubierta con una tapa de vidrio.
- Use un microscopio equipado con UV en la fluorescencia con un aumento de 20X, lo que permite la visualización de alrededor de 1.000 epidermislas células de Al a la vez. Desplazarse a lo largo del segmento y buscar figuras mitóticas proliferativas (metafase, anafase, telofase y citocinesis), pero evita la división celular formativo de los estomas en desarrollo (Figura 1viii) 9. Definir dónde se encuentra la figura mitótica más distal.
- Determinar la longitud del meristemo mediante la medición de la distancia entre la base de la hoja y el más figura mitótica epidérmica distal. Utilice un software de análisis de imágenes (por ejemplo, ImageJ) para medir la longitud total de la trama de imagen.
- Contar el número de cuadros que cubren la longitud total de meristemas (desde la base de la hoja de la figura mitótica más distal) y multiplicar este número por la longitud de una trama para obtener la longitud completa de meristemas (Figura 1ix).
4. célula de cuerpo entero Perfil
- Tome el segmento que se almacena en ácido láctico (paso 2.5) y colocarlo cuidadosamente en el banquillo. Cortar el ingenio segmentosja bisturí en 10 segmentos de 1 cm cada una (Figura 1 x).
- Montar los segmentos de hojas sucesivas sobre un portaobjetos de microscopía en una pequeña gota de ácido láctico. Asegúrese de hacer frente a la consistencia, ya sea adaxial o el lado abaxial hacia arriba. En principio, no hay ninguna preferencia por un lado particular.
- Use un microscopio equipado con contraste de interferencia diferencial óptica (DIC) para analizar los segmentos, a partir de la base de la hoja. Medir con un software de análisis de imagen de la longitud de al menos 20 células epidérmicas de duplicados en archivos directamente adyacentes a los archivos de los estomas con el fin de seleccionar siempre el mismo tipo de célula.
- Para ello, en posiciones equidistantes a lo largo de cada uno de los segmentos (4 posiciones son suficientes por segmento), y asegúrese de anotar la posición correspondiente para cada medición a lo largo de la hoja (Figura 1xI).
- Determinar la longitud de la célula normal en cada mm a lo largo del eje de la hoja mediante el uso de una suavización polinómica local de pPROCEDIMIENTO, implementado en un R-escritura (Figura 1xii; Archivo 1).
NOTA: La secuencia de comandos-R proporciona una serie de datos con el aumento de suavizado. La cantidad de suavizado requerida es algo arbitrario y lo ideal sería que acaba de quitar el ruido local, pero no afectará a la curva en general. Asegúrese de usar la misma cantidad de suavizado para todas las muestras dentro de un experimento. - Promediar la longitud de la célula en cada posición entre las plantas y calcular el error estándar para crear un perfil de longitud de la célula a lo largo del eje de la hoja.
5. Los cálculos de los parámetros cinemáticos (véase la disposición complementaria 2)
- Calcular la LER tomando el cambio en la longitud de la hoja entre dos puntos de tiempo sucesivos (por ejemplo, 24 hr, como en el paso 1.3) y dividiéndolo por el intervalo de tiempo.
- Calcular la longitud de la zona de crecimiento (L gz) correspondiente a la posición distal de la base donde las células alcanzan 95% de su ce madurall longitud del perfil de suavizado longitud de la célula.
- Tomemos, por cada posición en el perfil smoothened longitud de la célula 95% de la media de todas las longitudes de células siguientes esa posición (Figura 2).
- Comparar las longitudes de células smoothened (paso 4,4) con la longitud de la célula 95% calculado en cada posición. Partiendo de la base de la hoja, la zona de crecimiento termina en la posición en la que la longitud de la célula actual es igual a 95% de las siguientes longitudes de células (Figura 2; véase los datos adicionales 2).
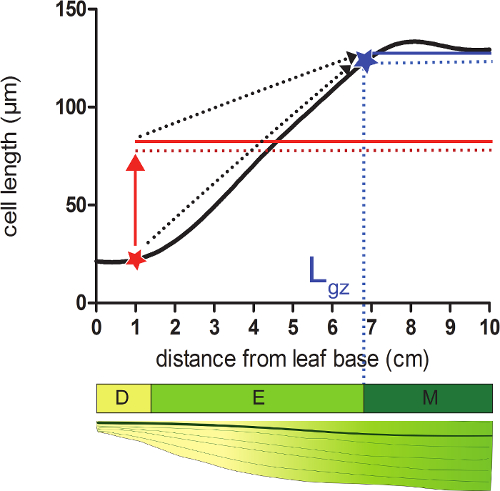
Figura 2:. La determinación de la final de la zona de crecimiento de meristemas: en la posición indicada con una estrella roja, el tamaño de celda actual es menor que 95% (línea roja punteada) del tamaño de celda promedio de todas las células siguientes esta posición (sólido de color rojo línea). El final de la zona de crecimiento (L gz; indicado con abLue estrellas) se encuentra en el 95% (línea punteada azul) del tamaño de celda promedio de todas las células después de esta posición (sólida línea azul) es igual al tamaño real de la celda. zona División (D), zona de elongación (E), y la zona maduro (M). Discontinuas flechas indican la convergencia entre el tamaño local y el 95% del tamaño promedio de la porción distal de la hoja cuando se pasa de las posiciones basales a la punta de la hoja. Por favor, haga clic aquí para ver una versión más grande de esta figura.
- Calcular la longitud de la zona de elongación (L el) como la diferencia entre la longitud de la zona de crecimiento (L gz) y el tamaño de meristemas (L mer; determinado en el paso 3).
- Calcular la longitud de la célula madura (l mat) como la longitud de celda promedio en la zona maduro.
- Divida la LER por l tapete para obtener eltasa de producción de células (P).
- Calcular el número de células en la zona de elongación (N el) como la diferencia entre N y N gz mer. El número de células en el meristemo (mer N) es igual al número acumulado de células situadas en los intervalos correspondientes a la meristemo. El número de células en la zona de crecimiento (N gz) es igual al número acumulado de células situadas en los intervalos correspondientes a la zona de crecimiento.
- Calcular la tasa de división celular promedio (D) como mer P / N. La duración del ciclo celular (T c) es igual a ln (2) / D.
- Calcular el tiempo en la zona de alargamiento (T el) dividiendo el N por P. El tiempo en la zona de la división es igual a log 2 (N mer) * Tc. La longitud de las células que salen del meristemo (l div)es igual a la longitud de la célula a partir del perfil smoothened longitud de la célula en el extremo del meristemo.
- Calcular la tasa promedio de expansión de células (R el) utilizando la fórmula siguiente: ln (l mat) ln (l div)] / T el.
Resultados
Aquí, se muestra una comparación entre las plantas bien regadas (control, el contenido de agua del suelo 54%, (SWC)) y plantas sometidas a condiciones de estrés hídrico (sequía, el 34% de CSA) en términos de su crecimiento de las hojas. Todas las plantas se cultivaron en una cámara de crecimiento bajo condiciones controladas (16 horas día / 8 horas por la noche, 25 ° C / 18 ° C día / noche, 300-400 μEm -2 s -1 de radiación fotosintéticamente activa (PA...
Discusión
Un análisis cinemático completo en las hojas de maíz permite la determinación de la base celular de crecimiento de la hoja y permite el diseño de estrategias de muestreo eficientes. Aunque el protocolo es relativamente sencillo, algunos se recomienda precaución en los siguientes pasos críticos: (1) Es importante separar las hojas más jóvenes cerrados (paso 2.3) sin dañar el meristemo, ya determinación de la longitud de meristemas (paso 3) requiere la completa meristemo de estar presente. Un poco de práctica ...
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por una beca de doctorado de la Universidad de Amberes a VA; una beca de doctorado de la Fundación de Ciencias de Flandes (FWO, 11ZI916N) de KS; subvenciones para proyectos de la FWO (G0D0514N); una beca de investigación actividad de investigación concertada (GOA), "Un enfoque de Biología de Sistemas de la hoja de la morfogénesis" del Consejo de Investigación de la Universidad de Amberes; y la atracción Interuniversitario polacos (IUAP VII / 29, MARS), "El maíz y Arabidopsis raíces y brotes de crecimiento" de la Oficina Federal de Bélgica Ciencia Política (BELSPO) para GTSB Han Asard, Bulelani L. Sizani y Hamada Abdelgawad contribuyeron al video .
Materiales
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measueres, but can be different depending on the treatment/study : bottom diameter: 11cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1,5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 ml falcon tubes | Any | Any | The 15 ml falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquire with the corresponding author. We have versions for Mac and Windows. |
Referencias
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., Hennig, L., Köhler, C. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. , (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G., Bennetzen, J. L., Hake, S. C. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. , (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406 (2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., DeSmet, I. . Plant Organogenesis. , (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados