A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח קינמטית של חטיבה ואת הרחבת תא: כימות הבסיס הנייד של אזורי התפתחותית צמיחת הדגימה
* These authors contributed equally
In This Article
Summary
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Abstract
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Introduction
ניתוח צמיחה תלוי סט של כלים המשמשים בדרך כלל על ידי מדעני צמח לתאר הבדלי צמיחה ו / או תשובות פנוטיפי נקבע גנוטיפ לגורמים סביבתיים. הם כוללים מדידות גודל ומשקל של הצמח כולו או איבר וחישובי שיעורי צמיחה לחקור את המנגנונים של צמיחה. צמיחת איברים נקבעת על ידי חלוקת תא והרחיב ברמה התאית. לכן, כולל הכימות של שני תהליכים אלו בצמיחת המנתח הוא מפתח להבנת הבדלים בצמיחה כולו באיברי 1. כתוצאה מכך, חשוב להיות בעל במתודולוגיה לקבוע פרמטרי צמיחה הסלולר כי הוא יחסית קל לשימוש על ידי מעבדות ללא התמחות.
ניתוח קינמטית כבר קמה, כגישה מתן מסגרת רבת עוצמה לפיתוח מודלים של גידול איברים 2. הטכניקה כבר אופטימיזציה עבור מערכות לינאריות,כמו שורשי ארבידופסיס thaliana ועלי monocotyledonous, אלא גם למערכות שאינן ליניארי, כגון עלי dicotyledonous 3. כיום, מתודולוגיה זו נמצאת בשימוש יותר ויותר כדי ללמוד איך גנטי, הורמונלית, התפתחותיים, וגורמים סביבתיים משפיעים חלוקת תא והרחיב באיברים שונים (טבלה 1). יתר על כן, הוא גם מספק מסגרת לקשר תהליכים תאיים לתקנות ביוכימיים, מולקולריות, ופיזיולוגיים הבסיסיות שלהם (טבלה 2), למרות מגבלות שניתן להטיל לפי גודל איבר וארגון מרחבי טכניקות הדורשות כמויות גדולות יותר של חומר צמחי (למשל, המטבוליט מדידות, פרוטאומיקה, וכו ').
עלי Monocotyledonous, כגון התירס (Zea Mays) עלה, מייצגים מערכות ליניאריות שבו תאים להעביר מהבסיס של העלה כלפי הקצה, ברצף עוברים דרך אזור meristem ואת ההתארכות להגיע הבוגרתאֵזוֹר. זה עושה את זה מערכת מודל אידיאלית עבור מחקרים כמותיים של התבניות המרחביות של צמיחה 4. יתר על כן, עלי תירס יש אזורי צמיחה גדולים (meristem אזור התארכות פורשים כמה סנטימטרים 5) ולספק אפשרויות ללימודים ברמות ארגוניות אחרות. זה מאפשר חקירת מנגנוני הוויסות (המשוערים) שליטת חלוקת תא ורחב, לכמת ידי ניתוח kinematic באמצעות מגוון של שיטות מולקולריות, מדידות פיסיולוגיות, וגישות ביולוגיה של תא (טבלה 2).
כאן, אנו מספקים פרוטוקול לביצוע ניתוח kinematic בעלי monocot. ראשית, נסביר כיצד לבצע ניתוח נכון של שני חלוקת התא ואת התארכות התא כפונקציה של המיקום לאורך ציר עלה וכיצד לחשב פרמטרים קינמטיקה. שנית, אנחנו גם להראות איך זה יכול לשמש כבסיס לעיצוב דגימה. כאן, אנו דנים בשני מקרים: דגימה ברזולוציה גבוהה ד ממוקד דגימה, המאפשר פרשנות נתונים משופרות ולחיסכון בזמן / כסף, בהתאמה.
סקירת טבלת 1. קינמטיקה מנתח שיטות כימות של חלוקת תא והרחבה באיברים שונים.
| אֵיבָר | התייחסות |
| עלי monocotyledonous | 16, 20, 21, 22 |
| טיפים שורש | 2, 23, 24, 25, 26, 27, 28, 29 |
| עלי dicotyledonous | 21, 30, 31 |
| לירות meristem הפסגה | 32 |
סקירת טבלת 1. קינמטיקה מנתח שיטות כימות של חלוקת תא והרחבה באיברים שונים.
ther.within-page = "1"> 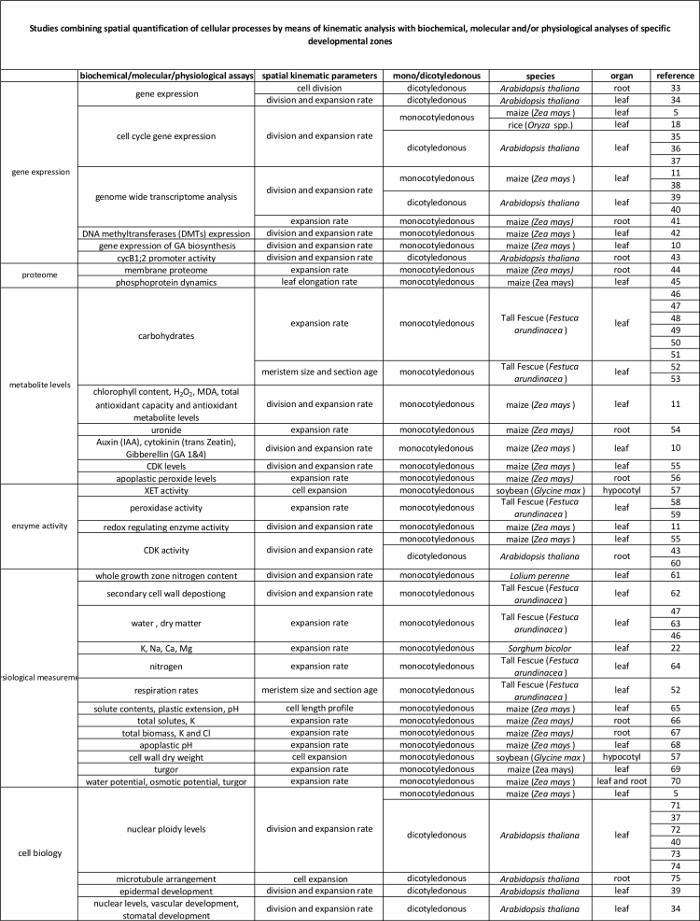
קישור טבלה 2. בין תהליכים תאיים לכמת ידי ניתוח kinematic לרגולציה שלהם ברמה המולקולרית. הפניות למחקרים שונים מקשרים כימות של תהליכים תאיים לתוצאות מבחני ביוכימיים ומולקולריים במינים ואיברים שונים. Endotransglucosylase Xyloglucan (XET), malondialdehyde (מד"א), קינאזות תלויות-ציקלין (CDK). נא ללחוץ כאן כדי לצפות בגרסה גדולה יותר של הטבלה.
Protocol
הערה: הפרוטוקול הבא לניתוח קינמטיקה תקף רק עלים במהלך הצמיחה יציבה. זה מצביע על שיעור התארכות עלה יציב ודפוסי מרחב של אורך תא והתרחבות עלה במהלך תקופה של מספר ימים 6.
צמח צמיחת 1. ומדידות של דרג התארכות ליף (הימלר)
- בחר עלו בצמיחה יציבה ואת שלב ההתפתחותי של עניין.
הערה: יש הבדל בין צמיחה היציבה וצמיחה חוזרת, מה שמרמז תבניות המרחביות דומות על עלים רצופים על אותו ציר. במהלך השלבים המוקדמים של צמיחת שתיל, עלים רצופים בדרך כלל גדלים יותר ויותר מהר בגלל הגודל הגובר של אזור צמיחת 7. למרות כמה תפקידים עלה גבוה יכול להיות דפוס צמיחה דומה 8, זהו שלב חולף העשויים להיות מושפעים על ידי טיפולים תחת חקירה. לכן חשוב להשוות קווי tr eatments ורק על העמדה עלה אותו, למרות שזה ניתן לפתח בזמן אחר. אפילו בקצב התארכות מתמיד, פרופיל שיעור הצמיחה אינו בהכרח זהה בשלבי התפתחותיים שונים. לכן, חשוב לנתח העלים באותו שלב התפתחותי 8, בדרך כלל מוגדר במספר ימים לאחר הופעתה. - כדי לבצע ניתוח kinematic מלא צמיחה עלה ב monocots, לגדול לפחות 15 צמחים עבור כל טיפול ו גנוטיפ בתנאים מבוקרים בחדר צמיחה.
- באותו הזמן העלה של עניין מופיע (הופעתה מן במערבולת של עלים שמסביב), להתחיל למדוד את האורך של העלה יומי עם סרגל עד העלה מורחב מלא (האיור 1i). אורך ליף מרמז על אורך מרמה הקרקע עד קצה העלה. היזהר שלא לשבור או לפגוע עלה, כיוון שזה עלול לשנות את צמיחתה.
בתשובה לשאלה 1 "src =" / files / ftp_upload / 54,887 / 54887fig1.jpg "/>
איור 1:. סקירה סכמטי של ניתוח kinematic עלי תירס העלה של ריבית נמדד עם שליט במשך שלושה ימים רצופים כדי לחשב את שיעור ההתארכות ליף (הימלר). לאחר מכן, העלה שנקטף וקטע שלושה סנטימטר משמש לקביעת גודל meristem. הדבר נעשה על ידי מדידת אורך מהבסיס עד הדמות mitotic הדיסטלי ביותר לאחר מכתים DAPI. (א) דוגמאות של דמויות mitotic שגשוג ו (ב) דמויות mitotic מכוננות. אחד עשרה הסנטימטרים הראשונים מהבסיס עלה בצד השני של הווריד באמצע משמשים לחתוך עשרה קטעים חד-סנטימטר למדידות אורך תא. מדידות אלה מספקים את הבסיס ליצירת פרופיל אורך התא, המשמש כדי לקבוע את אורך התא הבוגר (מחצלת l) ואורך תאים עוזב את meristem (div l). ה הימלר מחצלת l משמשים לחישוב שיעור ייצור תאים (P), בעוד div L ו- L mer משמשים כדי לחשב את מספר התאים meristem (N mer). בתורו, P ו- N mer משמשים לחישוב שיעור חלוקת התא הממוצע (D), שהוא ההופכי של משך מחזור התא (ג T). חצים של אותו הצבע עולים פרמטרים המשמשים לחישוב הפרמטר הבא על החצים האלה. ברי סולם = 40 מיקרומטר. מספרים רומים משמשים להתייחס להליכים ספציפיים ניסיוני כמתואר בפרוטוקול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
קציר 2.
- בשלב ההתפתחותי של עניין (למשל, ביום השלישי לאחר הופעתה), לבחור לפחות חמש p נציגlants מהאצווה שעליו לנהל את ניתוח kinematic. המשך מדידת שאר הצמחים כמוסבר בשלב 1.3 כדי לקבוע את אורך הדף האחרון.
- חותכים את החלק מעל הקרקע של המפעל. כדי לשמור על חלק meristematic שלם, לחתוך קרוב ככל האפשר אל השורשים (איור 1ii).
- החל העלים החיצוניים, להסיר את כל העלים עד העלה עניין ידי unrolling אותם אחד בעדינות על ידי אחד. במידת צורך, להסיר כמה מילימטרים נוספים מהבסיס לנתק את העלים. כמו כן להסיר את עלי איפקס קטנים וסגורים על ידי עלה העניין (איור 1iii).
- חותכים מקטע 3 ס"מ, החל מבסיס בצד אחד של וריד באמצע, ולאחסן אותו צינור 1.5 מ"ל מבחן מלא 3: 1 (v: v) אתנול אבסולוטי: פתרון חומצה אצטית (זהירות: ללבוש כפפות) ב 4 ° C. במשך 24 שעות עד מספר חודשים (איור 1iv). קטע זה ישמש מאוחר יותר כדי לקבוע את האורך של meristem.
- מ הבצד השני של הווריד, לחתוך קטע 11 ס"מ מבסיס (איור 1 נ) ולמקם אותו בתוך שפופרת 15 מ"ל מלא אתנול אבסולוטי ב 4 מעלות צלזיוס במשך לפחות 6 שעות כדי להסיר פיגמנטים (איור 1 vi).
הערה: בהמשך, השתמשו רק 10 הסנטימטרים הראשונים כדי לקבוע את פרופיל אורך תא (ראה דיון). - חדשו את אתנול אבסולוטי לסיבוב נוסף של ניקוי על 4 מעלות צלזיוס במשך לפחות 24 שעות (איור 1vi).
- לבסוף, להחליף את אתנול האבסולוטי עם חומצה לקטית טהורה (זהירות: ללבוש כפפות) לניקוי ואחסון ב 4 מעלות צלזיוס למשך 24 שעות או עד לשימוש נוסף (איור 1vi).
3. מדידות אורך meristem
- הכן חיץ שטיפה המכילים נתרן כלורי 50 מ"מ (NaCl), 5 מ"מ חומצה ethylenediaminetetraacetic (EDTA; זהירות: ללבוש כפפות) ו -10 מ"מ טריס (hydroxymethyl) חומצה aminomethane-הידרוכלורית (טריס-HCl; pH 7).
- קח את קטע 3 ס"מ בסעיף 2.4 וכן הלאהAK אותו למאגר במשך 20 דקות (איור 1vii).
- בזמן ההמתנה, להשתמש חיץ שטיפה להכין פתרון מכתים 4 ', 6-diamidino-2-phenylindole (DAPI) של 1 מיקרוגרם / מ"ל, שמירה על אותה על הקרח בחושך.
- כתם הגרעינים ידי צבת במגזר meristem במשך 2-5 דקות בתמיסה המכתימה DAPI. עבודה על הקרח בחושך (איור 1vii).
- בדקו אותות קרינה על ידי הרכבה במגזר במהירות על כוס מיקרוסקופיה והמריחה עם מכסה זכוכית. תאי אפידרמיס צריכים להראות קרינה, בעוד שכבות תאי הבסיס לא צריכות.
- אם המכתים אינו מספיק, לשים במגזר בחזרה הפתרון המכתים DAPI עבור כמה דקות נוספות.
- כדי לעצור את המכתים, הר המגזרים בטיפת שטיפת חיץ בשקופית מיקרוסקופיה ומכסה כיסוי זכוכית.
- השתמש מיקרוסקופ מצויד קרינת UV בהגדלת 20X, המאפשר הדמיה של כ -1,000 epidermאל תאים בבת אחת. גלול לאורך קטע ולחפש דמויות mitotic שגשוג (metaphase, anaphase, telophase, ו cytokinesis), אך להימנע חלוקת התא המכונן של (1viii איור) בפיתוח הפיוניות 9. גדר שם דמות mitotic הדיסטלי ביותר ממוקמת.
- לקבוע את אורך meristem על ידי מדידת המרחק בין הבסיס של העלה והדמות mitotic ביותר דיסטלי אפידרמיס. השתמש תמונות תוכנה לניתוח (למשל, ImageJ) כדי למדוד את אורכו של מסגרת התמונה.
- לספור את מספר המסגרות שמכסות את אורך meristem המלא (מהבסיס עלה לנתון mitotic הדיסטלי ביותר) ו להכפיל את המספר הזה לפי אורך מסגרת אחת כדי לקבל את אורך meristem המלא (1ix איור).
4. פרופיל אורך תא
- קח במגזר המאוחסן חומצה לקטית (שלב 2.5) ולמקם אותו בזהירות על הספסל. חותכים את השנינות מגזריםחה אזמל ב 10 מקטעים של 1 ס"מ כל אחת (איור 1x).
- הר המגזרים עלו הרצופים בשקופית מיקרוסקופ ב טיפה קטנה של חומצה לקטית. הקפד להתמודד באופן עקבי גם את adaxial או למעלה בצד abaxial. באופן עקרוני, אין העדפת צד מסוים.
- השתמש מיקרוסקופ מצויד התערבות הפרש לעומת זאת אופטיקה (DIC) לנתח את המגזרים, החל מבסיס העלה. מדוד עם תוכנת ניתוח התמונה אורך תאי אפידרמיס לשכפל 20 לפחות ב קבצים סמוכים ישירות לקבצי הפיוניות על מנת לבחור את סוג התא אותו בעקביות.
- האם זה על עמדות ברווחים שווים לאורך אחד ממגזרי (4 עמדות לכל להספיק קטע), ולוודא כדי לרשום את המיקום המתאים לכל מדידה לאורך (1xi איור) עלה.
- לקבוע את אורך התא הממוצע בכל מ"מ לאורך הציר עלה באמצעות p חלקת פולינום מקומיrocedure, ויושם R-סקריפט (איור 1xii; קובץ משלים 1).
הערה: The-סקריפט R מספק סדרה של נתונים עם הגדלת חלקה. כמות החלקה הנדרשת היא שרירותית ו אידיאלי צריך רק להסיר את הרעש המקומי, אך לא להשפיע על עקומת הכולל. הקפד להשתמש באותה כמות של החלקה עבור כל הדגימות בתוך בניסוי אחד. - ממוצע אורך תא במיקום כל בין צמחים ובעלי לחשב את סטיית התקן ליצור פרופיל אורך התא לאורך ציר עלה.
5. חישובים של פרמטרים קינמטית (ראה משלים קובץ 2)
- חשב את הימלר על ידי לקיחת השינוי באורך עלה בין שתי נקודות זמן רצופות (למשל, 24 שעות, כמו בשלב 1.3) וחלוקתו את מרווח הזמן.
- חשבתי את אורך צמיחת האזור (GZ L) המתאים דיסטלי עמד מהבסיס שבו תאים מגיעים 95% של ce הבוגרת שלהםאורך ll על פרופיל אורך תא smoothened.
- קח לכל עמדה על% 95 פרופיל אורך תא smoothened של הממוצע של כל אורכי התא הבאים עמדה (איור 2).
- השוואת אורכי תא smoothened (שלב 4.4) עם אורך תא מחושב 95% בכל אחת מעמדות. החל מהבסיס של העלה, אזור הגידול ומסתיים במצב שבו אורך התא בפועל שווה 95% של אורכי התא הבאים (איור 2; לראות משלי נתונים 2).
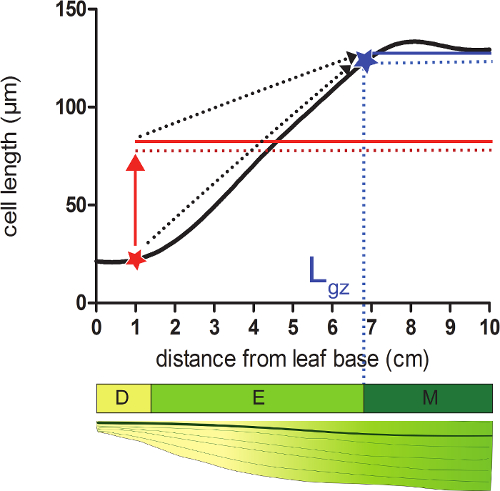
איור 2:. קביעת מועד לסיום לאזור הצמיחה meristem: במיקום מצוין עם כוכב אדום, גודל התא בפועל הוא קטן מ -95% (קו מקווקו אדום) של גודל התא הממוצע של כל התאים הבאים עמדה זו (אדום מוצק קַו). סופו של אזור הגידול (GZ L; מצוין עם ablue כוכב) ממוקם שבו 95% (קו כחול מנוקד) של גודל התא הממוצע של כל התאים הבאים עמדה זו (הקו הכחול מוצק) שווה לגודל התא בפועל. אגף אזור (D), אזור התארכות (E), ואת האזור הבוגר (M). חצים המקווקווים מציינים ההתכנסות בין הגודל המקומי ו -95% ביחס לגודל הממוצע על החלק הדיסטלי של העלה בעת מעבר מהעמדות הבסיסיות אל קצה העלה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
- חשב את אורך אזור התארכות (L אל) כהפרש בין אורך של אזור הגידול (GZ L) ואת גודל meristem (L mer; נקבע בשלב 3).
- חשבתי את אורך התא הבוגר (מחצלת l) כמו אורך תא הממוצע באזור הבוגר.
- מחלקים את הימלר ידי מחצלת l כדי להשיג אתשיעור ייצור תאים (P).
- לחשב את מספר התאים באזור התארכות (N אל) כהפרש בין GZ N ו- N mer. מספר תאי meristem (mer N) שווה למספר המצטבר של תאים הממוקמים במרווחים המתאימים meristem. מספר תאים באזור צמיחה (GZ N) שווה למספר המצטבר של תאים הממוקמים במרווחים החופף את אזור הגידול.
- חשב את קצב חלוקת התא הממוצע (ד) כפי mer P / N. משך מחזור התא (ג T) שווה ln (2) / D.
- לחשב את הזמן באזור ההתארכות (T אל) על ידי חלוקת N אל ידי P. השעה באזור חלוקה שווה log 2 (mer N) * ג T. אורכו של תאים עוזב את meristem (div l)שווה אורך תא מהפרופיל אורך תא smoothened בסוף של meristem.
- חשב את קצב התפשטות תאים הממוצע (R אל) באמצעות הנוסחה הבאה: ln (מחצלת l) -ln (div l)] / T אל.
תוצאות
הנה, אנחנו מראים השוואה בין צמחים מושקים (שליטה, 54% תכולת מים בקרקע, (SWC)) וצמחים נתונים בתנאי עקת בצורת (בצורת, 34% SWC) במונחים של צמיחת העלה שלהם. כל הצמחים גדלו בתא צמיחה בתנאים מבוקרים (16 שעות ביום / 8 שעות בלילה, 25 ° C / 18 ° C יום / לילה, 300-400 μEm -2 שניות
Discussion
ניתוח kinematic מלא על עלי תירס מאפשר קביעת הבסיס הסלולר של צמיחה עלה ומאפשר את העיצוב של אסטרטגיות דגימה יעילות. אף על פי הפרוטוקול הוא פשוט יחסית, קצת זהירות מומלצת השלבים הקריטיים הבאים: (1) חשוב לנתק את העלים הצעירים, סגורים (שלב 2.3) מבלי לפגוע meristem, מאז קביעת אורך meristem (ש?...
Disclosures
החוקרים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענק דוקטורט מאוניברסיטת אנטוורפן VA; המילגה דוקטורט של קרן המדע פלמית (FWO, 11ZI916N) כדי KS; מענקי פרויקט מן FWO (G0D0514N); פעילות מחקרית מתואמת מענק מחקר (GOA), "גישה ביולוגיה מערכות של ליף המורפוגנזה" ממועצת המחקר של אוניברסיטת אנטוורפן; הפולנים ואת המשיכה הבינאוניברסיטאי (IUAP ז / 29, MARS), "תירס ו ארבידופסיס רוט ולירות צמיחה" ממשרד מדיניות המדע הפדרלית הבלגית (BELSPO) כדי GTSB האן Asard, Sizani Bulelani ל 'חמאדה AbdElgawad כל תרמו וידאו .
Materials
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measueres, but can be different depending on the treatment/study : bottom diameter: 11cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1,5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 ml falcon tubes | Any | Any | The 15 ml falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquire with the corresponding author. We have versions for Mac and Windows. |
References
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., Hennig, L., Köhler, C. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. , (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G., Bennetzen, J. L., Hake, S. C. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. , (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406 (2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., DeSmet, I. . Plant Organogenesis. , (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved