Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hücre Bölünmesi ve Genişleme Kinematik Analizi: Büyüme ve Örnekleme Gelişim Bölgeleri Hücresel Temeli Quantifying
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Quantifying cell division and expansion is of crucial importance to the understanding of whole-plant growth. Here, we present a protocol to calculate cellular parameters determining maize leaf growth rates and highlight the use of these data for investigating molecular growth regulatory mechanisms by directing developmental stage-specific sampling strategies.
Özet
Growth analyses are often used in plant science to investigate contrasting genotypes and the effect of environmental conditions. The cellular aspect of these analyses is of crucial importance, because growth is driven by cell division and cell elongation. Kinematic analysis represents a methodology to quantify these two processes. Moreover, this technique is easy to use in non-specialized laboratories. Here, we present a protocol for performing a kinematic analysis in monocotyledonous maize (Zea mays) leaves. Two aspects are presented: (1) the quantification of cell division and expansion parameters, and (2) the determination of the location of the developmental zones. This could serve as a basis for sampling design and/or could be useful for data interpretation of biochemical and molecular measurements with high spatial resolution in the leaf growth zone. The growth zone of maize leaves is harvested during steady-state growth. Individual leaves are used for meristem length determination using a DAPI stain and cell-length profiles using DIC microscopy. The protocol is suited for emerged monocotyledonous leaves harvested during steady-state growth, with growth zones spanning at least several centimeters. To improve the understanding of plant growth regulation, data on growth and molecular studies must be combined. Therefore, an important advantage of kinematic analysis is the possibility to correlate changes at the molecular level to well-defined stages of cellular development. Furthermore, it allows for a more focused sampling of specified developmental stages, which is useful in case of limited budget or time.
Giriş
Büyüme analizi yaygın çevresel faktörlere genotipi belirlenmiş büyüme farklılıkları ve / veya fenotipik yanıtları tanımlamak için bitki bilim adamları tarafından kullanılan araçlar bir dizi bağlıdır. Onlar büyümenin altında yatan mekanizmaları keşfetmek için boyut ve ağırlık tüm tesisin ölçümleri veya uzuv ve büyüme oranları hesaplamalarını içerir. Organ büyümesi hücresel düzeyde hücre bölünmesi ve genişleme ile belirlenir. Bu nedenle, analiz büyüme bu iki sürecin ölçümü de dahil olmak üzere tüm organ büyümesi 1. farklılıkları anlamanın anahtarıdır. Sonuç olarak, uzman olmayan laboratuvarlar tarafından kullanımı nispeten kolaydır hücresel büyüme parametrelerini belirlemek için uygun bir yöntem olması çok önemlidir.
Kinematik analiz zaten Organ büyüme modelleri 2 geliştirilmesi için güçlü bir çerçeve sağlayarak bir yaklaşım olarak kurulmuştur. teknik lineer sistemler için optimize edilmiştir,Bu Arabidopsis thaliana kökleri ve monokotiledon yapraklar gibi, aynı zamanda bu tür çift filizli yaprak 3 arasındaki doğrusal olmayan sistemleri de olabilir. Günümüzde bu yöntem giderek nasıl genetik, hormonal, gelişimsel incelemek için kullanılıyor, ve çevresel faktörler, hücre bölünmesini ve çeşitli organlarda genişleme (Tablo 1) etkilemektedir. Sınırlamalar bitki materyali yüksek miktarda gerektiren teknikler (örneğin, metaboliti organ büyüklüğü ve mekansal organizasyon tarafından empoze edilebilir, ancak Ayrıca, aynı zamanda, bunların altında yatan, biyokimyasal, moleküler ve fizyolojik düzenlemelere (Tablo 2) hücresel süreçleri bağlamak için bir çerçeve sağlar ölçümler, proteomik, vs.).
Mısır (Zea mays), yaprak, gibi monokotiledonlu yapraklar, ardışık olarak, olgun ulaşmak meristem ve uzama bölgesi boyunca geçen hücreler, uca doğru yaprak tabanından hareket içinde lineer sistemleri temsil ederbölge. Bu büyüme 4 mekansal desen nicel çalışmalar için ideal bir model sistem yapar. Ayrıca, mısır yaprağı (birkaç santimetre 5 yayılan meristemi ve uzama bölgesi) büyük büyüme bölgeleri ve diğer örgütsel düzeyde çalışmalar için olanaklar sağlar. Bu moleküler teknikler fizyolojik ölçümler, hücre biyolojisi yaklaşımları (Tablo 2), bir dizi aracılığıyla kinematik analizi ile saptanır hücre bölünmesini ve genişleme, kontrol (farazi) düzenleyici mekanizmalardan incelenmesi için izin verir.
Burada, monokot yaprakları bir kinematik analizi yapmak için bir protokol sağlar. İlk olarak, biz yaprak ekseni boyunca pozisyon ve nasıl kinematik parametreleri hesaplamak için bir fonksiyonu olarak, hücre bölünmesi ve hücre uzaması hem uygun bir analiz yapmak için nasıl açıklar. İkinci olarak, bu örnekleme dizaynı için bir temel olarak kullanılabilir şeklini göstermektedir. Burada, iki vakayı tartışmak: yüksek çözünürlüklü örneklemesid sırasıyla geliştirilmiş veri yorumlama ve zaman / para tasarrufu sağlayan, örnekleme duruldu.
Kinematik Tablo 1. Genel hücre bölünmesi ve çeşitli organlarda genleşme ölçümü için analiz yöntemleri.
| organ | referans |
| çenekli yapraklar | 16, 20, 21, 22 |
| kök uçları | 2, 23, 24, 25, 26, 27, 28, 29 |
| iki çenekli yapraklar | 21, 30, 31 |
| apikal meristemi ateş | 32 |
Kinematik Tablo 1. Genel hücre bölünmesi ve çeşitli organlarda genleşme ölçümü için analiz yöntemleri.
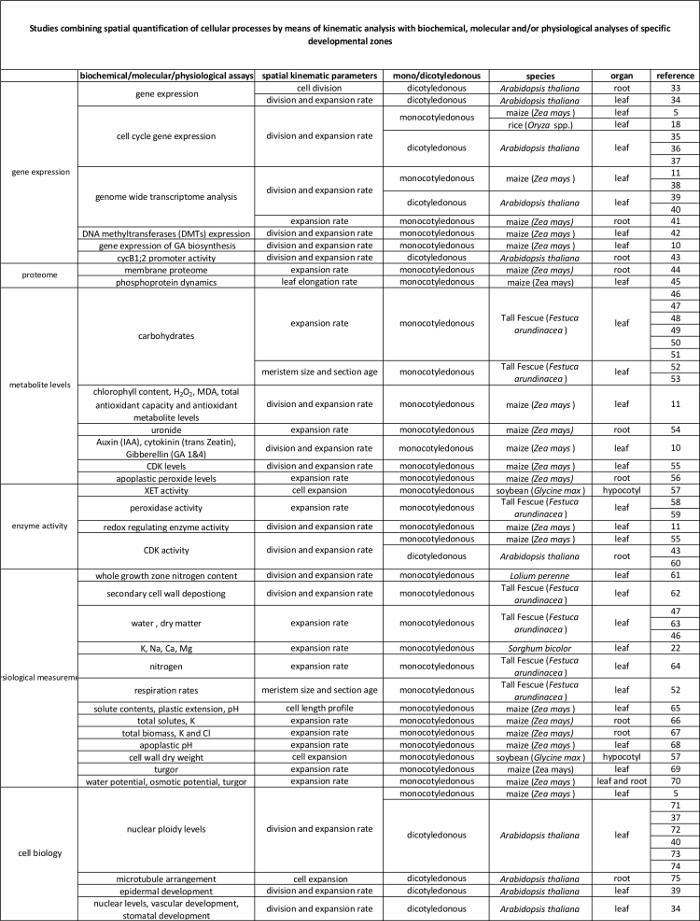
Moleküler düzeyde düzenlemeye kinematik analizi ile saptanır hücresel süreçleri arasındaki Tablo 2. bağlantı. Çeşitli türlerde ve organlarda biyokimyasal ve moleküler deneyleri sonuçlarına hücresel süreçlerin ölçümü bağlayan çeşitli çalışmalar yapılan atıflar. Eksiloglukan endotransglucosylase (XET), malondialdehit (MDA), siklin bağımlı kinazlar (CDK). Bu tablonun büyük halini görmek için lütfen buraya tıklayınız.
Protokol
NOT: kinematik analiz için aşağıdaki protokol kararlı durum büyüme sırasında yaprakları için geçerlidir. Bu, birkaç gün 6 bir süre boyunca sabit bir yaprak uzama oranı ve hücre boyu ve yaprak genişlemesinin uzamsal desen anlamına gelmektedir.
1. Bitki Büyüme ve Yaprak Uzama Oranı Ölçümleri (LER)
- kararlı hal büyümesinde bir yaprak ve ilgi gelişimsel aşaması seçin.
NOT: Aynı eksen üzerinde ardışık yapraklar üzerinde benzer mekansal kalıpları ima kararlı durum büyüme ve tekrarlayan büyüme arasında bir fark yoktur. Fide büyümesinin ilk aşamalarında, ardışık yaprakları genellikle büyüme bölgesi 7 artan boyutu giderek daha hızlı nedeniyle büyür. Bir kaç yüksek yaprak pozisyonları benzer bir büyüme modeli 8 olabilir, ancak bu soruşturma kapsamında tedavi etkilenebilir geçici aşamasıdır. Çizgiler ve tr karşılaştırmak için önemlidir farklı bir zamanda gelişen olabilir olsa bile, kesinlikle aynı yaprak pozisyonunda eatments. Hatta sabit bir uzama hızında, büyüme hızı profili mutlaka farklı gelişim aşamalarında aynı değildir. Nedenle, tipik olarak ortaya çıkması gün sonra sayısı ile tanımlanan aynı gelişim aşamasında 8, yaprakları analiz etmek önemlidir. - büyüme odasında kontrollü koşullar altında her tedavi ve genotip için en az 15 bitki büyümesi, monokotlarda yaprak büyüme tam kinematik analizini yapmak.
- Yaprak tamamen (Şekil 1i) genişletilmiş kadar ilgi yaprak (çevreleyen yaprakların ağırşak gelen ortaya çıkması) belirir anda bir cetvel ile günlük yaprak uzunluğu ölçme başlar. Yaprak uzunluğu yaprak ucuna toprak seviyesinden uzunluğunu ifade eder. Bu büyümesini değiştirebilecek beri, kırmak veya yaprak zarar vermemek için dikkatli olun.
1 re "src =" / files / ftp_upload / 54887 / 54887fig1.jpg "/>
Şekil 1:. Mısır yapraklarından bir kinematik analiz şematik bakış ilgi yaprak Yaprak Uzama Oranı (LER) hesaplamak için üç gün boyunca bir cetvel ile ölçülür. Bundan sonra, yaprak hasat edilir ve üç santimetre kademeli bir meristem boyutunun saptanması için kullanılmaktadır. Bu DAPI boyama sonra en uzak mitotik rakam tabanından yukarıya doğru uzunluğu ölçülerek yapılır. Proliferatif mitoz ve (B) biçimlendirici mitoz (A) örnekler. ortası ven diğer tarafında yaprak tabanından ilk on santimetre hücre boyu ölçümleri için 1001 santimetre kesimleri kesmek için kullanılmaktadır. Bu ölçümler olgun hücre uzunluğu (l mat) ve meristem (l div) ayrılan hücrelerin uzunluğunu belirlemek için hizmet veren hücre uzunluğu profili oluşturmak için temel sağlar. l div ve L mer meristem (N mer) hücrelerin sayısını hesaplamak için kullanılır ise m> Ler ve l mat, hücre üretim oranı (P) hesaplanması için kullanılır. Buna karşılık, P ve N mer, hücre döngüsü süresi (T c) tersi olan ortalama hücre bölünmesi oranı (D) hesaplamak için kullanılır. Aynı renkteki oklar bu oklara aşağıdaki parametreyi hesaplamak için kullanılan parametreleri gösterir. Ölçek çubukları 40 mikron =. Roma sayılar protokol açıklanan spesifik deneysel yöntemlere başvurmak için kullanılır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
2. Hasat
- Ilgi gelişim aşamasında (örneğin, çıktıktan sonra, üçüncü gün), en az beş Örnek p tercihpartiden lants hangi kinematik analiz yapmak için. Nihai yaprak uzunluğunu belirlemek için adım 1.3 açıklandığı gibi bitkilerin dinlenme ölçüm devam edin.
- Bitkinin toprak üstü bölümünü kesmek. Köklerine mümkün olduğunca yakın kesim, bozulmamış (Şekil 1ii) meristematik bölümünü tutmak için.
- dış yaprakları itibaren yavaşça teker teker unrolling tüm ilgi yaprak kadar bırakır kaldırın. Gerekirse, yaprakları ayırmak için tabanından birkaç ekstra milimetre kaldırın. Ayrıca faiz (Şekil 1iii) yaprak çevrelediği apeks ve küçük yaprakları temizleyin.
- ortası damarın bir tarafta tabandan başlayan bir 3 cm bölümü kesmek ve 3 ile doldurulmuş bir 1.5 mi test tüpü içinde saklayın: 1 (hacim: hacim) mutlak etanol: asetik asit solüsyonu (DİKKAT: eldiven giymek) de birkaç ay 24 saat kadar, 4 ° C (Şekil 1iv). Bu bölüm daha sonra meristem uzunluğunu belirlemek için kullanılır.
- itibarendamar diğer tarafında, tabandan 11 cm bir bölümü kesilmiş (Şekil 1 V) ve pigmentlerin (Şekil 1 vi) çıkarmak için en az 6 saat boyunca 4 ° C'de mutlak etanol ile doldurulmuş bir 15 ml tüp içine koyun.
NOT: Daha sonra, (Tartışma) hücre uzunluğu profilini belirlemek için sadece ilk 10 cm kullanın. - En az 24 saat (Şekil 1vi) 4 ° C 'de temizlik bir tur için mutlak etanol yenileyin.
- Son olarak, saf laktik asit ile mutlak etanol yerine (DİKKAT: eldiven giymek) temizleme ve depolama için, 4 ° C'de 24 saat süre ile ya da daha sonra kullanmak (Şekil 1vi kadar).
3. Meristem Uzunluk Ölçümleri
- 50 mM sodyum klorür (NaCl), 5 mM etilendiamintetraasetik asit içeren bir yıkama tamponu hazırlayın (EDTA, DİKKAT: eldiven aşınma) ve 10 mM Tris (hidroksimetil) aminometan-hidroklorik asit (Tris-HCI, pH 7).
- bölüm 2.4 ve böylece 3 cm segmenti alın20 dakika (Şekil 1vii) için tampon içinde ak.
- beklerken, buz üzerinde ve karanlıkta tutarak, 1 ug / ml'lik bir 4 ', 6-diamidino-2-fenilindol (DAPI) boyama solüsyonu hazırlamak için durulama tamponu kullanın.
- DAPI boyama çözeltisi 2-5 dakika boyunca, meristem segmenti yerleştirerek çekirdekleri leke. Buz üzerinde ve koyu (Şekil 1vii) çalışın.
- hızlı bir şekilde mikroskop camına segmenti montaj ve cam kapak ile kaplayıp floresan sinyal olup olmadığını kontrol edin. epidermal hücreler ise altta yatan hücre tabakaları olmamalı, floresan göstermelidir.
- boyama yeterli değilse, bazı ekstra dakika için DAPI boyama çözeltisi geri segmenti koydu.
- , Lekelenmeye durdurmak kapak camı ile bir mikroskop lamı ve kapağında tampon durulama bir damla segmentleri monte etmek için.
- 1.000 Epiderm görselleştirme için izin veren bir 20X büyütmede UV floresan ile donatılmış bir mikroskop kullanınal hücreleri bir kerede. Segmenti boyunca ilerleyin ve proliferatif mitoz (metafaz, anafaz, telofaz ve sitokinez) için bakmak, ama gelişmekte olan stoma (Şekil 1viii) biçimlendirici hücre bölünmesini önlemek 9. En uzak mitotik figür bulunduğu tanımlayın.
- yaprak tabanı ve en distal epidermal mitotik figür arasındaki mesafeyi ölçerek meristem uzunluğunu belirler. Resim çerçevesi tam uzunluğunu ölçmek için bir görüntü analiz yazılımı (örneğin, ImageJ) kullanın.
- (En uzak mitotik rakam yaprak tabanından) tam meristem uzunluğunu kapsayan kare sayısını ve tam meristem uzunluğu (Şekil 1IX) elde etmek için bir çerçeve uzunluğu çarpın.
4. Hücre Uzunluğu Profili
- laktik asit (adım 2.5) saklanır segmenti alın ve bankta dikkatlice yerleştirin. segmentler zekâ Cut1 cm her (Şekil 1x) 10 segmentlerinde ha neşter.
- laktik asit, küçük bir damla bir mikroskop lamı üzerine birbirini takip eden yaprak segmentleri monte edin. sürekli polar taraf veya eksen dışı tarafı yukarı ya yüz emin olun. Prensip olarak, belirli bir tarafı için bir tercih edilmektedir.
- Yaprak tabanından başlayarak, segmentleri analiz diferansiyel girişim kontrast (DIC) optik ile donatılmış bir mikroskop kullanarak. sürekli aynı hücre tipini seçmek için bir görüntü analiz yazılımı ile stoma dosyalara doğrudan bitişik dosyaları en az 20 tekrarlı epidermal hücrelerin uzunluğunu ölçün.
- Segmentler (segment yeterli olurken başına 4 pozisyon) her biri boyunca eşit aralıklı pozisyonlarda bunu ve yaprak (Şekil 1xi) boyunca her ölçüm için ilgili pozisyon yazmak emin olun.
- Yerel bir polinom düzeltme s kullanarak yaprak ekseni boyunca her mm ortalama hücre uzunluğunu belirlemekrocedure, R-script (; Ek Dosya 1 Şekil 1xii) uygulanan.
NOT: R-komut yumuşatma artan veri bir dizi sağlar. Gerekli düzgünleştirme miktarı sadece yerel gürültü çıkarmak, ama genel eğri etkilememelidir ideal biraz keyfi ve. bir deney içinde tüm örnekler için yumuşatma aynı miktarda kullanmaya dikkat edin. - bitkiler arasındaki her pozisyonda hücre uzunluğu ortalama ve yaprak ekseni boyunca bir hücre uzunluğu profili oluşturmak için standart hata hesaplayın.
Kinematik Parametrelerinin 5. Hesaplamaları (Ek Dosya 2 bakınız)
- (Adım 1.3 olarak örneğin 24 saat) iki ardışık zaman noktaları arasında yaprak uzunluğu değişimi alarak ve zaman aralığı bölünerek LER hesaplayın.
- Hücreler kendi olgun ce% 95 ulaşır nerede tabanından pozisyon distaline karşılık gelen büyüme bölgesi (L gz) uzunluğunu hesaplamakdüzeltilir hücre uzunluğu profilde ll uzunluğu.
- Bu konumda (Şekil 2) Aşağıdaki tüm hücre uzunluklarının ortalama düzeltilir hücre uzunluğu profili% 95 üzerindeki her pozisyon için atın.
- Her pozisyonda hesaplanan% 95 hücre uzunluğu ile düzeltilir hücre uzunluklarını (adım 4.4) karşılaştırın. (; Ek Veriler 2'ye bakınız Şekil 2) yaprağın tabanından başlayarak, büyüme bölgesi gerçek hücre uzunluğu aşağıdaki hücre uzunlukları% 95 eşit konumda biter.
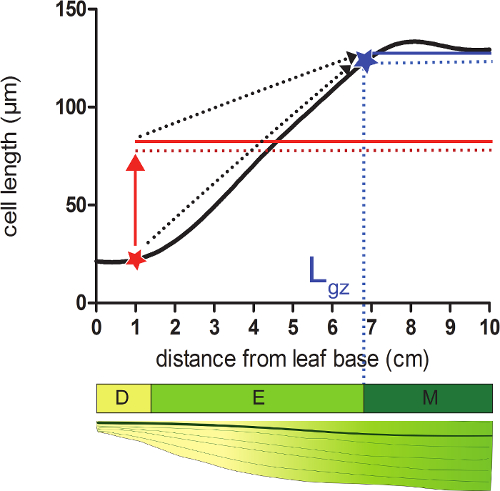
Şekil 2:. Büyüme bölgesinin son belirleme meristem: yıldız simgesi ile gösterilen pozisyonda, gerçek hücre boyutu% 95'inden daha az, bu konumu, aşağıdaki tüm hücrelerin ortalama hücre boyutuna (kırmızı çizgi) (kırmızı katı hat). Büyüme bölgesi (L gz sonu; ab ile gösterilir% 95 bu pozisyonda (katı mavi çizgi izleyen tüm hücrelerin ortalama hücre boyutu (noktalı mavi çizgi)) gerçek hücre boyutunu eşittir lue yıldızı) yer almaktadır. Küme bölgesi (D), uzama bölgesi (E), ve olgun bölgesi (M). Kesikli oklar, yerel boyut ve yaprak ucu bazal pozisyonlarda hareket yaprak uzak kısmı üzerinde ortalama büyüklüğü% 95 arasında yakınlaşmayı gösteriyor. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
- Büyüme bölgesi (L gz) ve meristem boyutu uzunluğu arasındaki fark olarak uzama bölgesi (L el) uzunluğunu hesaplamak (L mer; 3. adımda belirlenen).
- Olgun bölgede ortalama hücre uzunluğu gibi olgun hücre uzunluğu (l mat) hesaplayın.
- Elde etmek için l mat LER bölünHücre üretim hızı (P).
- N GZ ve N mer arasındaki fark olarak uzama bölgesi (N El) hücre sayısını hesaplayın. Meristem (N mer) hücre sayısı meristem mukabil aralıklarla yer alan hücrelerin toplam sayısına eşittir. Büyüme bölgesi (N gz) hücrelerin sayısı büyüme bölgesine tekabül eden aralıklarda bulunan hücrelerin toplam sayısına eşittir.
- P / N mer olarak ortalama hücre bölünmesi oranı (D) hesaplayın. Hücre döngüsü süresi (T c) ln (2) / D eşittir.
- P N el bölerek uzama bölgesi (T el) zamanı hesaplayın. Bölünme bölgesinde zaman günlüğü 2 (N mer) * T c eşittir. Meristemi ayrılan hücrelerin uzunluğu (l div)meristem sonunda düzeltilir hücre uzunluğu profilinden hücre uzunluğuna eşittir.
- Ln (l mat) -ln (l div)] / T el: ortalama aşağıdaki formül kullanılarak hücre genişleme oranı (R el) hesaplayın.
Sonuçlar
Burada, biz onların yaprak büyümesi açısından kuraklık stresi koşullarında (kuraklık,% 34 SWC) tabi sulak bitkiler (kontrol,% 54 toprak su içeriği, (SWC)) ve bitkiler arasındaki bir eşleşme göstermiştir. Tüm bitkiler ° C gündüz / gece, 300-400 μEm -2 sn-1 fotosentetik aktif radyasyon (PAR). Kuraklık 25 ° C / 18, kontrollü şartlar (16 saat gün / 8 saat gece altında bir büyütme odası içinde yetiştirilmiştir doğru SWC ulaştı ve daha...
Tartışmalar
mısır yapraklarında tam kinematik analiz yaprak büyüme hücresel bazda tespitine imkan ve verimli örnekleme stratejilerinin tasarımı için izin verir. protokol nispeten basit olmasına rağmen, bazı dikkatli takip kritik adımlarda tavsiye edilir: (1) meristem uzunluğu tayini (adım 3) beri, meristemi zarar vermeden genç, kapalı yaprakları (2.3 adım) ayırmak için önemlidir tam gerektirir meristem mevcut olması. Bazı uygulama önceden gerekebilir. (2) Meristematik uzunluğu tayini mitoz yorumuna dayanm...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
Bu çalışma VA Anvers Üniversitesi'nden bir doktora bursu ile desteklenmiştir; KS Flamanca Bilim Vakfı (FWO, 11ZI916N) bir doktora bursu; FWO (G0D0514N) proje hibeleri; uyumlu bir araştırma faaliyeti (GOA) Araştırma hibe, Antwerp Üniversitesi araştırma konseyinden "Yaprak Morfogenez A Sistem Biyolojisi Yaklaşımı"; ve Üniversitelerarası Atraksiyon Polonyalılar (IUAP VII / 29, MARS), tüm video katkıda GTSB Han Asard, Bulelani L. Sizani ve Hamada AbdElgawad için Belçika Federal Bilim Politikası Dairesi (BELSPO) den "Mısır ve Arabidopsis Kök ve Büyüme Vur" .
Malzemeler
| Name | Company | Catalog Number | Comments |
| Pots | Any | Any | We use pots with the following measueres, but can be different depending on the treatment/study : bottom diameter: 11cm, opening diameter: 15 cm, height: 12 cm. We grow one maize plant per pot. |
| Planting substrate | Any | Any | We use potting medium (Jiffy, The Netherlands), but other substrates can be used, depending on treatment/study. |
| Ruler | Any | Any | An extension ruler that covers at least 1,5 meters is needed to measure the final leaf length of the plants. |
| Seeds | Any | NA | Seeds can be ordered from a breeder. |
| Scalpel | Any | Any | The scalpel is used during leaf harvesting to detach the leaf of interest from its surrounding leaves and right after harvesting to cut a proper sample for cell length and meristem length measurements. |
| 15 ml falcon tubes | Any | Any | The 15 ml falcon tubes are used for storing samples used for cell length measurements during sample clearing with absolute ethanol and lactic acid. |
| Eppendorf tubes | Any | Any | The eppendorf tubes are used for storing samples used for meristem length measurements in ethanol:acetic acid 3:1 (v:v) solution. |
| Gloves | Any | Any | Latex gloves, which protect against corrosive reagents. |
| Acetic acid | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1; Flammable liquids, categories 1,2,3 |
| Absolute ethanol | Any | Any | CAUTION: Hazardous in case of skin contact (irritant), of eye contact (irritant), of inhalation. Slightly hazardous in case of skin contact (permeator), of ingestion |
| Lactic acid >98% | Any | Any | CAUTION: Corrosive to metals, category 1 Skin corrosion, categories 1A,1B,1C Serious eye damage, category 1 |
| Sodium chloride (NaCl) | Any | Any | |
| Ethylenediaminetetraacetic acid (EDTA) | Any | Any | CAUTION: Acute toxicity (oral, dermal, inhalation), category 4 Skin irritation, category 2 Eye irritation, category 2 Skin sensitisation, category 1 Specific Target Organ Toxicity – Single exposure, category 3 |
| Tris(hydroxymethyl)aminomethane hydrochloride (Tris-HCl) | Any | Any | This material can be an irritant, contact with eyes and skin should be avoided. Inhalation of dust may be irritating to the respiratory tract. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Any | Any | Cell permeable fluorescent minor groove-binding probe for DNA. Causes skin irritation. May cause an allergic skin reaction. May cause respiratory irritation. |
| Ice | Any | NA | The DAPI solution has to be kept on ice. |
| Fluorescent microscope | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any fluorescent microscope can be used for determining meristem length. | |
| Microscopic slide | Any | Any | |
| Cover glass | Any | Any | |
| Tweezers | Any | Any | Tweezers are needed for unfolding the rolled maize leaf right after harvesting in order to cut a proper sample for cell length and meristem length measurements. |
| Image-analysis software | Axiovision (Release 4.8) from Zeiss | NA | The software can be downloaded at: http://www.zeiss.com/microscopy/en_de/downloads/axiovision.html. Other softwares such as ImageJ (https://imagej.nih.gov/ij/) could be used as well. |
| Microscope equipped with DIC | AxioScope A1, Axiocam ICm1 from Zeiss or other | Any microscope, equipped with differential interference contrast (DIC) can be used to measure cell lengths. | |
| R statistical analysis software | R Foundation for Statistical Computing | NA | Open source; Could be downloaded at https://www.r-project.org/ |
| R script | NA | NA | We use the kernel smoothing function locpoly of the Kern Smooth package (Wand MP, Jones MC. Kernel Smoothing: Chapman & Hall/CRC (1995)). The script is available for Mac and Windows upon inquire with the corresponding author. We have versions for Mac and Windows. |
Referanslar
- Fiorani, F., Beemster, G. T. S. Quantitative analyses of cell division in plants. Plant Mol. Biol. 60, 963-979 (2006).
- Silk, W. K., Erickson, R. O. Kinematics of Plant-Growth. J. Theor. Biol. 76, 481-501 (1979).
- Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., Hennig, L., Köhler, C. Kinematic Analysis of Cell Division and Expansion. Plant Developmental Biology. , (2010).
- Avramova, V., Sprangers, K., Beemster, G. T. S. The Maize Leaf: Another Perspective on Growth Regulation. Trends Plant Sci. 20, 787-797 (2015).
- Rymen, B., et al. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol. 143, 1429-1438 (2007).
- Muller, B., Reymond, M., Tardieu, F. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot. 52, 1259-1268 (2001).
- Beemster, G. T. S., Masle, J., Williamson, R. E., Farquhar, G. D. Effects of soil resistance to root penetration on leaf expansion in wheat (Triticum aestivum L): Kinematic analysis of leaf elongation. J. Exp. Bot. 47, 1663-1678 (1996).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Spatial and Temporal Aspects of Leaf Growth-Inhibition. Planta. 191, 433-439 (1993).
- Sylvester, A. W., Smith, L. G., Bennetzen, J. L., Hake, S. C. Cell Biology of Maize Leaf Development. Handbook of maize: It's Biology. , (2009).
- Nelissen, H., et al. A Local Maximum in Gibberellin Levels Regulates Maize Leaf Growth by Spatial Control of Cell Division. Curr. Biol. 22, 1183-1187 (2012).
- Avramova, V., et al. Drought Induces Distinct Growth Response, Protection, and Recovery Mechanisms in the Maize Leaf Growth Zone. Plant Physiol. 169, 1382-1396 (2015).
- Picaud, J. C., et al. Total malondialdehyde (MDA) concentrations as a marker of lipid peroxidation in all-in-one parenteral nutrition admixtures (APA) used in newborn infants. Pediatr. Res. 53, 406 (2003).
- Basu, P., Pal, A., Lynch, J. P., Brown, K. M. A novel image-analysis technique for kinematic study of growth and curvature. Plant Physiol. 145, 305-316 (2007).
- Vander Weele, C. M., et al. A new algorithm for computational image analysis of deformable motion at high spatial and temporal resolution applied to root growth. Roughly uniform elongation in the meristem and also, after an abrupt acceleration, in the elongation zone. Plant Physiol. 132, 1138-1148 (2003).
- Nelissen, H., Rymen, B., Coppens, F., Dhondt, S., Fiorani, F., Beemster, G. T. S., DeSmet, I. . Plant Organogenesis. , (2013).
- Ben-Haj-Salah, H., Tardieu, F. Temperature Affects Expansion Rate of Maize Leaves without Change in Spatial-Distribution of Cell Length - Analysis of the Coordination between Cell-Division and Cell Expansion. Plant Physiol. 109, 861-870 (1995).
- Fiorani, F., Beemster, G. T. S., Bultynck, L., Lambers, H. Can meristematic activity determine variation in leaf size and elongation rate among four Poa species? A kinematic study. Plant Physiol. 124, 845-855 (2000).
- Pettko-Szandtner, A., et al. Core cell cycle regulatory genes in rice and their expression profiles across the growth zone of the leaf. J. Plant Res. 128, 953-974 (2015).
- Poorter, H., Remkes, C. Leaf-Area Ratio and Net Assimilation Rate of 24 Wild-Species Differing in Relative Growth-Rate. Oecologia. 83, 553-559 (1990).
- Macadam, J. W., Volenec, J. J., Nelson, C. J. Effects of Nitrogen on Mesophyll Cell-Division and Epidermal-Cell Elongation in Tall Fescue Leaf Blades. Plant Physiol. 89, 549-556 (1989).
- Tardieu, F., Granier, C. Quantitative analysis of cell division in leaves: methods, developmental patterns and effects of environmental conditions. Plant Mol. Biol. 43, 555-567 (2000).
- Bernstein, N., Silk, W. K., Lauchli, A. Growth and Development of Sorghum Leaves under Conditions of Nacl Stress - Possible Role of Some Mineral Elements in Growth-Inhibition. Planta. 196, 699-705 (1995).
- Erickson, R. O., Sax, K. B. Rates of Cell-Division and Cell Elongation in the Growth of the Primary Root of Zea-Mays. P. Am. Philos. Soc. 100, 499-514 (1956).
- Beemster, G. T. S., Baskin, T. I. Analysis of cell division and elongation underlying the developmental acceleration of root growth in Arabidopsis thaliana. Plant Physiol. 116, 1515-1526 (1998).
- Goodwin, R. H., Stepka, W. Growth and differentiation in the root tip of Phleum pratense. Am. J. Bot. 32, 36-46 (1945).
- Hejnowicz, Z. Growth and Cell Division in the Apical Meristem of Wheat Roots. Physiologia Plantarum. 12, 124-138 (1959).
- Gandar, P. W. Growth in Root Apices .1. The Kinematic Description of Growth. Bot. Gaz. 144, 1-10 (1983).
- Baskin, T. I., Cork, A., Williamson, R. E., Gorst, J. R. Stunted-Plant-1, a Gene Required for Expansion in Rapidly Elongating but Not in Dividing Cells and Mediating Root-Growth Responses to Applied Cytokinin. Plant Physiol. 107, 233-243 (1995).
- Sacks, M. M., Silk, W. K., Burman, P. Effect of water stress on cortical cell division rates within the apical meristem of primary roots of maize. Plant Physiol. 114, 519-527 (1997).
- Granier, C., Tardieu, F. Spatial and temporal analyses of expansion and cell cycle in sunflower leaves - A common pattern of development for all zones of a leaf and different leaves of a plant. Plant Physiol. 116, 991-1001 (1998).
- De Veylder, L., et al. Functional analysis of cyclin-dependent kinase inhibitors of Arabidopsis. Plant Cell. 13, 1653-1667 (2001).
- Kwiatkowska, D. Surface growth at the reproductive shoot apex of Arabidopsis thaliana pin-formed 1 and wild type. J. Exp. Bot. 55, 1021-1032 (2004).
- Kutschmar, A., et al. PSK-alpha promotes root growth in Arabidopsis. New Phytol. 181, 820-831 (2009).
- Vanneste, S., et al. Plant CYCA2s are G2/M regulators that are transcriptionally repressed during differentiation. Embo J. 30, 3430-3441 (2011).
- Eloy, N. B., et al. Functional Analysis of the anaphase-Promoting Complex Subunit 10. Plant J. 68, 553-563 (2011).
- Eloy, N. B., et al. SAMBA, a plant-specific anaphase-promoting complex/cyclosome regulator is involved in early development and A-type cyclin stabilization. P. Natl. Acad. Sci. USA. 109, 13853-13858 (2012).
- Dhondt, S., et al. SHORT-ROOT and SCARECROW Regulate Leaf Growth in Arabidopsis by Stimulating S-Phase Progression of the Cell Cycle. Plant Physiol. 154, 1183-1195 (2010).
- Baute, J., et al. Correlation analysis of the transcriptome of growing leaves with mature leaf parameters in a maize RIL population. Genome Biol. 16, (2015).
- Andriankaja, M., et al. Exit from Proliferation during Leaf Development in Arabidopsis thaliana: A Not-So-Gradual Process. Dev. Cell. 22, 64-78 (2012).
- Beemster, G. T. S., et al. Genome-wide analysis of gene expression profiles associated with cell cycle transitions in growing organs of Arabidopsis. Plant Physiol. 138, 734-743 (2005).
- Spollen, W. G., et al. Spatial distribution of transcript changes in the maize primary root elongation zone at low water potential. Bmc Plant Biol. 8, (2008).
- Candaele, J., et al. Differential Methylation during Maize Leaf Growth Targets Developmentally Regulated Genes. Plant Physiol. 164, 1350-1364 (2014).
- West, G., Inze, D., Beemster, G. T. S. Cell cycle modulation in the response of the primary root of Arabidopsis to salt stress. Plant Physiol. 135, 1050-1058 (2004).
- Zhang, Z., Voothuluru, P., Yamaguchi, M., Sharp, R. E., Peck, S. C. Developmental distribution of the plasma membrane-enriched proteome in the maize primary root growth zone. Front. Plant Sci. 4, (2013).
- Bonhomme, L., Valot, B., Tardieu, F., Zivy, M. Phosphoproteome Dynamics Upon Changes in Plant Water Status Reveal Early Events Associated With Rapid Growth Adjustment in Maize Leaves. Mol. Cell Proteomics. 11, 957-972 (2012).
- Schnyder, H., Nelson, C. J. Growth-Rates and Assimilate Partitioning in the Elongation Zone of Tall Fescue Leaf Blades at High and Low Irradiance. Plant Physiol. 90, 1201-1206 (1989).
- Schnyder, H., Nelson, C. J., Spollen, W. G. Diurnal Growth of Tall Fescue Leaf Blades .2. Dry-Matter Partitioning and Carbohydrate-Metabolism in the Elongation Zone and Adjacent Expanded Tissue. Plant Physiol. 86, 1077-1083 (1988).
- Schnyder, H., Nelson, C. J. Growth-Rates and Carbohydrate Fluxes within the Elongation Zone of Tall Fescue Leaf Blades. Plant Physiol. 85, 548-553 (1987).
- Vassey, T. L., Shnyder, H. S., Spollen, W. G., Nelson, C. J. Cellular Characterisation and Fructan Profiles in Expanding Tall Fescue. Curr. T. Pl. B. 4, 227-229 (1985).
- Allard, G., Nelson, C. J. Photosynthate Partitioning in Basal Zones of Tall Fescue Leaf Blades. Plant Physiol. 95, 663-668 (1991).
- Spollen, W. G., Nelson, C. J. Response of Fructan to Water-Deficit in Growing Leaves of Tall Fescue. Plant Physiol. 106, 329-336 (1994).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .1. Relationship to Genetically Altered Leaf Elongation Rates. Plant Physiol. 74, 590-594 (1984).
- Volenec, J. J., Nelson, C. J. Carbohydrate-Metabolism in Leaf Meristems of Tall Fescue .2. Relationship to Leaf Elongation Rates Modified by Nitrogen-Fertilization. Plant Physiol. 74, 595-600 (1984).
- Silk, W. K., Walker, R. C., Labavitch, J. Uronide Deposition Rates in the Primary Root of Zea-Mays. Plant Physiol. 74, 721-726 (1984).
- Granier, C., Inze, D., Tardieu, F. Spatial distribution of cell division rate can be deduced from that of p34(cdc2) kinase activity in maize leaves grown at contrasting temperatures and soil water conditions. Plant Physiol. 124, 1393-1402 (2000).
- Voothuluru, P., Sharp, R. E. Apoplastic hydrogen peroxide in the growth zone of the maize primary root under water stress.1. Increased levels are specific to the apical region of growth maintenance. J. Exp. Bot. 64, 1223-1233 (2012).
- Wu, Y. J., Jeong, B. R., Fry, S. C., Boyer, J. S. Change in XET activities, cell wall extensibility and hypocotyl elongation of soybean seedlings at low water potential. Planta. 220, 593-601 (2005).
- Macadam, J. W., Nelson, C. J., Sharp, R. E. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .1. Spatial-Distribution of Ionically Bound Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 872-878 (1992).
- Macadam, J. W., Sharp, R. E., Nelson, C. J. Peroxidase-Activity in the Leaf Elongation Zone of Tall Fescue .2. Spatial-Distribution of Apoplastic Peroxidase-Activity in Genotypes Differing in Length of the Elongation Zone. Plant Physiol. 99, 879-885 (1992).
- Beemster, G. T. S., De Vusser, K., De Tavernier, E., De Bock, K., Inze, D. Variation in growth rate between Arabidopsis ecotypes is correlated with cell division and A-type cyclin-dependent kinase activity. Plant Physiol. 129, 854-864 (2002).
- Kavanova, M., Lattanzi, F. A., Schnyder, H. Nitrogen deficiency inhibits leaf blade growth in Lolium perenne by increasing cell cycle duration and decreasing mitotic and post-mitotic growth rates. Plant Cell Environ. 31, 727-737 (2008).
- Macadam, J. W., Nelson, C. J. Secondary cell wall deposition causes radial growth of fibre cells in the maturation zone of elongating tall fescue leaf blades. Ann. Bot-London. 89, 89-96 (2002).
- Schnyder, H., Nelson, C. J. Diurnal Growth of Tall Fescue Leaf Blades .1. Spatial-Distribution of Growth, Deposition of Water, and Assimilate Import in the Elongation Zone. Plant Physiol. 86, 1070-1076 (1988).
- Gastal, F., Nelson, C. J. Nitrogen Use within the Growing Leaf Blade of Tall Fescue. Plant Physiol. 105, 191-197 (1994).
- Vanvolkenburgh, E., Boyer, J. S. Inhibitory Effects of Water Deficit on Maize Leaf Elongation. Plant Physiol. 77, 190-194 (1985).
- Silk, W. K., Hsiao, T. C., Diedenhofen, U., Matson, C. Spatial Distributions of Potassium, Solutes, and Their Deposition Rates in the Growth Zone of the Primary Corn Root. Plant Physiol. 82, 853-858 (1986).
- Meiri, A., Silk, W. K., Lauchli, A. Growth and Deposition of Inorganic Nutrient Elements in Developing Leaves of Zea-Mays L. Plant Physiol. 99, 972-978 (1992).
- Neves-Piestun, B. G., Bernstein, N. Salinity-induced inhibition of leaf elongation in maize is not mediated by changes in cell wall acidification capacity. Plant Physiol. 125, 1419-1428 (2001).
- Bouchabke, O., Tardieu, F., Simonneau, T. Leaf growth and turgor in growing cells of maize (Zea mays L.) respond to evaporative demand under moderate irrigation but not in water-saturated soil. Plant Cell Environ. 29, 1138-1148 (2006).
- Westgate, M. E., Boyer, J. S. Transpiration-Induced and Growth-Induced Water Potentials in Maize. Plant Physiol. 74, 882-889 (1984).
- Horiguchi, G., Gonzalez, N., Beemster, G. T. S., Inze, D., Tsukaya, H. Impact of segmental chromosomal duplications on leaf size in the grandifolia-D mutants of Arabidopsis thaliana. Plant J. 60, 122-133 (2009).
- Fleury, D., et al. The Arabidopsis thaliana homolog of yeast BRE1 has a function in cell cycle regulation during early leaf and root growth. Plant Cell. 19, 417-432 (2007).
- Vlieghe, K., et al. The DP-E2F-like gene DEL1 controls the endocycle in Arabidopsis thaliana. Curr. Biol. 15, 59-63 (2005).
- Boudolf, V., et al. The plant-specific cyclin-dependent kinase CDKB1;1 and transcription factor E2Fa-DPa control the balance of mitotically dividing and endoreduplicating cells in Arabidopsis. Plant Cell. 16, 2683-2692 (2004).
- Baskin, T. I., Beemster, G. T. S., Judy-March, J. E., Marga, F. Disorganization of cortical microtubules stimulates tangential expansion and reduces the uniformity of cellulose microfibril alignment among cells in the root of Arabidopsis. Plant Physiol. 135, 2279-2290 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır