Method Article
Tratamiento de las estructuras de ligamentos con suero acondicionado con ejercicio: Un modelo de ingeniería de tejidos traslacional
En este artículo
Resumen
Presentamos un modelo de tejido ligamentario en el que las construcciones tridimensionales se tratan con el suero humano condicionado al ejercicio y se analizan el contenido de colágeno, la función y la bioquímica celular.
Resumen
Los experimentos in vitro son esenciales para comprender los mecanismos biológicos; Sin embargo, la brecha entre el cultivo de tejidos monocapa y la fisiología humana es grande, y la traducción de los hallazgos es a menudo pobre. Por lo tanto, existe una amplia oportunidad para enfoques experimentales alternativos. Aquí presentamos un enfoque en el que las células humanas se aíslan de remanentes humanos del tejido del ligamento cruzado anterior, se expanden en cultivo y se usan para formar ligamentos manipulados. El ejercicio altera el medio bioquímico en la sangre de tal manera que se mejora la función de muchos tejidos, órganos y procesos corporales. En este experimento, los medios de cultivo de construcción de ligamentos se suplementaron con suero humano experimental que ha sido "condicionado" por el ejercicio. Por lo tanto, la intervención es más biológicamente relevante ya que un tejido experimental está expuesto al medio bioquímico endógeno completo, incluyendo proteínas de unión y compuestos adyuvantes que pueden alterarse en tándem con la actividad de unAgente desconocido de interés. Después del tratamiento, los ligamentos de ingeniería pueden ser analizados para determinar la función mecánica, el contenido de colágeno, la morfología y la bioquímica celular. En general, hay cuatro ventajas principales en comparación con el cultivo monocapa tradicional y los modelos animales, del modelo fisiológico del tejido del ligamento que se presenta aquí. En primer lugar, las construcciones ligamentales son tridimensionales, permitiendo cuantificar las propiedades mecánicas ( es decir , la función) tales como la tensión de tracción final, la carga máxima de tracción y el módulo. En segundo lugar, la entesis, la interfaz entre los huesos y los nervios elementos, se puede examinar en detalle y dentro del contexto funcional. En tercer lugar, la preparación de los medios con suero post-ejercicio permite que los efectos del medio bioquímico inducido por el ejercicio, que es responsable de la amplia gama de beneficios para la salud del ejercicio, sean investigados de manera imparcial. Finalmente, este modelo experimental avanza la investigación científica de una manera humana y ética reemplazando el uso deAnimales, un mandato básico de los Institutos Nacionales de Salud, el Centro para el Control de Enfermedades y la Administración de Alimentos y Medicamentos.
Introducción
Las lesiones de tendones y ligamentos son comunes y pueden tener consecuencias debilitantes sobre la movilidad normal y la calidad de vida. La intervención quirúrgica es a menudo necesaria, pero puede tener un éxito limitado y variado 4 , 5 . La comprensión actual de cómo los tendones y los ligamentos se desarrollan, maduran y responden a la lesión es incompleta, por lo tanto, los modelos de investigación eficaces son necesarios para proporcionar una visión sobre el desarrollo de tratamientos más eficaces 5 . Para abordar esta brecha de conocimiento, pueden utilizarse modelos animales, pero los estudios in vivo son intrínsecamente complejos con dificultad en controlar el medio ambiente y dirigir directamente las intervenciones al tejido deseado. En contraste, el entorno experimental puede ser fácilmente controlado y monitorizado in vitro con cultivo de células monocapa tradicional. Sin embargo, esta técnica puede simplificar excesivamente el ambiente químico y mecánico y por lo tanto no puede recapituEl comportamiento in vivo de las células. La ingeniería de tejidos es capaz de casar las ventajas del complejo ambiente in vivo en modelos animales con el control del ambiente in vitro y proporciona una herramienta adicional para estudiar la fisiología. Además, armado con una mejor comprensión del desarrollo del ligamento, ingeniería de tejidos también puede proporcionar una fuente de tejido de injerto cuando la reconstrucción quirúrgica es necesaria [ 6] . Por lo tanto, el método descrito en este documento valida un tejido in vitro 3D manipulado que puede usarse para estudiar la función y morfología del ligamento.
Las construcciones de tendones o ligamentos a base de fibrina se han utilizado como un modelo in vitro para estudiar procesos fisiológicos que incluyen fibrilación 7 de colágeno y desarrollo de tendones 8 , así como aplicaciones de traducción en las que se ha evaluado su utilidad como tejido de injerto en un modelo de oveja de cru anteriorCial (ACL) 9 . Nuestro laboratorio ha establecido previamente un modelo de ligamento 3D dirigido a través de dos brushite, un fosfato de calcio material sustituto óseo, anclajes de cemento. Este modelo puede ser sometido a diferentes condiciones experimentales con facilidad simplemente complementando los medios de cultivo con factores biológicos 10 o aplicando estimulación mecánica 11 . Es importante destacar que este modelo de ligamento de hueso a hueso permite el análisis en profundidad de la entesis, la interfaz entre los huesos y los nervios elementos, que es susceptible de lesión.
En el estudio destacamos 1 para presentar esta metodología, estábamos interesados en el efecto de los cambios inducidos por el ejercicio en el medio bioquímico en la función del ligamento. El ejercicio mejora la función celular y de órganos en una variedad de tejidos en todo el cuerpo 2 , 3 , 12 , un efecto que puede atribuirse a la liberación de varios conocidos (por ejemplo IL-6 13 , IL-15 14 , Meteorin-like 15 , exosomes 16 , 17 ) y otros factores bioquímicos desconocidos liberados en la circulación sistémica . Además, el medio bioquímico después del ejercicio se enriquece con hormonas sensibles al ejercicio, cuya liberación es estimulada por estimulación del sistema nervioso simpático de las glándulas secretoras ( por ejemplo , cortisol y catecolaminas de la glándula suprarrenal 18 y hormona del crecimiento de la pituitaria 19 ). Sin embargo, en vivo , es imposible diferenciar los efectos del estímulo mecánico del ejercicio de los cambios bioquímicos inducidos por el ejercicio. Aunque algunos estudios han caracterizado el aumento esperado de ciertas hormonas circulantes y citoquinas en respuesta al ejercicioE como se mencionó anteriormente, hay demasiados factores, tanto conocidos como desconocidos, para recapitular fielmente in vitro. Es decir, aislar algunos factores para un estudio in vitro aborda inadecuadamente la complejidad de la respuesta bioquímica. En este estudio, se investigó cómo los cambios en el medio bioquímico del suero, impulsado por el ejercicio, afecta la función del ligamento de ingeniería. Para aislar los efectos de los cambios bioquímicos, obtuvimos suero de participantes humanos antes y después de un ejercicio de resistencia y lo usamos para tratar ligamentos de ingeniería 3D formados usando fibroblastos del ligamento cruzado anterior (ACL) humano. Utilizando este modelo, podemos obtener datos funcionales, incluyendo efectos sobre las propiedades mecánicas y el contenido de colágeno, así como cuantificar los efectos sobre la señalización molecular.
Protocolo
Los siguientes procedimientos se adhieren a un protocolo que fue aprobado por la Junta de Revisión Institucional de la Universidad de California, Davis; Consulte con la junta de ética local antes de comenzar la investigación.
1. Aísle los fibroblastos primarios de los remanentes del LCA humano
NOTA: Mantenga la esterilidad y realice todos los pasos en un gabinete de seguridad biológica (BSC).
- Obtener la aprobación de la junta de revisión ética apropiada para la recolección y uso de tejidos humanos como se describe a continuación.
- Preparar la solución antibiótica / antimicótica (ABAM) 5x diluyendo 100 veces la solución antibiótica / antimicótica en solución salina tamponada con fosfato 1X (PBS)
- Recoger los fragmentos de tejido ACL en solución ABAM 5X en un tubo cónico de 50 ml, almacenar a 4 ° C hasta el paso de digestión. Cortar el tejido en fragmentos más pequeños con una hoja de afeitar si es necesario hasta un tamaño máximo de 1 x 1 x 1 cm 3 .
PRECAUCIÓN: Cumplir con las regulaciones locales deEl uso adecuado de material de riesgo biológico y la descontaminación y eliminación de desechos de riesgo biológico. - Preparar un volumen suficiente de solución de colagenasa para sumergir los fragmentos de tejido. Disolver la colagenasa tipo II (1 mg / ml) en medio Eagle modificado con Dulbecco de alta glucosa (DMEM) que contenga 1 penicilina / estreptomicina y 20% de suero fetal bovino (FBS) y filtrar a 0,22 μm.
- Enjuague el tejido de ACL 3 veces en PBS.
- Digerir el tejido. Transferir el tejido de la ACL a un nuevo tubo cónico de 50 ml y agregar un volumen suficiente de solución de colagenasa para sumergir el tejido. Incubar a 37 ° C durante la noche (~ 17 h).
- Antes de que la duración de la digestión sea completa, preparar el medio de crecimiento (GM) mediante la adición de medios de glucosa de DMEM de alta con FBS al 10% y 100 U / mL de penicilina.
- 15 minutos antes de que se complete el tiempo de digestión, vórtice brevemente el tubo de 50 ml que contiene tejido, 3 veces cada 5 min.
- Usando una pipeta serológica de 25 ml, tritura el tejido digerido vigorosamente para romper el tiSsue más arriba y desalojar las células.
- Centrifugar a 1.500 xg durante 5 min. Aspirar el sobrenadante y resuspender pellet en 10 ml de GM.
- Repita los pasos 1.8-1.9 tres veces más.
- Después de la última centrifugación, resuspender el gránulo en 5-10 ml de GM. Utilice una pequeña muestra de la suspensión de células para realizar un recuento de células con un hemocitómetro y evaluar la viabilidad celular utilizando azul de tripano.
- Se plancha la suspensión de células en placas de cultivo de tejido de 15 cm a una densidad de 3-4 x 105 células por placa.
- Cultura a 70% de confluencia en un incubador estéril mantenido a 37 ° C y 5% de CO 2 , cambiando el GM cada tres días. Use o almacene (vea abajo) las células dentro de 5 pasajes.
- Congelar las celdas para su uso futuro.
- Trypsinize células en el 70% de confluencia de la siguiente manera. Aspirar los medios y lavar las células con PBS. Añadir suficiente precalentada (37 ° C) 0,05% tripsina para cubrir sólo la parte inferior de las placas de cultivo de tejidos. Colocar las placas en la incubadora de cultivoAtor durante ~ 5 min hasta que las células estén separadas (verifique que las células están flotando usando un microscopio óptico). Utilice una pipeta para recoger las células y dispensar en un tubo de Falcon.
- Centrifugar para sedimentar células y resuspender las células en medios de glucosa de alto DMEM que contienen FBS al 20% y dimetilsulfóxido al 10% (DMSO). La suspensión de células alícuotas en cryovials y enfriar a -1 ° C / min durante al menos 24 h. Almacene los crioviales congelados en nitrógeno líquido.
2. Prepare placas recubiertas de silicona
- Prepare placas de cultivo de tejido de 35 mm: Retire las tapas y coloque las placas abiertas sobre una superficie plana.
- Mezcle el kit de elastómero de silicona de acuerdo con las instrucciones del fabricante.
- Utilice una jeringa de 10 ml para dispensar aproximadamente 2 ml por placa de 35 mm.
- Deje secar la silicona a temperatura ambiente durante 2-3 días.
3. Prepare anclajes de cemento Brushite
- De antemano, prepare moldes inversos de silicona que contenganLls para la formación del ancla. Los moldes inversos se pueden hacer a las especificaciones de la forma y el tamaño deseados del ancla.
- Determine la altura y el diámetro deseados del anclaje final. Este protocolo utiliza un molde hecho a medida formado de silicona artesanal en un plato de cultivo de tejidos de 35 mm en el que se colocaron cilindros de plástico de aproximadamente 3,25 mm de diámetro, lo que permite una altura final del molde de aproximadamente 6,5 mm. Las dimensiones finales del anclaje son de aproximadamente 3-3,5 mm de altura y aproximadamente 3,4 mm de diámetro con un pasador de 1,5 mm sobresaliendo desde el fondo del anclaje.
- Agregue silicona sin curar a un plato de 35 mm en el que se hará el molde. Coloque los cilindros de plástico en consecuencia.
NOTA: El tamaño de los cilindros de plástico determinará el diámetro de los anclajes finales. La colocación de los cilindros de plástico y la cantidad de silicona utilizada se pueden modificar para producir anclajes de diferentes alturas. El grosor entre el fondo de los pocillos en el molde y el fondo del propio molde dEtermine cuánto del perno puede sobresalir de la parte inferior del ancla permitiendo que el anclaje sea fijado más adelante firmemente en el plato revestido de silicona. - Después de dejar que la silicona cure, retire los cilindros de plástico y retire el molde de la placa de 35 mm.
- Preparar una solución de ácido cítrico de 3,5 M ortofosfórica / 100 mM. Disolver 0,961 g de ácido cítrico en 11,5 ml de ácido ortofosfórico. Llevar el volumen de la solución hasta 50 ml con agua MilliQ. Almacene la solución a temperatura ambiente y proteja de la luz.
- Preparar los moldes: Colocar un pasador minutien en el centro de cada pozo cilíndrico en los moldes.
- Combinar fosfato β-tricálcico y solución de ácido ortofosfórico / cítrico a una concentración de 1 g / ml en un barco de pesada de plástico sobre hielo.
- Mezclar el cemento vigorosamente con un raspador de plástico.
- Tritura el cemento para continuar mezclando y pipeta la mezcla en el molde
- Centrifugar el molde relleno durante 1 min a 2.250 x g.
- Permitir que los anclajes de cemento brushite se ajusten a temperatura ambiente durante la noche.
- Retire los anclajes del molde y fije dos anclajes separados 12 mm en cada placa recubierta de silicona.
- Esterilice las placas fijadas pulverizando con etanol al 70%, llenando las placas y tapas, y colocándolas en un BSC. Después de al menos 30 min, aspire las placas y reemplace las tapas, almacenando en el BSC hasta que sea necesario.
4. Obtener suero humano
- Asegurar que se haya obtenido la aprobación de la junta de revisión ética correspondiente para este protocolo.
- Asegúrese de que el consentimiento informado por escrito ha sido obtenido de sujetos humanos para participar en una intervención dada ( por ejemplo , ejercicio, intervención de alimentos o medicamentos) que afectará los cambios deseados en el suero. Aquí, describimos la colección en reposo y 15 minutos después del ejercicio de resistencia.
- Usando un flebotomista entrenado, obtenga una muestra de sangre en reposo de un participante por venopunción en un recipiente evacuado apropiado.
- Recoja una muestra de sangre después del ejercicio 15 minutos después de que los participantes participen en el protocolo de ejercicio deseado. Como se describió anteriormente 1 , utilizar el protocolo de ejercicio de resistencia en este experimento para estimular una respuesta bioquímica endógena.
- Haga que los participantes realicen cinco series de prensa de pierna con un minuto de descanso entre series. A continuación, haga que los participantes realicen un conjunto de extensiones de rodilla y un conjunto de rizos de tendones consecutivos sin descanso y luego repita los ejercicios de espalda con espalda tres veces con 1 min de descanso entre series.
- Deje que la sangre se coagule antes de centrifugar a 1.500 xg durante 10 min. Bajo condiciones estériles, transfiera suero a tubos estériles para su posterior suplementación con medios (suero almacenado a 4 ° C) y análisis bioquímico (una pequeña alícuota de suero almacenada a -20 ° C).
5. Formar ligamentos artificiales
NOTA: De antemano, expanda primaria fiBroblastos y preparar placas recubiertas de silicona con anclajes pincelados.
- Prepare los reactivos:
- Preparar trombina. Disolver la trombina bovina a 200 U / ml en medio DMEM de alta glucosa. Filtrar a 0,22 μm, alícuota, y almacenar a -20 ° C.
- Preparar el fibrinógeno. Disolver fibrinógeno bovino a 20 mg / ml en medios de glucosa de alto DMEM. Incubar durante 3-4 h en un baño de agua a 37 ° C, remolino cada 30 min para ayudar a la disolución. Filtrar a 0,22 μm (pueden ser necesarios múltiples filtros), alícuota y almacenar a -20 ° C.
- Preparar la aprotinina. Disolver la aprotinina en 10 mg / ml en agua. Filtrar a 0,22 μm, alícuota, y almacenar a -20 ° C.
- Preparar ácido aminohexanoico. Disolver ácido aminohexanoico a 0,1 g / ml en agua. Filtrar a 0,22 μm, alícuota, y almacenar a 4 ° C.
- Preparar ácido ascórbico. Disolver el ácido ascórbico en medio DMEM de alta glucosa a una concentración de 50 mM. Filtrar a 0,22 μm y almacenar a 4 ° C.
- Prepare L-prolina. Disolver L-prolina en PBS a una concentración de 50 mM. Filtrar a 0,22 μm y almacenar a 4 ° C.
- Preparar el factor de crecimiento de transformación-β1 (TGF-β1). Reconstituir TGF-β1 de acuerdo con las instrucciones del fabricante a una concentración de 10 μg / mL. Alícuota y almacenar a -20 ° C.
- Determine el número de construcciones requeridas para el experimento y asegúrese de que se preparen suficientes números de placas fijadas. Se recomiendan repeticiones biológicas y técnicas. En el estudio 1 destacado aquí, se utilizan repeticiones técnicas duplicadas y 12 repeticiones biológicas (suero de 12 individuos en reposo y después del ejercicio).
NOTA: Realice los siguientes pasos bajo condiciones estériles en un BSC. - Expandir las células mediante el cultivo en placas de 15 cm a 70% de confluencia. Se requieren 2,5 x 105 células por constructo.
- Trypsinize células y resuspender en GM a una concentración de 3,67 x 105 células / ml.
- Generar una mezcla maestra para el número de construcciones requeridas: Para 1 construcción, la mezcla maestra contiene 681 μl de suspensión celular (que contiene 2,5 x 10 5 células), 29 μL de trombina, 2 μl de aprotinina y 2 μl de ácido aminohexanoico.
- Después de mezclar bien la mezcla maestra, añada 714 μl a cada placa fijada en un patrón de "figura 8" alrededor de los anclajes de cemento brushite. Asegúrese de que la mezcla maestra contacte directamente los lados de los anclajes.
- Golpee suavemente cada placa para distribuir la mezcla principal uniformemente a través de la placa.
- Para una placa a la vez, a~nadir rápidamente 286 μl de fibrinógeno de una manera gota a gota uniformemente sobre una placa e inmediatamente deslizar la placa hacia adelante y hacia atrás y de lado a lado sobre la superficie de la BSC para distribuir el fibrinógeno para formar los geles de fibrina incrustados en la célula . Continúe con la siguiente placa.
- Colocar las construcciones en un incubador estéril mantenido a 37 ° C y 5% de CO 2 e incubarDurante al menos 15 minutos para permitir la polimerización del fibrinógeno.
- Preparar suficientes medios de alimentación (FM) para 2 ml por construcción. Suplemento de GM con 200 μ M de ácido ascórbico, 50 μ M prolina, y 5 ng / ml TGF-β1.
- Agregue 2 mL de FM para cubrir cada constructo. Cultivar los constructos en un incubador estéril mantenido a 37 ° C y 5% de CO 2 durante un total de 14 días o al punto final deseado, refrescando el medio cada segundo día con 2 mL de FM
6. Ensayos de tracción de ligamentos de ingeniería
NOTA: La prueba de tracción se realizó utilizando un probador de tracción construido a la medida en un baño de PBS; Las empuñaduras moldeadas por inversión que están acopladas al transductor de fuerza mantienen anclas de cemento brushite en su lugar durante la prueba.
- Determine la longitud y el ancho de las construcciones del ligamento utilizando pinzas digitales; Calcular el área de la sección transversal del tejido.
- Suelte la construcción del ligamento de la placa y coloque los anclajes en laReversa, garantizando que la construcción se sumerge en PBS.
- Ajuste la distancia entre las empuñaduras, ajustando la longitud de la construcción a su longitud inicial.
- Comenzar el ensayo: colar el constructo al fallo a una velocidad de deformación de 0,4 mm / s (o ~ 3% / s).
- Después de completar la prueba, procese los restos de tejido para determinar el contenido de colágeno (ver sección 7).
- A partir de los datos de carga-deformación resultantes, calcular los datos tensión-deformación y cuantificar las propiedades mecánicas de interés; Por ejemplo, carga máxima de tracción, resistencia a la tracción final y módulo ( es decir , propiedad elástica sobre una región lineal de la curva tensión-deformación).
7. Cuantificación del contenido de colágeno de los ligamentos de ingeniería
- Quitar los ligamentos de ingeniería de anclajes de cemento brushite y secar a 120 ° C durante 25 min.
- Determine la masa seca de las construcciones y colóquelas en tubos individuales de 1,5 ml. Las construcciones secas se pueden almacenar a temperatura ambienteHasta su posterior procesamiento.
- A cada construcción, se a~naden 200 μl de HCl 6 M. Hervir a 120 ° C en un bloque de calefacción durante 2 h en una campana extractora.
PRECAUCIÓN: El HCl es altamente corrosivo y ácido, se recomienda el uso de tubos a prueba de ebullición / seguridad o cualquier otro método de fijación de tubos. - Centrifugar los tubos brevemente para recoger el líquido y dejarlos sin tapar para evaporar a 120 ° C en un bloque de calefacción durante 1,5 h en una campana extractora.
- Resuspender el sedimento resultante en 200 μl de tampón de hidroxiprolina. Guarde a -20 ° C hasta que sea necesario.
- Preparar el tampón de hidroxiprolina. En 300 ml de agua, se añaden 16,6 g de ácido cítrico, 4 ml de ácido acético, 11,4 g de NaOH y se agita hasta disolución. PH a 6-6,5 y llevar volumen hasta 500 mL. Añadir 250 μL de tolueno como conservante y almacenar a 4 ° C protegido de la luz.
- Prepare los reactivos.
- Preparar trans-4-hidroxi-L-prolina. Disolver en agua para obtener una solución de 4 mg / ml.
- Preparar cloramina-T. Disolver en agua para obtener una solución de 14,1 mg / ml.
- Preparar aldehído-perclorato. Disolver 1,5 g de 4-dimetilaminobenzaldehído en 6 ml de 1-propanol, 2,6 ml de ácido perclórico (PRECAUCIÓN: corrosivo, oxidante fuerte, tomar las precauciones apropiadas) y 0,5 ml de agua.
- En un conjunto de nuevos tubos de 1,5 ml, diluir una muestra de cada pellet resuspendido en tampón de hidroxiprolina a un volumen de 200 μl.
NOTA: Las diluciones pueden variar de 1: 4 a 1:50 de muestra: tampón dependiendo del contenido esperado de colágeno de la muestra; Por lo que puede ser necesario realizar algunas pruebas de ensayo y error para determinar un factor de dilución apropiado para el conjunto de muestras dado (es decir, colocar las muestras hacia el centro de la curva estándar). - Preparar los estándares de hidroxiprolina. Diluir hidroxiprolina en tampón de hidroxiprolina (ver sección 7.5.1) a 80 μg / mL. Realizar diluciones en serie para hacer 6-8 200 μL estándares entre 0-20 μg / mL.
- Añadir 150 μl 14,1 mg /Ml de solución de cloramina T a cada muestra estándar y diluida. Vortex e incubar a temperatura ambiente durante 20 min.
- Añadir 150 μl de solución de aldehído-perclorato a cada muestra y diluir la muestra. Vortex e incubar en un bloque de calentamiento a 60 ° C durante 15 min. Desechar la solución de percloruro de aldehído en exceso como residuo peligroso de acuerdo con las regulaciones locales (contiene ácido perclórico).
- Permita que los patrones y muestras se enfríen, antes de alícuotas de 200 μl de cada una, por duplicado, en placas de 96 pocillos.
- Leer la placa a 550 nm en un espectrofotómetro. Desechar la placa y el volumen restante en tubos de 1,5 mL como residuo peligroso de acuerdo con las regulaciones locales (contiene ácido perclórico).
- Cálculo de colágeno total y fracción de colágeno.
- Convertir el valor de absorbancia para cada muestra en microgramos de hidroxiprolina usando la curva estándar de hidroxiprolina.
- Multiplique cada pocillo por 2,5 para calcular la cantidad de hidroxiprolina enDe la muestra diluida. Recuerde que sólo 200 de la mezcla total de 500 μL (200 μl de muestra diluida + 150 μL de cloramina T +150 μl de solución AP) se añaden a cada pocillo de muestra.
- Multiplicar por el factor de dilución (Sección 7.7) para calcular la cantidad de hidroxiprolina en la muestra original.
- Se divide por 0,137 para calcular la cantidad de colágeno (se supone que el colágeno contiene 13,7% de hidroxiprolina 20 ).
NOTA: La abundancia de hidroxiprolina de mamíferos en el colágeno varía ligeramente entre tejidos y especies de mamíferos; Por ejemplo, el tendón de Aquiles de cerdo y oveja contiene 13,5 y 13,7% (masa de hidroxiprolina / masa seca del tejido), respectivamente 21 . En este caso, utilice el 13,7% para estimar el porcentaje de hidroxiprolina en colágeno, que se utiliza para calcular el contenido de colágeno de una muestra de tejido utilizando la siguiente ecuación: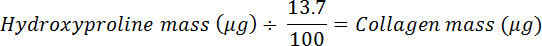
- Divida por la masa seca para calcular el colágeno fraY convertir a un porcentaje.
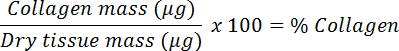
8. Cuantificación de los puntos finales moleculares
NOTA: Además de los resultados primarios de las pruebas de tracción y del contenido de colágeno, los puntos finales moleculares se pueden medir en tejidos 2D o 3D para añadir una visión mecanicista. Los bioensayos pueden usarse para determinar los puntos finales moleculares (ver la siguiente sección para el contexto). El impacto del medio de suero post-ejercicio en la función del ligamento in vitro .
- Para el tejido 3D:
- Prepare los constructos según el Paso 5 anterior.
- Después del tratamiento / intervención de construcción, las construcciones de congelación rápida en nitrógeno líquido.
- Usando un mortero y una maja enfriada en hielo seco, muele las construcciones en un polvo. Continúe en el paso 8.4 / 5).
- Para el tejido 2D:
- Cultivo de fibroblastos de ACL humanos hasta confluencia en unOlayer en placas de seis pocillos que contienen DMEM.
- Aspirar DMEM y aplicar los medios de tratamiento de acuerdo con su estrategia de experimentación ( por ejemplo , experimentos de tiempo o respuesta a la dosis).
- Aspirar los medios de tratamiento y lavar las células con PBS.
- Raspe las células para recogerlas usando un tampón / reactivo de extracción apropiado (véase a continuación).
- Análisis de la expresión de proteínas: Utilizar un tampón de extracción citosólico ( por ejemplo , sacarosa 250 mM, Tris 50 mM pH 7,4, MgCl _ {2} 5 mM y cóctel inhibidor de proteasa / fosfatasa) para obtener lisados proteicos. Realizar el ensayo de concentración de proteínas y continuar el análisis de acuerdo con los procedimientos estándar de Western blot.
- Análisis de expresión génica: Aislar el ARN total usando 500 μl de reactivo de aislamiento de ARN de acuerdo con las instrucciones del fabricante para obtener ARN de alta calidad. Realizar la transcripción inversa y análisis de PCR cuantitativa en tiempo real de acuerdo con los procedimientos estándar.
- Aislamiento del ADN: Aislar y cuantificar gEnomic usando reactivo de aislamiento de ADN de acuerdo con las instrucciones del fabricante. Cuantificar la concentración de ADN utilizando un espectrofotómetro para medir la absorbancia de la muestra a 260 nm.
Resultados
Visión general de la formación del ligamento genético y la intervención experimental
La figura 1 muestra una visión general de la formación de ligamentos manipulados. El cemento de brushita, un material sustitutivo óseo 22, se prepara combinando una solución de ácido ortofosfórico / ácido cítrico con fosfato de β-tricálcico en pocillos cilíndricos. Alternativamente, si no se mide directamente la función mecánica de los tejidos, se pueden usar suturas de seda 3-0 como anclas en la formación de un tejido. Estos se separan 12 mm en placas de 35 mm revestidas con silicona y se esterilizan por inmersión en etanol al 70%. Los fibroblastos se aíslan de los restos del ligamento cruzado anterior obtenidos durante la cirugía de reconstrucción del LCA. Después de la expansión, 2,5 x 10 ^ { 5 } células se encapsulan en un gel de fibrina formado en el plato fijado con anclaje de cemento de cepita. Después de la formación,Se pueden examinar los cambios en las propiedades mecánicas, el contenido de colágeno, la proliferación celular, la expresión génica, los niveles de proteínas y la morfología de los tejidos.
A lo largo del cultivo, las células contraen el gel de fibrina y forman un tejido lineal entre los dos anclajes ( Figura 2A ). Después de 1-2 días en cultivo, las células se han unido al gel de fibrina, procesos de células extendidas, y comenzaron a ejercer fuerzas de tracción ( Figura 2B ). A medida que el gel de fibrina es contraído por fuerzas de tracción y descompuesto por enzimas celulares, se genera tensión entre los dos puntos de anclaje y nuestras células se alinean paralelamente a este eje ( Figura 2B ) y comienzan a depositar colágeno. Después de 4-5 días, las construcciones se han contraído alrededor de los anclajes formando un tejido cilíndrico lineal ( Figura 2A , en este punto pueden aplicarse estímulos externos al sistemaEn este momento evita la interrupción del proceso lineal de formación de tejidos). Las intervenciones pueden consistir en completar los medios de cultivo con suero humano o animal después de una intervención dada, citoquinas exógenas y factores de crecimiento, emplear estimulación mecánica o cambiar otros factores ambientales tales como la tensión del oxígeno. Usando medio de crecimiento (DMEM con 10% de FBS y 100 U / mL de penicilina) suplementado con 200 μM de ácido ascórbico, 50 μM de L-prolina y 5 ng / ml de TGF-β1, hemos determinado que la proliferación celular continúa a lo largo de un cultivo de 2 semanas ( Figura 2C ) y de hecho, la microscopía de luz revela un tejido denso que contiene células altamente alineadas a los 14 días de cultivo ( Figura 2B ).
Evaluación de los ligamentos de ingeniería
Al final del período de cultivo, los ligamentos de ingeniería se pueden evaluar en una variedadY de maneras. Una ventaja importante de este sistema es la capacidad de determinar cambios funcionales en el tejido a través de pruebas mecánicas, una evaluación vital teniendo en cuenta el papel mecánico del ligamento nativo. Las pruebas de tracción uniaxial se pueden utilizar para medir las propiedades mecánicas, incluyendo la carga al fallo, la resistencia a la tracción final y el módulo de Young. Las propiedades viscoelásticas también pueden medirse con ensayos de relajación de tensión y fluencia. La figura 3A representa un ligamento manipulado mantenido en empuñaduras moldeadas inversas en un probador de tracción uniaxial construido a la medida. La empuñadura derecha se une a un transductor de fuerza para medir la carga a través del ligamento a medida que el tejido se somete a un fallo. La Figura 3B muestra una gráfica de esfuerzo-deformación representativa para una prueba de fallo. Después de someterse a ensayos mecánicos, las mismas construcciones se pueden secar y procesar para un ensayo de hidroxiprolina 23 para evaluar el contenido total de colágeno, así como otros bioquímicosEnsayos clínicos. Con un número suficiente de muestras adicionales por condición, puede realizarse un examen exhaustivo de una intervención experimental, incluyendo sus efectos sobre la proliferación celular, la expresión de genes y proteínas y la morfología histológica. Mientras que 14 días es un punto final típico de nuestros estudios, ligamentos de ingeniería siguen mejorando en sus propiedades mecánicas y el contenido de colágeno a través de 28 días de cultivo como se muestra en la Figura 3C y puede sobrevivir por lo menos 3 meses en el cultivo [ 24] .
La variabilidad de los donantes es una consideración importante para la repetibilidad experimental. La Figura 4 muestra un experimento representativo descrito por Lee et al. 25 comparando 7 diferentes donantes de ACL (n = 3 machos y n = 4 mujeres) que demuestran propiedades de tracción típicas y contenido de colágeno después de un cultivo de 2 semanas en el descrito anteriormente Los medios de crecimiento suplementados. El uso de células de colecciones ACL similares, la edad del donante, el tiempo después de la lesión, el sexo, etc., los ligamentos modificados demuestran una baja variabilidad entre donantes y características similares entre donantes masculinos y femeninos con la excepción de la diferencia en la fracción de colágeno. En el estudio mencionado anteriormente, los ligamentos de ingeniería se utilizaron como un modelo in vitro para investigar por qué las mujeres tienen un riesgo significativamente mayor de lesión del LCA que los hombres, y demostró que los fibroblastos de ACL aislados de las donantes femeninas no inherentemente más débiles y menos colágeno ingeniería ligamentos [ 25] .
El impacto del medio de suero post-ejercicio sobre la función del ligamento in vitro
Hemos demostrado previamente la capacidad de los ligamentos diseñados para ser utilizados para sondear los procesos fisiológicos 1 ,Ss = "xref"> 25. En el siguiente experimento representativo según lo informado por West et al. 1 , determinamos los efectos bioquímicos del ejercicio sobre la función del ligamento y destacamos la metodología y los hallazgos aquí. Se formaron ligamentos de ingeniería utilizando células de ACL humanas y se aplicó una intervención, al día 7 de cultivo, que consistía en medios de cultivo acondicionados con suero humano recogido antes o después del ejercicio. En pocas palabras, reclutó a jóvenes varones sanos participantes y recogió muestras de sangre antes y después de un ataque agudo de ejercicio de resistencia que aumenta las hormonas circulantes y citoquinas, incluyendo la hormona del crecimiento humano (GH). El suero humano se aisló de muestras de sangre antes y después del ejercicio y se usó en lugar de suero bovino fetal en el medio de cultivo durante la segunda semana de cultivo de ligamento manipulado ( Figura 5A ). Las muestras de suero antes y después del ejercicio se analizaron usando ELISA para los cambios en la GH y el factor 1 de crecimiento similar a la insulina (IGF-1), elCuya concentración puede ser alterada por el ejercicio ( Figura 5B ). Esta información se utilizó para correlacionar los efectos del suero en los ligamentos de ingeniería con cambios en el suero en respuesta al ejercicio. Después de un período de cultivo de 14 días, las construcciones del ligamento se evaluaron mediante pruebas mecánicas y una determinación de hidroxiprolina del contenido de colágeno y demostraron un aumento significativo tanto en la carga máxima de tracción como en el contenido de colágeno en respuesta al suero posterior al ejercicio. Con el objetivo de evaluar si este efecto estaba relacionado con liberaciones inducidas por ejercicio de GH o IGF-1, se formaron ligamentos manipulados en un experimento separado y se trataron con una respuesta a la dosis de GH recombinante humana o IGF-1. Curiosamente, mientras que la GH sérica aumentó en la sangre ( Figura 5B- i), el aumento progresivo de la concentración de GH recombinante en el medio de cultivo no aumentó el contenido de colágeno ( Figura 5D- i) o mecánicaPropiedades (datos no mostrados) en ligamentos manipulados. Por el contrario, los niveles séricos de IGF-1 no aumentaron después del ejercicio, pero un experimento de dosis-respuesta reveló que los niveles crecientes en los medios de cultivo mejoraban el contenido de colágeno de las construcciones ligamentarias ( Figura 4D- iii). Por lo tanto, mientras que el ejercicio dio lugar a fuertes aumentos en la GH post-ejercicio, el experimento de dosis-respuesta utilizando rhGH plantea dudas sobre si GH es directamente responsable de la mejora fenotípica de los ligamentos de ingeniería (al menos, la isoforma 22 kDa por sí sola no Parecen ser responsables). Por el contrario, mientras que el IGF-1 sérico no se alteró a los 15 minutos después del ejercicio, el ensayo de rhIGF-1 en un amplio intervalo de concentraciones reveló que el IGF-1 es capaz de mejorar el contenido de colágeno; Sin embargo, debe observarse que el aumento de las concentraciones de rhIGF-1 a través de un intervalo que estimó los niveles fisiológicos no aumentó significativamente el contenido de colágeno. Así, el único entorno de suero post-ejercicioNal era importante para mejorar la mecánica y el colágeno de los ligamentos de ingeniería.
En el estudio resaltado aquí 1 , el volumen de suero experimental fue limitado debido a consideraciones éticas; Así, los bioensayos 2D a corto plazo, que tenían demandas de suero más bajas, se utilizaron para investigar más a fondo los mecanismos moleculares responsables del aumento de colágeno que se observó. Los fibroblastos de ACL se cultivaron hasta la confluencia en placas de 6 pocillos y se trataron durante 1 hora con suero en reposo o post-ejercicio, y se compararon con respuestas de dosis de GH recombinante, IGF-1, TGF-β1 y la activación de dianas en PI3K / mTORC1 , ERK1 / 2, y Smad vías de señalización se determinaron. En la presencia de suero post-ejercicio, el PI3K / mTORC1 y ERK1 / 2 vía mostró una mayor activación, evaluada por la fosforilación de S6K ( Figura 5D- i) y ERK1 / 2 ( Figura 5D- ii), respectivamente.En comparación con las respuestas a la dosis de hormonas y citoquinas, mientras que la GH tuvo un pequeño efecto positivo en la señalización de mTOR ( Figura 5D- i) y IGF-1 mostraron un efecto positivo a la dosis más baja, los tres tratamientos de GH, IGF-1 y TGF -Β1 no tuvo en cuenta el aumento de PI3K / mTORC1 y ERK1 / 2 de señalización. En conjunto, nuestro modelo de ligamento 3D manipulado y datos de bioensayos 2D sugieren que el ambiente de suero después del ejercicio es capaz de mejorar la función del ligamento y el contenido de colágeno mediante la activación de las vías PI3K / mTORC1 y ERK1 / 2.
En resumen, utilizando un modelo de ligamento modificado combinado con suero condicionado al ejercicio, pudimos i) investigar el efecto del ambiente sérico post-ejercicio sobre la función ligamentaria y el colágeno, ii) correlacionar los cambios en el fenotipo del ligamento con los cambios en la concentración hormonal del suero, Con el objetivo de determinar qué cambios en el suero condujeron a cambiosEn los ligamentos de ingeniería, y iii) ampliar el alcance del trabajo mediante el uso de bioensayos 2D para sondear los objetivos moleculares del medio bioquímico del suero para determinar los mecanismos moleculares que son activados por el suero posterior al ejercicio que conducen a mejoras en la función del ligamento.
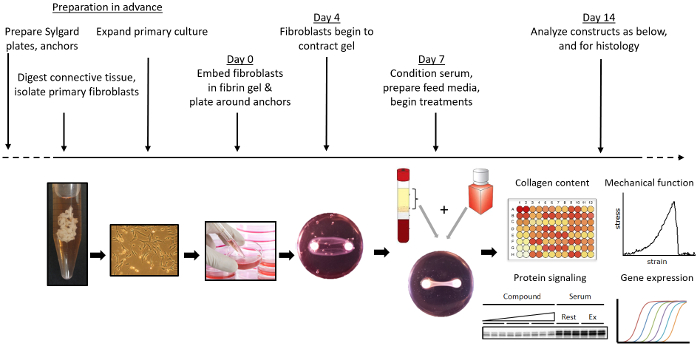
Figura 1: Visión general de la formación y el uso de ligamentos de ingeniería. Los anclajes de cemento Brushite se fabrican y se fijan en placas recubiertas de silicona. Los fibroblastos primarios son aislados y expandidos a partir de los restos de ACL. Los ligamentos de ingeniería se forman encapsulando fibroblastos en un gel de fibrina alrededor de dos anclajes de cemento de pincelita. Los ligamentos de ingeniería se cultivan y se tratan con cualquier estímulo químico o mecánico específico ( por ejemplo , a través de un biorreactor) deseado. En el punto final deseado, los ligamentos de ingeniería se pueden recoger y evaluar para mecánicaL propiedades, expresión génica, contenido de colágeno, expresión proteica e histología. Haga clic aquí para ver una versión más grande de esta figura.
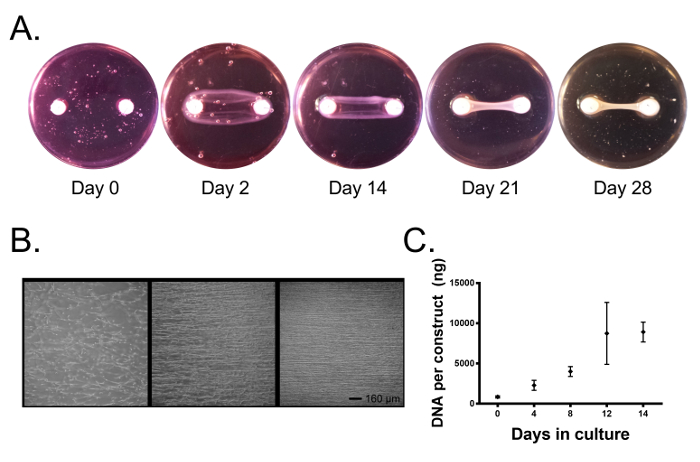
Figura 2. Los fibroblastos de ligamentos primarios forman un ligamento de hueso a hueso basado en fibrina que atraviesa dos anclajes de cemento de pincelita. ( A ) Con el tiempo, los fibroblastos contraen el gel de fibrina alrededor de los anclajes de cemento de cepita formando un tejido lineal. ( B ) En los tres primeros días, las células se unen al gel de fibrina y ejercen fuerzas de tracción, alineando las células con el eje largo del constructo. Durante 14 días, las células forman un tejido altamente alineado. Barra de escala = 160 μm. ( C ) El contenido de ADN de los ligamentos de ingeniería sigue aumentandoVer 14 días en cultivo como las células proliferan. Los datos se presentan como media ± SD con n = 3-4 construcciones por grupo. Grupos. Haga clic aquí para ver una versión más grande de esta figura.
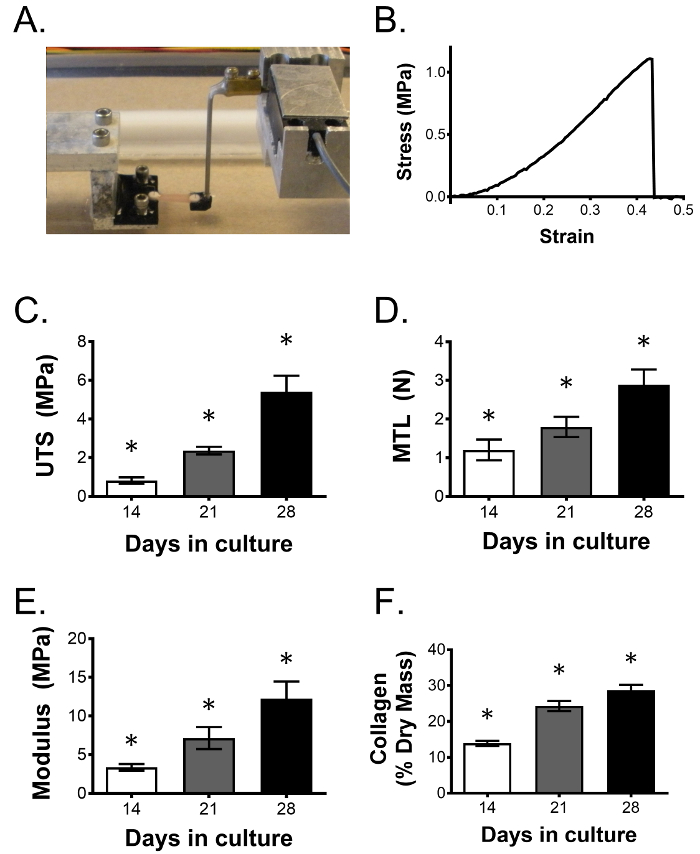
Figura 3: Las propiedades mecánicas del ligamento mecánico y el contenido de colágeno mejoran con el tiempo. ( A ) Las construcciones ligamentales se ensayan uniaxialmente a tracción para determinar el efecto de una intervención dada en la función ligamentaria. Como se muestra, dos puños impresos en 3D, moldeados en reversa, mantienen anclajes de forma recíproca que están puenteados por el tendón de ingeniería. Los anclajes están acoplados a un motor paso a paso y un transductor de fuerza para generar curvas de tensión / deformación del tejido ensayado, permitiendo determinar propiedades mecánicas. ( B </ Strong>) Curva de tensión-deformación representativa de un ligamento manipulado que se sometió a un fallo. En el transcurso de 28 días, la resistencia a la tracción final (UTS), ( D ) la carga máxima de tracción (MTL), el módulo de Young y la fracción de colágeno ( F ) continúan mejorando. Los datos se presentan como media ± DE con n = 5 construcciones por grupo. * Indica una diferencia significativa con respecto a todos los demás grupos. Haga clic aquí para ver una versión más grande de esta figura.
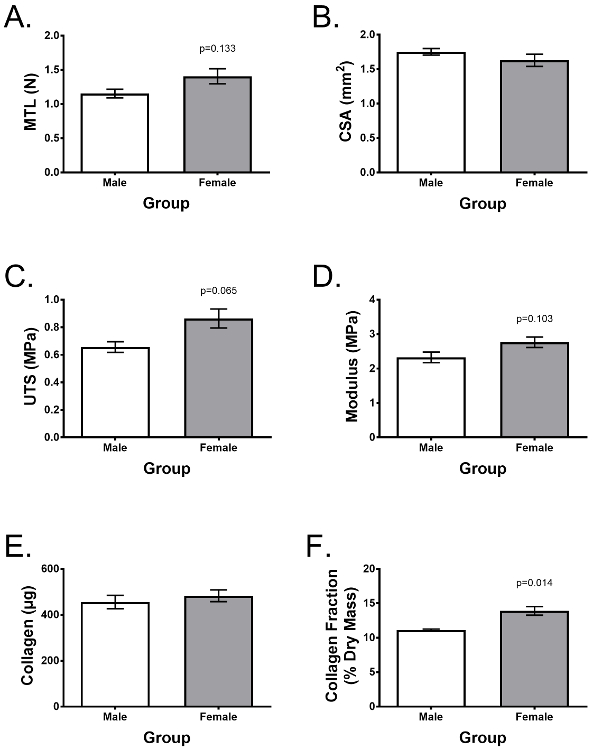
Figura 4: Los ligamentos de ingeniería pueden ser evaluados para determinar la funcionalidad y el contenido bioquímico, mostrando una baja variabilidad del donante. Se formaron ligamentos de ingeniería 7 diferentes donantes (n = 3 machos, n = 4 mujeres). Después de 2 semanas oF), se evaluaron las diferencias en ( A ) carga máxima de tracción, ( B ) resistencia a la tracción final (UTS), ( C ) módulo de Young, ( D ) área de sección transversal (CSA), ( E ) Construir, y ( F ) colágeno como una fracción de masa seca. Los datos se presentan como media ± SD y la significación estadística fue con la prueba t de Student. * Indica diferencia significativa con otros grupos (p <0,05). Figura adaptada de Lee et al. 25 Haga clic aquí para ver una versión más grande de esta figura.
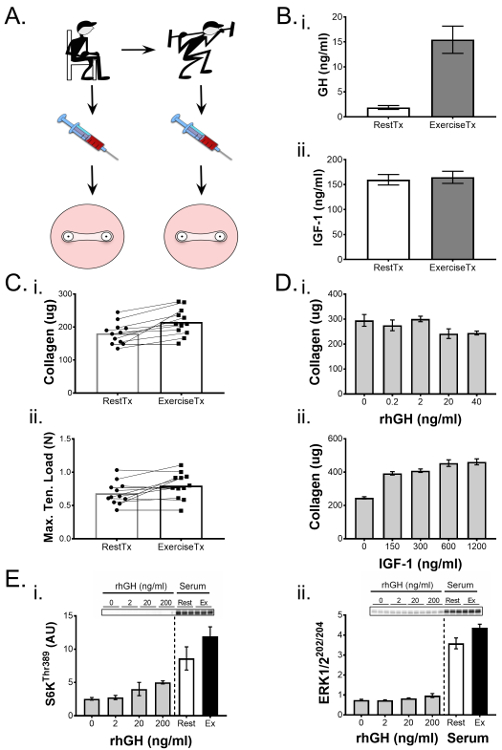
Figura 5. Los ligamentos de ingeniería demuestran cambios mecánicos y bioquímicos en respuesta al bioloIntervenciones médicas. ( A ) Se aisló el suero de muestras de sangre recogidas de sujetos pre- (RestTx) y post-ejercicio (ExTx) y se usaron para tratar ligamentos de ingeniería durante la segunda semana de cultivo. ( B ) (i) La hormona del crecimiento humano (GH) y (ii) los niveles del factor de crecimiento similar a la insulina (IGF) -1 en el resto y el suero de ejercicio se cuantificaron mediante ELISA. ( C ) Los ligamentos de ingeniería tratados con ExTx demostraron mejorar (i) el contenido de colágeno y (ii) la máxima carga de tracción. La significación estadística de las comparaciones apareadas (RestTx y ExTx) se analizó mediante una prueba t con un nivel de significación establecido en p <0,05. ( D ) Se utilizó una dosis-respuesta de (i) GH y (ii) IGF-1 para determinar las posibles contribuciones de estos factores a los cambios en el contenido de colágeno debidos a ExTx. E) Se usaron bioensayos 2D para comparar los efectos de dosis crecientes de GH, RestTx y ExTx sobre dianas de señalización molecular tales como la fosforilación de (i) S6K Thr389 y (ii) ERK1 / 2 Thr202 / Tyr204 . Comparación estadística de más de dos grupos experimentales se realizó mediante ANOVA y Tukey HSD. Los datos se presentan en forma de media ± DE. * Indica una diferencia significativa con respecto al control (p <0,05) y § indica una diferencia significativa de 150 ng / ml y 300 ng / ml de IGF-1. Figura adaptada de West et al. 1 Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El presente manuscrito describe un modelo de tejido ligamentario que es una plataforma experimental útil para investigadores con un amplio espectro de temas de investigación, desde el desarrollo de tejidos hasta las preguntas clínicas / traslacionales. El modelo de ligamento modificado descrito aquí se basa en un protocolo versátil que puede adaptarse en varios puntos a lo largo del flujo de trabajo ( Figura 1 y sección de discusión ). Además, la naturaleza inherentemente reduccionista del entorno in vitro se puede acercar al dominio fisiológico suplementando medios de alimentación con suero humano o animal acondicionado.
Las construcciones se pueden formar usando fibroblastos de una variedad de fuentes
Aunque la metodología y los resultados representativos mostrados aquí se basan en el uso de fibroblastos primarios de ACL, el protocolo de aislamiento celular puede ajustarse para recoger otros tipos de fibroblastos primarios. Como se describeEn la Figura 4 , los ligamentos de ingeniería formados con células primarias aisladas de donantes humanos jóvenes muestran una baja variabilidad del donante. Las células primarias están limitadas por el aislamiento inicial y la restricción de paso; El uso de líneas celulares puede mejorar la reproducibilidad de los experimentos. El uso de otros tipos de células puede requerir modificaciones en los medios de cultivo celular y en la formulación de gel de fibrina. Por ejemplo, hemos observado que las células madre mesenquimatosas humanas (MSCs) no son capaces de formar tejidos lineales entre los anclajes de cemento brushite en el transcurso de 2 semanas, mientras que los fibroblastos superiores del tendón flexor digital equino superior, células estromales de médula ósea equina, fibroblastos de tendón embrionario de pollo , Y C3H10T1 / 2 MSC murino rápidamente contraer y digerir el gel de fibrina para formar un tejido lineal (observaciones no publicadas). Este contraste puede ser una consecuencia de las diferencias en la contractilidad celular, la proliferación y la producción de enzimas fibrinolíticas.
Aplicación de productos químicosY estimulación mecánica
En el método descrito en el presente documento, el tejido a base de fibrina se forma alrededor de anclajes de cemento de pincel, permitiendo la aplicación de estimulación mecánica a través de un biorreactor estirable 11 , así como para ensayos de tracción de punto final. La presencia de la interfase cementita-tejido blando (entesis) también presenta una oportunidad para una mayor investigación y mejora 22 , 26 (ver sección de aplicaciones clínicas a continuación). En este entorno in vitro , la contribución de los factores químicos y mecánicos puede identificarse más fácilmente; Un ejemplo de esto se muestra en la Figura 5 , por lo que el efecto del ambiente de suero después del ejercicio se separó de los estímulos mecánicos del ejercicio. Es posible que se necesiten estudios piloto para determinar el plazo de las intervenciones experimentales, la composición de los tratamientos y los criterios de valoración adecuados para esperar un cambio observable. ParaPor ejemplo, en el estudio de suero 1 post-ejercicio, la duración del tratamiento experimental fue limitada por el suministro de suero utilizado para suplementar los medios, de los cuales se alimentaron los constructos cada dos días. Además, durante la segunda semana de cultivo, se suplementaron los medios de cultivo con suero en reposo o post-ejercicio con ácido ascórbico y se mantuvo L-prolina mientras se eliminaba TGF-β1. El TGF-β1 es un factor de crecimiento pro-fibrótico conocido que aumenta en suero después del ejercicio 27 . Por lo tanto, para evitar oscurecer los efectos relacionados con TGF-β1 del suero posterior al ejercicio, esta citoquina no se mantuvo en el medio de cultivo.
Este modelo de ligamento modificado también puede usarse para probar el efecto del estiramiento mecánico. Mediante la ingeniería de apretones de modelado inverso para sostener los extremos de anclaje del cemento brushite (similar al probador de tracción uniaxial representado en la figura 1 ), se pueden diseñar biorreactores de estiramiento Los ligamentos. Nuestro laboratorio ha utilizado previamente este modelo para investigar la respuesta de señalización molecular de los ligamentos de ingeniería para el estiramiento de tracción uniaxial en un biorreactor 11 a medida que proporcionará una mejor comprensión para el diseño racional de un paradigma de estiramiento in vitro o incluso, potencialmente, in vivo Estiramiento / actividad / aplicaciones terapéuticas.
Evaluación de los ligamentos de ingeniería
Al igual que con el cultivo monocapa tradicional, las construcciones 3D pueden ser ensayadas para la expresión de genes / proteínas; Además, su morfología 3D también proporciona la oportunidad de evaluar los cambios funcionales y morfológicos y las construcciones pueden mantenerse en la cultura para estudios a largo plazo ( Figura 3 ). Mientras que los ligamentos de ingeniería no son equivalentes a los ligamentos nativos maduros, que tienen similitud con el desarrollo de tendones / ligamentos y se comportan de manera similar a los tejidos nativos en respuesta a los nutrientes, 26, factores de crecimiento 10 , hormonas 25 y ejercicio 11 , 28. Por lo tanto, si bien la precaución se justifica antes de hacer amplias generalizaciones de cualquier modelo in vitro , los resultados de la construcción del ligamento de prueba puede revelar o informar un mecanismo fisiológico particular que de lo contrario podría ser Imposible investigar in vivo.
Suplemento de los medios de alimentación con suero acondicionado para un modelo flexible y dinámico con amplias aplicaciones
El metaboloma del suero humano es un medio de ~ 4.500 compuestos incluyendo, pero no limitado a, glicoproteínas, lipoproteínas, derivados lipídicos, sustratos energéticos, metabolitos, vitaminas, enzimas, hormonas, neurotransmisores y una plétora de bloques de construcción / intermedios. 29 La inspección adicional del metaboloma del suero humano de acuerdo con las clases compuestas 29 revela additiBeneficios de integrar el suero experimental en experimentos in vitro. Es decir, la mayoría de los ~ 4500 compuestos en suero son hidrofóbicos o derivados de lípidos, subrayando la importancia de las proteínas de unión para el transporte / solubilización. Se deduce que sería prácticamente imposible recapitular experimentalmente la dinámica de transporte del compuesto endógeno y, por tanto, la biodisponibilidad y las interacciones compuesto-objetivo. Por lo tanto, el suero experimental es particularmente eficaz para el estudio de compuestos que se sabe que dependen de moléculas accesorias para la solubilización, el transporte, la unión de diana y el mecanismo de acción.
Nuestro laboratorio tiene un interés de largo plazo en los beneficios para la salud del ejercicio. El ejercicio mejora la función celular y de órganos en una variedad de tejidos en todo el cuerpo 12 , un efecto que puede atribuirse a una variedad de factores (por ejemplo, IL-6 13 , IL-15 14 , Meteorin-like 15 ,Exosomas 16 , 17 ) que se liberan en la circulación sistémica. El medio bioquímico posterior al ejercicio refleja factores liberados tanto de la contracción de las hormonas sensibles al ejercicio de los músculos esqueléticos como de los factores liberados como resultado de la estimulación del sistema nervioso simpático de las glándulas secretoras ( por ejemplo , cortisol y catecolaminas de la glándula suprarrenal 18 y crecimiento Hormona de la pituitaria anterior 19 ). Recientemente utilizamos un modelo de suero pre y post-ejercicio para investigar los efectos del medio bioquímico inducido por el ejercicio en el tejido de ingeniería. 1 Si bien subsisten numerosas preguntas importantes relacionadas con la investigación relacionada con el ejercicio, el modelo no se limita de ninguna manera. Por ejemplo, se puede obtener suero, ya sea de origen animal o humano, después de intervenciones dietéticas o farmacológicas, o de diferentes grupos de edad o población clínicaS 30 . De esta manera, los compuestos exógenos o endógenos de interés estarán presentes en el suero y los medios de tratamiento, en cantidades biodisponibles e interactuarán con el tejido diana de acuerdo con el medio endógeno ( es decir , en un contexto más fisiológico). Este enfoque es dinámico, ya que es muy probable que una determinada intervención ejerza un efecto multiorgánico (y multi-compuesto) y, por lo tanto, el entorno fisiológico será co-modificado. Si bien este enfoque presenta ciertos desafíos, ya que múltiples variables bioquímicas sistémicas se alteran simultáneamente, es un enfoque que puede ayudar a superar los inconvenientes de metodología experimental puramente reduccionista [ 31 , 32] . En conjunto, la implementación de suero condicionado junto con un tejido de ingeniería tisular (biomimético in vitro ) de tejido se puede utilizar como una herramienta para la fisiología, la nutrición y las preguntas de investigación clínica.
Las aplicaciones clínicas son numerosas
El modelo de ingeniería de tejidos presentado aquí puede ser utilizado para investigar las preguntas de investigación anatómica y clínica que los modelos in vitro tradicionales no pueden. Un ligamento o tendón in vivo contiene una región de transición de tejido blando a duro llamada entesis. El enthesis, que es vulnerable a la lesión mecánica relacionada con el estrés 33 , puede ser estudiado en sección transversal a través de técnicas de microscopía histoquímica y electrónica 22 , 26 . Esta única interfaz es doblemente importante para aquellos con movilidad baja o restringida, ya que la inactividad física perjudica la capacidad del tejido conectivo para transferir la carga a regiones de bajo a alto cumplimiento 34 , lo que resulta en una disminución general en el cumplimiento de los tejidos y un mayor riesgo de lesiones.
Nuestro laboratorio ha utilizado recientemente este modelo de ingeniería de tejidos 25 </ Sup> para modelar otra población, las mujeres atletas, que están en riesgo de lesiones del tejido conectivo: la incidencia de lesión del LCA es aproximadamente cinco veces mayor que sus homólogos masculinos 35 . Los mecanismos potenciales que sustentan esta disparidad basada en el sexo en la lesión se investigaron mediante el tratamiento de construcciones ligamentales con concentraciones fisiológicas de la hormona sexual femenina, el estrógeno, en concentraciones que imitaban etapas del ciclo menstrual. Curiosamente, altas concentraciones de estrógenos inhibieron la expresión génica y la actividad de la lysl oxidasa, la enzima primaria responsable de la creación de lisina-lisina enlaces cruzados en la matriz de colágeno de ligamentos y tendones. Es importante destacar que 48 h de alto estrógeno (para simular la fase folicular) disminuyó la rigidez de la construcción del ligamento sin alterar la densidad de colágeno de los constructos. Desde un punto de vista fisiológico, esto sugiere que el aumento de la laxitud ligamentaria en las mujeres puede deberse, al menos en parte, a la disminuciónFormación de enlaces cruzados. Desde una perspectiva experimental, estos hallazgos 25 destacan la utilidad del modelo de construcción 3D, que permitió examinar la actividad funcional de reticulación. Desde un punto de vista clínico, este modelo ahora se puede utilizar para detectar rápidamente intervenciones que pueden prevenir los efectos negativos del estrógeno de la función del ligamento.
Comentarios de cierre
Aquí presentamos una metodología detallada para la formación de ligamentos de ingeniería y su utilidad como un modelo de tejido 3D in vitro . El modelo es altamente adaptable a una amplia gama de objetivos, proporcionando flexibilidad en el tipo de células, intervenciones y medidas de resultado de interés. La suplementación de los medios de alimentación con suero acondicionado añade un contexto fisiológico que no se puede lograr en un ambiente in vitro tradicional, mejorando el modelado de la fisiología in vivo . En resumen, creemos que este es un modo ampliamente aplicableL con implicaciones emocionantes para fomentar los campos de la fisiología y la ingeniería de tejidos.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Este trabajo fue apoyado por una beca postdoctoral del NSERC (DWDW), una beca de la Fundación ARCS (AL) y una beca de UC Davis College of Biological Sciences (KB).
Materiales
| Name | Company | Catalog Number | Comments |
| Austerlitz Insect pins, minutien stainless steel, size 0.20 | Entomoravia | N/A | For brushite cement anchors |
| β-tricalcium phosphate | Plasma Biotal Ltd (Derbyshire, UK) | N/A | For brushite cement anchors |
| o-phosphoric acid, 85% (w/w) | EMD Millipore | PX0995 | For brushite cement anchors |
| Citric acid | Sigma-Aldrich | 251275-500g | For brushite cement anchors |
| Falcon 35 mm tissue culture dishes | Fisher Scientific | 08-772A | For silicone-coated plates |
| Sylgard 184 silicone elastomer kit | Ellsworth Adhesives | 4019862 | For silicone-coated plates |
| 1x Phosphate-buffered saline (PBS) | Fisher Scientific | SH3002802 | For cell isolation and expansion |
| 100x antibiotic/antimycotic solution | VWR | 45000-616 | For cell isolation |
| Type II collagenase | Thermo Fisher Scientific | 17101015 | For cell isolation |
| 100x penicillin/streptomycin solution | Thermo Fisher Scientific | 15140122 | For cell isolation |
| Steriflip-GP, 0.22 µm pore, polyethersulfone, gamma irradiated | EMD Millipore | SCGP00525 | For reagent sterilization |
| DMEM high glucose with sodium pyruvate and L-glutamine | VWR | 10-013-CV | For cell and tissue culture |
| Fetal bovine serum | BioSera | FBS2000 | Component of tissue digestion media and growth media |
| Penicillin G Potassium Salt | MP Biomedicals | 0219453680 - 100 MU | Component of growth media. Dissolve in water to 100,000 U/mL, filter sterilize, aliquot, and store at -20°C. |
| CELLSTAR polystyrene tissue culture dishes (145 mm x 20 mm) | VWR | 82050-598 | For cell culture |
| Trypan blue | Thermo Fisher Scientific | T10282 | For cell isolation |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | For cell culture. Dilute to 0.05% in PBS |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | For cell freezing media |
| Nalgene Mr. Frosty Cryogenic Freezing Container | Thermo Fisher Scientific | 5100-0001 | For cell freezing |
| BD Vacutainer Red Plastic 10 mL | Fisher Scientific | 367820 | For human serum collection |
| Bound Tree Insyte Autoguard IV Catheters, 22 G x 1 inch Needle | Fisher Scientific | 354221 | For human serum collection |
| Thrombin, bovine origin | Sigma-Aldrich | T4648-1KU | For engineered ligament formation. Dissolve at 200 U/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Fibrinogen, bovine origin | Sigma-Aldrich | F8630-5G | For engineered ligament formation. Dissolve at 20 mg/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Aprotinin from bovine lung | Sigma-Aldrich | A3428 | For engineered ligament formation. Dissolve at 10 mg/mL in water. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| 6-Aminohexanoic acid | Sigma-Aldrich | 07260-100g | For engineered ligament formation. Dissolve at 0.1g/mL in water. Filter at 0.22 μm, aliquot, and store at 4 °C. |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | Component of feed media. Dissolve in DMEM high glucose media at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| L-proline | Sigma-Aldrich | P5607-25G | Component of feed media. Dissolve in PBS at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| Transforming growth factor-β1 | Peprotech | 100-21 | Component of feed media. Reconsistute according to manufacturer's instructions at a concentration of 10 μg/mL. Aliquot and store at -20 °C. |
| Stericup-GP, 0.22 µm, polyethersulfone, 250 mL, radio-sterilized | EMD Millipore | SCGPU02RE | For reagent sterilization |
| Hydrochloric acid | Fisher Scientific | A144-212 | Dilute in water to 6 M |
| 4-Dimethylaminobenzaldehyde | Sigma-Aldrich | 39070-50g | For hydroxyproline assay |
| Chloramine-T trihydrate | Sigma-Aldrich | 402869-100g | For hydroxyproline assay |
| trans-4-Hydroxy-L-proline | Sigma-Aldrich | H54409-100g | For hydroxyproline assay |
| 1-propanol | Sigma-Aldrich | 279544-1L | For hydroxyproline assay |
| Perchloric acid | Sigma-Aldrich | 311421-250ml | For hydroxyproline assay |
| Acetic acid, glacial | EMD Millipore | AX0073-9 | For hydroxyproline assay |
| Sodium hydroxide | Fisher Scientific | S318-500 | For hydroxyproline assay |
| Toluene, anhydrous | Sigma-Aldrich | 244511-1L | For hydroxyproline assay |
| Corning Costar Clear Polystyrene 96-Well Plates | Fisher Scientific | 07-200-656 | For hydroxyproline assay |
Referencias
- West, D. W., et al. The exercise-induced biochemical milieu enhances collagen content and tensile strength of engineered ligaments. J Physiol. 593 (20), 4665-4675 (2015).
- Booth, F. W., Laye, M. J. Lack of adequate appreciation of physical exercise's complexities can pre-empt appropriate design and interpretation in scientific discovery. J Physiol. 587 (Pt 23), 5527-5539 (2009).
- Booth, F. W., Hargreaves, M. Understanding multi-organ pathology from insufficient exercise. J Appl Physiol (1985). 111 (4), 1199-1200 (2011).
- Shearn, J. T., et al. Tendon tissue engineering: progress, challenges, and translation to the clinic. J Musculoskelet Neuronal Interact. 11 (2), 163-173 (2011).
- Liu, C. F., et al. What we should know before using tissue engineering techniques to repair injured tendons: a developmental biology perspective. Tissue Eng Part B Rev. 17 (3), 165-176 (2011).
- Vunjak-Novakovic, G., Altman, G., Horan, R., Kaplan, D. L. Tissue engineering of ligaments. Annu Rev Biomed Eng. 6, 131-156 (2004).
- Bayer, M. L., et al. The initiation of embryonic-like collagen fibrillogenesis by adult human tendon fibroblasts when cultured under tension. Biomaterials. 31 (18), 4889-4897 (2010).
- Guerquin, M. J., et al. Transcription factor EGR1 directs tendon differentiation and promotes tendon repair. J Clin Invest. 123 (8), 3564-3576 (2013).
- Ma, J., et al. Three-dimensional engineered bone-ligament-bone constructs for anterior cruciate ligament replacement. Tissue Eng Part A. 18 (1-2), 103-116 (2012).
- Hagerty, P., et al. The effect of growth factors on both collagen synthesis and tensile strength of engineered human ligaments. Biomaterials. 33 (27), 6355-6361 (2012).
- Paxton, J. Z., Hagerty, P., Andrick, J. J., Baar, K. Optimizing an intermittent stretch paradigm using ERK1/2 phosphorylation results in increased collagen synthesis in engineered ligaments. Tissue Eng Part A. 18 (3-4), 277-284 (2012).
- Safdar, A., et al. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc Natl Acad Sci U S A. 108 (10), 4135-4140 (2011).
- Pedersen, B. K., Febbraio, M. A. Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nat Rev Endocrinol. 8 (8), 457-465 (2012).
- Crane, J. D., et al. Exercise-stimulated interleukin-15 is controlled by AMPK and regulates skin metabolism and aging. Aging Cell. 14 (4), 625-634 (2015).
- Rao, R. R., et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis. Cell. 157 (6), 1279-1291 (2014).
- Aswad, H., et al. Exosomes participate in the alteration of muscle homeostasis during lipid-induced insulin resistance in mice. Diabetologia. 57 (10), 2155-2164 (2014).
- Safdar, A., Saleem, A., Tarnopolsky, M. A. The potential of endurance exercise-derived exosomes to treat metabolic diseases. Nat Rev Endocrinol. 12 (9), advance online publication 504-517 (2016).
- Maling, H. M., Stern, D. N., Altland, P. D., Highman, B., Brodie, B. B. The physiologic role of the sympathetic nervous system in exercise. J Pharmacol Exp Ther. 154 (1), 35-45 (1966).
- Pritzlaff, C. J., et al. Impact of acute exercise intensity on pulsatile growth hormone release in men. J Appl Physiol (1985). 87 (2), 498-504 (1999).
- Creemers, L. B., Jansen, D. C., van Veen-Reurings, A., van den Bos, T., Everts, V. Microassay for the assessment of low levels of hydroxyproline. Biotechniques. 22 (4), 656-658 (1997).
- Neuman, R. E., Logan, M. A. The determination of hydroxyproline. J Biol Chem. 184 (1), 299-306 (1950).
- Paxton, J. Z., Donnelly, K., Keatch, R. P., Baar, K., Grover, L. M. Factors affecting the longevity and strength in an in vitro model of the bone-ligament interface. Ann Biomed Eng. 38 (6), 2155-2166 (2010).
- Woessner, J. F. Jr The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid. Arch Biochem Biophys. 93, 440-447 (1961).
- Paxton, J. Z., Wudebwe, U. N., Wang, A., Woods, D., Grover, L. M. Monitoring sinew contraction during formation of tissue-engineered fibrin-based ligament constructs. Tissue Eng Part A. 18 (15-16), 1596-1607 (2012).
- Lee, C. A., et al. Estrogen inhibits lysyl oxidase and decreases mechanical function in engineered ligaments. J Appl Physiol (1985). 118 (10), 1250-1257 (2015).
- Paxton, J. Z., Grover, L. M., Baar, K. Engineering an in vitro model of a functional ligament from bone to bone. Tissue Eng Part A. 16 (11), 3515-3525 (2010).
- Heinemeier, K., Langberg, H., Kjaer, M. Exercise-induced changes in circulating levels of transforming growth factor-beta-1 in humans: methodological considerations. Eur J Appl Physiol. 90 (1-2), 171-177 (2003).
- Mackey, A. L., Heinemeier, K. M., Koskinen, S. O., Kjaer, M. Dynamic adaptation of tendon and muscle connective tissue to mechanical loading. Connect Tissue Res. 49 (3), 165-168 (2008).
- Psychogios, N., et al. The human serum metabolome. PLoS One. 6 (2), e16957(2011).
- Nguyen, T., et al. The effects of resting and exercise serum from children with cystic fibrosis on C2C12 myoblast proliferation in vitro. Physiol Rep. 2 (6), e12042(2014).
- Joyner, M. J., Pedersen, B. K. Ten questions about systems biology. J Physiol. 589 (Pt 5), 1017-1030 (2011).
- Joyner, M. J. Giant sucking sound: can physiology fill the intellectual void left by the reductionists? J Appl Physiol (1985). 111 (2), 335-342 (2011).
- Benjamin, M., et al. Where tendons and ligaments meet bone: attachment sites ('entheses') in relation to exercise and/or mechanical load. J Anat. 208 (4), 471-490 (2006).
- Arruda, E. M., Calve, S., Dennis, R. G., Mundy, K., Baar, K. Regional variation of tibialis anterior tendon mechanics is lost following denervation. J Appl Physiol (1985). 101 (4), 1113-1117 (1985).
- Arendt, E., Dick, R. Knee injury patterns among men and women in collegiate basketball and soccer. NCAA data and review of literature. Am J Sports Med. 23 (6), 694-701 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados