Method Article
Лечение связочных конструкций с помощью сыворотки, обусловленной упражнениями: модель трансляционной тканевой инженерии
В этой статье
Резюме
Мы представляем модель связующей ткани, в которой трехмерные конструкции обрабатывают сывороткой, обработанной человеком, и анализируют на содержание, функцию и клеточную биохимию коллагена.
Аннотация
Эксперименты in vitro необходимы для понимания биологических механизмов; Однако разрыв между монослойной тканевой культурой и физиологией человека велик, и перевод результатов часто является плохим. Таким образом, имеются широкие возможности для альтернативных экспериментальных подходов. Здесь мы представляем подход, в котором человеческие клетки выделяются из остатков тканей передней крестообразной связки человека, расширяются в культуре и используются для образования искусственных связок. Упражнение изменяет биохимическую среду в крови, так что улучшается функция многих тканей, органов и телесных процессов. В этом эксперименте культуральная среда для связки была дополнена экспериментальной человеческой сывороткой, которая была «обусловлена» физическими упражнениями. Таким образом, вмешательство более биологически важно, так как экспериментальная ткань подвергается полной эндогенной биохимической среде, включая связывающие белки и вспомогательные соединения, которые могут быть изменены в тандеме с активностьюНеизвестный агент, представляющий интерес. После обработки, инженерные связки могут быть проанализированы на предмет механической функции, содержания коллагена, морфологии и клеточной биохимии. В целом, существует четыре основных преимущества по сравнению с традиционными монослойными культурами и животными моделями, физиологической модели связующей ткани, которая представлена здесь. Во-первых, конструкции связок трехмерны, что позволяет количественно определять механические свойства ( например , функцию), такие как предельное растягивающее напряжение, максимальную растягивающую нагрузку и модуль. Во-вторых, энтез, интерфейс между медом и сухожильными элементами, можно детально изучить и в функциональном контексте. В-третьих, подготовка средств массовой информации с помощью сыворотки после тренировки позволяет объективно исследовать воздействие биохимической среды, вызванной упражнениями, которая отвечает за широкий спектр преимуществ для здоровья от физических упражнений. Наконец, эта экспериментальная модель продвигает научные исследования гуманным и этическим образом, заменяя использованиеЖивотных, основной мандат Национального института здоровья, Центра борьбы с болезнями и Управления по контролю за продуктами и лекарствами.
Введение
Повреждения сухожилий и связок являются общими и могут иметь изнурительные последствия для нормальной мобильности и качества жизни. Хирургическое вмешательство часто необходимо, но может иметь ограниченный и разнообразный успех 4 , 5 . Нынешнее понимание того, как сухожилия и связки развиваются, созревают и реагируют на травмы, являются неполными, и поэтому необходимы эффективные исследовательские модели, чтобы дать представление о разработке более эффективных методов лечения 5 . Чтобы устранить этот пробел в знаниях, можно использовать модели на животных, но исследования in vivo по своей сути сложны с трудностями в управлении окружающей средой и непосредственно нацеливают вмешательства на предполагаемую ткань. Напротив, экспериментальную среду можно легко контролировать и контролировать in vitro с помощью традиционной культуры монослоев. Однако этот метод может упростить химическую и механическую среду и, следовательно, не может быть recapituПоздно поведение in vivo клеток. Тканевая инженерия может выйти замуж за преимущества комплексной среды in vivo на животных моделях с контролем окружающей среды in vitro и является дополнительным инструментом для изучения физиологии. Кроме того, с улучшенным пониманием развития связок, тканевая инженерия может также обеспечить источник трансплантатной ткани, когда требуется хирургическая реконструкция. 6 . Таким образом, описанный здесь способ подтверждает трехмерную инженерную ткань in vitro, которая может быть использована для изучения функции связок и морфологии.
Сухожилие на основе фибрина или связочные конструкции использовались в качестве модели in vitro для изучения физиологических процессов, включая коллагеновый фибриллогенез 7 и развитие сухожилий 8 , а также трансляционные применения, в которых их полезность в качестве трансплантатной ткани оценивалась в модели овец переднего крестаCial ligament (ACL) 9 . В нашей лаборатории ранее была создана трехмерная инженерная модель связки, охватывающая два кистита, материал для замены костных фосфатов кальция, цементные анкеры. Эта модель может быть легко подвергнута различным экспериментальным условиям просто путем добавления культуральной среды биологическими факторами 10 или применения механической стимуляции 11 . Важно отметить, что эта костно-костная связочная модель позволяет провести углубленный анализ энтеза, интерфейса между медом и сухожильными элементами, который подвержен травмам.
В исследовании, посвященном 1 здесь, чтобы представить эту методологию, нас интересовал эффект вызванных физической нагрузкой изменений в биохимической среде на связочную функцию. Упражнения улучшают функцию клеток и органов в различных тканях по всему телу 2 , 3 , 12 , эффект, который может быть связан с высвобождением различных известных (например, IL-6 13 , IL-15 14 , метеориновых 15, экзосомы 16 , 17 ) и других неизвестных биохимических факторов, высвобождающихся в системную циркуляцию , Кроме того, биохимическая среда после упражнений обогащается упражнениями-реагирующими гормонами, выделение которых стимулируется стимуляцией симпатической нервной системы секреторных желез ( например , кортизолом и катехоламинами из надпочечников 18 и гормоном роста из переднего гипофиза 19 ). Однако, i n vivo , невозможно отличить эффекты механического стимула от физических упражнений от биохимических изменений. Хотя некоторые исследования характеризовали ожидаемый рост некоторых циркулирующих гормонов и цитокинов в ответ на упражненияE, как уже упоминалось выше, слишком много факторов, как известных, так и неизвестных, точно повторяют in vitro. То есть, выделение нескольких факторов для исследования in vitro недостаточно учитывает сложность биохимического ответа. В этом исследовании мы исследовали, как изменения в биохимической среде сыворотки, вызванные физическими упражнениями, влияют на конструктивную связочную функцию. Чтобы изолировать эффекты биохимических изменений, мы получили сыворотку от участников человека до и после приступа сопротивления и использовали ее для лечения трехмерных инженерных связок, образованных с использованием фибробластов передней крестообразной связки (ACL). Используя эту модель, мы можем получить функциональные данные, включая влияние на механические свойства и содержание коллагена, а также количественно оценить влияние на молекулярную сигнализацию.
протокол
Следующие процедуры соответствуют протоколу, который был одобрен Институциональным советом по обзору Калифорнийского университета, Дэвис; Проконсультируйтесь с местной комиссией по этике до начала исследований.
1. Изолировать первичные фибробласты из остатков ACL человека
ПРИМЕЧАНИЕ. Поддерживайте стерильность и выполняйте все шаги в шкафу биологической безопасности (BSC).
- Получить одобрение от соответствующей комиссии по обзору этики для сбора и использования тканей человека, как описано ниже.
- Подготовьте 5-кратный антибиотико-антимикотический (АБАМ) раствор, разбавив 100-кратным антибиотиком / антимикотическим раствором в 1X забуференном фосфатом физиологическом растворе (PBS)
- Собирайте фрагменты ткани ACL в 5X растворе ABAM в конической трубке емкостью 50 мл, храните при 4 ° C до стадии пищеварения. Вырезать ткань на более мелкие фрагменты с помощью бритвенного лезвия, если необходимо, до максимального размера 1 х 1 х 1 см 3 .
ПРЕДОСТЕРЕЖЕНИЕ: Соблюдайте местные правила биологической защиты дляНадлежащего использования биологического материала и дезактивации и удаления отходов биологической опасности. - Подготовьте достаточный объем раствора коллагеназы для погружения фрагментов ткани. Растворить коллагеназу типа II (1 мг / мл) в среде с высоким содержанием глюкозы Dulbecco's Eagle (DMEM), содержащей 1x пенициллин / стрептомицин и 20% фетальную бычью сыворотку (FBS) и фильтровать при 0,22 мкм.
- Промойте ткань ACL 3 раза в PBS.
- Дайджест ткани. Перенесите ткань ACL в новую коническую трубку объемом 50 мл и добавьте достаточный объем раствора коллагеназы для погружения в ткань. Инкубируйте при 37 ° С в течение ночи (~ 17 ч).
- До завершения процесса пищеварения подготовьте среду для выращивания (GM), добавив DMEM с высокой глюкозной средой 10% FBS и 100 ед. / Мл пенициллина.
- За 15 минут до завершения процесса пищеварения коротко встряхните ткань, содержащую 50 мл пробирку 3 раза каждые 5 мин.
- Используя 25 мл серологической пипетки, растирайте переваренную ткань энергично, чтобы разбить tiДальше и выбивать клетки.
- Центрифуга при 1500 мкг в течение 5 мин. Аспирируют супернатант и ресуспендируют гранулу в 10 мл GM.
- Повторите шаги 1,8-1,9 еще три раза.
- После последнего центрифугирования ресуспендируют гранулу в 5-10 мл GM. Используйте небольшой образец клеточной суспензии для проведения подсчета клеток с помощью гемоцитометра и оценки жизнеспособности клеток с использованием Trypan Blue.
- Нанесите клеточную суспензию на планшеты для культивирования тканей 15 см с плотностью 3-4 × 10 5 клеток на пластину.
- Культура до 70% слияния в стерильном инкубаторе поддерживалась при 37 ° С и 5% СО 2 , меняя ГМ каждые три дня. Используйте или храните (см. Ниже) ячейки в пределах 5 проходов.
- Заморозить клетки для будущего использования.
- Трипсинизируют клетки с 70% слиянием следующим образом. Аспирируйте среду и промывайте клетки PBS. Добавьте достаточное количество предварительно нагретого (37 ° C) 0,05% трипсина, чтобы просто закрыть дно пластин для культивирования тканей. Поместите тарелки в культуральный инкубаторAtor в течение ~ 5 минут, пока клетки не будут отсоединены (проверьте, что клетки плавают с помощью светового микроскопа). Используйте пипетку для сбора клеток и раздачи в трубку Falcon.
- Центрифугируют к таблетированным клеткам и ресуспендируют клетки в среде с высокой глюкозой DMEM, содержащей 20% FBS и 10% диметилсульфоксида (ДМСО). Аликвотная суспензия клеток в криогенные сосуды и охлаждение при -1 ° С / мин в течение по меньшей мере 24 ч. Храните замороженные криовины в жидком азоте.
2. Подготовьте пластины с силиконовым покрытием
- Подготовьте 35-миллиметровые пластинки для культивирования тканей: снимите крышки и выложите открытые пластины на плоскую поверхность.
- Смесь силиконового эластомера в соответствии с инструкциями производителя.
- Используйте 10 мл шприц для дозирования приблизительно 2 мл на 35 мм планшета.
- Дайте силикону вылечить при комнатной температуре в течение 2-3 дней.
3. Подготовьте цементные анкеры на основе Brushite
- Предварительно подготовьте силиконовые обратные формы, содержащие цилиндрические мыLls для формирования якоря. Обратные формы могут быть изготовлены с учетом требуемой формы и размера якоря.
- Определите желаемую высоту и диаметр конечного анкера. В этом протоколе используется изготовленная на заказ пресс-форма, сформированная из силиконового силикона в 35-миллиметровой чашке для культивирования ткани, в которой были установлены пластиковые цилиндры диаметром около 3,25 мм, что позволило достичь конечной высоты формы около 6,5 мм. Конечные размеры анкера составляют приблизительно 3-3,5 мм в высоту и около 3,4 мм в диаметре с 1,5 мм штырем, выступающим со дна анкера.
- Добавьте неотвержденный силикон к тарелке 35 мм, в которой будет изготовлена пресс-форма. Поместите пластиковые цилиндры соответственно.
ПРИМЕЧАНИЕ. Размер пластиковых цилиндров определит диаметр конечных анкеров. Размещение пластиковых цилиндров и количество используемого силикона можно модифицировать для изготовления якорей различной высоты. Толщина между дном скважин в пресс-форме и нижней частью самой пресс-формы будет dEtermine, какая часть штыря может выступать из нижней части анкера, позволяя прикреплять якорь, чтобы он был надежно закреплен в тарелке с силиконовым покрытием. - После того, как силикон вылечит, удалите пластиковые цилиндры и удалите пресс-форму из тарелки 35 мм.
- Подготовьте 3,5 М раствор ортофосфорной / 100 мМ лимонной кислоты. Растворяют 0,961 г лимонной кислоты в 11,5 мл ортофосфорной кислоты. Довести объем раствора до 50 мл водой MilliQ. Хранить раствор при комнатной температуре и защищать от света.
- Подготовьте пресс-формы: Поместите один штырь minutien в центр каждой цилиндрической скважины в пресс-формах.
- Объединить раствор β-трикальцийфосфата и ортофосфорной / лимонной кислоты с концентрацией 1 г / мл в пластиковой взвешенной лодке на льду.
- Аккуратно перемешайте цемент, используя скребок для пластиковых клеток.
- Растирайте цемент, чтобы продолжить перемешивание и смесь пипетки в форму
- Центрифугируйте заполненную форму в течение 1 мин при температуре 2250 x g.
- Дайте латунным цементным анкерам установить при комнатной температуре в течение ночи.
- Удалите анкеры из формы и закрепите два анкера на расстоянии 12 мм друг от друга на каждой пластине с силиконовым покрытием.
- Стерилизовать приколотые пластины, распыляя 70% этанолом, заполняя как пластины, так и крышки, и помещая их в BSC. По истечении как минимум 30 минут вылейте пластины и замените крышки, сохраняя их в BSC до тех пор, пока это не понадобится.
4. Получите сыворотку человека
- Убедитесь, что для этого протокола получено одобрение соответствующей комиссии по обзору этики.
- Обеспечить, чтобы письменное информированное согласие было получено от людей для участия в данном вмешательстве ( например , упражнение, питание или вмешательство с лекарственными средствами), которые будут влиять на желаемые изменения в сыворотке. Здесь мы описываем коллекцию в покое и через 15 минут после упражнения сопротивления.
- Используя подготовленного флеботомиста, получите образец крови для отдыха от участника путем венопункции в соответствующий эвакуированный контейнер.
- Соберите образец крови после тренировки через 15 минут после того, как участники участвуют в желаемом протоколе упражнений. Как описано выше, 1 , используйте протокол резистентности в этом эксперименте для стимуляции эндогенного биохимического ответа.
- Попросите участников выполнить пять комплектов ножного пресса с одноминутным отдыхом между сетами. Затем, чтобы участники выполнили набор расширений коленного сустава и набор завитушек подколенного сустава последовательно без отдыха, а затем повторяют упражнения «спина к спине» три раза с 1 минутой отдыха между сетами.
- Разрешить кровь сгущаться перед центрифугированием при 1500 мкг в течение 10 мин. В стерильных условиях переносите сыворотку в стерильные пробирки для будущих медиа-добавок (сыворотка хранится при 4 ° C) и биохимический анализ (небольшая аликвота сыворотки, хранящаяся при -20 ° C).
5. Формализованные связки
ПРИМЕЧАНИЕ. Заблаговременно разверните основной файлБлббласты и готовят пластины с силиконовым покрытием с закрепленными анкерными креплениями.
- Подготовьте реагенты:
- Подготовьте тромбин. Растворить тромбин крупного рогатого скота при 200 Ед / мл в среде с высокой глюкозой DMEM. Фильтруют при 0,22 мкм, аликвоту и хранят при -20 ° С.
- Подготовьте фибриноген. Растворить фибриноген крупного рогатого скота в дозе 20 мг / мл в среде с высоким содержанием глюкозы DMEM. Инкубируйте в течение 3-4 часов на 37 ° C водяной бане, закручивая каждые 30 минут, чтобы помочь растворению. Фильтр при 0,22 мкм (может потребоваться несколько фильтров), аликвот и хранить при -20 ° C.
- Подготовьте апротинин. Растворить апротинин в 10 мг / мл в воде. Фильтруют при 0,22 мкм, аликвоту и хранят при -20 ° С.
- Подготовьте аминогексановую кислоту. Растворяют аминогексановую кислоту при 0,1 г / мл в воде. Фильтровать при 0,22 мкм, аликвоту и хранить при 4 ° C.
- Подготовьте аскорбиновую кислоту. Растворить аскорбиновую кислоту в среде с высоким содержанием глюкозы DMEM в концентрации 50 мМ. Фильтровать при 0,22 мкм и хранить при 4 ° C.
- Подготовьте L-пролин. Растворить L-пролин в PBS при концентрации 50 мМ. Фильтровать при 0,22 мкм и хранить при 4 ° C.
- Подготовьте фактор роста трансформации-β1 (TGF-β1). Восстановить TGF-β1 в соответствии с указаниями производителя в концентрации 10 мкг / мл. Аликвоту и хранить при -20 ° C.
- Определить количество конструкций, необходимых для эксперимента, и обеспечить достаточное количество закрепленных пластин. Рекомендуются как биологические, так и технические репликации. В рассмотренном здесь исследовании 1 используйте повторяющиеся технические репликации и 12 биологических копий (сыворотка из 12 особей в состоянии покоя и после тренировки).
ПРИМЕЧАНИЕ. В стерильных условиях в BSC выполните следующие шаги. - Разверните клетки путем культивирования в 15 см планшетах до 70% слияния. Для каждой конструкции требуется 2,5 × 10 5 ячеек.
- Трипсинизируют клетки и ресуспендируют в GM при концентрации 3,67 × 105 клеток / мл.
- Генерируйте мастер-микс для количества требуемых конструкций: для 1-й конструкции основной смеси содержит 681 мкл клеточной суспензии (содержащей 2,5 × 10 5 клеток), 29 мкл тромбина, 2 мкл апротинина и 2 мкл аминогексановой кислоты.
- После тщательного смешивания мастер-смеси добавьте 714 мкл к каждой закрепленной пластине на рисунке «рисунок 8» вокруг анкерных крепежных элементов. Убедитесь, что мастер-микс непосредственно контактирует с сторонами анкеров.
- Аккуратно надавите на каждую пластину, чтобы равномерно распределить мастер-смесь по плите.
- Для одной пластины за один раз быстро добавьте 286 мкл фибриногена по каплям равномерно по одной пластине и немедленно сдвиньте пластину назад и вперед и сбоку по поверхности BSC, чтобы распределить фибриноген с образованием вложенных в клетку фибриновых гелей , Перейдите к следующей пластине.
- Поместите конструкции в стерильный инкубатор, поддерживаемый при 37 ° C и 5% CO 2, и инкубируйтеВ течение по меньшей мере 15 мин, чтобы обеспечить полимеризацию фибриногена.
- Подготовьте достаточную питательную среду (FM) по 2 мл на каждую конструкцию. Дополнение GM с 200 мкМ аскорбиновой кислотой, 50 мкМ пролина и 5 нг / мл TGF-β1.
- Добавьте 2 мл FM, чтобы покрыть каждую конструкцию. Культуру конструкции в стерильном инкубаторе поддерживали при 37 ° С и 5% СО 2 в течение 14 дней или до желаемой конечной точки, освежая среду каждый второй день 2 мл FM
6. Испытания на растяжение.
ПРИМЕЧАНИЕ. Испытания на растяжение проводились с использованием специально разработанного тестера на растяжение в ванне PBS; Обратные формованные захваты, которые соединены с датчиком силы, удерживают щеткообразные цементные анкеры на месте во время испытания.
- Определите длину и ширину связующих конструкций с помощью цифровых суппортов; Вычислить площадь поперечного сечения ткани.
- Открепите конструкцию связки от пластины и поместите анкеры вОбратные формованные захваты, обеспечивающие погружение конструкции в PBS.
- Отрегулируйте расстояние между захватами, задав длину конструкции до ее начальной длины.
- Начните тест: деформация конструкции до отказа при скорости деформации 0,4 мм / с (или ~ 3% / с).
- После завершения теста обработайте остатки тканей для содержания коллагена (см. Раздел 7).
- Из полученных данных нагрузки-деформации вычислить данные напряженного напряжения и количественно оценить интересующие механические свойства; Например максимальная растягивающая нагрузка, предел прочности при растяжении и модуль упругости ( т . Е. Упругое свойство в линейной области кривой напряжений и деформаций).
7. Количественное определение содержания коллагена в конструктивных связках
- Удалите инженерные связки из анкерных крепеток и сушат при 120 ° C в течение 25 мин.
- Определите сухую массу конструкций и поместите в отдельные пробирки объемом 1,5 мл. Сухие конструкции могут храниться при комнатной температуреДо дальнейшей обработки.
- Для каждой конструкции добавьте 200 мкл 6 М HCl. Кипятите при 120 ° C в нагревательном блоке в течение 2 часов в вытяжном шкафу.
ПРЕДОСТЕРЕЖЕНИЕ: HCl является высококоррозионным и кислотным, рекомендуется использовать трубы с защитой от кипячения / безопасного замка или другой метод крепления труб. - Вначале центрифугируйте трубки, чтобы собрать жидкость, и не оставляйте их без испарения при 120 ° C в нагревательном блоке в течение 1,5 часов в вытяжном шкафу.
- Ресуспендируют полученный осадок в 200 мкл гидроксипролинового буфера. Хранить при температуре -20 ° C до тех пор, пока это не понадобится.
- Подготовьте буфер гидроксипролина. В 300 мл воды добавьте 16,6 г лимонной кислоты, 4 мл уксусной кислоты, 11,4 г NaOH и перемешайте до растворения. РН до 6-6,5 и довести объем до 500 мл. Добавить 250 мкл толуола в качестве консерванта и хранить при температуре 4 ° C, защищенной от света.
- Подготовьте реагенты.
- Подготовьте транс-4-гидрокси-L-пролин. Растворите в воде, чтобы получить раствор 4 мг / мл.
- Подготовьте хлорамин-Т. Растворить в воде, чтобы получить раствор 14,1 мг / мл.
- Подготовьте альдегид-перхлорат. Растворить 1,5 г 4-диметиламинобензальдегида в 6 мл 1-пропанола, 2,6 мл хлорной кислоты (ВНИМАНИЕ: агрессивный, сильный окислитель, использовать соответствующие меры предосторожности) и 0,5 мл воды.
- В набор новых 1,5-мл пробирки разведите образец каждого ресуспендированного гранулы в гидроксипролиновом буфере до объема 200 мкл.
ПРИМЕЧАНИЕ. Разведения могут варьироваться от 1: 4 до 1:50 образца: буфер в зависимости от ожидаемого содержания коллагена в образце; Поэтому для определения коэффициента разбавления, подходящего для данного набора образцов (например, поместите образцы к середине стандартной кривой), может потребоваться тестирование проб и ошибок. - Подготовьте стандарты гидроксипролина. Разбавьте гидроксипролин в буфере гидроксипролина (см. Раздел 7.5.1) до 80 мкг / мл. Выполните серийные разведения, чтобы сделать 6-8 200 мкл стандартов между 0-20 мкг / мл.
- Добавить 150 мкл 14,1 мг /Мл раствора хлорамина Т для каждого стандартного и разбавленного образца. Вихрь и инкубируйте при комнатной температуре в течение 20 мин.
- Добавьте 150 мкл раствора альдегид-перхлората в каждый образец и разбавленный образец. Вихрь и инкубируйте в нагревательном блоке при 60 ° C в течение 15 мин. Утилизируйте избыточный раствор альдегид-перхлорат в качестве опасных отходов в соответствии с местными правилами (содержит перхлорную кислоту).
- Разрешить стандарты и образцы остыть, до аликвоты по 200 мкл каждого, в двух экземплярах, в 96-луночные планшеты.
- Прочитайте пластину при 550 нм на спектрофотометре. Утилизируйте тарелку и оставшийся объем в 1,5 мл трубах в качестве опасных отходов в соответствии с местными правилами (содержит перхлорную кислоту).
- Расчет общей коллагеновой и коллагеновой фракций.
- Преобразуйте значение поглощения для каждого образца в микрограммы гидроксипролина, используя стандартную кривую гидроксипролина.
- Умножьте каждую лунку на 2,5 для расчета количества гидроксипролина вРазбавленный образец. Напомним, что к каждой лунке для образцов добавляют только 200 из 500 мкл общей смеси (200 мкл разбавленного образца + 150 мкл хлорамина T +150 мкл раствора АР).
- Умножить на коэффициент разбавления (раздел 7.7) для расчета количества гидроксипролина в исходном образце.
- Разделите на 0.137 для расчета количества коллагена (предполагается, что коллаген содержит 13,7% гидроксипролина 20 ).
ПРИМЕЧАНИЕ: Содержание гидроксипролина млекопитающих в коллагене незначительно варьирует в тканях и млекопитающих; Например, сухожилия ахиллова свиньи и овец содержат 13,5 и 13,7% (масса гидроксипролина / масса сухой ткани), соответственно 21 . Здесь используют 13,7% для оценки процента гидроксипролина в коллагене, который используется для расчета содержания коллагена в образце ткани с использованием следующего уравнения: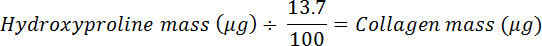
- Разделите сухой массой для расчета коллагенаИ конвертировать в проценты.
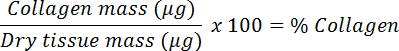
8. Количественная оценка молекулярных конечных точек
ПРИМЕЧАНИЕ. Помимо первичных результатов испытаний на растяжение и содержания коллагена, молекулярные конечные точки могут быть измерены на двумерной или трехмерной ткани, чтобы добавить механистическое понимание. Биоанализы могут быть использованы для определения молекулярных конечных точек (см. Следующий раздел ниже для контекста. Влияние среды после тренировки на связочную функцию in vitro ).
- Для трехмерной ткани:
- Подготовьте конструкции согласно шагу 5 выше.
- После конструктивного лечения / интерференции замораживают конструкции в жидком азоте.
- Используя ступку и пестик, охлажденные на сухом льду, измельчают конструкции в порошок. Продолжите на шаге 8.4 / 5).
- Для двумерной ткани:
- Культурные человеческие ACL фибробласты слияния в monВ шестиходовых планшетах, содержащих DMEM.
- Аспирируйте DMEM и применяйте средства для обработки в соответствии с вашей стратегией экспериментов ( например , эксперименты с временным течением или дозой).
- Препарат для аспирации обрабатывают и промывают клетки PBS.
- Очистите клетки для сбора с использованием соответствующего экстракционного буфера / реагента (см. Следующий).
- Анализ экспрессии белка. Используйте цитозольный экстракционный буфер ( например , 250 мМ сахарозы, 50 мМ Трис, рН 7,4, 5 мМ MgCl2 и коктейль ингибитора протеазы / фосфатазы) для получения белковых лизатов. Проведите анализ концентрации белка и продолжайте анализ в соответствии со стандартными процедурами вестерн-блоттинга.
- Анализ экспрессии генов. Изолируйте общую РНК, используя реагент изоляции 500 мкл РНК в соответствии с инструкциями производителя для получения высококачественной РНК. Выполнять обратную транскрипцию и количественный анализ ПЦР в реальном времени в соответствии со стандартными процедурами.
- Изоляция ДНК: Изолировать и количественно gС использованием ДНК-изоляционного реагента в соответствии с инструкциями производителя. Определить концентрацию ДНК с помощью спектрофотометра для измерения поглощения образца при 260 нм.
Результаты
Обзор инженерной связки и экспериментального вмешательства
На рисунке 1 показан обзор формирования инженерных связок. Брушитовый цемент, материал 22 для замены костей получают путем объединения раствора ортофосфорной кислоты / лимонной кислоты с β-трикальцийфосфатом в цилиндрических лунках. В качестве альтернативы, если непосредственно не измерять механическую функцию тканей, в качестве якорей при образовании ткани можно использовать шовные швы 3-0. Они прикреплены на 12 мм друг от друга в силиконовом покрытии 35-миллиметровых чашках и стерилизуются замачиванием в 70% этаноле. Фибробласты изолированы от остатков передней крестообразной связки, полученных во время операции реконструкции ACL. После расширения 2,5 x 10 5 клеток инкапсулируют в фибриновый гель, сформированный в закрепленной на якоре клише. После образования связка constrМогут быть исследованы изменения механических свойств, содержания коллагена, клеточной пролиферации, экспрессии генов, уровней белка и морфологии тканей.
На протяжении всей культуры клетки сжимают фибриновый гель и образуют линейную ткань между двумя анкерами ( рис. 2А ). Через 1-2 дня в культуре клетки присоединяли к фибриновому гелю, удлиняли клеточные процессы и начали оказывать тяговые усилия ( рисунок 2B ). Поскольку фибриновый гель сжимается тяговыми силами и разрушается клеточными ферментами, между двумя опорными точками образуется напряжение, и наши клетки выравниваются параллельно этой оси ( рис. 2B ) и начинают осаждать коллаген. Через 4-5 дней конструкции сжимались вокруг якорей, образующих линейную цилиндрическую ткань ( рис. 2А , в этот момент к системе могут быть применены внешние раздражители (intervВ настоящее время избегает нарушения процесса формирования линейной ткани). Вмешательства могут состоять из дополнения культуральной среды сывороткой человека или животных после данного вмешательства, экзогенных цитокинов и факторов роста, с использованием механической стимуляции или изменения других факторов окружающей среды, таких как напряжение кислорода. Используя среду роста (DMEM с 10% FBS и 100 ед. / Мл пенициллина), дополненную 200 мкМ аскорбиновой кислотой, 50 мкМ L-пролина и 5 нг / мл TGF-β1, мы определили, что пролиферация клеток продолжается в течение 2-недельной культуры ( Рис. 2C ), и, действительно, световая микроскопия показывает плотную ткань, содержащую высокоориентированные клетки, в 14 дней культуры ( рисунок 2B ).
Оценка инженерных связок
В конце периода культивирования инженерные связки могут быть оценены в разновидностиПути. Основным преимуществом этой системы является способность определять функциональные изменения ткани через механическое тестирование, что является важной оценкой, учитывая механическую роль нативной связки. Одноосное испытание на растяжение может быть использовано для измерения механических свойств, включая нагрузку на отказ, предельную прочность на растяжение и модуль Юнга. Вязкоупругие свойства также могут быть измерены с помощью релаксации напряжений и испытаний на ползучесть. На фиг. 3А изображена конструкционная связка, удерживаемая в обращенных формованных захватах в индивидуальном одноосевом тесте на растяжение. Правое сцепление прикрепляется к датчику силы для измерения нагрузки по связующим, так как ткань напряжена до отказа. На рисунке 3B показан типичный график напряжений и деформаций для испытания на отказ. После проведения механических испытаний одни и те же конструкции могут быть высушены и обработаны для анализа гидроксипролина 23 для оценки общего содержания коллагена, а также другого биоша. При наличии достаточного количества дополнительных образцов в каждом состоянии может быть проведен тщательный осмотр экспериментального вмешательства, включая его влияние на клеточную пролиферацию, экспрессию гена и белка и гистологическую морфологию. В то время как 14 дней являются типичной конечной точкой для наших исследований, инженерные связки продолжают улучшать свои механические свойства и содержание коллагена в течение 28 дней культуры, как показано на рисунке 3C, и могут выжить в культуре по меньшей мере 3 месяца в культуре 24 .
Изменчивость доноров является важным фактором для экспериментальной повторяемости. На рисунке 4 показан типичный эксперимент, описанный Lee et al. 25, сравнивая 7 различных доноров ACL (n = 3 самец и n = 4 женщины), демонстрируя типичные свойства растяжения и содержание коллагена после 2-недельной культуры в ранее описанном Дополненные среды роста. Использование клеток из аналогичных коллекций ACL, возраст донора, время после травмы, пол и т. Д., Сконструированные связки демонстрируют низкую вариабельность между донорами и сходными характеристиками между донорами мужского и женского пола, за исключением разницы в коллагеновой фракции. В вышеупомянутом исследовании искусственные связки использовались в качестве модели in vitro для исследования того, почему женщины имеют значительно больший риск поражения ACL, чем мужчины, и продемонстрировали, что фибробласты ACL, выделенные из доноров-доноров, по своей сути не образуют более слабые и менее коллагеновые инженерные связки 25 .
Воздействие среды после тренировки на сыворотку в отношении in vitro связки
Ранее мы продемонстрировали способность искусственных связок использоваться для зондирования физиологических процессов 1 ,Ss = "xref"> 25. В следующем репрезентативном эксперименте, как сообщает West et al. 1 , мы определили биохимические эффекты упражнения на связочной функции и выделим здесь методологию и результаты. Мы сформировали инженерные связки с использованием человеческих ACL-клеток и применили вмешательство на 7-й день культуры, состоящее из культуральных сред, обусловленных человеческой сывороткой, собранной до или после тренировки. Вкратце, мы приняли на работу здоровых молодых участников мужского пола и собрали образцы крови до и после острого приступа сопротивления, который увеличивает циркулирующие гормоны и цитокины, включая гормон роста человека (GH). Сыворотку человека выделяли из образцов крови до и после тренировки и использовали вместо эмбриональной бычьей сыворотки в культуральной среде на вторую неделю сконструированной культуры связок ( фиг. 5А ). Образцы сыворотки перед и после исследования анализировали с использованием ELISA для изменения GH и инсулиноподобного фактора роста 1 (IGF-1),Концентрация которых может быть изменена путем упражнений ( рис. 5B ). Эта информация использовалась для корреляции влияния сыворотки на сконструированные связки с изменениями в сыворотке в ответ на физические нагрузки. После 14-дневного периода культивирования конструкции связок оценивали с использованием механических испытаний и определения содержания гидроксила в крови на основе гидроксипролина и демонстрировали значительное увеличение как максимальной растягивающей нагрузки, так и содержания коллагена в ответ на сыворотку после тренировки. В целях оценки того, был ли этот эффект связан с вызванными физическими упражнениями выбросами GH или IGF-1, инженерные связки были сформированы в отдельном эксперименте и обработаны дозовым ответом либо рекомбинантной GH человека, либо IGF-1. Интересно, что в то время как сывороточная GH повышалась в крови ( рис. 5B- i), постепенно возрастающая концентрация рекомбинантного GH в культуральной среде не увеличивала содержание коллагена ( рисунок 5D- i) или механическаяСвойства (данные не показаны) в конструктивных связях. Напротив, уровни IGF-1 в сыворотке не увеличивались после тренировки, но эксперимент с дозой-ответ показал, что увеличение уровней в культуральных средах улучшает содержание коллагена в конструкциях связок ( рис. 4D -ii). Таким образом, в то время как физические упражнения приводили к устойчивому увеличению послегрузочной ГР, эксперимент с дозой-дозой с использованием rhGH вызывает сомнения в том, несет ли GH прямую ответственность за фенотипическое улучшение инженерных связок (по крайней мере, изоформа 22 кДа сама по себе не Как представляется, несут ответственность). И наоборот, тогда как сывороточный IGF-1 не изменялся через 15 минут после тренировки, тестирование rhIGF-1 в широком диапазоне концентраций показало, что IGF-1 способен улучшать содержание коллагена; Однако следует отметить, что увеличение концентрации rhIGF-1 в диапазоне, который оценил физиологические уровни, не значительно увеличивал содержание коллагена. Таким образом, уникальная постиндустриальная сывороточная средаЧто важно для улучшения механики и коллагена искусственных связок.
В исследовании, выделенном здесь 1 , объем экспериментальной сыворотки был ограничен из-за этических соображений; Поэтому краткосрочные двумерные биоанализы, которые имели более низкие потребности в сыворотке крови, были использованы для дальнейшего изучения молекулярных механизмов, ответственных за увеличение коллагена, который наблюдался. Фибробласты ACL культивировали для слияния в 6-луночных планшетах и обрабатывали в течение 1 часа сывороткой для отдыха или после тренировки и сравнивали с дозовыми ответами рекомбинантного GH, IGF-1, TGF-β1 и активации мишеней в PI3K / mTORC1 , ERK1 / 2 и пути сигнализации Smad. В присутствии сыворотки после тренировки путь PI3K / mTORC1 и ERK1 / 2 показал большую активацию, которая была оценена путем фосфорилирования S6K ( рис. 5D- i) и ERK1 / 2 ( рисунок 5D -ii) соответственно.По сравнению с ответами на дозу гормонов и цитокинов, тогда как у GH было небольшое положительное влияние на сигнализацию mTOR ( рис. 5D -i) и IGF-1 показали положительный эффект при самой низкой дозе, три обработки GH, IGF-1 и TGF -β1 не учитывали увеличение сигналов PI3K / mTORC1 и ERK1 / 2. Взятые вместе, наша трехмерная инженерная модель связки и данные двумерного биоанализа позволяют предположить, что среда после тренировки сыворотки способна улучшить конструктивную связочную функцию и содержание коллагена путем активации путей PI3K / mTORC1 и ERK1 / 2.
Таким образом, с использованием разработанной модели связки в сочетании с сывороточной физиологической способностью мы смогли: i) исследовать влияние пост-тренировочной сывороточной среды на сконструированную связочную функцию и коллаген, ii) коррелировать изменения фенотипа связок с изменениями концентрации гормонов в сыворотке, С целью определить, какие изменения в сыворотке привели к изменениюИ в) расширение сферы работы с использованием двумерных биоанализов для исследования молекулярных мишеней биохимической среды в сыворотке для определения молекулярных механизмов, которые активируются послеоперационной сывороткой, что приводит к улучшению функции связок.
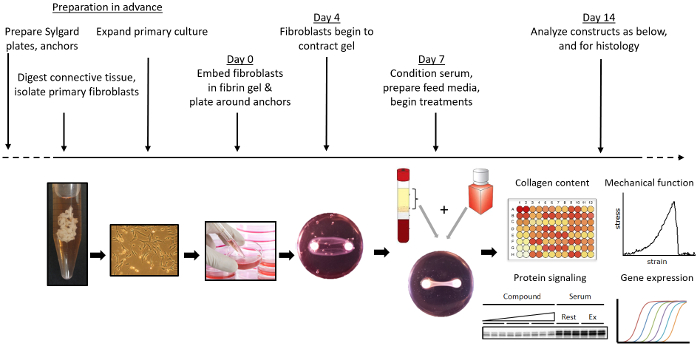
Рисунок 1: Обзор формирования и использования инженерных связок. Бруститовые цементные анкеры изготавливаются и закрепляются на пластинах с силиконовым покрытием. Первичные фибробласты выделяют и экспандируют из остатков ACL. Инженерные связки формируются путем инкапсулирования фибробластов в фибриновом геле вокруг двух якорных цементных анкеров. Инженерные связки культивируют и обрабатывают любым желательным химическим или механическим ( например , через биореактор) раздражители. На желаемой конечной точке могут быть собраны и оценены инженерные связки для механикиЛ, экспрессию генов, содержание коллагена, экспрессию белка и гистологию. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
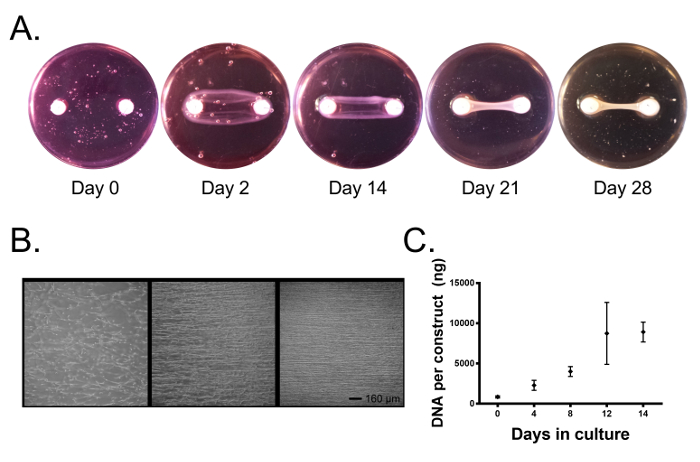
Рисунок 2. Первичные связочные фибробласты образуют на основе фибрина костяную конструкцию связки, связывающую два якорных цементных анкера. ( A ) Со временем фибробласты контактируют с фибриновым гелем вокруг анкерных крепежных узлов, образующих линейную ткань. ( B ) В первые три дня клетки прикрепляются к фибриновому гелю и оказывают тяговые усилия, выравнивая клетки с длинной осью конструкции. Более 14 дней клетки образуют высокоуровневую ткань. Шкала шкалы = 160 мкм. ( C ) Содержание ДНК в конструктивных связях продолжает увеличиваться oVer 14 дней в культуре по мере пролиферации клеток. Данные представлены как среднее ± SD с n = 3-4 конструкциями на группу. групп. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
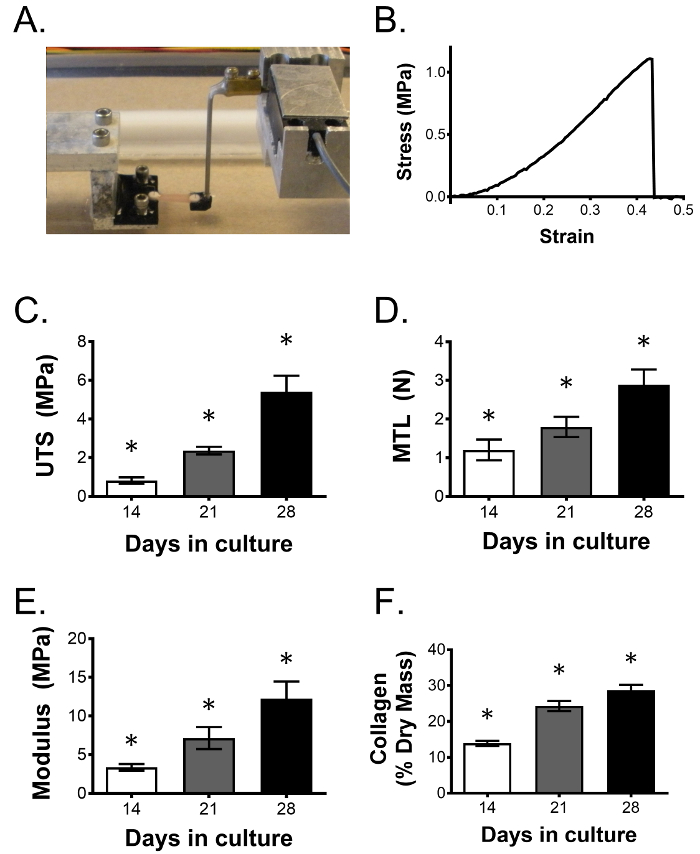
Рисунок 3: Механические свойства механических связок и содержание коллагена улучшаются с течением времени. ( A ) Конструкции связок одноосно растягиваются, чтобы определить влияние данного вмешательства на связочную функцию. Как показано на рисунке, две реверсированные трехмерные печатные рукоятки содержат анкеры с взаимной формой, которые соединяются с помощью искусственного сухожилия. Анкеры соединены с шаговым двигателем и преобразователем силы для генерации кривых напряжения / деформации тестируемой ткани, позволяя определить механические свойства. ( B </ Strong>) Репрезентативная кривая напряжения-деформации из сконструированной связки, напряженной до отказа. В течение 28 дней продолжают улучшаться ( C ) предельная прочность на растяжение (UTS), ( D ) максимальная растягивающая нагрузка (MTL), ( E ) модуль Юнга и ( F ) коллагеновая фракция. Данные представлены как среднее ± SD с n = 5 конструкциями на группу. * Указывает на значительное отличие от всех других групп. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
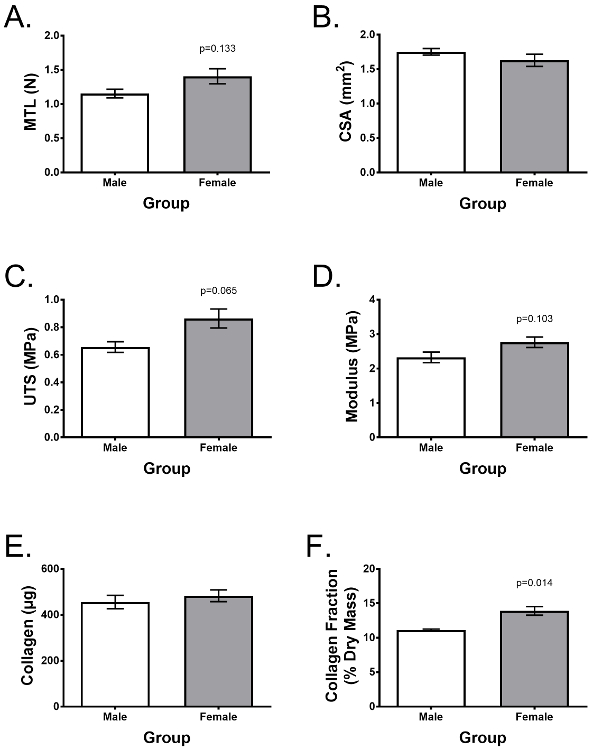
Рисунок 4: Инженерные связки можно оценивать по функциональности и биохимическому содержанию, демонстрируя низкую донорскую изменчивость. У конструктивных связок были сформированы 7 разных доноров (n = 3 самец, n = 4 женщины). Через 2 недели o( B ) предел прочности при растяжении (UTS), ( C ) модуль Юнга, ( D ) площадь поперечного сечения (CSA), ( E ) общее содержание коллагена в Конструкции и ( F ) коллагена в виде доли сухой массы. Данные представлены как среднее ± SD, а статистическое значение - с t-критерием Стьюдента. * Указывает на значительное отличие от других групп (p <0,05). Рисунок, адаптированный из Lee et al. 25 Нажмите здесь, чтобы посмотреть увеличенную версию этого рисунка.
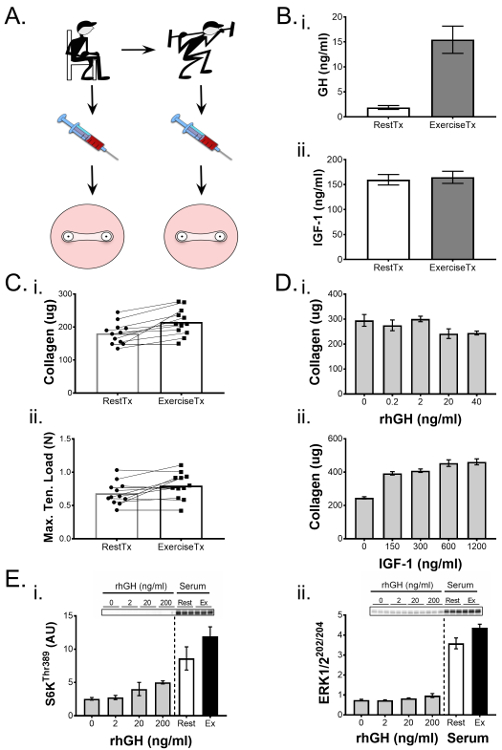
Рисунок 5. Инженерные связки демонстрируют механические и биохимические изменения в ответ на биолоПрактических мероприятий. ( A ) Сыворотка была выделена из крови, собранной у субъектов pre- (RestTx) и после тренировки (ExTx) и использовалась для лечения искусственных связок во вторую неделю культивирования. ( B ) (i) Гормон роста человека (GH) и (ii) уровни инсулиноподобного фактора роста (IGF) -1 в сыворотке и сыворотке крови определяли количественно с помощью ELISA. ( C ) Инженерные связки, обработанные ExTx, продемонстрировали улучшение (i) содержания коллагена и (ii) максимальную растягивающую нагрузку. Статистическую значимость парных сравнений (RestTx и ExTx) анализировали с помощью t-теста с уровнем значимости, установленным при p <0,05. ( D ) Доза-реакция (i) GH и (ii) IGF-1 была использована для определения возможных вкладов этих факторов в изменения содержания коллагена из-за ExTx. E) Двумерные биоанализы использовались для сравнения эффектов увеличения доз GH, RestTx и ExTx на молекулярные сигнальные мишени, такие как фосфорилирование (i) S6K Thr389 и (ii) ERK1 / 2 Thr202 / Tyr204 . Статистическое сравнение более двух экспериментальных групп проводилось с использованием ANOVA и HSD Tukey. Данные представлены в виде среднего значения ± SD. * Указывает на значительное отличие от контроля (р <0,05), а § указывает на значительную разницу между 150 нг / мл и 300 нг / мл ИФР-1. Рисунок, адаптированный из West et al. 1 Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Настоящая рукопись описывает модель связующей ткани, которая является полезной экспериментальной платформой для исследователей с широким спектром исследовательских тем, от развития тканей до трансляционных / клинических вопросов. Разработанная здесь модель связки основана на универсальном протоколе, который может быть адаптирован в разных точках рабочего процесса ( рис. 1 и раздел обсуждения ). Кроме того, по своей природе редукционистский характер среды in vitro может быть приближен к физиологической области, дополняя питательную среду обработанной человеческой или животной сывороткой.
Конструкции могут быть сформированы с использованием фибробластов из различных источников
Хотя методология и репрезентативные результаты, показанные здесь, основаны на использовании первичных фибробластов ACL, протокол изоляции клеток может быть скорректирован для сбора других типов первичных фибробластов. Как описаноНа фиг. 4 , сконструированные связки, образованные с первичными клетками, выделенными из молодых доноров-доноров, демонстрируют низкую донорскую изменчивость. Первичные клетки ограничены первоначальной изоляцией и ограничением прохождения; Использование клеточных линий может улучшить воспроизводимость экспериментов. Использование других типов клеток может потребовать внесения изменений в клеточные культуральные среды и композицию фибринового геля. Например, мы заметили, что человеческие мезенхимальные стволовые клетки (MSC) не способны образовывать линейные ткани между якорь-цементными анкерами в течение 2 недель, в то время как фибробласты конечного цифрового сгибательного сухожилия конечности, стромальные клетки лошадиного костного мозга, фибробласты фибриллов куриного эмбриона , И мышиные C3H10T1 / 2 MSCs быстро сжимают и переваривают фибриновый гель для образования линейной ткани (неопубликованные наблюдения). Этот контраст может быть следствием различий в сократимости клеток, пролиферации и производства фибринолитических ферментов.
Применение химическихИ механическая стимуляция
В способе, описанном здесь, ткань на основе фибрина образуется вокруг якорных цементных анкеров, что позволяет применять механическую стимуляцию через растягивающий биореактор 11 , а также для испытаний на растяжение конечной точки. Присутствие интерфейса щетко-цементно-мягкой ткани (энтез) также дает возможность для дальнейшего изучения и улучшения 22 , 26 (см. Раздел «Клинические применения» ниже). В этой среде in vitro можно более легко определить вклад химических и механических факторов; Пример этого показан на рисунке 5 , в результате чего эффект среды после тренировки отделяется от механических стимулов упражнений. Пилотные исследования могут потребоваться для определения сроков экспериментальных вмешательств, состава обработок и соответствующих конечных точек, чтобы ожидать заметных изменений. FoНапример, в исследовании 1 после исследования сыворотки продолжительность экспериментального лечения ограничивалась подачей сыворотки, используемой для добавления среды, из которой конструкции питались каждый второй день. Кроме того, в течение второй недели культивирования культуральную среду дополняли остаточной или пост-физической сывороткой с аскорбиновой кислотой и L-пролином, поддерживаемым при удалении TGF-β1. TGF-β1 является известным про-фибротическим фактором роста, который усиливается в сыворотке после тренировки 27 . Поэтому, чтобы избежать затенения эффектов, связанных с TGF-β1 после сыворотки после тренировки, этот цитокин не поддерживался в культуральной среде.
Эта разработанная модель связки также может использоваться для проверки влияния механического растяжения. Посредством инженерных обратных моделей захватов для крепления концов анкерных крестообразных цементов (аналогично одноосевому тестеру растяжения, изображенному на рисунке 1 ), растягивающие биореакторы могут быть спроектированы для размещения Инкрустированные связки. Наша лаборатория ранее использовала эту модель для исследования реакции молекулярной сигнализации инженерных связок на одноосное растягивающее растяжение в пользовательском биореакторе 11, который обеспечит лучшее понимание рационального проектирования парадигмы растяжения in vitro или даже потенциально in vivo Растяжения / активности / терапевтических применений.
Оценка инженерных связок
Как и в случае традиционной монослойной культуры, 3D-конструкции могут быть проанализированы для экспрессии гена / белка; Кроме того, их трехмерная морфология также дает возможность оценить функциональные и морфологические изменения, и конструкции могут сохраняться в культуре для долгосрочных исследований ( рисунок 3 ). В то время как сконструированные связки не эквивалентны нативным, зрелым связям, они имеют сходство с развитием сухожилий / связок и ведут себя подобно родной ткани в ответ на питательные вещества«> 26, факторы роста 10 , гормоны 25 и упражнения 11 , 28. Таким образом, хотя предостережение оправдано перед широкими обобщениями из любой модели in vitro , результаты тестирования конструкции связки могут выявлять или сообщать конкретный физиологический механизм, который в противном случае мог бы быть Невозможно исследовать in vivo.
Дополнить питательную среду кондиционированной сывороткой для гибкой и динамичной модели с широкими возможностями применения
Метаболизм сыворотки человека составляет около 4500 соединений, включая, но не ограничиваясь ими, гликопротеины, липопротеины, производные липидов, энергетические субстраты, метаболиты, витамины, ферменты, гормоны, нейротрансмиттеры и множество строительных блоков / промежуточных соединений. 29 Дальнейшая проверка сывороточного метаболизма человека в соответствии с составными классами 29 показывает аддитиПреимущества интегрирования экспериментальной сыворотки в эксперименты in vitro. То есть, большинство из 4500 соединений в сыворотке являются гидрофобными или липидными, подчеркивая важность связывания белков для транспорта / солюбилизации. Из этого следует, что экспериментальная рекапиляция динамики переноса эндогенных соединений и, следовательно, биодоступность и взаимодействие соединений-мишеней были бы почти невозможны. Таким образом, экспериментальная сыворотка особенно эффективна для изучения соединений, которые, как известно, зависят от вспомогательных молекул для солюбилизации, транспорта, связывания с мишенью и механизма действия.
Наша лаборатория имеет давний интерес к преимуществам здоровья для физических упражнений. Упражнение улучшает функцию клеток и органов в различных тканях по всему телу 12 , что может быть связано с множеством факторов (например, IL-6 13 , IL-15 14 , Meteorin-like 15 ,Экзосомы 16 , 17 ), которые высвобождаются в системную циркуляцию. Биохимическая среда после упражнений отражает факторы, выделяющиеся как от сжимающих гормоны, реагирующих на скелетные мышцы, так и с факторами, которые выделяются в результате стимуляции симпатической нервной системы секреторных желез ( например , кортизола и катехоламинов из надпочечников 18 и роста Гормон из передней доли гипофиза 19 ). Недавно мы использовали модель до- и пост-тренировочной сыворотки для исследования эффектов биохимической среды, вызванной упражнениями, на инженерную ткань. 1 Несмотря на то, что остаются многочисленные важные вопросы, связанные с физическими упражнениями, модель никоим образом не ограничена таким образом. Например, сыворотка может быть получена либо из животных, либо из-за людей, после диетических или фармакологических вмешательств или из разных возрастных групп или клинической популяцииС 30 . Таким образом, экзогенные или эндогенные соединения, представляющие интерес, будут присутствовать в сыворотке и обрабатывающих средах в количествах биодоступных веществ и будут взаимодействовать с тканью-мишенью в соответствии с эндогенной средой ( то есть в более физиологическом контексте). Этот подход является динамичным, поскольку весьма вероятно, что данное вмешательство будет оказывать многоорганизационное (и многокомпонентное) действие, и, таким образом, физиологическая среда будет комодифицирована. Хотя этот подход представляет определенные проблемы, поскольку одновременно изменяются многочисленные системные биохимические переменные, это подход, который может помочь преодолеть недостатки чисто редукционистской экспериментальной методологии 31 , 32 . Взятые вместе, внедрение кондиционированной сыворотки вместе с тканевой инженерией ( биохимическая ткань in vitro ) может быть использована в качестве инструмента для вопросов физиологии, питания и клинических исследований.
Клинические применения многочисленны
Представленная здесь модель тканевой инженерии может быть использована для исследования анатомических и клинических вопросов исследования, которые традиционные модели in vitro не могут. Связка или сухожилия in vivo содержит область перехода ткани от мягкой к твердой, называемую энтезом. Энтез, который подвержен механическому стрессовому повреждению 33 , может быть изучен в поперечном сечении с помощью методов гистохимической и электронной микроскопии 22 , 26 . Этот уникальный интерфейс вдвойне важен для людей с низкой или ограниченной подвижностью, поскольку физическая неактивность снижает способность соединительной ткани переносить нагрузку в области с низким до высоким уровнем соответствия 34 , что в конечном итоге приводит к общему снижению соответствия тканей и увеличению риска травматизма.
Недавно наша лаборатория использовала эту модель тканевой инженерии 25 </ Sup> для моделирования другой популяции, спортсменов-женщин, которые подвержены риску травм соединительной ткани: заболеваемость ACL-травмой примерно в пять раз выше, чем у мужчин-мужчин 35 . Потенциальные механизмы, лежащие в основе этого неравенства по половому признаку при травме, были исследованы путем лечения связочных конструкций физиологическими концентрациями женского полового гормона, эстрогена, в концентрациях, которые имитировали стадии менструального цикла. Интересно, что высокие концентрации эстрогена ингибировали экспрессию гена и активность лизил оксидазы, первичного фермента, ответственного за создание лизино-лизиновых перекрестных связей в коллагеновой матрице связок и сухожилий. Важно отметить, что 48 ч высокого эстрогена (для имитации фолликулярной фазы) уменьшали жесткость связки, не изменяя плотность коллагена конструкций. С физиологической точки зрения это говорит о том, что увеличение слабости связок у женщин может быть обусловлено, по крайней мере частично, уменьшениемСкрещивание. С экспериментальной точки зрения эти данные 25 подчеркивают полезность модели 3D-конструкции, которая позволила изучить функциональную сшивающую активность. С клинической точки зрения, эта модель теперь может быть использована для быстрого экранирования вмешательств, которые могут предотвратить негативные эффекты функции эстрогена связки.
Заключительные замечания
Здесь мы представили подробную методику формирования инженерных связок и их полезность в качестве трехмерной модели ткани in vitro . Модель очень адаптируется к широкому спектру задач, обеспечивая гибкость в отношении типа клеток, вмешательств и ожидаемых результатов. Дополнение питательной среды с кондиционированной сывороткой добавляет физиологический контекст, который не может быть достигнут в традиционной среде in vitro , улучшая моделирование физиологии in vivo . Короче говоря, мы считаем, что это широко применяемый режимС захватывающими последствиями для развития как физиологии, так и тканевой инженерии.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана постдокторской стипендией NSERC (DWDW), стипендией Фонда ARCS (AL) и грантом UC Davis College of Biological Sciences (KB).
Материалы
| Name | Company | Catalog Number | Comments |
| Austerlitz Insect pins, minutien stainless steel, size 0.20 | Entomoravia | N/A | For brushite cement anchors |
| β-tricalcium phosphate | Plasma Biotal Ltd (Derbyshire, UK) | N/A | For brushite cement anchors |
| o-phosphoric acid, 85% (w/w) | EMD Millipore | PX0995 | For brushite cement anchors |
| Citric acid | Sigma-Aldrich | 251275-500g | For brushite cement anchors |
| Falcon 35 mm tissue culture dishes | Fisher Scientific | 08-772A | For silicone-coated plates |
| Sylgard 184 silicone elastomer kit | Ellsworth Adhesives | 4019862 | For silicone-coated plates |
| 1x Phosphate-buffered saline (PBS) | Fisher Scientific | SH3002802 | For cell isolation and expansion |
| 100x antibiotic/antimycotic solution | VWR | 45000-616 | For cell isolation |
| Type II collagenase | Thermo Fisher Scientific | 17101015 | For cell isolation |
| 100x penicillin/streptomycin solution | Thermo Fisher Scientific | 15140122 | For cell isolation |
| Steriflip-GP, 0.22 µm pore, polyethersulfone, gamma irradiated | EMD Millipore | SCGP00525 | For reagent sterilization |
| DMEM high glucose with sodium pyruvate and L-glutamine | VWR | 10-013-CV | For cell and tissue culture |
| Fetal bovine serum | BioSera | FBS2000 | Component of tissue digestion media and growth media |
| Penicillin G Potassium Salt | MP Biomedicals | 0219453680 - 100 MU | Component of growth media. Dissolve in water to 100,000 U/mL, filter sterilize, aliquot, and store at -20°C. |
| CELLSTAR polystyrene tissue culture dishes (145 mm x 20 mm) | VWR | 82050-598 | For cell culture |
| Trypan blue | Thermo Fisher Scientific | T10282 | For cell isolation |
| Trypsin-EDTA (0.25%) | Thermo Fisher Scientific | 25200056 | For cell culture. Dilute to 0.05% in PBS |
| Dimethyl sulfoxide | Sigma-Aldrich | 472301 | For cell freezing media |
| Nalgene Mr. Frosty Cryogenic Freezing Container | Thermo Fisher Scientific | 5100-0001 | For cell freezing |
| BD Vacutainer Red Plastic 10 mL | Fisher Scientific | 367820 | For human serum collection |
| Bound Tree Insyte Autoguard IV Catheters, 22 G x 1 inch Needle | Fisher Scientific | 354221 | For human serum collection |
| Thrombin, bovine origin | Sigma-Aldrich | T4648-1KU | For engineered ligament formation. Dissolve at 200 U/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Fibrinogen, bovine origin | Sigma-Aldrich | F8630-5G | For engineered ligament formation. Dissolve at 20 mg/mL in DMEM high glucose media. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| Aprotinin from bovine lung | Sigma-Aldrich | A3428 | For engineered ligament formation. Dissolve at 10 mg/mL in water. Filter at 0.22 μm, aliquot, and store at -20 °C. |
| 6-Aminohexanoic acid | Sigma-Aldrich | 07260-100g | For engineered ligament formation. Dissolve at 0.1g/mL in water. Filter at 0.22 μm, aliquot, and store at 4 °C. |
| L-Ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960-5G | Component of feed media. Dissolve in DMEM high glucose media at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| L-proline | Sigma-Aldrich | P5607-25G | Component of feed media. Dissolve in PBS at a concentration of 50 mM. Filter at 0.22 μm and store at 4 °C. |
| Transforming growth factor-β1 | Peprotech | 100-21 | Component of feed media. Reconsistute according to manufacturer's instructions at a concentration of 10 μg/mL. Aliquot and store at -20 °C. |
| Stericup-GP, 0.22 µm, polyethersulfone, 250 mL, radio-sterilized | EMD Millipore | SCGPU02RE | For reagent sterilization |
| Hydrochloric acid | Fisher Scientific | A144-212 | Dilute in water to 6 M |
| 4-Dimethylaminobenzaldehyde | Sigma-Aldrich | 39070-50g | For hydroxyproline assay |
| Chloramine-T trihydrate | Sigma-Aldrich | 402869-100g | For hydroxyproline assay |
| trans-4-Hydroxy-L-proline | Sigma-Aldrich | H54409-100g | For hydroxyproline assay |
| 1-propanol | Sigma-Aldrich | 279544-1L | For hydroxyproline assay |
| Perchloric acid | Sigma-Aldrich | 311421-250ml | For hydroxyproline assay |
| Acetic acid, glacial | EMD Millipore | AX0073-9 | For hydroxyproline assay |
| Sodium hydroxide | Fisher Scientific | S318-500 | For hydroxyproline assay |
| Toluene, anhydrous | Sigma-Aldrich | 244511-1L | For hydroxyproline assay |
| Corning Costar Clear Polystyrene 96-Well Plates | Fisher Scientific | 07-200-656 | For hydroxyproline assay |
Ссылки
- West, D. W., et al. The exercise-induced biochemical milieu enhances collagen content and tensile strength of engineered ligaments. J Physiol. 593 (20), 4665-4675 (2015).
- Booth, F. W., Laye, M. J. Lack of adequate appreciation of physical exercise's complexities can pre-empt appropriate design and interpretation in scientific discovery. J Physiol. 587 (Pt 23), 5527-5539 (2009).
- Booth, F. W., Hargreaves, M. Understanding multi-organ pathology from insufficient exercise. J Appl Physiol (1985). 111 (4), 1199-1200 (2011).
- Shearn, J. T., et al. Tendon tissue engineering: progress, challenges, and translation to the clinic. J Musculoskelet Neuronal Interact. 11 (2), 163-173 (2011).
- Liu, C. F., et al. What we should know before using tissue engineering techniques to repair injured tendons: a developmental biology perspective. Tissue Eng Part B Rev. 17 (3), 165-176 (2011).
- Vunjak-Novakovic, G., Altman, G., Horan, R., Kaplan, D. L. Tissue engineering of ligaments. Annu Rev Biomed Eng. 6, 131-156 (2004).
- Bayer, M. L., et al. The initiation of embryonic-like collagen fibrillogenesis by adult human tendon fibroblasts when cultured under tension. Biomaterials. 31 (18), 4889-4897 (2010).
- Guerquin, M. J., et al. Transcription factor EGR1 directs tendon differentiation and promotes tendon repair. J Clin Invest. 123 (8), 3564-3576 (2013).
- Ma, J., et al. Three-dimensional engineered bone-ligament-bone constructs for anterior cruciate ligament replacement. Tissue Eng Part A. 18 (1-2), 103-116 (2012).
- Hagerty, P., et al. The effect of growth factors on both collagen synthesis and tensile strength of engineered human ligaments. Biomaterials. 33 (27), 6355-6361 (2012).
- Paxton, J. Z., Hagerty, P., Andrick, J. J., Baar, K. Optimizing an intermittent stretch paradigm using ERK1/2 phosphorylation results in increased collagen synthesis in engineered ligaments. Tissue Eng Part A. 18 (3-4), 277-284 (2012).
- Safdar, A., et al. Endurance exercise rescues progeroid aging and induces systemic mitochondrial rejuvenation in mtDNA mutator mice. Proc Natl Acad Sci U S A. 108 (10), 4135-4140 (2011).
- Pedersen, B. K., Febbraio, M. A. Muscles, exercise and obesity: skeletal muscle as a secretory organ. Nat Rev Endocrinol. 8 (8), 457-465 (2012).
- Crane, J. D., et al. Exercise-stimulated interleukin-15 is controlled by AMPK and regulates skin metabolism and aging. Aging Cell. 14 (4), 625-634 (2015).
- Rao, R. R., et al. Meteorin-like is a hormone that regulates immune-adipose interactions to increase beige fat thermogenesis. Cell. 157 (6), 1279-1291 (2014).
- Aswad, H., et al. Exosomes participate in the alteration of muscle homeostasis during lipid-induced insulin resistance in mice. Diabetologia. 57 (10), 2155-2164 (2014).
- Safdar, A., Saleem, A., Tarnopolsky, M. A. The potential of endurance exercise-derived exosomes to treat metabolic diseases. Nat Rev Endocrinol. 12 (9), advance online publication 504-517 (2016).
- Maling, H. M., Stern, D. N., Altland, P. D., Highman, B., Brodie, B. B. The physiologic role of the sympathetic nervous system in exercise. J Pharmacol Exp Ther. 154 (1), 35-45 (1966).
- Pritzlaff, C. J., et al. Impact of acute exercise intensity on pulsatile growth hormone release in men. J Appl Physiol (1985). 87 (2), 498-504 (1999).
- Creemers, L. B., Jansen, D. C., van Veen-Reurings, A., van den Bos, T., Everts, V. Microassay for the assessment of low levels of hydroxyproline. Biotechniques. 22 (4), 656-658 (1997).
- Neuman, R. E., Logan, M. A. The determination of hydroxyproline. J Biol Chem. 184 (1), 299-306 (1950).
- Paxton, J. Z., Donnelly, K., Keatch, R. P., Baar, K., Grover, L. M. Factors affecting the longevity and strength in an in vitro model of the bone-ligament interface. Ann Biomed Eng. 38 (6), 2155-2166 (2010).
- Woessner, J. F. Jr The determination of hydroxyproline in tissue and protein samples containing small proportions of this imino acid. Arch Biochem Biophys. 93, 440-447 (1961).
- Paxton, J. Z., Wudebwe, U. N., Wang, A., Woods, D., Grover, L. M. Monitoring sinew contraction during formation of tissue-engineered fibrin-based ligament constructs. Tissue Eng Part A. 18 (15-16), 1596-1607 (2012).
- Lee, C. A., et al. Estrogen inhibits lysyl oxidase and decreases mechanical function in engineered ligaments. J Appl Physiol (1985). 118 (10), 1250-1257 (2015).
- Paxton, J. Z., Grover, L. M., Baar, K. Engineering an in vitro model of a functional ligament from bone to bone. Tissue Eng Part A. 16 (11), 3515-3525 (2010).
- Heinemeier, K., Langberg, H., Kjaer, M. Exercise-induced changes in circulating levels of transforming growth factor-beta-1 in humans: methodological considerations. Eur J Appl Physiol. 90 (1-2), 171-177 (2003).
- Mackey, A. L., Heinemeier, K. M., Koskinen, S. O., Kjaer, M. Dynamic adaptation of tendon and muscle connective tissue to mechanical loading. Connect Tissue Res. 49 (3), 165-168 (2008).
- Psychogios, N., et al. The human serum metabolome. PLoS One. 6 (2), e16957(2011).
- Nguyen, T., et al. The effects of resting and exercise serum from children with cystic fibrosis on C2C12 myoblast proliferation in vitro. Physiol Rep. 2 (6), e12042(2014).
- Joyner, M. J., Pedersen, B. K. Ten questions about systems biology. J Physiol. 589 (Pt 5), 1017-1030 (2011).
- Joyner, M. J. Giant sucking sound: can physiology fill the intellectual void left by the reductionists? J Appl Physiol (1985). 111 (2), 335-342 (2011).
- Benjamin, M., et al. Where tendons and ligaments meet bone: attachment sites ('entheses') in relation to exercise and/or mechanical load. J Anat. 208 (4), 471-490 (2006).
- Arruda, E. M., Calve, S., Dennis, R. G., Mundy, K., Baar, K. Regional variation of tibialis anterior tendon mechanics is lost following denervation. J Appl Physiol (1985). 101 (4), 1113-1117 (1985).
- Arendt, E., Dick, R. Knee injury patterns among men and women in collegiate basketball and soccer. NCAA data and review of literature. Am J Sports Med. 23 (6), 694-701 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены