Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición de las densidades de gafas acuosas a temperaturas criogénicas
* Estos autores han contribuido por igual
En este artículo
Resumen
Se describe un protocolo para determinar las densidades de fase vítrea de gotas de tamaño micro a pico-litro de mezclas acuosas a temperaturas criogénicas.
Resumen
Demostramos un método para determinar las densidades de temperatura criogénicas de la fase vítrea de mezclas acuosas, y otras muestras que requieren un enfriamiento rápido, para preparar la fase de temperatura criogénica deseada. Las gotas de tamaño de microlitro a picolitro se enfrían por proyección en una mezcla de nitrógeno-argón líquido (N2 - Ar). La fase de temperatura criogénica de la gota se evalúa utilizando un ensayo visual que se correlaciona con mediciones de difracción de rayos X. La densidad de la mezcla N _ { 2} - Ar líquida se ajusta mediante la adición de N _ { 2 } o Ar hasta que la gota se vuelve neutralmente flotante. La densidad de esta mezcla y por lo tanto de la gota se determina usando una masa de prueba y el principio de Arquímedes. Con un cuidado adecuado en la preparación de gotas, la gestión del gas por encima de la mezcla líquida de criógenos para minimizar el hielo y la mezcla regular de la mezcla criogénica para evitar la estratificación de la densidad y la separación de fases, densidades <0.5% de gotas tan pequeñas como 50 pLFácilmente determinado. Las mediciones de las mezclas de crioprotectores acuosos proporcionan información sobre la acción crioprotectora y proporcionan datos cuantitativos para facilitar la adaptación de la contracción térmica en la crioconservación biológica.
Introducción
Las propiedades físicas del agua y de las mezclas acuosas en sus diversas fases son de interés fundamental y son importantes para la comprensión in vivo e in vitro de los sistemas biológicos. En la criobiología contemporánea y la crioconservación biológica, las fases vítreas o amorfas de las mezclas acuosas de crioprotectores son de particular interés 1 , 2 . La nucleación y el crecimiento de los cristales de hielo pueden interrumpir las células y los tejidos, y promover la desnaturalización y agregación de proteínas, por lo que los protocolos de crioconservación que vitrifican el disolvente se han vuelto cada vez más populares. En la cristalografía biomolecular, la cristalización del disolvente en los canales entre las biomoléculas interrumpe las rejillas de cristal y degrada las propiedades de difracción. La vitrificación se consigue a través de una combinación de enfriamiento rápido, deshidratación y adición de solutos crioprotectores tales como glicerol, etilenglicol, polietilenglicoles (PEGs),Alcoholes y sales.
La vitrificación limita la cristalización y el crecimiento del hielo, pero no elimina todos los daños relacionados con la refrigeración. Por ejemplo, la mosaicidad cristalina (una medida de la distribución de las orientaciones de los planos de cristal) aumenta rutinariamente en un factor de 10 a 100 cuando los cristales de proteína se enfrían en un estado vitrificado 3 , y las tasas de supervivencia de espermatozoides vitrificados y ovocitos varían ampliamente .
Un mecanismo de daño es la contracción diferencial del disolvente y del material circundante durante el enfriamiento 3 , 4 , 5 . El disolvente de equilibrio y las concentraciones de soluto dentro de un cristal, célula o tejido son dependientes de la temperatura, y el disolvente más el soluto y el material circundante pueden contraerse en diferentes cantidades. El enfriamiento rápido puede prevenir la redistribución del solvente y del soluto antes de la vitrificación, y Puede conducir a tensiones grandes, inhomogéneas y no equilibradas que causan daño a la muestra.
Por lo tanto, los enfoques racionales para reducir el daño inducido por refrigeración podrían beneficiarse del conocimiento de las densidades dependientes de la temperatura de las mezclas acuosas líquidas y vitrificadas. A concentraciones de soluto superiores al 50% en peso de soluto a peso de solución (p / p), la mayoría de las mezclas de crioprotectores acuosos pueden vitrificarse con tasas de enfriamiento modestas de 10 K / s o menos, permitiendo la producción y medidas de densidad usando muestras vítreas grandes 6 . La densidad puede entonces determinarse usando el principio de Arquímedes, midiendo el peso aparente de la muestra cuando se suspende en un criógeno líquido como nitrógeno. Sin embargo, a medida que disminuye la concentración de soluto, las velocidades de enfriamiento requeridas para la vitrificación aumentan rápidamente: Las velocidades de enfriamiento para mezclas acuosas de glicerol aumentan de <10 K / s a 50% en peso de soluto en g al volumen de solución en ml (p / v) K / sa 25% p / vAsno = "xref"> 7. La transferencia de calor se limita a la capa límite, de modo que lograr mayores tasas de enfriamiento requiere muestras cada vez más pequeñas 8 .
Las mediciones de la densidad de agua vítrea pura y hielo se han conseguido depositando gotas de diámetro micrométrico (volumen de femtolitro) en vacío sobre una superficie enfriada criogénicamente para construir una muestra macroscópica (masa gramatical). La densidad de esta muestra se determinó mediante crioflotación en una mezcla de nitrógeno líquido-argón, en la que se ajustó la densidad del líquido criogénico hasta que la muestra se volvió neutralmente flotante 9 . Sin embargo, la generación de grandes muestras de un gran número de pequeñas gotas de una manera que minimiza los volúmenes de vacío - una importante fuente de error en las mediciones anteriores de la densidad de la fase vítrea - no es trivial. Para las mezclas acuosas, la evaporación diferencial de los componentes de la solución durante la aerosolización y la deposición en vacío puede conducir aIncertidumbres sustanciales en las concentraciones depositadas.
Hemos desarrollado un método, basado en cryoflotation, que permite la determinación precisa de la densidad de mezclas acuosas utilizando gotas individuales tan pequeñas como 50 pL 10 . Estas gotas pueden enfriarse rápidamente mientras se mantienen sus concentraciones originales, y su estado de temperatura criogénica (vitrificado o cristalino) se puede evaluar usando un ensayo visual simple que se correlaciona con mediciones de difracción de rayos X. Este método es ampliamente aplicable a mezclas acuosas y no acuosas, y puede extenderse a una variedad de muestras biológicas que incluyen células ( vg , tallos y huevos), muestras de tejido y cristales de proteína que tienen densidades a baja temperatura entre 0,8 y 1,4 g / Ml.
Protocolo
PRECAUCIÓN: Antes de usar, consulte todas las hojas de datos de seguridad de materiales relevantes (MSDS). Por favor, use todas las prácticas de seguridad apropiadas cuando use gases comprimidos, incluyendo reguladores y válvulas de manejo de gases calibrados apropiados y tubos de gas aprobados. El contacto con criogénicos líquidos puede causar congelación severa y necrosis. Use equipo de protección personal adecuado (visera, guantes, bata de laboratorio, pantalones largos, zapatos cerrados), todos los cuales deben ser impermeables al nitrógeno líquido. Permanezca de pie y asegure un camino de salida sin obstrucciones desde el aparato cuando use criogénicos líquidos. Tenga en cuenta los riesgos de asfixia cuando utilice gases comprimidos y criogénicos líquidos y trabaje en un área bien ventilada con suficiente aire de preparación (una campana extractora de humos o una habitación con un alto índice de renovación del aire).
1. Preparación de Soluciones Acuosas para Mediciones de Densidad
NOTA: Dado que los pesos se miden más fácilmente con una alta precisión que el vol, Las concentraciones en solución se miden en unidades w / w. Todas las densidades y temperaturas de fusión o de ebullición asumen una presión atmosférica de ~ 100 kPa. Los siguientes pasos describen la preparación de una solución de glicerol al 35% p / p. El mismo procedimiento se puede utilizar para otras concentraciones y solutos.
- Para cada tipo de soluto y concentración de interés, estimar aproximadamente la masa de soluto requerida para obtener la concentración final deseada ( por ejemplo , entre 25% p / p y 100% p / p) para un volumen de solución total, V $ _ { tot } $ = 10 ml de volumen de disolución . Por ejemplo, para una solución de glicerol al 35% p / p ( ρ s = 1,26 g / ml), la masa de soluto, m s es:

Donde x es la fracción de masa de soluto (0.35) y ρ w = 1 g / mL es la densidad de agua. - Coloque un tubo de centrífuga de 15 ml (u otro recipiente impermeable al agua calibrado en volumen) sobre la sarténDe una microbalanza analítica. Dispensar la masa deseada de soluto / crioprotector ( por ejemplo , 3,77 g de glicerol para una solución al 35% p / p) en el tubo y registrar la masa de soluto real.
- Añadir agua desionizada de alta pureza (> 18 MΩ) para llevar la masa total hasta 10,0 g
- Vórtice el recipiente durante 30 s (para solutos líquidos) o 5 min (para solutos sólidos), hasta que la solución sea ópticamente homogénea.
- Medir y registrar la masa final de la solución. Selle el contenedor con un tapón hermético y guárdelo a temperatura constante (293-298 K).
2. Preparación de la cámara de refrigeración de muestras
- Coloque el aparato experimental descrito a continuación en un recinto y drene el aire seco (> 5% de humedad relativa (HR)) en el recinto.
NOTA: El recinto puede ser un simple bastidor de metal con su parte superior y tres lados sellados con una lámina de plástico transparente y con acceso experimental a través de un cuarto lado cubierto con una lámina de plástico flexible. VestirLos escudos faciales y el revestimiento del cuerpo para minimizar la humedad introducida por el experimentador. La condensación de humedad y la formación de hielo pueden interferir con las mediciones de la densidad de temperatura criogénica de varias maneras, por lo que debe ser minimizada. - Coloque un disco de caucho de neopreno en la parte inferior de un frasco de Dewar de 4,5 L de vidrio, para proteger el frasco de Dewar de daños.
- Inserte cuidadosamente una cámara de cobre de alta conductividad térmica (un cilindro hueco con un fondo sellado) en el frasco hasta que se apoye en el disco de goma. Ajuste los puntales que sobresalen hacia afuera de la cámara a las paredes de Dewar de modo que la cámara esté centrada y no tenga tendencia a la roca.
NOTA: El frasco de Dewar contendrá nitrógeno líquido, y la cámara de cobre de volumen mucho menor contendrá una mezcla de N2 - Ar líquido. El nitrógeno líquido proporciona un baño térmico que mantiene la cámara de cobre y su contenido a una temperatura constante de 77 K y reduce las pérdidas por ebullición y evaporación en la cámara. La Cámara&#El pequeño diámetro suprime las ondas de superficie que pueden interferir con las mediciones de flotabilidad y ayuda a aislar el líquido dentro de la cámara de heladas y hielo formados en otras partes del aparato. - Introduzca la salida de un tubo de gas con gas N2 seco que fluya a ~ 2 l / min hasta el fondo de la cámara de cobre y purgue la cámara de aire húmedo.
- Lentamente vierta nitrógeno líquido en el frasco de Dewar, fuera de la cámara de cobre, lo que permite el tiempo de ebullición de nitrógeno.
NOTA: El nivel de llenado final, después de que haya terminado el ebullición, debe estar a aproximadamente 4 cm de la parte superior de la cámara de cobre. - Cubra la parte exterior del frasco Dewar con una tapa aislante de espuma anular. Retire el tubo de purga de gas N 2 seco de la cámara de cobre e inserte en una abertura correspondiente de la tapa.
NOTA: La combinación de gas N2 de la ebullición en el frasco de Dewar y del flujo de purga expulsa cualquier aire húmedo y evita que se condense y cristaliza.N superficies frías. - Vierta lentamente nitrógeno líquido en la cámara de cobre. El nivel de llenado final, después de que haya terminado el ebullición, debe estar a aproximadamente 4 cm de la parte superior de la cámara de cobre.
- Coloque una fina lámina de plástico transparente ópticamente sobre la abertura central o ventilación en la tapa y reduzca el caudal de gas N2 a ~ 0,2 L / min, dejando una ligera sobrepresión de gas N2 dentro de los espacios de gas por encima de los líquidos criogénicos.
NOTA: Mientras los líquidos criogénicos estén presentes en Dewar y en la cámara, continúe ajustando el flujo de gas N 2 según sea necesario para mantener esta sobrepresión y evitar que la humedad entre en Dewar y forme hielo.
3. Determinación del volumen y densidad de la masa de prueba a T = 298 K y T = 77 K
- Determine la masa aparente de una masa de prueba de PTFE de ~ 1 g, ~ 0,4 mL ( Tabla de Materiales ) en aire a T = 298 K colocándola sobre el recipienteDe una microbalanza analítica calibrada.
- Determinar el volumen V (298 K) de la masa de ensayo a T = 298 K usando un picnómetro de gas, o mediciones dimensionales con calibradores. Si se utilizan medidas dimensionales, la masa de ensayo debe tener una forma simple y precisa (sin curvaturas o esquinas redondeadas) y debe determinarse el volumen del orificio pasante (para la línea de suspensión).
- Calcular la masa m de la masa de ensayo corrigiendo la masa aparente medida para la fuerza de flotación ejercida por el aire de acuerdo con lo siguiente:
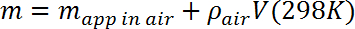
Donde ρ aire = 1,23 g / L (~ 0,1% de corrección). - Coloque la microbalanza sobre una plataforma estable aproximadamente 10 cm por encima del frasco de Dewar y verifique su calibración. Suspender la masa de prueba con una línea de monofilamento de 2 mil (50 μm), colgada del gancho en la parte inferior de la microbalanza (diseñada para suspender mediciones de masa) yGh un agujero en la masa de prueba. Determine la masa aparente en el aire, y compárela con la medición en el paso 3.3, corrigiendo según sea necesario para la masa de la línea.
- Determinar el volumen V (77 K) de la masa de ensayo a T = 77 K midiendo su masa aparente en nitrógeno líquido puro, m AP en LN2 . Baje la masa de prueba en el nitrógeno líquido dentro de la cámara de cobre hasta que esté completamente sumergida. Cuando haya dejado de hervir, mida la masa aparente.
NOTA: Si el nitrógeno líquido en la cámara de cobre es quiescente y las corrientes de aire entre la microbalanza y la superficie del líquido son mínimas, esta masa puede medirse con una precisión superior a ± 0,0002 g. - Estimar la fuerza de flotación en la parte sumergida de la línea, y verificar que es pequeña en comparación con los errores de medición.
- Calcular el volumen y la densidad de la masa de ensayo a 77 K utilizando su masa conocida m y la masa aparente medida en LN2 a 77 K, mapp iN LN2, de acuerdo con lo siguiente:

Donde ρ LN2 ( (77 K) = 0,807 g / mL.
4. Preparación de la mezcla líquida N2 - Ar inicial
- Flujo de gas Ar a un caudal de ~ 2 L / min a través de un tubo enrollado a su salida. Coloque el tubo en espiral en la parte superior de los puntales superiores que estabilizan la posición de la cámara de cobre, justo por encima del nivel de nitrógeno líquido y por debajo de la superficie superior del Dewar. El gas frío N2 y el gas Ar se acumularán por encima de los líquidos criogénicos, y la conducción térmica, la convección y la radiación enfriarán la tubería y el gas Ar dentro.
- Después de dejar que el tubo enrollado se enfríe durante 5 minutos, coloque la salida del tubo en la cámara de cobre, al menos 10 cm por debajo de la superficie del nitrógeno líquido. Luego cubra el Dewar con la tapa anular y la hoja transparente.
- Ajuste el caudal Ar hasta que las burbujas Ar subanDesde la salida del tubo hasta la superficie superior del nitrógeno líquido. A continuación, reduzca el caudal hasta que las burbujas se formen en la salida, pero se disuelven o licúan justo antes de romper la superficie del nitrógeno líquido.
NOTA: A medida que aumenta la concentración de Ar en la cámara de cobre, ajuste periódicamente el caudal de Ar según sea necesario para mantener la formación de burbujas. Si el caudal de Ar es demasiado bajo, el Ar puede congelarse dentro del tubo y bloquear el flujo. - Agregue nitrógeno líquido según sea necesario para mantener su nivel en el Dewar circundante. Retire el hielo que se acumula en las superficies frías.
- Periódicamente, mezcle el líquido insertando una delgada lámina de cobre ( por ejemplo , 35 micras) de lámina de cobre unida a una barra aislante delgada dentro de la cámara de cobre y moviéndola lentamente hacia arriba y hacia abajo como un pistón. Esto reducirá gradientes de concentración y la tendencia de que Ar se cristaliza fuera de la solución.
5. Medición y ajuste de la densidad de la mezcla inicial de N2 - ArTure
- Calcular la densidad objetivo de la mezcla de N2 - Ar estimando la densidad de T = 77 K de la muestra a medir, por ejemplo , mediciones a concentraciones mayores del componente no acuoso de la muestra.
- Conecte la masa de prueba con la línea de monofilamento al gancho en la parte inferior de la cubeta de medición de la microbalanza, mida su masa aparente en el aire y confirme la concordancia con la medición en el paso 3.1.
- Mezclar la solución de N2 - Ar para eliminar los gradientes de concentración y densidad como en el paso 4.5.
- Pre-enfriar la masa de prueba a T = 77 K bajándola en el nitrógeno líquido fuera de la cámara de cobre. Elevar la masa de ensayo a la capa fría de gas nitrógeno por encima del nitrógeno líquido, esperar a que el nitrógeno líquido residual se evapore de la masa de ensayo y luego bajar la masa de ensayo fría y seca en la mezcla de N2 - Ar hasta que esté completamente sumergida y Dentro de 2 cm de la superficie del líquido.
- Después de que todas las ondas de ebullición y de superficie hayan desaparecido, mida la masa aparente de la masa de prueba. Calcular la densidad de la solución usando su masa verdadera m y T = 77 K volumen V (77K) del paso 3.7 de acuerdo con lo siguiente:
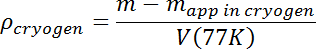
- Aumentar la densidad de la solución mediante el flujo de Ar adicional hasta obtener la densidad inicial deseada. Las gotas de muestra que se hunden pueden perderse fácilmente, por lo que la densidad inicial debe ser por lo menos un poco más alta que la densidad de muestra esperada. La muestra flotará entonces, haciéndola más fácil seguirla, y entonces la densidad de la mezcla de N2 - Ar sólo tendrá que ajustarse hacia abajo añadiendo N2 líquido.
- Retire el tubo Ar de preenfriamiento y déjelo calentar y secar antes de usarlo.
6. Gotas de enfriamiento de la solución de muestra
- Inmediatamente antes de la dispensación y enfriamiento de gota, repita el paso 1.5 a miX el líquido criogénico de nitrógeno / argón. Tenga cuidado de no introducir burbujas.
- Retire la tapa hermética del tubo de muestra. Usando una jeringa limpia de 1 mL, extraiga hasta 1 mL de solución y vuelva a colocar la tapa. Coloque una aguja de 27 a 33 G en la jeringa y, a continuación, empuje una pequeña cantidad de muestra a través de la aguja para expulsar el aire y los residuos de la dispensación anterior.
- Se pueden usar dos métodos para proyectar gotas de muestra en la mezcla de N2 - Ar.
- Para muestras con grandes concentraciones de componentes no acuosos (> 45% p / p) que pueden vitrificarse con tasas de enfriamiento moderadas, presione ligeramente la jeringa para desplazar un diámetro pequeño (250 μm a 1 mm), ~ 10 nL a 1 μl de gota Que cuelga de la punta de la aguja por la tensión superficial. Golpee suavemente la aguja para separarla y proyectar la gota hacia la mezcla líquida de N2 - Ar.
- Para las muestras que requieren un enfriamiento más rápido para la vitrificación, coloque la salida de un tubo de gas conectado a un generat de vacíoO (suministrado por aire comprimido de laboratorio) en el espacio de gas por encima de la mezcla de N2 - Ar líquido, y succione suavemente la capa de gas frío que se forma. Esto aumenta las tasas de enfriamiento de las pequeñas muestras [ 11] .
- Con cuidado, toque la punta de la aguja en una tira de polímero transparente de 25-75 μm de grosor para dispensar un pequeño volumen (<10 nL, correspondiente a un diámetro de gota <200 μm) de muestra.
NOTA: Para obtener las gotas más pequeñas, casi las más esféricas y más fácilmente eliminadas, empapar la tira en una solución de recubrimiento hidrófobo durante 10 min y dejar secar antes de dispensar la muestra. - Agarrar la tira con una varilla de plástico o de madera unida, y sumergir manualmente la varilla más la tira en la mezcla líquida de N2 - Ar.
- Una vez que la gota se ha solidificado y la ebullición ha cesado, agarre el borde de la tira opuesto a la varilla usando pinzas. Flexión de la tira, manteniéndola sumergida en el líquido N 2 -Ar, hasta que la gota de muestra se desprenda y flote al surfas.
- Con cuidado, toque la punta de la aguja en una tira de polímero transparente de 25-75 μm de grosor para dispensar un pequeño volumen (<10 nL, correspondiente a un diámetro de gota <200 μm) de muestra.
7. Evaluación del estado de la muestra
- Utilizando un microscopio binocular de larga distancia de trabajo (5-10 cm) e iluminación brillante y fresca de un iluminador LED o de fibra óptica, examine cuidadosamente la gota mientras la mantiene sumergida en el líquido N 2 -Ar. Las gotas vitrificadas deben aparecer claras 12 , 13 . Rechace las gotas que son nebulosas o nubladas (que probablemente contengan más de una fase) y / o que muestren imperfecciones ópticas incluyendo grietas (que pueden estar asociadas con huecos que cambian la densidad media).
NOTA: Pintura de la superficie interior de la cámara de cobre para proporcionar un fondo negro puede facilitar la identificación de las imperfecciones de la muestra.
8. Determinación de la Densidad de la Muestra
- La gota dispensada inicialmente flotará, se hundirá o (rara vez) flotará neutralmente en la mezcla de N2 - Ar.A veces, las gotas flotantes pueden mantenerse por tensión superficial, pequeñas burbujas o partículas de hielo adheridas. Inspeccione toda la superficie de la gota con el microscopio. Desplace la gota hacia abajo de la superficie del líquido usando un pequeño plástico o barra de madera precooled (2-3 mm de diámetro, 10 cm de largo) y observe su respuesta.
- Si la gota se hunde, aumente la densidad del líquido N2 - Ar utilizando el procedimiento del paso 4 hasta que la gota se vuelva flotante o flota.
- Si la gota flota, disminuya la densidad del líquido N2 - Ar añadiendo nitrógeno líquido usando un criovial de 1,8 ml. A densidades de mezcla iniciales grandes (1,2-1,3 g / mL), la adición de N 2 en incrementos de 1 mL da cambios de densidad apreciables, pero esto se debe aumentar hacia 5 mL a densidades bajas (0,8-0,9 g / mL). Mezcle suavemente el N 2 -Ar (para no perder la pista de la gota de muestra) usando la lámina de cobre perforada delgada hacia arriba y hacia abajo en la cámara de cobre.
- Después de cada adición de N2, Utilice una varilla preenfriada pequeña para desplazar suavemente la gota flotante hacia abajo en el líquido y observe su velocidad a medida que vuelve a la superficie.
- Cuando la densidad de la solución ha sido ajustada de modo que la gota pareciera ser flotante neutral o ascienda muy lentamente (<50 μm / s garantizará una precisión de densidad de ~ 0,1% o mejor para gotas con volúmenes de hasta 50 μl) Ar como se describe en el paso 5. A continuación, añadir líquido adicional N 2 hasta que la gota primero comienza a hundirse lentamente, y medir de nuevo la densidad de la mezcla N 2 -Ar. Estas dos medidas proporcionarán límites en la densidad de caída.
Resultados
Las mediciones de densidad a T = 77 K para las gotas vitrificadas de glicerol acuoso y etilenglicol frente a la concentración de crioprotector se muestran en la Figura 1A y Figura 1B respectivamente y el cambio correspondiente en el volumen específico entre T = 298K y 77K, calculado usando previamente Determinado T = 298 K densidades, se muestra en la
Discusión
El presente aparato y métodos, desarrollados principalmente por estudiantes de grado con acceso limitado a herramientas y maquinaria para la construcción de instrumentos, proporciona sin embargo mediciones de densidad muy precisas para gotas líquidas individuales tan pequeñas como 50 pL. En el intervalo de concentración cercano y superior al 50% p / p, donde las tasas de enfriamiento pequeñas son suficientes para obtener muestras vitrificadas, las densidades coinciden con las obtenidas en mediciones anteriores en ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la NSF bajo el premio MCB-1330685. DWM reconoce el apoyo parcial de la Universidad de Cornell Molecular Biophysics Training Grant (NIH T32GM0082567).
Materiales
| Name | Company | Catalog Number | Comments |
| centrifuge tube | Falcon | 6029236 | 15 mL conical centrifuge tube |
| glycerol, >99.5% | Sigma | G9012-100 mL | |
| ethylene glycol, >99.8% | Sigma | 324558-100 mL | |
| analytical microbalance | Mettler | AE240 | Analytical balance, 0.01 mg resolution, has hook on bottom for weighing below the balance |
| vortexer | Scientific Industries | SI-0236 | Vortex-Genie 2 |
| Apparatus enclosure framing | Unistrut | 1-5/8" metal framing | 48" wide x 24" deep x 40" tall |
| Apparatus enclosure air barrier | any clear plastic sheeting | ||
| neoprene rubber disk | 4" diameter, 1/8" thick | ||
| dewar flask | Scilogix Dilvac | SS333 | 4.5 liter dewar flask with steel case and clamp lid |
| copper chamber | This fabricated part is comprised of a 1.43" diameter, 0.017" wall thickness copper tube with a solid cylindrical copper base soldered to seal one end. The copper base is 0.87" tall and the overall chamber height is 7". | ||
| nitrogen gas | Airgas | NI HP300 | 99.998% pure N2 gas |
| argon gas | Airgas | AR HP300 | 99.998% pure Ar gas |
| rotameter | Omega | FL3692ST | 2.52 l/min max flow rate |
| foam insulating lid | This part is fabricated from 4 lb/ft3 crosslinked polyethylene foam (supplied by Technifab, 1355 Chester Industrial Parkway, Avon, OH), and has an OD of 2.42", and ID of 1.52", and a thickness of 0.79". | ||
| PTFE test mass | This fabricated part is a 0.246" diameter, 0.580" tall cylinder with a 0.060" diameter hole running perpendicular to and intersecting the cylinder axis ~0.10" from one end. | ||
| microbalance platform | Unistrut | 1-5/8" metal framing | 11" wide x 24" long x 24" high rectangular frame with an top aluminum sheet containing a hole for the monofilament and hanging test mass |
| 2 mil (50 um) monofilament line | Berkley | NF1502-CM | Nanofil fishing line |
| Argon precooling coil tubing | VWR | 60985-512 | 1/8" ID x 1/4" OD PVC tubing |
| perforated copper foil mixer | 1.4" diameter, 35 micron thick copper disk, cut from 1 ounce/ft2 copper sheet and perforated with holes using an awl or other sharp pointed tool. Insert 1-2 mm diameter rigid thermally insulating (plastic or wood) rod into the center and fix using epoxy as needed. | ||
| syringe | BD | 309628 | 1 ml Luer-Lok tip syringe |
| vacuum generator | Gast | VG-015-00-00 | compressed air venturi single stage vacuum generator |
| hydrophobic coating spray | RainX | 620036 | plastic water repellent |
| long focal length stereo microscope | Bausch and Lomb Stereozoom 6 | 0.67-4 x zoom pod with 20x eyepieces, 10 cm working distance | |
| LED ring illuminator | Amscope | LED144S | |
| LED spot illuminator | Newhouse Lighting | NHCLP-LED | 3W LED gooseneck clamp lamp |
| 1.8 ml cryo vial | Nunc | V7634-500EA | Any 1.8 or 2 ml cryovial is adequate |
Referencias
- Fahy, G. M., Wowk, B. Principles of Cryopreservation by Vitrification. Cryopreservation and Freeze-Drying Protocols. , 21-82 (2015).
- Nagy, Z. P., Nel-Themaat, L., Chang, C. -. C., Shapiro, D. B., Berna, D. P. Cryopreservation of eggs. Human Fertility: Methods and Protocols. , 439-454 (2014).
- Kriminski, S., Caylor, C. L., Nonato, M. C., Finkelstein, K. D., Thorne, R. E. Flash cooling and annealing of protein crystals. Acta Cryst Sect D. 58 (3), 459-471 (2002).
- Juers, D. H., Matthews, B. W. Reversible lattice repacking illustrates the temperature dependence of macromolecular interactions. J Mol Biol. 311 (4), 851-862 (2001).
- Juers, D. H., Matthews, B. W. Cryo-cooling in macromolecular crystallography: advantages, disadvantages and optimization. Q Rev Biophys. 37 (2), 105-119 (2004).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta Cryst Sect D. 66 (4), 366-373 (2010).
- Warkentin, M., Sethna, J., Thorne, R. Critical Droplet Theory Explains the Glass Formability of Aqueous Solutions. Phys Rev Lett. 110 (1), 15703 (2013).
- Kriminski, S., Kazmierczak, M., Thorne, R. E. Heat transfer from protein crystals: implications for flash-cooling and X-ray beam heating. Acta Cryst Sect D. 59 (4), 697-708 (2003).
- Loerting, T., Bauer, M., Kohl, I., Watschinger, K., Winkel, K., Mayer, E. Cryoflotation: Densities of amorphous and crystalline ices. J Phys Chem B. 115 (48), 14167-14175 (2011).
- Shen, C., Julius, E. F., Tyree, T. J., Moreau, D. W., Thorne, R. E. Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection. Acta Cryst Sect D. 72 (6), 742-752 (2016).
- Warkentin, M., Berejnov, V., Husseini, N. S., Thorne, R. E. Hyperquenching for protein cryocrystallography. J Appl Cryst. 39 (6), 805-811 (2006).
- McFerrin, M. B., Snell, E. H. The development and application of a method to quantify the quality of cryoprotectant solutions using standard area-detector X-ray images. J Appl Cryst. 35 (5), 538-545 (2002).
- Chinte, U., Shah, B., DeWitt, K., Kirschbaum, K., Pinkerton, A. A., Schall, C. Sample size: An important parameter in flash-cooling macromolecular crystallization solutions. J. Appl. Cryst. 38 (3), 412-419 (2005).
- Bosart, L. W., Snoddy, A. O. Specific gravity of glycerol. Ind Eng Chem. 20 (12), 1377-1379 (1928).
- Rodrigues, M., Francesconi, A. Z. Experimental study of the excess molar volumes of binary and ternary mixtures containing water + (1,2-ethanediol, or 1,2-propanediol, or 1,3-propanediol, or 1,2-butanediol) + (1-n-butyl-3-methylimidazolium bromide) at 298.15 K and atmospheric pressure. J Solution Chem. 40 (11), 1863-1873 (2011).
- Berejnov, V., Husseini, N. S., Alsaied, O. A., Thorne, R. E. Effects of cryoprotectant concentration and cooling rate on vitrification of aqueous solutions. J Appl Cryst. 39 (2), 244-251 (2006).
- Meisburger, S. P., Warkentin, M., et al. Breaking the Radiation Damage Limit with Cryo-SAXS. Biophys J. 104 (1), 227-236 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados