このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
低温での水性ガラスの密度の測定
要約
極低温での水性混合物のミクロン〜ピコリットルの滴のガラス質相密度を測定するためのプロトコルが記載されている。
要約
本発明者らは、所望の極低温相を調製するために、水性混合物および急冷を必要とする他の試料のガラス相低温温度密度を決定する方法を実証する。マイクロリットル〜ピコリットルサイズの液滴は、液体窒素 - アルゴン(N 2 -Ar)混合物中に投射することによって冷却される。液滴の極低温相は、X線回折測定と相関する視覚アッセイを用いて評価される。液体N 2 -Ar混合物の密度は、液滴が中立的に浮揚するまでN 2またはArを加えることによって調整される。この混合物の密度、したがって滴の密度は、試験物質およびアルキメデスの原理を用いて決定される。液状低温混合物の上のガスの管理により、液状低温混合物の上に適切な注意を払い、氷結を最小限に抑え、極低温混合物を定期的に混合して密度の層別化および相分離を防止し、50pLほどの液滴の<0.5%容易に決定することができる。水性凍結保護剤混合物の測定は、凍結保護剤作用の洞察を提供し、生物学的凍結保存における熱収縮適合を容易にする定量的データを提供する。
概要
それらの様々な段階における水および水性混合物の物理的特性は、基本的な関心事であり、生物学的系のインビボおよびインビトロでの理解にとって重要である。現代の低温生物学および生物学的凍結保存では、凍結保護剤水溶液のガラス質または非晶質相が特に興味深い1,2 。氷結晶の核形成および増殖は、細胞および組織を破壊し、タンパク質の変性および凝集を促進し、溶媒をガラス化する凍結保存プロトコールがますます普及している。生体分子結晶学において、生体分子間のチャネルにおける溶媒の結晶化は結晶格子を破壊し、回折特性を劣化させる。ガラス化は、急速冷却、脱水、およびグリセロール、エチレングリコール、ポリエチレングリコール(PEG)などの凍結保護溶質の添加の組み合わせによって達成される。アルコールおよび塩が挙げられる。
ガラス化は氷の結晶化および成長を制限するが、冷却関連の試料の損傷をすべて排除するものではない。例えば、タンパク質結晶がガラス化状態3に冷却され、ガラス化された精子細胞および卵母細胞の解凍後の生存率が広範に変化する場合、結晶のモザイシシティ(結晶面の配向の尺度)は、通常、10〜 。
1つの損傷メカニズムは、冷却中の溶媒および周囲の物質の差別的な収縮である3,4,5 。結晶、細胞または組織内の平衡溶媒および溶質濃度は温度依存性であり、溶媒+溶質および周囲物質は異なる量で収縮し得る。迅速な冷却は、ガラス化前の溶媒および溶質の再分配を防止することができ、不均一な非平衡応力が試料の損傷の原因となることがあります。
冷却によって誘発される損傷を減少させる合理的なアプローチは、液体およびガラス化した水性混合物の温度依存密度の知識から利益を得ることができる。溶液の重量に対する溶質の重量(w / w)の50%以上の溶質濃度では、ほとんどの水性凍結保護剤混合物を10 K / s以下の適度な冷却速度でガラス化することができ、大きなガラス質試料を用いて密度測定を行い、密度は、窒素のような液体寒剤に懸濁したときの試料の見かけの重量を測定することによって、アルキメデスの原理を用いて決定することができる。しかし、溶質の濃度が低下すると、ガラス化に必要な冷却速度が急速に上昇します。水性グリセリン混合物の冷却速度は、gの溶質の50%重量で10 K / sからmL(w / v) K /秒で25%w / vass = "xref"> 7。熱伝達は境界層に制限されるので、より大きな冷却速度を達成するためには、より小さい試料8が必要となる。
純粋な硝子水と氷の密度の測定は、巨視的な(グラム質量)試料を構築するために極低温冷却表面上に真空中のマイクロメーター直径(フェムトリットル体積)滴を堆積させることによって達成されている。この試料の密度は液体窒素 - アルゴン混合物中でのクライオフロット法により測定した。この場合、試料が中性に浮揚するまで低温液体の密度を調整した。しかし、従来のガラス質相の密度測定における誤差の重要な原因である空隙量を最小限に抑える方法で、多数の小さな液滴から大きなサンプルを生成することは、自明ではありません。水性混合物の場合、エアロゾル化および真空中での堆積中の溶液成分の差別的な蒸発は、堆積した濃度における実質的な不確実性。
私たちは、クライオフロット法に基づいた方法を開発しました。この方法では、個々の液滴を50μLほどの小さなものを使って水性混合物を正確に密度測定することができます。これらの滴は、元の濃度を維持しながら急速に冷却することができ、X線回折測定と相関する単純な視覚アッセイを使用して極低温状態(ガラス化または結晶化)を評価することができます。この方法は、水性および非水性混合物に広く適用可能であり、細胞( 例えば 、茎および卵)、組織サンプル、および0.8〜1.4g / mlの低温密度を有するタンパク質結晶を含む様々な生物学的サンプルに拡張することができる。 mLであった。
プロトコル
注意:使用前に関連するすべての物質安全データシート(MSDS)を参照してください。適切なキャリブレーションされたガス取扱い調整器およびバルブ、承認されたガス配管を含む圧縮ガスを使用する場合は、適切な安全対策をすべて使用してください。液体の低温薬との接触は、重度の凍傷および壊死を引き起こす可能性がある。適切な個人保護具(顔面シールド、手袋、ラボコート、全長ズボン、閉じたつま先靴)を使用してください。これらはすべて液体窒素不透過性でなければなりません。立ったままにして、液体凍結剤を使用する際に装置からの妨げにならない出口経路を確保する。圧縮ガスと液体寒剤を使用する場合は窒息の危険があることに気をつけ、適切な補給空気(換気フードまたは高い換気率の部屋)で十分に換気された区域で作業してください。
1.密度測定のための水溶液の調製
注記:重量は体積よりも高精度でより簡単に測定されるため溶液濃度はw / w単位で測定される。すべての密度および融解温度または沸騰温度は、~100kPaの大気圧を想定しています。以下の工程は、35%w / wグリセロール溶液の調製を記載する。同じ手順を他の濃度および溶質についても使用することができる。
- 関心のある各溶質タイプおよび濃度について、総溶液体積V tot = 10mLの溶液容量について所望の最終濃度( 例えば 、25%w / w〜100%w / w)を得るために必要な溶質質量を概算する。例えば、35%w / wグリセロール溶液( ρs = 1.26g / mL)の場合、溶質質量m sは、

ここで、 xは溶質質量分率(0.35)であり、 ρw = 1g / mLは水の密度である。 - 15 mLの遠心チューブ(または他の容量較正された水不透過性容器)を皿の上に置きます分析微量天秤の管に所望の量の溶質/凍結保護剤( 例えば 、35%w / w溶液については3.77gグリセロール)を分配し、実際の溶質質量を記録する。
- 高純度(> 18MΩ)の脱イオン水を加えて総質量を10.0 gにする
- 溶液が光学的に均質になるまで、容器を30秒間(液体溶質の場合)または5分間(固体溶質の場合)ボルテックスする。
- 溶液の最終質量を測定し、記録する。容器を気密キャップで密封し、一定温度(293-298 K)で保管する。
試料冷却室の準備
- 下記の実験装置をエンクロージャに置き、エンクロージャ内に乾燥空気(> 5%の相対湿度(rh))を流します。
注記:エンクロージャーは、上部と3つの側面が透明なプラスチックシートでシールされ、フレキシブルなプラスチックシートで覆われた4番目の面を介して実験的にアクセスできる単純な金属フレームでもかまいません。着るフェイスシールド、およびフルボディカバーを使用して、実験者が吸入した水分を最小限に抑えます。結露と氷の形成は、いくつかの点で低温の温度密度の測定を妨げる可能性があるため、最小限に抑える必要があります。 - Dewarフラスコを損傷から保護するために、ネオプレンゴムのディスクを4.5LガラスのDewarフラスコの底に置きます。
- 慎重に、熱伝導率の高い銅製のチャンバー(密閉されたボトムが付いた中空シリンダー)をラバーディスクに載るまでフラスコに挿入します。チャンバーがDewarの壁に向かって外側に突き出ているストラットを調整して、チャンバーが中心に置かれ、揺動する傾向がないようにします。
注:デュワーフラスコは液体窒素を保持し、はるかに小さい体積の銅チャンバは液体N 2 -Ar混合物を保持する。液体窒素は、銅チャンバおよびその内容物を77Kの一定温度に維持し、チャンバ内の沸騰および蒸発損失を低減する熱浴を提供する。チャンバー&浮力測定を妨げ得る表面波を抑制し、装置内の他の場所で形成された霜や氷からチャンバ内の液体を隔離するのに役立つ。 - 約2L /分で流れる乾燥窒素ガスを含むガス管の出口を銅チャンバの底部に挿入し、湿った空気のチャンバをパージする。
- 液体窒素をゆっくりと銅チャンバーの外側のデュワーフラスコに注ぎ、窒素の沸騰時間を確保します。
注記:最終充填レベルは、沸騰が止まった後、銅チャンバの上部から約4cm以内にある必要があります。 - Dewarフラスコの外側部分を環状発泡断熱蓋で覆う。乾燥したN 2ガスパージ管を銅チャンバから取り出し、蓋の対応する開口部に挿入する。
注:デュワーフラスコ内のボイルオフおよびパージ流からのN 2ガスの組み合わせは、湿った空気を排出し、凝縮および結晶化を防止する。n冷たい表面。 - ゆっくりと液体窒素を銅チャンバに注ぎます。沸騰が止まった後の最終充填レベルは、銅チャンバの上部から約4cm以内にあるべきである。
- 薄い光学的に透明なプラスチックシートを中央開口部または蓋の通気口の上に置き、N 2ガス流量を約0.2L /分に減少させ、極低温液体より上のガス空間内にN 2ガスをわずかに過剰圧力にする。
注:極低温液体がDewarとチャンバーに存在する限り、必要に応じてN 2ガス流量を調整し続け、この過圧を維持し、水分がDewarに入り込み、氷を形成するのを防ぎます。
T = 298KおよびT = 77Kにおける試験質量の体積および密度の決定
- T = 298 Kの空気中の〜1 g、〜0.4 mLのPTFE試験質量( 見本材料 )の見掛けの質量をパン上に置くことにより決定する較正された分析用微量天秤の。
- ガス比重計を使用してT = 298 Kで試験質量の体積V (298 K)を測定するか、キャリパーを使用して寸法測定する。寸法測定を使用する場合、試験質量は単純で正確な形状(テーパまたは丸みのない角)でなければならず、貫通孔の容積(懸濁ライン用)を決定する必要があります。
- 空気による浮力の測定された見かけ上の質量を次のように補正することによって、試験質量の質量mを計算する。
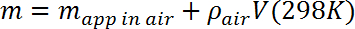
ここで、 ρair = 1.23g / L(補正値約0.1%)。 - 微量天秤をDewarフラスコの約10cm上に安定した台の上に置き、キャリブレーションを確認します。微量天秤(吊り下げ測定のために設計されている)の底面にあるフックから張られた2ミル(50μm)のモノフィラメント線を使用してテストマスをサスペンドし、テストマスに穴をあけてください。空気中の見かけの質量を決定し、ステップ3.3の測定と比較して、必要に応じてラインの質量を補正する。
- LN2の純液体窒素m app中の見掛け質量を測定することにより、 T = 77Kでの試験質量の体積V (77K)を決定する。完全に水没するまで、試験片を銅チャンバ内の液体窒素中に下げます。沸騰が止まったら、見かけの質量を測定する。
注記:銅チャンバの液体窒素が静止しており、微量天秤と液面の間の気流が最小の場合、この質量は±0.0002g以上の精度で測定できます。 - ラインの水没部分の浮力を推定し、測定誤差に比べて小さいことを確認します。
- その既知の質量mと、77KでのLN2の測定された見掛け質量m app iを用いて、77Kでの試験質量の体積および密度を計算するn LN2とする。

ρLN2( (77K)= 0.807g / mL)。
初期液体N 2 -Ar混合物の調製
- コイル状のチューブを通ってその出口まで約2L /分の流速でArガスを流す。液体窒素レベルの真上でDewarの上面の下にある銅チャンバーの位置を安定させる上部ストラットの上にコイル状チューブを置きます。冷N 2およびArガスが極低温液体の上に蓄積し、熱伝導、対流、および放射がチューブおよびArガスを冷却する。
- コイル状チューブを5分間冷却した後、チューブの出口を液体窒素の表面の少なくとも10cm下の銅チャンバに入れます。環状のふたと透明なシートでDewarを覆う。
- Ar気泡が上昇するまでAr流量を調整する管の出口から液体窒素の上面に至る。その後、液体窒素表面を破壊する直前に、出口で気泡が形成されるまでは流量を減少させるが、溶解または液化する。
注記:銅チャンバのAr濃度が増加するにつれて、気泡の形成を維持するためにAr流量が必要に応じて定期的に調整されます。 Ar流量が低すぎると、Arがチューブ内で凍結して流れをブロックすることがあります。 - 周囲のDewarのレベルを維持するために、必要に応じて液体窒素を加えます。冷たい表面に氷が溜まったら、氷を取り除く。
- 細い絶縁ロッドに取り付けられた薄い( 例えば 35ミクロン)円形箔の銅箔を銅チャンバに挿入し、それをピストンのようにゆっくりと上下に動かすことによって液体を定期的に混合する。これにより、濃度勾配およびArが溶液から結晶化する傾向が減少する。
初期N 2 -Ar混合物の密度の測定および調整治る
- 測定すべき試料のT = 77Kの密度、 例えば試料の非水性成分の高濃度での測定値を推定することにより、N 2 -Ar混合物の目標密度を計算する。
- モノフィラメントラインを使用してテストマスをマイクロバランス測定パンの下のフックに取り付け、空気中の見掛けの質量を測定し、ステップ3.1の測定との一致を確認する。
- ステップ4.5のようにN 2 -Ar溶液を混合して濃度および濃度勾配を除去する。
- T = 77 Kまで試験片を銅チャンバーの外側の液体窒素中に降下させて予冷する。試験質量を液体窒素上の窒素ガスの低温層に持ち上げ、残留液体窒素が試験質量から蒸発するのを待ってから、冷たい乾燥試験質量を完全に水没するまでN 2 -Ar混合物に下げ、液体表面の2cm以内にある。
- 沸騰した表面波が消えたら、試験質量の見掛けの質量を測定する。ステップ3.7からの真の質量mおよびT = 77K体積V (77K)を用いて、以下に従って、溶液密度を計算する:
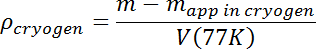
- 所望の初期密度が得られるまで追加のArを流すことによって溶液密度を増加させる。シンクするサンプル液滴は簡単に失われる可能性があるため、初期密度は予想されるサンプル密度よりも数%以上高くなければなりません。試料は浮遊し、それを追跡しやすくなり、N 2 -Ar混合物の密度は液体N 2を加えることによって下方に調整する必要があるだけである。
- Arプリクーリングコイルチューブを取り外し、次の使用の前に温めて乾燥させます。
6.サンプル溶液の冷却滴
- 滴下および冷却の直前に、ステップ1.5〜x窒素/アルゴン極低温液体。気泡が入らないように注意してください。
- サンプルチューブの気密キャップを取り外します。きれいな1 mLシリンジを使用して、溶液1 mLまで抽出し、キャップを交換します。シリンジに27〜33 Gの針を取り付け、少量のサンプルを針に押し込み、前の分注から空気や残留物を追い出す。
- 試料滴をN 2 -Ar混合物に投影するには、2つの方法を使用することができる。
- 適度な冷却速度でビトリファイドすることができる大きな非水性成分濃度(> 45%w / w)を有するサンプルについては、シリンジを軽く押して、直径が250μm〜1mmの小さな(〜10nL〜1μLの液滴表面張力によって針先端から垂れ下がる。穏やかに針を叩いて液滴を液体N 2 -Ar混合物に向けて投射してください。
- ガラス化のためのより速い冷却を必要とするサンプルの場合、真空管に接続されたガス管の出口を配置するまたは液体N 2 -Ar混合物の上方のガス空間内で(実験室の圧縮空気によって供給される)、形成される低温ガス層を静かに吸引する。これは、小さな試料11の冷却速度を増加させる。
- 注意深くニードルチップを厚さ25〜75μmの透明なポリマーストリップに触れ、少量(<10 nL、滴径<200μmに相当)のサンプルを分注します。
注:最小、ほぼ球状、最も容易に除去された滴を得るために、疎水性コーティング溶液に10分間浸漬し、サンプルを分注する前に乾燥させます。 - 付属のプラスチックまたは木製ロッドを使用してストリップをつかみ、手動でロッドとストリップを液体N 2 -Ar混合物に入れる。
- 液滴が凝固して沸騰が止まったら、ピンセットを使ってロッドの反対側のストリップエッジをつかんでください。ストリップを液体N 2 -Arの中に浸した状態で、試料の滴が飛び出してサーフに浮かぶまでエース。
- 注意深くニードルチップを厚さ25〜75μmの透明なポリマーストリップに触れ、少量(<10 nL、滴径<200μmに相当)のサンプルを分注します。
7.サンプルの状態の評価
- 長い作動距離(5〜10cm)の双眼顕微鏡と、LEDまたは光ファイバー照明装置からの明るく冷たいイルミネーションを使用して、液体N 2 -Arに浸した状態で慎重に液滴を検査する。ガラス化した滴は透明に見えるべきである 12,13 。曇っているか曇っているか(1つより多くの相を含む可能性が高い)、および/または亀裂(平均密度を変える空隙に関連する可能性がある)を含む光学的不完全性を示す滴を拒絶する。
注:黒い背景を提供するために銅チャンバの内側表面をペイントすることで、サンプルの不完全性の識別を容易にすることができます。
8.試料の密度の測定
- 分配された液滴は、N 2 -Ar混合物中で最初は浮遊し、沈降し、または中立的に浮揚する(まれに)。浮遊滴は、表面張力、小さな泡、または付着した氷粒子によって保持されることがあります。顕微鏡で落下面全体を点検します。小さな(直径2〜3 mm、長さ10 cmの)予冷されたプラスチックまたは木製ロッドを使用して液面から液滴を下方に置き、その応答を観察する。
- 液滴が沈む場合は、液滴が中立浮力または浮上するまで、ステップ4の手順を使用して液体N 2 -Arの密度を増加させる。
- 滴が浮く場合は、液体窒素を1.8 mLのクライオバイアルを使用して添加することにより、液体N 2 -Arの密度を下げます。大きな初期混合密度(1.2〜1.3g / mL)では、N 2を1mL単位で加えるとかなりの密度変化が生じるが、これは低密度(0.8〜0.9g / mL)で5mLに向かって増加するはずである。銅チャンバー内の薄い穴あき銅箔シートを上下に使用して、N 2 -Ar(試料液滴を追跡しないように)を穏やかに混合する。
- 各N 2添加後小さな予備冷却されたロッドを使用して、浮遊液滴を液体中に静かに置き換え、表面に戻るときの速度を観察する。
- 溶液の濃度を調整して、液滴が中性に浮遊しているように見えるか、または非常にゆっくりと上昇するようにします(50μL以下では50μL以下の液滴で〜0.1%またはそれ以上の精度が保証されます) Ar混合物の密度を測定する。次に液滴が最初にゆっくりと沈み始めるまで液体N 2を追加し、N 2 -Ar混合物密度を再び測定する。これらの2つの測定値は、ドロップ密度の境界を提供する。
結果
水性グリセロールおよびエチレングリコール対凍結保護剤濃度のガラス化した滴についてのT = 77Kでの密度測定をそれぞれ図 1Aおよび図 1Bに示し、 T = 298Kと77Kとの対応する変化を以前に用いて計算した決定されたT = 298Kの密度が図2に示されている。高い凍?...
ディスカッション
それにもかかわらず、器具製造ツールおよび機械へのアクセスが制限された学部によって主に開発された本装置および方法は、50pL程度の個々の液滴に対して高精度の密度測定を提供する。ビトリファイド試料を得るのに十分な冷却速度が十分である50%w / w近くの濃度範囲では、密度は以前のバルク試料の測定で得られた密度と一致する。現在の密度を0%濃度(純水)に外挿することは、77K?...
開示事項
著者は何も開示することはない。
謝辞
この研究は、MCB-1330685賞のNSFによって支持された。 DWMは、コーネル大学の分子生物学訓練グラント(NIH T32GM0082567)からの部分的な支持を認めている。
資料
| Name | Company | Catalog Number | Comments |
| centrifuge tube | Falcon | 6029236 | 15 mL conical centrifuge tube |
| glycerol, >99.5% | Sigma | G9012-100 mL | |
| ethylene glycol, >99.8% | Sigma | 324558-100 mL | |
| analytical microbalance | Mettler | AE240 | Analytical balance, 0.01 mg resolution, has hook on bottom for weighing below the balance |
| vortexer | Scientific Industries | SI-0236 | Vortex-Genie 2 |
| Apparatus enclosure framing | Unistrut | 1-5/8" metal framing | 48" wide x 24" deep x 40" tall |
| Apparatus enclosure air barrier | any clear plastic sheeting | ||
| neoprene rubber disk | 4" diameter, 1/8" thick | ||
| dewar flask | Scilogix Dilvac | SS333 | 4.5 liter dewar flask with steel case and clamp lid |
| copper chamber | This fabricated part is comprised of a 1.43" diameter, 0.017" wall thickness copper tube with a solid cylindrical copper base soldered to seal one end. The copper base is 0.87" tall and the overall chamber height is 7". | ||
| nitrogen gas | Airgas | NI HP300 | 99.998% pure N2 gas |
| argon gas | Airgas | AR HP300 | 99.998% pure Ar gas |
| rotameter | Omega | FL3692ST | 2.52 l/min max flow rate |
| foam insulating lid | This part is fabricated from 4 lb/ft3 crosslinked polyethylene foam (supplied by Technifab, 1355 Chester Industrial Parkway, Avon, OH), and has an OD of 2.42", and ID of 1.52", and a thickness of 0.79". | ||
| PTFE test mass | This fabricated part is a 0.246" diameter, 0.580" tall cylinder with a 0.060" diameter hole running perpendicular to and intersecting the cylinder axis ~0.10" from one end. | ||
| microbalance platform | Unistrut | 1-5/8" metal framing | 11" wide x 24" long x 24" high rectangular frame with an top aluminum sheet containing a hole for the monofilament and hanging test mass |
| 2 mil (50 um) monofilament line | Berkley | NF1502-CM | Nanofil fishing line |
| Argon precooling coil tubing | VWR | 60985-512 | 1/8" ID x 1/4" OD PVC tubing |
| perforated copper foil mixer | 1.4" diameter, 35 micron thick copper disk, cut from 1 ounce/ft2 copper sheet and perforated with holes using an awl or other sharp pointed tool. Insert 1-2 mm diameter rigid thermally insulating (plastic or wood) rod into the center and fix using epoxy as needed. | ||
| syringe | BD | 309628 | 1 ml Luer-Lok tip syringe |
| vacuum generator | Gast | VG-015-00-00 | compressed air venturi single stage vacuum generator |
| hydrophobic coating spray | RainX | 620036 | plastic water repellent |
| long focal length stereo microscope | Bausch and Lomb Stereozoom 6 | 0.67-4 x zoom pod with 20x eyepieces, 10 cm working distance | |
| LED ring illuminator | Amscope | LED144S | |
| LED spot illuminator | Newhouse Lighting | NHCLP-LED | 3W LED gooseneck clamp lamp |
| 1.8 ml cryo vial | Nunc | V7634-500EA | Any 1.8 or 2 ml cryovial is adequate |
参考文献
- Fahy, G. M., Wowk, B. Principles of Cryopreservation by Vitrification. Cryopreservation and Freeze-Drying Protocols. , 21-82 (2015).
- Nagy, Z. P., Nel-Themaat, L., Chang, C. -. C., Shapiro, D. B., Berna, D. P. Cryopreservation of eggs. Human Fertility: Methods and Protocols. , 439-454 (2014).
- Kriminski, S., Caylor, C. L., Nonato, M. C., Finkelstein, K. D., Thorne, R. E. Flash cooling and annealing of protein crystals. Acta Cryst Sect D. 58 (3), 459-471 (2002).
- Juers, D. H., Matthews, B. W. Reversible lattice repacking illustrates the temperature dependence of macromolecular interactions. J Mol Biol. 311 (4), 851-862 (2001).
- Juers, D. H., Matthews, B. W. Cryo-cooling in macromolecular crystallography: advantages, disadvantages and optimization. Q Rev Biophys. 37 (2), 105-119 (2004).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta Cryst Sect D. 66 (4), 366-373 (2010).
- Warkentin, M., Sethna, J., Thorne, R. Critical Droplet Theory Explains the Glass Formability of Aqueous Solutions. Phys Rev Lett. 110 (1), 15703 (2013).
- Kriminski, S., Kazmierczak, M., Thorne, R. E. Heat transfer from protein crystals: implications for flash-cooling and X-ray beam heating. Acta Cryst Sect D. 59 (4), 697-708 (2003).
- Loerting, T., Bauer, M., Kohl, I., Watschinger, K., Winkel, K., Mayer, E. Cryoflotation: Densities of amorphous and crystalline ices. J Phys Chem B. 115 (48), 14167-14175 (2011).
- Shen, C., Julius, E. F., Tyree, T. J., Moreau, D. W., Thorne, R. E. Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection. Acta Cryst Sect D. 72 (6), 742-752 (2016).
- Warkentin, M., Berejnov, V., Husseini, N. S., Thorne, R. E. Hyperquenching for protein cryocrystallography. J Appl Cryst. 39 (6), 805-811 (2006).
- McFerrin, M. B., Snell, E. H. The development and application of a method to quantify the quality of cryoprotectant solutions using standard area-detector X-ray images. J Appl Cryst. 35 (5), 538-545 (2002).
- Chinte, U., Shah, B., DeWitt, K., Kirschbaum, K., Pinkerton, A. A., Schall, C. Sample size: An important parameter in flash-cooling macromolecular crystallization solutions. J. Appl. Cryst. 38 (3), 412-419 (2005).
- Bosart, L. W., Snoddy, A. O. Specific gravity of glycerol. Ind Eng Chem. 20 (12), 1377-1379 (1928).
- Rodrigues, M., Francesconi, A. Z. Experimental study of the excess molar volumes of binary and ternary mixtures containing water + (1,2-ethanediol, or 1,2-propanediol, or 1,3-propanediol, or 1,2-butanediol) + (1-n-butyl-3-methylimidazolium bromide) at 298.15 K and atmospheric pressure. J Solution Chem. 40 (11), 1863-1873 (2011).
- Berejnov, V., Husseini, N. S., Alsaied, O. A., Thorne, R. E. Effects of cryoprotectant concentration and cooling rate on vitrification of aqueous solutions. J Appl Cryst. 39 (2), 244-251 (2006).
- Meisburger, S. P., Warkentin, M., et al. Breaking the Radiation Damage Limit with Cryo-SAXS. Biophys J. 104 (1), 227-236 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved