É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medindo as densidades de vidros aquosos em temperaturas criogênicas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
É descrito um protocolo para determinar as densidades de fase vítrea de gotas de tamanho micro-a pico-litro de misturas aquosas em temperaturas criogênicas.
Resumo
Demonstramos um método para determinar a densidade de temperatura criogênica da fase vítrea de misturas aquosas e outras amostras que requerem arrefecimento rápido, para preparar a fase desejada de temperatura criogênica. As gotas de Microliter para picoliter são arrefecidas por projecção para uma mistura líquida de azoto-árgon (N2-Ar). A fase de temperatura criogênica da gota é avaliada usando um ensaio visual que se correlaciona com as medições de difracção de raios X. A densidade da mistura líquida de N 2 -Ar é ajustada adicionando N 2 ou Ar até que a queda se torne neutra. A densidade desta mistura e, portanto, da queda é determinada usando uma massa de teste e o princípio de Arquimedes. Com o cuidado apropriado na preparação de gotas, gerenciamento de gás acima da mistura líquida de criogênio para minimizar a formação de gelo e mistura regular da mistura criogênica para evitar a estratificação da densidade e a separação de fases, densidades precisas de <0,5% de gotas tão pequenas quanto 50 pL podemProntamente seja determinado. As medições sobre misturas crioprotectoras aquosas fornecem informações sobre a ação crioprotectora e fornecem dados quantitativos para facilitar a combinação de contração térmica na criopreservação biológica.
Introdução
As propriedades físicas da água e das misturas aquosas nas suas diversas fases são de interesse fundamental e são importantes para a compreensão in vivo e in vitro dos sistemas biológicos. Na criobiologia contemporânea e na criopreservação biológica, as fases vítrea ou amorfa de misturas crioprotectoras aquosas são de particular interesse 1 , 2 . A nucleação eo crescimento de cristais de gelo podem perturbar células e tecidos e promover a desnaturação e agregação de proteínas, de modo que os protocolos de criopreservação que vitrificam o solvente tornaram-se cada vez mais populares. Na cristalografia biomolecular, a cristalização do solvente nos canais entre biomoléculas interrompe as redes de cristal e degrada as propriedades de difracção. A vitrificação é conseguida através de uma combinação de arrefecimento rápido, desidratação e adição de solutos crioprotetores tais como glicerol, etilenoglicol, polietilenoglicóis (PEGs),Álcoois e sais.
A vitrificação limita a cristalização e crescimento do gelo, mas não elimina todo o dano da amostra relacionado ao resfriamento. Por exemplo, a mosaicidade do cristal (uma medida da distribuição das orientações do plano de cristal) aumenta rotineiramente por um fator de 10 a 100 quando os cristais de proteína são arrefecidos em um estado vitrificado 3 e as taxas de sobrevivência pós-descongelamento de espermatozóides e oócitos vitrificados variam amplamente .
Um mecanismo de danos é a contração diferencial do solvente e do material circundante durante o resfriamento 3 , 4 , 5 . As concentrações de solvente e soluto de equilíbrio dentro de um cristal, célula ou tecido dependem da temperatura, e o solvente mais o soluto e o material circundante podem se contrair por diferentes quantidades. O resfriamento rápido pode evitar a redistribuição de solvente e soluto antes da vitrificação e contração diferencial Pode levar a tensões grandes, não homogêneas e sem equilíbrio que causam danos à amostra.
As abordagens racionais para reduzir o dano induzido pelo resfriamento podem assim beneficiar do conhecimento das densidades dependentes da temperatura de misturas aquosas líquidas e vitrificadas. Em concentrações de soluto acima de 50% de peso de soluto em peso de solução (p / p), a maioria das misturas de crioprotectores aquosas pode ser vitrificada com taxas de resfriamento moderadas de 10 K / s ou menos, permitindo a produção e medições de densidade usando grandes amostras vítreas 6 . A densidade pode então ser determinada usando o princípio de Arquimedes, medindo o peso aparente da amostra quando suspenso em um criógeno líquido como nitrogênio. No entanto, à medida que a concentração de soluto diminui, as taxas de resfriamento necessárias para a vitrificação aumentam rapidamente: as taxas de resfriamento para as misturas aquosas de glicerol aumentam de <10 K / s a 50% do peso do soluto em g para o volume de solução em mL (p / v) para> 1.000 K / s a 25% p / vAss = "xref"> 7. A transferência de calor torna-se limitada na camada limite, de modo que a obtenção de maiores taxas de resfriamento requer amostras menores e menores 8 .
As medições da densidade de água vítrea pura e gelo foram conseguidas através da deposição de diâmetro do micômetro (volume de femtoliter) em um vácuo em uma superfície de refrigeração criogênica, de modo a construir uma amostra macroscópica (massa de grama). A densidade desta amostra foi determinada por crioflotação em uma mistura de nitrogênio-árgon líquido, na qual a densidade do líquido criogênico foi ajustada até a amostra tornar-se neutra 9 . No entanto, gerar grandes amostras de um grande número de pequenas gotas de uma maneira que minimiza os volumes vazios - uma importante fonte de erro nas medidas anteriores de densidade de fase vítrea - não é trivial. Para misturas aquosas, a evaporação diferencial dos componentes da solução durante a aerossolização e deposição no vácuo pode levar aIncertezas substanciais nas concentrações depositadas.
Desenvolvemos um método, baseado na crioflotação, que permite a determinação precisa da densidade de misturas aquosas usando gotas individuais tão pequenas quanto 50 pL 10 . Estas gotas podem ser rapidamente arrefecidas mantendo suas concentrações originais e seu estado de temperatura criogênica (vitrificado ou cristalino) pode ser avaliado usando um ensaio visual simples que se correlaciona com as medidas de difração de raios X. Este método é amplamente aplicável a misturas aquosas e não aquosas e pode ser alargado a uma variedade de amostras biológicas, incluindo células ( por exemplo , caule e ovo), amostras de tecido e cristais de proteínas com densidades de baixa temperatura entre 0,8 e 1,4 g / ML.
Protocolo
CUIDADO: Consulte todas as folhas relevantes de dados de segurança de material (MSDS) antes de usar. Use todas as práticas de segurança adequadas ao usar gases comprimidos, incluindo reguladores e válvulas de controle de gás calibrado e tubos de gás aprovados. O contato com criogênios líquidos pode causar congelamento severo e necrose. Use equipamento de proteção pessoal apropriado (protetor facial, luvas, bata de laboratório, calças de comprimento total, sapatos fechados), todos os quais devem ser impermeáveis ao nitrogênio líquido. Permaneça em pé e assegure um caminho de saída desobstruído do aparelho ao usar criogens líquidos. Esteja ciente dos riscos de asfixia ao usar gases comprimidos e criogênios líquidos, e trabalhe em uma área bem ventilada com ar de maquiagem adequado (uma aspiradora ou uma sala de alta taxa de rotação do ar).
1. Preparação de soluções aquosas para medições de densidade
NOTA: Como os pesos são mais facilmente medidos com uma alta precisão do que volAs concentrações da solução são medidas em unidades w / w. Todas as densidades e temperaturas de fusão ou de ebulição assumem uma pressão atmosférica de ~ 100 kPa. As seguintes etapas descrevem a preparação de uma solução de glicerol a 35% p / p. O mesmo procedimento pode ser usado para outras concentrações e solutos.
- Para cada tipo de soluto e concentração de interesse, estimule aproximadamente a massa de soluto necessária para obter a concentração final desejada ( por exemplo , entre 25% p / p e 100% p / p) para um volume de solução total, V tot = volume de solução de 10 mL . Por exemplo, para uma solução de glicerol a 35% p / p ( ρ s = 1.26 g / mL), a massa de soluto, m s é:

Onde x é a fração de massa de soluto (0,35) e ρ w = 1 g / mL é a densidade de água. - Coloque um tubo de centrífuga de 15 mL (ou outro recipiente impermeável à água calibrado em volume) na panelaDe uma microbalança analítica. Dispense a massa desejada de soluto / crioprotetor ( por exemplo , 3.77 g de glicerol para uma solução a 35% p / p) no tubo e registre a massa real do soluto.
- Adicione água desionizada de alta pureza (> 18 MΩ) para trazer a massa total até 10,0 g
- Vorteie o recipiente por 30 s (para solutos de líquido) ou 5 min (para solutos sólidos), até que a solução seja opticamente homogênea.
- Medir e registrar a massa final da solução. Selar o recipiente com uma tampa hermética e armazenar a temperatura constante (293-298 K).
2. Preparação da Câmara de Arrefecimento de Amostras
- Coloque o aparelho experimental descrito abaixo em um invólucro e arde o ar seco (> 5% de umidade relativa (rh)) no compartimento.
NOTA: O gabinete pode ser uma estrutura metálica simples, com a sua parte superior e os três lados selados com folha de plástico transparente e com acesso experimental por um quarto lado coberto com folha de plástico flexível. VestemEscudos faciais e cobertura de corpo inteiro para minimizar a umidade introduzida pelo experimentador. A condensação de umidade e a formação de gelo podem interferir com as medições de densidade de temperatura criogênica de várias maneiras e, portanto, devem ser minimizadas. - Coloque um disco de borracha de neoprene no fundo de um frasco Dewar de vidro de 4,5 L, para proteger o frasco Dewar de danos.
- Insira cuidadosamente uma câmara de cobre de alta condutividade térmica (um cilindro oco com um fundo selado) no frasco até que ele repousa sobre o disco de borracha. Ajuste os suportes que se projectam para fora da câmara para as paredes de Dewar, de modo que a câmara seja centrada e não tenha tendência a roçar.
NOTA: O balão Dewar irá manter o nitrogênio líquido e a câmara de cobre de volume muito menor manterá uma mistura líquida de N 2 -Ar. O nitrogênio líquido fornece um banho termal que mantém a câmara de cobre e seu conteúdo a uma temperatura constante de 77 K e reduz as perdas por evaporação e evaporação na câmara. A Câmara&#O diâmetro reduzido suprime as ondas de superfície que podem interferir com as medidas de flutuação e ajuda a isolar o líquido dentro da câmara de gelo e gelo formados em outro lugar do aparelho. - Insira a saída de um tubo de gás com gás seco de N 2 fluindo a ~ 2 L / min até o fundo da câmara de cobre e purgue a câmara de ar úmido.
- Leve lentamente o nitrogênio líquido no balão de Dewar, fora da câmara de cobre, permitindo tempo para a injeção de nitrogênio.
NOTA: O nível de enchimento final, após a cessação de ferver, deve estar dentro de aproximadamente 4 cm do topo da câmara de cobre. - Cubra a porção externa do frasco Dewar com uma tampa isolante de espuma anular. Remova o tubo de purga de gás seco N 2 da câmara de cobre e insira-o numa abertura correspondente na tampa.
NOTA: A combinação de gás N 2 de ferver no balão Dewar e do fluxo de purga expulsa qualquer ar úmido e evita que ele se condense e cristalize oN superfícies frias. - Leve lentamente o nitrogênio líquido na câmara de cobre. O nível de enchimento final, após a cessação da ferver, deve estar dentro de aproximadamente 4 cm do topo da câmara de cobre.
- Coloque uma folha de plástico fina, transparente opticamente sobre a abertura central ou ventilação na tampa, e reduza a taxa de fluxo de gás N 2 para ~ 0,2 L / min, deixando uma ligeira sobrepressão de gás N2 dentro dos espaços de gás acima dos líquidos criogênicos.
NOTA: Enquanto os líquidos criogênicos estiverem presentes no Dewar e na câmara, continue ajustando o fluxo de gás N 2 conforme necessário para manter esta sobrepressão e evitar a entrada de umidade no Dewar e formar gelo.
3. Determinação do Volume e Densidade da Massa de Teste em T = 298 K e T = 77 K
- Determine a massa aparente de uma massa de teste de PTFE de ~ 1 g, ~ 0,4 mL ( Tabela de Materiais ) no ar a T = 298 K colocando-a na panelaDe uma microbalança analítica calibrada.
- Determine o volume V (298 K) da massa de teste em T = 298 K usando um picnómetro de gás, ou por medidas dimensionais usando compassos de calibre. Se estiver usando medições dimensionais, a massa de teste deve ter uma forma simples e precisa (sem distorções ou cantos arredondados) e o volume do orifício de passagem (para a linha de suspensão) deve ser determinado.
- Calcule a massa m da massa de teste corrigindo a massa aparente medida para a força de flutuação exercida pelo ar de acordo com o seguinte:
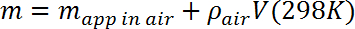
Onde ρ ar = 1,23 g / L (~ 0,1% de correção). - Coloque a microbalagem em uma plataforma estável a cerca de 10 cm acima do frasco Dewar e verifique sua calibração. Suspenda a massa de teste usando uma linha de monofilamento de 2 mil (50 μm) amarrada no gancho na parte inferior da microbalança (projetada para a suspensão de medidas de massa) e através deUm buraco na massa de teste. Determine a massa aparente no ar e compare com a medição no passo 3.3, corrigindo conforme necessário para a massa da linha.
- Determine o volume V (77 K) da massa de teste em T = 77 K, medindo a sua massa aparente em nitrogênio líquido puro, m app em LN2 . Abaixe a massa de teste no nitrogênio líquido dentro da câmara de cobre até que esteja completamente submersa. Quando a ferver cessou, medir a massa aparente.
NOTA: Se o nitrogênio líquido na câmara de cobre for quiescente e as correntes de ar entre a microbalança e a superfície do líquido forem mínimas, essa massa pode ser medida com uma precisão maior que ± 0,0002 g. - Estime a força de flutuação na porção submersa da linha e verifique se ela é pequena em comparação com os erros de medição.
- Calcule o volume e a densidade da massa de teste a 77 K usando sua massa conhecida m e a massa aparente medida em LN2 em 77 K, m app iN LN2, de acordo com o seguinte:

Onde ρ LN2 ( (77 K) = 0,807 g / mL.
4. Preparação da mistura líquida inicial de N 2 -Ar
- Flow Ar gasosa a uma taxa de fluxo de ~ 2 L / min através de um tubo enrolado para a sua saída. Coloque o tubo enrolado em cima dos suportes superiores que estabilizam a posição da câmara de cobre, logo acima do nível de nitrogênio líquido e abaixo da superfície superior do Dewar. O gás frio N 2 e Ar aumentarão acima dos líquidos criogênicos, e a condução térmica, a convecção e a radiação irão arrefecer a tubulação e o gás Ar dentro.
- Depois de permitir que o tubo enrolado esfrie durante 5 minutos, coloque a saída do tubo na câmara de cobre, pelo menos 10 cm abaixo da superfície do nitrogênio líquido. Em seguida, cubra o Dewar com a tampa anular e folha transparente.
- Ajuste a taxa de fluxo Ar até que as bolhas de Ar cresçamDa saída do tubo para a superfície superior do nitrogênio líquido. Em seguida, reduza o caudal até que as bolhas se formem na saída, mas dissolvam-se ou liquefimem antes de quebrar a superfície do nitrogênio líquido.
NOTA: À medida que a concentração de Ar na câmara de cobre aumenta, ajuste periodicamente a taxa de fluxo de Ar conforme necessário para manter a formação de bolhas. Se a taxa de fluxo Ar for muito baixa, o Ar pode congelar dentro do tubo e bloquear o fluxo. - Adicione o nitrogênio líquido, conforme necessário, para manter seu nível no Dewar circundante. Retire o gelo à medida que ele se acumula em superfícies frias.
- Misture periodicamente o líquido, inserindo uma folha circular de cobre fina ( por exemplo , 35 mícrons), unida a uma fina haste isolante na câmara de cobre, e movendo-a lentamente para cima e para baixo como um pistão. Isso reduzirá os gradientes de concentração e a tendência de Ar cristalizar fora da solução.
5. Medindo e Ajustando a Densidade da Mistura Inicial N 2 -ArTure
- Calcule a densidade alvo para a mistura N 2 -Ar, estimando a densidade T = 77 K da amostra a ser medida, por exemplo , medições em concentrações mais elevadas do componente não aquoso da amostra.
- Anexe a massa de teste usando a linha de monofilamento ao gancho na parte inferior da panela de medição de microbalanças, mede sua massa aparente no ar e confirme o acordo com a medição no passo 3.1.
- Misture a solução N 2- Ar para eliminar gradientes de concentração e densidade como no passo 4.5.
- Prefira a massa de teste para T = 77 K, baixando-a para o nitrogênio líquido fora da câmara de cobre. Levante a massa de teste na camada fria de gás nitrogênio acima do nitrogênio líquido, aguarde que o nitrogênio liquido residual evapore a massa de teste e, em seguida, abaixe a massa de teste seca e seca na mistura N2-Ar até que esteja totalmente submersa e Dentro de 2 cm da superfície líquida.
- Depois de todas as ondas de ebulição e de superfície terem desaparecido, medir a massa aparente da massa de teste. Calcule a densidade da solução usando sua massa real m e T = 77 K volume V (77K) do passo 3.7 de acordo com o seguinte:
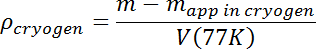
- Aumente a densidade da solução fluindo Ar adicional até que a densidade inicial desejada seja obtida. As gotas de amostra que afundam podem ser facilmente perdidas, então a densidade inicial deve ser pelo menos alguns por cento maior do que a densidade de amostra esperada. A amostra flutuará, tornando mais fácil acompanhar isso, e a densidade da mistura N 2- Ar precisará apenas ser ajustada para baixo, adicionando N 2 líquido.
- Remova o tubo enrolado pré-resfriamento Ar e deixe aquecer e secar antes do próximo uso.
6. Gotas de resfriamento da solução de amostra
- Imediatamente antes da dispensação e arrefecimento, repita o passo 1.5 atéX o líquido criogênico de nitrogênio / árgon. Tenha cuidado para não introduzir bolhas.
- Remova a tampa hermética do tubo de amostra. Usando uma seringa limpa de 1 mL, extraia até 1 mL de solução e substitua a tampa. Anexe uma agulha de 27 a 33 G na seringa e, em seguida, empurre uma pequena quantidade de amostra através da agulha para expulsar o ar e quaisquer resíduos da dispensação anterior.
- Dois métodos podem ser usados para projetar gotas de amostra na mistura N 2 -Ar.
- Para amostras com grandes concentrações de componentes não aquosos (> 45% p / p) que podem ser vitrificadas com taxas de arrefecimento modestas, pressione levemente a seringa para deslocar um pequeno (250 μm a 1 mm) de diâmetro, ~ 10 nL a 1 μL de queda Que pendura da ponta da agulha por tensão superficial. Toque suavemente a agulha para separar e projetar a queda em direção à mistura líquida de N 2 -Ar.
- Para amostras que requerem um arrefecimento mais rápido para vitrificação, coloque a saída de um tubo de gás conectado a um gerador de vácuoOu (fornecido pelo ar comprimido comprimido) no espaço de gás acima da mistura líquida de N 2 -Ar e suavemente afugenta a camada de gás frio que se forma. Isso aumenta as taxas de resfriamento para pequenas amostras 11 .
- Toque cuidadosamente a ponta da agulha em uma tira de polímero transparente de 25 a 75 μm de espessura para distribuir um pequeno volume (<10 nL, correspondente a um diâmetro de gota <200 μm) de amostra.
NOTA: Para obter as gotas mais pequenas, quase esféricas e mais facilmente removidas, remova a tira em uma solução de revestimento hidrofóbica por 10 min e deixe secar antes da distribuição da amostra. - Pegue a tira usando uma haste de plástico ou madeira em anexo e mergulhe manualmente a haste mais a tira na mistura líquida de N 2 -Ar.
- Uma vez que a queda se solidificou e a ebulição cessou, pegue a borda da tira oposta à haste usando uma pinça. Flexione a tira, mantendo-a imersa no líquido N 2 -Ar, até que a gota da amostra apareça e flutua no surfás.
- Toque cuidadosamente a ponta da agulha em uma tira de polímero transparente de 25 a 75 μm de espessura para distribuir um pequeno volume (<10 nL, correspondente a um diâmetro de gota <200 μm) de amostra.
7. Avaliação do estado da amostra
- Usando um longo microscópio binocular de distância de trabalho (5-10 cm) e iluminação brilhante e legal de um iluminador LED ou fibra óptica, examine cuidadosamente a gota enquanto mantém a imersão no líquido N 2 -Ar. As gotas vitrificadas devem parecer claras 12 , 13 . Rejeitar gotas que são nebulosas ou turvas (provavelmente contendo mais de uma fase) e / ou que mostram imperfeições ópticas, incluindo rachaduras (que podem estar associadas a vazios que alteram a densidade média).
NOTA: A pintura da superfície interna da câmara de cobre para fornecer um fundo preto pode facilitar a identificação das imperfeições da amostra.
8. Determinação da densidade da amostra
- A gota dispensada flutuará inicialmente, afundará, ou (raramente) será neutramente flutuante na mistura N 2 -Ar.As gotas flutuantes às vezes podem ser mantidas por tensão superficial, pequenas bolhas ou partículas de gelo aderidas. Inspecione toda a superfície de queda com o microscópio. Deslize a gota para baixo da superfície do líquido usando uma pequena (2-3 mm de diâmetro, 10 cm de comprimento) de plástico pré-resfriado ou barra de madeira e observe sua resposta.
- Se a queda cair, aumente a densidade do líquido N 2 -Ar usando o procedimento no passo 4 até a queda ficar neutra ou flutuando.
- Se a gota flutuar, diminua a densidade do N 2 -Ar líquido, adicionando nitrogênio líquido usando um criovial de 1,8 mL. Em grande densidade de mistura inicial (1,2-1,3 g / mL), adicionar N2 em incrementos de 1 mL dá mudanças de densidade apreciáveis, mas isso deve ser aumentado em direção a 5 mL com baixas densidades (0,8-0,9 g / mL). Misture suavemente o N 2 -Ar (para não perder o controle da queda da amostra) usando a chapa de cobre perfurada e perfurada para cima e para baixo na câmara de cobre.
- Após cada adição de N 2, Use uma pequena haste pré-resfriada para deslizar suavemente a gota flutuante para baixo no líquido e observe sua velocidade enquanto retorna à superfície.
- Quando a densidade da solução foi ajustada para que a queda pareça ser neutra ou aumente muito lentamente (<50 μm / s assegurará ~ 0.1% ou melhor precisão de densidade para gotas com volumes até 50 pL), mida o N 2 - Ar como a densidade da mistura como descrito no passo 5. Em seguida, adicione N 2 líquido adicional até que a gota primeiro comece a afundar lentamente e mude novamente a densidade da mistura N 2- Ar. Essas duas medidas proporcionam limites na densidade de queda.
Resultados
As medidas de densidade em T = 77 K para gotas vitrificadas de glicerol aquoso e etilenoglicol versus concentração de crioprotectores são mostradas na Figura 1 A e Figura 1 B , respectivamente, e a mudança correspondente no volume específico entre T = 298 K e 77 K, calculada usando anteriormente Determinada T = 298 K densidades, é mostrado na
Discussão
O presente aparelho e métodos, desenvolvidos principalmente por estudantes de graduação com acesso limitado a ferramentas e máquinas de construção de instrumentos, no entanto, oferecem medidas de densidade altamente precisas para gotas líquidas individuais tão pequenas quanto 50 pL. Na faixa de concentração próxima e acima de 50% p / p, onde pequenas taxas de arrefecimento são suficientes para obter amostras vitrificadas, as densidades concordam com as obtidas em medidas anteriores em amostras em massa. As e...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pela NSF sob o prêmio MCB-1330685. A DWM reconhece o apoio parcial da Bolsa de Treinamento de Biofísica Molecular da Universidade Cornell (NIH T32GM0082567).
Materiais
| Name | Company | Catalog Number | Comments |
| centrifuge tube | Falcon | 6029236 | 15 mL conical centrifuge tube |
| glycerol, >99.5% | Sigma | G9012-100 mL | |
| ethylene glycol, >99.8% | Sigma | 324558-100 mL | |
| analytical microbalance | Mettler | AE240 | Analytical balance, 0.01 mg resolution, has hook on bottom for weighing below the balance |
| vortexer | Scientific Industries | SI-0236 | Vortex-Genie 2 |
| Apparatus enclosure framing | Unistrut | 1-5/8" metal framing | 48" wide x 24" deep x 40" tall |
| Apparatus enclosure air barrier | any clear plastic sheeting | ||
| neoprene rubber disk | 4" diameter, 1/8" thick | ||
| dewar flask | Scilogix Dilvac | SS333 | 4.5 liter dewar flask with steel case and clamp lid |
| copper chamber | This fabricated part is comprised of a 1.43" diameter, 0.017" wall thickness copper tube with a solid cylindrical copper base soldered to seal one end. The copper base is 0.87" tall and the overall chamber height is 7". | ||
| nitrogen gas | Airgas | NI HP300 | 99.998% pure N2 gas |
| argon gas | Airgas | AR HP300 | 99.998% pure Ar gas |
| rotameter | Omega | FL3692ST | 2.52 l/min max flow rate |
| foam insulating lid | This part is fabricated from 4 lb/ft3 crosslinked polyethylene foam (supplied by Technifab, 1355 Chester Industrial Parkway, Avon, OH), and has an OD of 2.42", and ID of 1.52", and a thickness of 0.79". | ||
| PTFE test mass | This fabricated part is a 0.246" diameter, 0.580" tall cylinder with a 0.060" diameter hole running perpendicular to and intersecting the cylinder axis ~0.10" from one end. | ||
| microbalance platform | Unistrut | 1-5/8" metal framing | 11" wide x 24" long x 24" high rectangular frame with an top aluminum sheet containing a hole for the monofilament and hanging test mass |
| 2 mil (50 um) monofilament line | Berkley | NF1502-CM | Nanofil fishing line |
| Argon precooling coil tubing | VWR | 60985-512 | 1/8" ID x 1/4" OD PVC tubing |
| perforated copper foil mixer | 1.4" diameter, 35 micron thick copper disk, cut from 1 ounce/ft2 copper sheet and perforated with holes using an awl or other sharp pointed tool. Insert 1-2 mm diameter rigid thermally insulating (plastic or wood) rod into the center and fix using epoxy as needed. | ||
| syringe | BD | 309628 | 1 ml Luer-Lok tip syringe |
| vacuum generator | Gast | VG-015-00-00 | compressed air venturi single stage vacuum generator |
| hydrophobic coating spray | RainX | 620036 | plastic water repellent |
| long focal length stereo microscope | Bausch and Lomb Stereozoom 6 | 0.67-4 x zoom pod with 20x eyepieces, 10 cm working distance | |
| LED ring illuminator | Amscope | LED144S | |
| LED spot illuminator | Newhouse Lighting | NHCLP-LED | 3W LED gooseneck clamp lamp |
| 1.8 ml cryo vial | Nunc | V7634-500EA | Any 1.8 or 2 ml cryovial is adequate |
Referências
- Fahy, G. M., Wowk, B. Principles of Cryopreservation by Vitrification. Cryopreservation and Freeze-Drying Protocols. , 21-82 (2015).
- Nagy, Z. P., Nel-Themaat, L., Chang, C. -. C., Shapiro, D. B., Berna, D. P. Cryopreservation of eggs. Human Fertility: Methods and Protocols. , 439-454 (2014).
- Kriminski, S., Caylor, C. L., Nonato, M. C., Finkelstein, K. D., Thorne, R. E. Flash cooling and annealing of protein crystals. Acta Cryst Sect D. 58 (3), 459-471 (2002).
- Juers, D. H., Matthews, B. W. Reversible lattice repacking illustrates the temperature dependence of macromolecular interactions. J Mol Biol. 311 (4), 851-862 (2001).
- Juers, D. H., Matthews, B. W. Cryo-cooling in macromolecular crystallography: advantages, disadvantages and optimization. Q Rev Biophys. 37 (2), 105-119 (2004).
- Alcorn, T., Juers, D. H. Progress in rational methods of cryoprotection in macromolecular crystallography. Acta Cryst Sect D. 66 (4), 366-373 (2010).
- Warkentin, M., Sethna, J., Thorne, R. Critical Droplet Theory Explains the Glass Formability of Aqueous Solutions. Phys Rev Lett. 110 (1), 15703 (2013).
- Kriminski, S., Kazmierczak, M., Thorne, R. E. Heat transfer from protein crystals: implications for flash-cooling and X-ray beam heating. Acta Cryst Sect D. 59 (4), 697-708 (2003).
- Loerting, T., Bauer, M., Kohl, I., Watschinger, K., Winkel, K., Mayer, E. Cryoflotation: Densities of amorphous and crystalline ices. J Phys Chem B. 115 (48), 14167-14175 (2011).
- Shen, C., Julius, E. F., Tyree, T. J., Moreau, D. W., Thorne, R. E. Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection Thermal contraction of aqueous glycerol and ethylene glycol solutions for optimized protein-crystal cryoprotection. Acta Cryst Sect D. 72 (6), 742-752 (2016).
- Warkentin, M., Berejnov, V., Husseini, N. S., Thorne, R. E. Hyperquenching for protein cryocrystallography. J Appl Cryst. 39 (6), 805-811 (2006).
- McFerrin, M. B., Snell, E. H. The development and application of a method to quantify the quality of cryoprotectant solutions using standard area-detector X-ray images. J Appl Cryst. 35 (5), 538-545 (2002).
- Chinte, U., Shah, B., DeWitt, K., Kirschbaum, K., Pinkerton, A. A., Schall, C. Sample size: An important parameter in flash-cooling macromolecular crystallization solutions. J. Appl. Cryst. 38 (3), 412-419 (2005).
- Bosart, L. W., Snoddy, A. O. Specific gravity of glycerol. Ind Eng Chem. 20 (12), 1377-1379 (1928).
- Rodrigues, M., Francesconi, A. Z. Experimental study of the excess molar volumes of binary and ternary mixtures containing water + (1,2-ethanediol, or 1,2-propanediol, or 1,3-propanediol, or 1,2-butanediol) + (1-n-butyl-3-methylimidazolium bromide) at 298.15 K and atmospheric pressure. J Solution Chem. 40 (11), 1863-1873 (2011).
- Berejnov, V., Husseini, N. S., Alsaied, O. A., Thorne, R. E. Effects of cryoprotectant concentration and cooling rate on vitrification of aqueous solutions. J Appl Cryst. 39 (2), 244-251 (2006).
- Meisburger, S. P., Warkentin, M., et al. Breaking the Radiation Damage Limit with Cryo-SAXS. Biophys J. 104 (1), 227-236 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados