Method Article
ODELAY: Un método a gran escala para la cuantificación multiparamétrica del crecimiento de la levadura
En este artículo
Resumen
Presentamos un método para cuantificar los fenotipos de crecimiento de células de levadura individuales a medida que crecen en colonias en medios sólidos usando microscopía de lapso de tiempo denominada Evaluación de Duplicación de células vivas de levaduras (ODELAY). La heterogeneidad de la población de células genéticamente idénticas que crecen en colonias puede observarse y cuantificarse directamente.
Resumen
Los fenotipos de crecimiento de los microorganismos son un fuerte indicador de su aptitud genética subyacente y pueden segregarse en 3 regímenes de crecimiento: lag-phase, log-phase y stationary-phase. Cada fase de crecimiento puede revelar diferentes aspectos de la aptitud que están relacionados con diversas condiciones ambientales y genéticas. Las mediciones de alta resolución y cuantitativas de las 3 fases de crecimiento son generalmente difíciles de obtener. Aquí presentamos un método detallado para caracterizar todas las 3 fases de crecimiento en medios sólidos utilizando un ensayo denominado Evaluación de Duplicación de Celda de Arrays Vivientes de Levadura (ODELAY). ODELAY cuantifica los fenotipos de crecimiento de las células individuales que crecen en colonias en medios sólidos usando microscopía de lapso de tiempo. Este método puede observar directamente la heterogeneidad de la población con cada parámetro de crecimiento en células genéticamente idénticas que crecen en colonias. Esta heterogeneidad de población ofrece una perspectiva única para entender la regulación genética y epigenética, y las respuestas aGenéticas y ambientales. Aunque el método ODELAY se demuestra usando levadura, puede ser utilizado en cualquier microorganismo formador de colonias que sea visible por microscopía de campo brillante.
Introducción
Los fenotipos de crecimiento de microorganismos son un fuerte indicador de su aptitud genética subyacente a una condición ambiental dada. El crecimiento se clasifica clásicamente en 3 regímenes de crecimiento diferentes: fase de retraso, fase logarítmica y crecimiento en fase estacionaria 1 . Cada fase de crecimiento puede revelar diferentes aspectos de la aptitud que dependen de diversas condiciones ambientales y genéticas. Por ejemplo, el tiempo de retraso, o la cantidad de tiempo que un organismo pasa en fase de retraso antes del inicio del crecimiento exponencial, puede ser indicativo de la capacidad de un organismo para responder a condiciones ambientales alteradas 2 . El tiempo de duplicación durante el crecimiento de la fase logarítmica, la métrica más común de aptitud celular, revela la eficiencia global de la capacidad de un organismo para dividirse metabolizando y utilizando materiales ambientales para la replicación. La fase estacionaria, donde el crecimiento después de la fase logarítmica se reduce rápidamente, es otro indicador de aptitud, que es regularUtilizado como punto final de crecimiento en ensayos de crecimiento de levadura a base de manchas.
Varios ensayos de crecimiento de levadura están actualmente disponibles y se consideran métodos estándar para evaluar los fenotipos de crecimiento en levaduras 3 , 4 , 5 . Estos ensayos se basan principalmente en métodos para cultivar levadura ya sea en medio sólido o líquido. En medios sólidos, los ensayos de fijación de colonias transfieren un pequeño número de células sobre agar sólido con un alfiler, y las células de levadura se dejan crecer durante un periodo de tiempo definido. A continuación se forman imágenes de las colonias y se comparan sus tamaños en un extremo terminal 6 . Estos ensayos de fijación de colonias han demostrado ser robustos y escalables para generar pantallas de todo el genoma. Más recientemente, se han incorporado imágenes periódicas utilizando escáneres de lecho plano y cámaras SLR (Single Lens Reflex) en estos ensayos para registrar el crecimiento de colonias a lo largo del tiempo 7 , 8, 9 . Sin embargo, la resolución de estos dispositivos les impide detectar células individuales y, por lo tanto, estos ensayos de fijación de colonias no observan directamente el tiempo de retraso y no pueden observar la variación entre las células individuales que crecen en colonias.
También se han empleado ensayos de crecimiento a base de líquido para realizar pantallas de todo el genoma 3 . El acoplamiento de un ensayo de crecimiento líquido con microscopía de lapso de tiempo reveló heterogeneidad de la población en el tiempo de duplicación de células individuales genéticamente idénticas, lo que ofrece una perspectiva importante para comprender la regulación genética y la adaptación al medio ambiente. Sin embargo, este ensayo no mide otros aspectos del crecimiento tales como tiempo de retraso y capacidad de carga 10 . Aquí presentamos un método para caracterizar las tres fases de crecimiento de microorganismos formadores de colonias en medios sólidos usando un ensayo que denominamos ODELAY 11 . ODELAY consiste en utiliZing de alto rendimiento lapso de tiempo de microscopía para registrar imágenes de células individuales que crecen en colonias en medios sólidos. Esta población de células individuales que crecen en colonias revela la heterogeneidad de la población subyacente, que no es detectada por otras mediciones menos sensibles como la puntuación terminal. Se demuestra el método de la levadura, pero ODELAY puede aplicarse a cualquier organismo que muestra el contraste en microscopía de campo brillante.
Protocolo
1. Preparación de Agarose Gel Stock
- Pesar 2 g de agarosa de alta pureza.
- Añadir la agarosa a una botella de 500 ml y registrar su masa combinada.
- Calcular la masa objetivo de la botella más 2 g de agarosa con 150 g de agua ultra pura, luego añadir 150 g de agua ultra pura a 0,1 g de esta masa objetivo.
- Observe la masa de la botella más la agarosa y el agua.
- Coloque la botella en un microondas y asegúrese de colocar la botella con una tapa suelta en la parte superior para minimizar la evaporación del agua mientras se calienta la agarosa.
- Horno de microondas la botella en 15 - 20 s ráfagas seguido de un breve giro de la botella para mezclar la agarosa y el agua. Repita este procedimiento hasta que la solución esté hirviendo y la mezcla sea homogénea.
PRECAUCIÓN: Tenga cuidado de no quemar la piel con el vapor que sale de la botella. Además, la botella se calienta al tacto y se requiere una protección adecuada, como un guante de autoclave, para evitar lesiones. - Después de que la agarosa fundida sea homogénea, pese nuevamente la botella y añada agua ultrapura a 0,1 g de la masa original. Esto reemplazará cualquier pérdida de agua debido a la evaporación.
- Antes de que la agarosa fundida se solidifique, remueva para mezclar en el agua añadida para asegurar la homogeneidad.
- Alícuota 15,2 g de agarosa en tubos de plástico de 9 - 50 ml.
- Refrigere los tubos hasta que sean necesarios.
2. Preparación de Medios Agarosa ODELAY
- Calentar 400 ml de agua desionizada para hervir en un vaso de precipitados cubierto, sobre una placa caliente bajo agitación suave con una barra de agitación magnética.
- Añadir 2 ml de medio 10X ( por ejemplo , peptona de extracto de levadura (YEP) o mezcla de suplemento completo (CSM)) a una alícuota de agarosa de 15,2 g en un tubo cónico de 50 ml del paso 1.10.
NOTA: El medio CSM tiende a pegarse a las diapositivas de vidrio. Si se usan formulaciones de medios CSM, añadir 5 μl de Polietilenglicol (PEG) al 50% en peso en agua estéril a la formulación del medio. El PEG impide que el aGar de pegarse a los portaobjetos de vidrio durante la liberación del molde y no inhibe el crecimiento de la levadura. - Agregue suplementos de nutrientes adicionales de 100X, si es necesario, y use agua para llevar el volumen total añadido de este paso a 1 mL.
- Pesar la alícuota de agarosa con los medios añadidos y suplementos antes de colocar el tubo cónico de 50 ml en agua hirviendo de la etapa 2.1.
- Después de 16 minutos, extraer el tubo de 50 ml y homogeneizar la mezcla usando un vórtice. Mantenga la tapa firmemente apretada en el tubo cónico de 50 ml.
NOTA: Una tapa del vaso ayuda a calentar el tubo entero uniformemente, de lo contrario se formará una película de agarosa sólida y posiblemente no se derretirá. También durante este tiempo, es conveniente montar el molde de agarosa ( Figura 1 ). - Homogeneizar la mezcla utilizando un vórtice.
- Hervir durante 2 minutos adicionales para asegurar que todo el agar se mezcla y se funde.
- Pesar el tubo y reemplazar cualquier masa perdida con agua estéril ultra pura.
- Añadir 2 ml de ácido carbónico 10X(Por ejemplo , 20% p / v de glucosa) y agitar en vórtice para obtener una solución de medio de agarosa.
NOTA: Separación de los portaobjetos de vidrio: Al montar el molde hay que tener cuidado de que los espaciadores largos se coloquen en el molde con la orientación correcta. Esto se debe a que como el láser corta el acrílico, tiende a cortar como un cono dejando la parte con lados ligeramente angulados en lugar de exactamente 90 ° lados. A continuación, cuando el molde se coloca en el banco para liberar el vidrio del agar, el borde del espaciador debe estar en un ángulo agudo con el agar. El ángulo agudo ayuda a comprimir el borde del agar lejos de la pieza superior de vidrio cuando el borde exterior del espaciador del molde se hace pivotar alrededor del borde inferior (véase la figura 1 ). El resultado es una separación más consistente del agar de la pieza superior de vidrio.
NOTA: Los agentes de desmoldeo aplicados a los aceites de vidrio, aerosoles de silicio o incluso a los tratamientos de ventanas comerciales no deben usarse porque contaminan los La superficie del agar y posiblemente inhibir el crecimiento. Estos métodos toman cierta práctica para ser consistentes. - Limpie cuatro diapositivas de vidrio de 2 x 3 x 1 mm de espesor con etanol al 70% y seque utilizando aire forzado.
- Limpie los moldes de acrílico con etanol al 70%, seque y ensamble como se muestra en la Figura 1 . Tomar las tres piezas inferiores, como se muestra, y montarlas de modo que las dos piezas idénticas empareden la tercera pieza ( Figura 1B ). Sujete las piezas de base en cada lado utilizando dos clips de encuadernación pequeños ( Figura 1C ). Coloque los montantes en el molde asegurándose de que el corte láser está correctamente colocado ( Figura 1E ).
- Coloque la diapositiva de vidrio limpia y seca en el molde y manténgala en su lugar mientras coloca una segunda diapositiva de vidrio en el otro lado. Sujete el ensamblaje con un clip de encuadernación más grande ( Figura 1D ). Sujete ambos portaobjetos con clips de encuadernación más grandes (Lass = "xfig"> Figura 1D). Asegúrese de que la pinza superior del encuadernador esté en contacto con la lámina de vidrio que se solapa con el acrílico.
- Agregue los clips de encuadernación restantes. Una vez más, asegúrese de que las pinzas entren en contacto con la diapositiva donde se superpone al acrílico ( Figura 1D ).
NOTA: Antes de llenar el molde ensamblado con agar fundido, asegúrese de sellar los bordes pipeteando aproximadamente 70 μl de medio de agar fundido a lo largo del lado interno del molde. Este agar se solidificará rápidamente y evitará cualquier filtración. - Llene el molde con agar fundido, asegurándose de evitar atrapar burbujas de aire en el molde.
NOTA: Esto puede lograrse pipeteando lentamente el agar fundido a lo largo del borde del molde. Después de que se llena, dejar que el molde se enfríe durante 40 minutos a 1 hora a aproximadamente 23ºC de temperatura ambiente. Si se deja enfriar demasiado tiempo, el agar puede fracturarse en el molde.
NOTA: Separación del molde: La eliminación adecuada del molde del agar fundido es esencial para asegurar un sólido uniformeAlmohadilla de agar para el crecimiento de la levadura. La falta de aseguramiento de la separación eficaz del molde en esta etapa causará diferencias de crecimiento que son atribuibles a imperfecciones en la almohadilla de agar sólida. Practicar este paso un par de veces se recomienda. - Comience por retirar el clip de encuadernación inferior. Retire la parte inferior del molde que consta de las tres piezas intercaladas. Sostenga las diapositivas comprimiéndolas y luego quite los clips de encuadernación. Asegúrese de no golpear los lados del molde mientras retira los clips del encuadernador. Esto deformará los medios de comunicación.
- Coloque el molde en el borde de la bancada para que el lado del molde con el punto azul esté hacia arriba y en la esquina inferior izquierda ( Figura 1E ). Coloque los pulgares debajo del acrílico y el primer dedo en la parte superior hacia el borde interior del molde.
- Lentamente y cuidadosamente empuje hacia arriba con el pulgar contra el molde, como si el pivote del espaciador del molde alrededor de su borde inferior ( Figura 1F ). Aplicar constantePero aumentando lentamente la presión. Los usuarios verán una ruptura y una burbuja de aire aparecerá a lo largo de la línea donde el vidrio superior cubre el espaciador del molde.
- Después de ver la línea inicial de la rotura, continúe empujando para arriba con los pulgares y aplique la presión constante. El agar debe empezar a separarse del vidrio en este punto ( Figura 1F ). Continúe girando el molde hacia arriba. Esto levantará el vidrio sin deslizarlo. Una línea en la que el agar se desprende del vidrio debe continuar alejándose de la línea de ruptura inicial.
NOTA: En este punto, el agar se pega tanto a la parte inferior y superior del vidrio. Esto ocurrirá ocasionalmente con el borde más a la izquierda. Siempre y cuando el área deformada no está en el área donde la levadura es manchada, esto debería estar bien. - Como el cristal viene completamente libre, agarrarlo y quitarlo completamente del molde. A continuación, retire la otra pieza del molde con un movimiento similar para levantar la pieza libre sin mover el agar. Coloque los portaobjetos en unaCon un poco de agua estéril de alta pureza en el fondo. Cierre la caja y guárdela a 4 ° CO / N para su uso al día siguiente. Si se almacenan por más tiempo, las tasas de crecimiento se volverán inconsistentes.
3. Preparación de Cultura ODELAY
- Coloque las cepas en una placa de 96 pocillos para el crecimiento O / N.
- Al día siguiente, diluir 20 μL de cultivo durante la noche en 200 μL de medio para 220 μL de volumen total en una nueva placa.
- Medir la densidad óptica a 600 nm (OD600) de cada cultivo en un lector de placas. Utilizando un lector de placas y un robot de manipulación de líquidos, siga el protocolo de dilución automatizado de los pasos 3.3.1 a 3.3.6. Diluir manualmente los cultivos en la placa a aproximadamente 0,1 OD600 (opcional).
- En el lector de placas, pulse "Experiment" en "create new". Elija ODELAYDilution.exp y ejecute el experimento. Introduzca el nombre del experimento como ODELAY "Fecha" "Hora" "iteración del nombre del experimento".
- Haga clic en el botónTatistics y luego haga clic en el icono de Excel. Guarde los datos en una unidad de memoria y transfiéralo a una computadora de manipulación de líquidos.
- Abra el Layout y el Editor de métodos del robot. Abra el archivo de método "ODELAYDilution_v1.med". Ejecute el ejecutable "Convert_SynergyFiles.exe". Introduzca 0.09 para OD600 objetivo.
- Haga clic en "Corrección Glu" y "Corrección Gal" a 0,05. Medir los medios en blanco en una placa idéntica. Haga clic en "Generar archivo". Seleccione el archivo en el editor de métodos. Haga clic en el icono de semáforo para iniciar el método para abrir el programa de dilución en tiempo de ejecución.
- Asegúrese de que los tubos estén sin tapar y que las placas tengan tapas removidas y se retiren las cubiertas de polvo de las puntas. Cargue las placas, los tubos y las puntas en la cubierta del robot manipulador de líquidos, como se indica en la distribución de la cubierta.
- Haga clic en el botón "Reproducir" para ejecutar el programa de dilución. Seleccione el número correcto de puntas de 50 μL. Seleccione el número correcto de puntas de 300 μL. Esperar12 min para que el proceso se ejecute.
- Tome la placa de dilución del robot, cubra las puntas y recapitule los tubos de 15 ml. Cultivar la placa durante 5 - 6 h a 30 ° C.
- Aproximadamente 1 - 2 horas antes de comenzar la segunda dilución cerciórese de encender las cámaras de incubación para el microscopio. Permitir que se equilibren a ° C o la temperatura requerida para el experimento.
- Repita los pasos de dilución 3.3 - 3.4, pero los cultivos diluidos a una OD600 de 0.01 - 0.02 para manchar los cultivos en los portaobjetos de agarosa.
- Cubra la placa de dilución con un sello de congelador de metal.
- Sonicar la placa de dilución en un baño de hielo durante 30 s con la placa flotando en agua con hielo, utilizando una centrífuga de metal cuchara de sujeción para sostener la placa ( Figura 2A ]. Transferir los cultivos sonicados de la placa de dilución a una placa de fondo plano. Etiquetar 4 placas de fondo plano de 96 pocillos 1, 2, 3 y 4 ( Figura 2B ).
- Transferencia 150 &Después de transferir 150 μl de la placa de dilución de los pocillos A07 - D12 en los pocillos C04 - F09 de la placa marcada con 2. Luego transferir 150 μl de la placa de dilución de los pocillos A07 - D12 en los pocillos A02 - De la placa de dilución de los pocillos E01 - H06 en los pozos C04 - F09 de la placa marcada con 3. Finalmente transferir 150 μl de la placa de dilución de los pozos E07 - H12 a los pozos C04 - F09 de la placa marcada con 4.
- Vaya al paso 4, Spotting on Agar.
4. Detección de agar mediante un robot automatizado de detección de líquidos
- Retire los portaobjetos de agarosa almacenados a 4 ° CO / N (del paso 2.19) de sus cajas de pipeta estériles humidificadas.
- Si es necesario, recorte las esquinas del medio de agarosa con una cuchilla de afeitar limpia para asegurarse de que encajarán en la cámara de deslizamiento.
- Retire la abrazadera deslizante del soporte. Con cuidado, coloque la placa de agar en el área empotrada del soporte de la cámara de la etapa.
NOTA: Asegúrese de que laLa estabilización de la diapositiva es consistente de experimento a experimento. - Compruebe que la abrazadera esté a ras con el fondo de la cámara. Si está torcida, es posible que la diapositiva no esté completamente asentada en el área empotrada. Coloque el espaciador de nivelación en la posición de la placa central del robot de colocación. Este espaciador proporciona contacto para los tornillos de nivelación de modo que la cámara de deslizamiento puede ser nivelada con las puntas.
- Coloque las placas sobre la mesa en orden de su cuadrante. Las placas 1, 2, 3 y 4 se ordenan de izquierda a derecha ( figura 2B ).
- Coloque las puntas de modo que los 24 pocillos interiores C04 - F09 estén ocupados con puntas en 4 cajas de puntas vacías. Una quinta caja tendrá que tener una punta en la posición C10, así como 4 puntas con sus extremos cortados en las posiciones A01, A12, H01 y H12. Estas 4 puntas de corte proporcionan estabilidad para la abrazadera de la placa de punta ( Figura 2C y 2D ).
- Retire la cubierta superior del slIde.
- Coloque el punzón de la primera punta en el sitio de inicio del programa de detección de control del robot. Esto debe perforar un agujero en la agarosa que más tarde se utilizará para alinear la coordenada de origen. Coloque la placa 1 en el robot de manipulación de líquidos para detectar el primer cuadrante. Asegúrese de retirar la tapa y continúe con el programa de manchas.
- Asegúrese de que todos los puntos estén presentes. También, espere ~ 30 s para que se sequen. Cuando las manchas son de aproximadamente 1 mm de diámetro, el programa puede continuar. Vacíe las puntas usadas en el contenedor de riesgo biológico y coloque consejos frescos sobre el robot. Intercambie la placa 1 para la placa del segundo cuadrante.
- Repita para el tercer cuadrante. Y repita de nuevo para el 4 º cuadrante.
- Cuando las manchas estén secas, vuelva a colocar la tapa de la cámara deslizante y vuelva a colocar el aparato.
- Instale las conexiones de la tubería con un filtro de aire.
- Coloque un portaobjetos de vidrio en la parte superior de la cámara.
NOTA: Esta diapositiva es crucial para reduciNg el flujo de calor al agar y minimiza la formación de la condensación en el lado de deslizamiento de cubierta objetivo de la cámara. No se olvide de esta portada. Dependiendo de la configuración del microscopio, este reborde evita que el calentamiento desde el lado de la iluminación provoque la condensación en el lado objetivo. - Coloque un ventilador para soplar aire caliente en el lado objetivo de la cámara. Este ventilador evita la formación de condensación en la cubierta. Ajuste el caudal de aire a través del burbujeador a 10 ml / min.
5. Ejecución de ODELAY en Microscopio
- Ejecute el script "ODELAY_Microscope_Control.m".
- Haga clic en el "Obturador" para abrir el obturador de la luz transmitida y luego el botón "Enfoque" para iniciar la alta velocidad de la cámara ( Figura 3A , Flechas Rojas).
- Haga clic en "Go Origin" y mueva la etapa para encontrar la marca de origen que fue perforada en el agar.
- Luego, mueva un poco hacia la derecha paraSe centran en células de levadura manchadas en el área E07.
- Vuelve al punzón de origen y centralo en el campo de visión.
- Ajuste el origen a este valor pulsando el botón "set" ( Figura 3A , Flechas azules). Ahora mueva a la posición H18 y enfoque usando el tornillo hexagonal más cercano a esa ubicación. Luego mueva a la posición L07 y enfoque usando el tornillo hexagonal más cercano a esa ubicación. Luego mueva a la posición E07 y enfoque usando el tornillo hexagonal más cercano a esa ubicación.
- Repita los pasos 5.5 a 5.7 según sea necesario hasta que esas posiciones permanezcan enfocadas.
- Compruebe el enfoque en el centro y en los bordes en los puntos E12, H12, L12. Ajuste el rango de enfoque automático si los valores Z de enfoque, como se indica con el valor Z, son mayores que ± el rango de enfoque automático ( por ejemplo , ajuste el rango de enfoque automático a 60 μm el valor Z para un punto central que es mayor que ± 40 mu m).
- Presione el botón de reinicio ya que esto activará las propiedades del botón, y luego presioneODELAY ( Figura 3A , Flechas Verdes). Elija el directorio para guardar los datos. Asegúrese de que haya suficiente espacio en la unidad.
NOTA: El microscopio recoge datos durante 48 h, o hasta que el programa se cierra.
6. Procesamiento de datos ODELAY
- Abra el ODELAY_IPT.exe o utilice el script ODELAY_Image_Processing_Tool_v7.m ( Figura 3C ).
- Prepare una hoja de cálculo * ODELAYExpDisc.xlsx excel.
- Nombre el experimento en la celda B1.
- Seleccione el directorio de imágenes donde se almacenan los archivos de imagen E07 - H18.
- Seleccione el directorio de datos donde se escribirán los datos.
- Escriba la fecha en que se inició el experimento en la célula B04. Utilice el formato MM / DD / YYYY.
- Escriba el tiempo de dilución en la celda C04. Este tiempo es aproximadamente cinco minutos antes de que se recoja la primera imagen. Utilice el formato HH: MMpm donde HH es para h y MM es para min.
- Añadir los nombres de las deformaciones según tO la placa fuente (paso 3.1). Debido a la forma en que se detectan las cepas, se reordenan en el portaobjetos ODELAY. Las células de la hoja de cálculo B31-B126 son la placa fuente, mientras que las células C31-C126 son las localizaciones de manchas en la placa de agar ODELAY.
- A continuación, pulse el botón "Procesar datos" y seleccione el * ODELAYExpDisc.xlsx que se acaba de preparar.
- Espere de 16 a 24 h dependiendo del sistema informático utilizado para procesar los datos.
- Cuando se procesan las imágenes, aparecerá un directorio llamado "ODELAY Well Data" y un archivo "* _Index_ODELAYData.mat". Pulse el botón "Cargar datos" y seleccione el archivo "* _Index_ODELAYData.mat" que acaba de ser generado. Esto cargará el conjunto de datos que se acaba de procesar. El "*" en el nombre del archivo se mostrará según el nombre del experimento ingresado en la hoja de cálculo de Excel.
- Después de cargar los datos, inspeccionarlo usando la barra de tiempo que se encuentra en la parte inferior, haga clic en un cuadrado de imagen para ver las curvas de crecimiento fO ese punto, o encontrar un pozo de interés en la lista de la izquierda y luego cargar las imágenes de esa lista.
- Genere histogramas de los parámetros de crecimiento de la población pulsando el botón "Violin Plot". Esto generará un gráfico que se muestra en la Figura 4 o la Figura 6 .
Resultados
En la Figura 3B se muestran ejemplos de imágenes de levaduras que crecen en microscopía de lapso de tiempo. Después de procesar las imágenes de lapso de tiempo, se muestra en la Figura 4 un conjunto de datos representativos que comparan cepas de levadura BY4741 y BY4742. En este ejemplo de conjunto de datos, hay muy poca variación en el tiempo de duplicación entre diferentes posiciones en la placa. Si el medio de agarosa se prepara pobremente, entonces una clara desviación tanto en el tiempo de duplicación como en el tiempo de retraso sería evidente en las posiciones puntuales que coinciden con la región deformada del gel de agarosa. Aunque los tiempos de duplicación parecen ser relativamente uniformes, este ejemplo muestra variaciones en las mediciones del tiempo de retardo. Un conjunto de datos más consistente se muestra en la Figura 6 . En este conjunto de datos tanto el tiempo de retardo como el tiempo de duplicación son uniformes.
Archivos / ftp_upload / 55879 / 55879fig1.jpg "/>
Figura 1: Ensamblaje de molde de agar.
Los componentes del molde de agar se muestran en ( A ). Montar la base como se muestra en ( B ) y luego sujetar la base con clips pequeños. Coloque las piezas verticales más largas en la cavidad de la base ( C ) y luego acople las diapositivas al molde como se muestra en ( D ). Una vista lateral que muestra el ángulo del molde y la orientación del corte del molde necesario para una separación consistente del agar del portaobjetos de vidrio ( E ). Observe la posición del dedo pulgar y de los dedos índice, así como la línea recta del agar que se separa de la diapositiva ( F ) y observe la flecha horizontal. La línea de separación debe moverse uniformemente en la dirección de las flechas verticales. Haga clic aquí para ver una versión más grande de esta figura.
= "Jove_content" fo: keep-together.within-page = "1"> 
Figura 2: Método de sonicación y manchado.
Sonicar la placa en agua helada y usar un soporte de cubeta centrífuga para ayudar a apoyar la placa ( A ). Colocar las placas de los pasos 3.8.1 para el manchado en la placa de agarosa ( B ). También, arreglar las puntas para que la caja de la izquierda más la punta tiene una punta en la posición C10 y luego cuatro otras puntas con sus extremos cortados para que no choque el titular de la placa ( C ). Coloque las puntas restantes en cuatro cajas de manera que las 24 posiciones de las puntas interiores estén ocupadas ( D ). Haga clic aquí para ver una versión más grande de esta figura.
55879fig3.jpg "/>
Figura 3: Interfaz gráfica de usuario de ODELAY.
Una captura de pantalla de la interfaz gráfica de usuario para "ODELAY_Microscopecontrol.m" ( A ). Esta interfaz permite controlar la cámara y ajustar los ajustes de iluminación del microscopio para los modos epifluorescente y de campo brillante. Las flechas rojas apuntan a los botones de enfoque y transmisión que activan la cámara para adquirir imágenes rápidamente y abrir el obturador de la luz transmitida, respectivamente. Las flechas azules se utilizan para mover el escenario para el origen y, a continuación, establecer el origen con el botón "Go Origin" y el botón "Set". Las flechas verdes apuntan a "Reset" y "ODELAY !!!" Que restablecen los modos de imagen ODELAY a las condiciones actuales e inician la recopilación de imágenes ODELAY. Imágenes en tiempo transcurrido de la levadura que crece en medio sólido a 0, 3, 6 y 9 h después del manchado ( B ). Una captura de pantalla de la interfaz gráfica de usuario para "ODELAY_IPT.m" o th E Herramienta de procesamiento de imágenes ODELAY ( C ). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Ejemplo de salida ODELAY.
Este conjunto de datos compara las cepas BY4741 y BY4742 en los medios YPD. Esta figura es un ejemplo de una diapositiva de agarosa bien preparada; Sin embargo, las configuraciones de enfoque automático no son óptimas. Los datos presentados en cada columna, de izquierda a derecha, son: la capacidad de carga en Log 2 del área de la colonia; Tiempo de duplicación, dado en min; Y el tiempo de retardo, dado en min. En este ejemplo, los tiempos de duplicación de todos los puntos en la placa de agar se alinean bien con una pequeña cantidad de aumento del tiempo de duplicación hacia la columna. Sin embargo, los tiempos de retraso varían considerablemente en este conjunto de datos._upload / 55879 / 55879fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
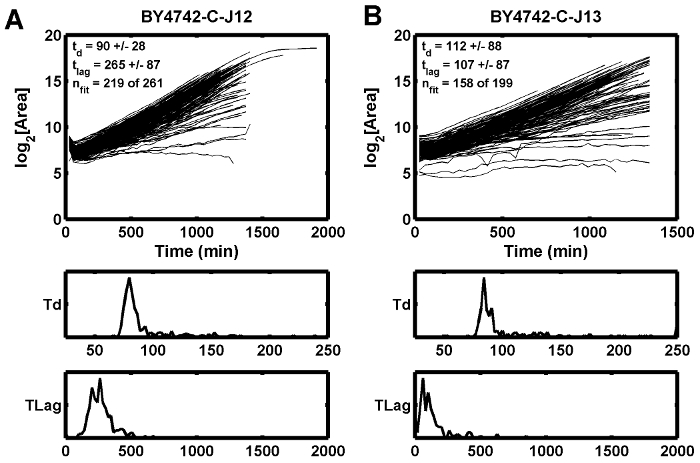
Figura 5: Ejemplos de la curva de crecimiento.
Este ejemplo demuestra cómo un enfoque inicial deficiente puede hacer que el tiempo de retardo estimado (t lag ) aumente ( A ), mientras que la posición adyacente muestra un tiempo de retardo más corto ( B ). T d es el tiempo de duplicación en min, y t lag es el tiempo de retardo en min. Haga clic aquí para ver una versión más grande de esta figura.
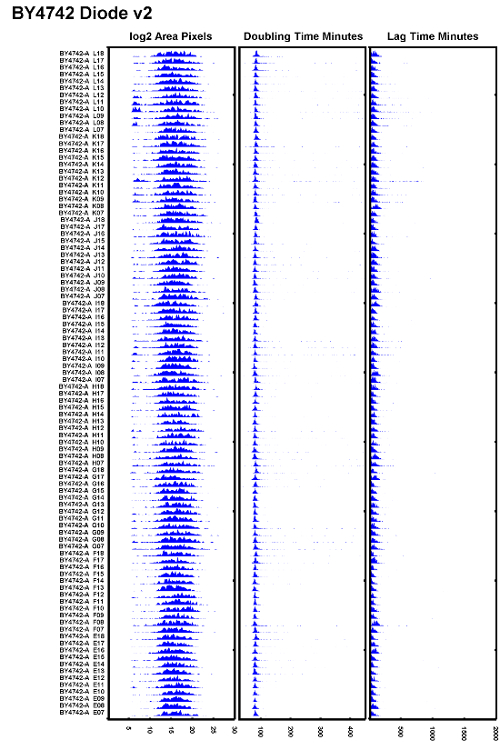
Figura 6: Ejemplo de experimento de prueba bien ejecutado.
AnXample de la cepa BY4742 probada después de reemplazar una bombilla halógena de tungsteno con un iluminador de diodo y asegurarse de que el autofoco está ajustado correctamente. Todos los tiempos de duplicación parecen superponerse bien y los tiempos de retraso parecen ser consistentes. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El ensayo ODELAY tiene varios puntos críticos para asegurar mediciones fenotípicas reproducibles y confiables. El primer punto crítico es la preparación consistente de los cultivos de levadura. Se debe tener cuidado de recoger las células de levadura de crecimiento logarítmico. Si los cultivos se han saturado, entonces su heterogeneidad de la población se incrementará lo que puede obscurecer la heterogeneidad causada por factores genéticos o ambientales ( por ejemplo, la fuente de carbono) 11 . El segundo punto crítico es la preparación consistente de los medios de comunicación. En general, se debe generar un gran volumen de solución de material de almacenamiento 10X y luego utilizarse con el tiempo para minimizar los efectos de los lotes. Formular los medios en peso, siempre que sea posible, ayuda a mejorar la consistencia del medio a lo largo del tiempo, asegurando que la densidad de agar y el contenido global en agua de la agarosa pueden ser monitorizados de cerca. El tercer punto crítico consiste en minimizar o eliminar cualquier deformación mecánica de la agarosa meDia La deformación mecánica del medio ocurrirá más frecuentemente durante la separación de la agarosa de las diapositivas de vidrio. Como con muchas técnicas de laboratorio, la práctica es necesaria para dominar este paso.
La variación en el tiempo de retardo, como se muestra en la Figura 4 , se relaciona a menudo con uno de los tres factores: deformación mecánica del medio de agarosa, variación en el espesor de agar moldeado o una fuente de luz inestable. Si el medio de agarosa varía en la altura Z a través de la matriz manchada, la variación de altura puede sobrepasar el rango de la rutina de enfoque automático, causando que las imágenes iniciales estén ligeramente fuera de foco. Por esta razón, compruebe la altura de enfoque en varios puntos en el centro ya lo largo de los bordes de la matriz manchada para asegurarse de que la rutina de enfoque automático tiene suficiente rango Z para encontrar el enfoque. Si es necesario, utilice el panel Autofocus para aumentar el rango de enfoque y aumentar el número de pasos de enfoque.
Un tercer condicion posibleIon que puede conducir a un enfoque deficiente es una fuente de luz inestable o parpadeante, que puede interrumpir la puntuación de enfoque calculado para una altura Z específica. Las bombillas halógenas de tungsteno tienden a parpadear bien antes de que los bulbos se quemen. El efecto de un enfoque deficiente se observa en un ejemplo en el que las curvas de crecimiento se sumergen entre el primer y segundo puntos temporales ( Figura 5A ), mientras que el punto adyacente no tiene la misma inclinación ( Figura 5B ). En este caso, la mala condición de enfoque se alivió reemplazando la fuente de luz halógena de tungsteno.
En la práctica, los autores han encontrado que para reducir el parpadeo de bulbos halógenos de tungsteno de 100W, los bulbos necesitan ser reemplazados cada 500 horas o aproximadamente cada 2 meses cuando los microscopios están bajo uso intensivo. Para evitar problemas de enfoque deficiente de una bombilla parpadeante, reemplace la fuente de luz halógena de tungsteno a menudo o reemplace la bombilla halógena con una fuente de luz de diodo. UnEl ejemplo de un conjunto de datos que muestra una baja variación en los tiempos de duplicación así como tiempos de retraso más uniformes se muestra en la Figura 6 . Este conjunto de datos se tomó con un iluminador de diodo que proporciona una iluminación más estable con el tiempo mientras se realiza el autofoco.
Aunque muchos de los puntos mencionados aquí para optimizar la preparación de los medios pueden parecer obvios, en la literatura la mayoría de las pantallas a gran escala no se replican bien entre sí 8 , 11 . Por lo tanto, hemos descrito cuidadosamente la preparación de cultivos y medios de agarosa para que se puedan generar pantallas fenotípicas más reproducibles.
El ensayo ODELAY está actualmente limitado en rendimiento cuando se compara con ensayos basados en fijación tales como matrices genéticas sintéticas o el análisis Scan-O-Matic. Aunque estos métodos aumentan el número de cepas que se miden, carecen de la capacidad de resolver células individuales aNd por lo tanto no puede medir la heterogeneidad de la población que observamos dentro de las cepas clonales de levadura. El origen de esta heterogeneidad de la población no se entiende actualmente, pero la fusión de la tecnología y la computación como se demuestra aquí ofrece una oportunidad para abordar objetivamente los mecanismos celulares subyacentes [ 12] .
Los autores desean notar que ODELAY actualmente sólo está optimizado para una marca de microscopio y tipo de cuerpo específicos. Modificar ODELAY para otros sistemas del microscopio es directo pero requerirá conocimiento de la fuente abierta API 13 . Sin embargo, tanto la API como los scripts ODELAY se escriben para adaptarse fácilmente a diferentes sistemas y ensayos experimentales.
Mientras ODELAY fue desarrollado originalmente para la levadura, hemos sido capaces de utilizarlo sin modificación para observar el crecimiento de Mycobacterium smegmatis . La observación de los otros microorganismos formadores de colonias esPosible con modificaciones del código fuente proporcionado 11 . En general, ODELAY es una herramienta poderosa y flexible para comparar microorganismos cultivados bajo diferentes condiciones ambientales y perturbaciones genéticas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores reconocen el apoyo a este trabajo por las subvenciones U54 RR022220 y P50 GM076547 a JDA de los EE.UU. National Institutes of Health. FDM es un becario postdoctoral de los Institutos Canadienses de Investigación en Salud. También damos las gracias al Centro de Biomedicina de Sistemas de Luxemburgo ya la Universidad de Luxemburgo por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| Agarose UltraPure | ThermoFisher | 16500500 | Gel Temp 36C, Gel Strength (1%) 1.2 g/sq cm |
| Yeast Extract Peptone (YEP) | Fisher Scientific | BP1422-2 | |
| Complete Suplement Mixture (CSM) | Fisher Scientific | MP114560222 | |
| Polyethylene Glycol 3350 (av. mol. wt. 3000-3700) | SigmaAldrich | P2906 | |
| Yeast Strain BY4741 | ThermoFisher | 95400.BY4741 | |
| Yeast Strain BY4742 | ThermoFisher | 95400.BY4742 | |
| 50 mL Falcon tubes | Corning | 430291 | 1 case |
| 15 mL Falcon tubes | Corning | 352096 | |
| 2 x 3 inch 1.0 mm thick slides 1/2 gross | VWR | 48382-179 | |
| 96-well plate flat bottom | Corning | 353072 | |
| Hydra liquid handleing robot | Thermo | 1096-DT-100 | |
| Hamilton Microlab Star Liquid Handleing Robot | Hamilton | ||
| hydra 100 mL tips Extended Length DARTS | Thermo | 5527 | |
| Synergy H4 Plate Reader | Biotek | H4MLFAD | |
| Leica DMI6000 B Microscope | Leica | ||
| Leica 10X/0.3NA objective | Leica | 11506289 | |
| Hamamatsu ORCA Flash 4.0 Camera | Hamamatsu | C11440-22CU | |
| MATLAB with image processing tool box | Mathworks | ||
| MicroManager | Open Imaging | https://micro-manager.org/ | |
| ODELAY Microscope Control (MATLAB scripts and GUI) | www.aitchisonlab.com\ODELAY for Matlab scripts and software | ||
| ODELAY Microscope Chamber | www.aitchisonlab.com\ODELAY for Mechanincal Drawings | ||
| ODELAY Agar Molds | www.aitchisonlab.com\ODELAY for mold drawings |
Referencias
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van't Riet, K. Modeling of the bacterial growth curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Sellick, C. A., Campbell, R. N., Reece, R. J. Galactose metabolism in yeast-structure and regulation of the leloir pathway enzymes and the genes encoding them. Int Rev Cell Mol Biol. 269, 111-150 (2008).
- Yoshikawa, K., et al. Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res. 9 (1), 32-44 (2009).
- Bryan, A. K., Goranov, A., Amon, A., Manalis, S. R. Measurement of mass, density, and volume during the cell cycle of yeast. Proc Natl Acad Sci U S A. 107 (3), 999-1004 (2010).
- Baryshnikova, A., et al. Quantitative analysis of fitness and genetic interactions in yeast on a genome scale. Nat Methods. 7 (12), 1017-1024 (2010).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327 (5964), 425-431 (2010).
- Collins, S. R., et al. Functional dissection of protein complexes involved in yeast chromosome biology using a genetic interaction map. Nature. 446 (7137), 806-810 (2007).
- Zackrisson, M., et al. Scan-o-matic: High-Resolution Microbial Phenomics at a Massive Scale. G3 (Bethesda). 6 (9), 3003-3014 (2016).
- Bean, G. J., Jaeger, P. A., Bahr, S., Ideker, T. Development of ultra-high-density screening tools for microbial 'omics'. PloS One. 9 (1), e85177 (2014).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS Biol. 10 (5), e1001325 (2012).
- Herricks, T., et al. One-Cell Doubling Evaluation by Living Arrays of Yeast. ODELAY! G3 (Bethesda). 7 (1), 279-288 (2017).
- Mast, F. D., Ratushny, A. V., Aitchison, J. D. Systems cell biology. J Cell Biol. 206 (6), 695-706 (2014).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. J Biol Methods. 1 (2), e10 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados