Method Article
ODELAY:酵母増殖の多パラメータ定量化のための大規模法
要約
私たちは、個々の酵母細胞の成長表現型を、酵母(ODELAY)の生存アレイの1細胞倍加評価と称する経時的顕微鏡法を用いて固体培地上でコロニー中に増殖させる際に定量する方法を提示する。コロニーに成長する遺伝的に同一の細胞の集団の異種性を直接観察および定量することができる。
要約
微生物の増殖表現型は、それらの根底にある遺伝的適応性の強い指標であり、3つの成長レジーム、すなわち、ラグ期、対数期、および定常期に分離することができる。それぞれの成長段階は、様々な環境および遺伝的条件に関連する適応性の異なる側面を明らかにすることができる。 3つの成長段階すべての高分解能および定量的測定は、一般に入手が困難である。ここでは、酵母の生きた配列(ODELAY)の1細胞倍加評価と呼ばれるアッセイを用いて、固体培地上の3つの成長段階のすべてを特徴付ける詳細な方法を提示する。 ODELAYは、時間経過顕微鏡法を用いて固体培地上でコロニーに成長する個々の細胞の増殖表現型を定量化する。この方法は、コロニーに成長する遺伝的に同一の細胞における各成長パラメータでの集団の異質性を直接観察することができる。この集団の異質性は、遺伝的および後成的な調節を理解するためのユニークな視点を提供し、遺伝的および環境的摂動。 ODELAY法は酵母を用いて実証されているが、明視野顕微鏡法で見える任意のコロニー形成微生物に利用することができる。
概要
微生物の増殖表現型は、所与の環境条件に対するそれらの根底にある遺伝的適合性の強力な指標である。成長は、古典的に3つの異なる成長レジーム、すなわち、ラグ期、対数期および定常期の成長に分けられる。各成長段階は、様々な環境および遺伝的条件に依存する適応性の異なる側面を明らかにすることができる。例えば、生物が指数関数的増殖の開始前に遅滞期に費やす遅れ時間または時間は、変化した環境条件に応答する生物の能力を示すことができる2 。対数増殖期の2倍の時間、最も一般的な細胞適合度は、複製に環境物質を代謝および利用することによって分裂する生物の全体的な効率を明らかにする。対数期後の成長が急速に減少する定常期は、適格性のもう一つの指標であり、定期的スポットベースの酵母増殖アッセイにおいて成長エンドポイントとして使用される。
現在、いくつかの酵母増殖アッセイが利用可能であり、酵母3,4,5における増殖表現型を評価するための標準的な方法と考えられている。これらのアッセイは、主として固体培地または液体培地のいずれかで酵母を成長させる方法に基づいている。固体培地では、コロニーピニングアッセイは、ピンを用いて固体寒天上に少数の細胞を移動させ、酵母細胞を一定期間増殖させる。次いで、コロニーを画像化し、それらのサイズを終点のエンドポイント6で比較する。これらのコロニーピニングアッセイは、ゲノムワイドスクリーンを生成するために堅牢でスケーラブルであることが証明されている。より最近では、フラットベッドスキャナーおよびSLR(Single Lens Reflex)カメラを用いた周期的な画像化が、これらのアッセイに組み込まれて、時間の経過とともにコロニーの成長が記録される7,8、 9 。しかしながら、これらの装置の分解能は、それらが単一細胞を検出することを妨げ、したがって、これらのコロニー固定アッセイは、ラグタイムを直接観察せず、コロニーに成長する個々の細胞間の変異を観察することができない。
ゲノムワイドスクリーンを行うために、液体ベースの成長アッセイも採用されている3 。液体成長アッセイを経時的顕微鏡と組み合わせることにより、遺伝的に同一の個々の細胞の倍加時間における集団の異質性が明らかとなり、これは遺伝的調節および環境適応を理解するための重要な視点を提供する。しかしながら、このアッセイは、ラグタイムおよびキャリー能力などの成長の他の側面を測定しない。ここでは、ODELAY 11と呼ばれるアッセイを用いて、固体培地上のコロニー形成微生物の3つの成長段階のすべてを特徴付ける方法を提示する。 ODELAYはutiliで構成されていますハイスループットの時間分解顕微鏡を用いて固体培地上のコロニーに成長する単一細胞の画像を記録する。コロニーに成長する個々の細胞のこの集団は、基礎となる集団の異種性を明らかにするが、これは、終点のエンドポイントのスコアリングなどの他の感度の低い測定によっては検出されない。私たちは酵母でこの方法を実証していますが、ODELAYは明視野顕微鏡検査でコントラストを示す生物に適用されるかもしれません。
プロトコル
1.アガロースゲルストックの調製
- 2gの高純度アガロースを秤量する。
- アガロースを500 mLのビンに加え、それらの合計質量を記録する。
- ボトルの目標質量と2gのアガロースと150gの超純水を計算し、次に150gの超純水をこの目標質量の0.1g以内に加える。
- ボトルの質量とアガロースと水に注意してください。
- 瓶を電子レンジに置き、アガロースを加熱しながら水の蒸発を最小限に抑えるために、ボトルをゆっくりとしたキャップで覆ってください。
- ボトルを15〜20秒間バーストしてマイクロ波を照射し、次にボトルを短く旋回させてアガロースと水を混合します。溶液が沸騰し、混合物が均質になるまで、この手順を繰り返します。
注意:ボトルから蒸気が漏れるのを避け、皮膚を傷つけないように注意してください。また、ボトルは触っても熱くなり、けがをしないようにオートクレーブの手袋などの適切な保護が必要です。 - 溶融したアガロースが均一になった後、再びボトルの重さを量り、元の質量の0.1g以内に超純水を加える。これは、蒸発によって失われた水を置き換えます。
- 溶融したアガロースが凝固する前に、添加された水に渦巻き混ぜて均一性を確保します。
- アリコート15.2gのアガロースを9〜50mLのプラスチックチューブに分注する。
- 必要になるまでチューブを冷やす。
2. ODELAYアガロース培地の調製
- 400mLの脱イオン水を加熱し、電磁攪拌棒を用いて穏やかに撹拌しながらホットプレート上で覆われたビーカー中で沸騰させる。
- ステップ1.10からの50mLコニカルチューブ中の15.2gのアガロースのアリコートに10mL培地( 例えば 、酵母抽出ペプトン(YEP)または完全補充混合物(CSM))2mLを加える。
注:CSM培地はスライドガラスにくっつく傾向があります。 CSM培地配合物を使用する場合、5μLの50重量%ポリエチレングリコール(PEG)を滅菌水に培地配合物に加える。 PEGは、ガーゼは、離型時にスライドガラスに付着するのを防ぎ、酵母の増殖を阻害しない。 - 必要に応じて100Xの栄養補助食品を追加し、水を使用してこのステップからの合計添加量を1mLにします。
- ステップ2.1の沸騰水に50 mLコニカルチューブを入れる前に、培地とサプリメントを加えてアガロースのアリコートを計量してください。
- 16分後、50mLチューブを取り出し、ボルテックスを用いて混合物をホモジナイズする。キャップを50 mLコニカルチューブにしっかりと締め付けてください。
注:ビーカーの蓋は、チューブ全体を均一に加熱するのに役立ちます。そうしないと、固体アガロースのフィルムが形成され、溶解しないことがあります。この間にも、アガロースモールドを組み立てると便利です( 図1 )。 - ボルテックスを用いて混合物を均質化する。
- すべての寒天が混和して溶けていることを確認するためにさらに2分間煮沸する。
- チューブを秤量し、失われた質量を超純粋な滅菌水で置き換えます。
- 2×10×炭素 - サワー( 例えば 、20%w / vグルコース)に溶解し、ボルテックスしてアガロース培地溶液を得る。
注:ガラススライドの分離:金型を組み立てるときは、長いスペーサが正しい向きで金型にセットされているかどうかを確認する必要があります。これは、レーザーがアクリルを切断するので、正確に90°の辺ではなく、わずかに角度のついた辺を持つ部分を残す円錐として切断する傾向があるからです。次に、金型を卓上に置き、ガラスを寒天から解放するとき、スペーサーの縁は寒天と鋭角にすべきである。鋭角は、モールドスペーサーの外側エッジが下側エッジ( 図1参照)の周りに旋回するので、寒天のエッジをガラスの上部から離すのに役立ちます。その結果、ガラスの一片から寒天がより一貫して分離される。
注:オイル、シリコンスプレー、または市販の窓処理剤などのガラスに塗布された離型剤は、それらを汚染するため使用しないでください寒天の表面に付着し、おそらく増殖を阻害する。これらのメソッドは、一貫性を保つためにいくつかのプラクティスを取ります。 - 2インチ×3インチ×1インチ×厚さ1mmの4枚のガラススライドを70%エタノールで洗浄し、強制空気を用いて乾燥させる。
- 70%エタノールできれいなアクリルモールドを乾燥させ、 図1のように組み立てます 。図のように3つの底部を持ち、2つの同じ部分が3番目の部分を挟むように組み立てます( 図1B )。 2つの小さなバインダークリップ( 図1C )を使用して、両側のベースピースを締めます。レーザー切れが正しく配置されていることを確認して、直立をモールドに置きます ( 図1E )。
- 清潔で乾燥したスライドガラスを金型に置き、反対側に2番目のガラススライドを置きながら所定の位置に保持します。大きなバインダークリップでアセンブリをクランプします( 図1D )。大きなバインダークリップで両方のスライドをクランプします(lass = "xfig">図1D)。上部のバインダークリップがアクリルと重なっているガラススライドに接触していることを確認します。
- 残りのバインダークリップを追加します。再び、クランプがアクリルと重なっているスライドに接触することを確認します( 図1D )。
注記:組み立てた金型に溶融寒天を充填する前に、金型の内側に沿って約70μLの溶融寒天培地をピペッティングすることによって、端がシールされていることを確認してください。この寒天はすぐに凝固して漏出を防ぎます。 - 溶融寒天で金型を満たし、金型内に気泡を閉じ込めるのを避けてください。
注:これは、金型の端に沿って溶融寒天をゆっくりピペッティングすることによって達成できます。それが満たされた後、約23℃の周囲温度で金型を40分〜1時間冷却する。長時間冷却することができれば、寒天は型内で破砕することがある。
注:金型の分離:キャストされた寒天から金型を適切に取り外すことは、均一な固体を確保する上で不可欠です酵母増殖のための寒天パッド。この段階での金型の効率的な分離を保証しなければ、固体寒天パッドの不完全性に起因する成長の差異が生じる。このステップを数回練習することをお勧めします。 - まず、下のバインダークリップを取り外します。 3つのピースからなる金型の底部を取り外します。スライドを圧縮して保持し、バインダークリップを取り外します。バインダークリップを外している間は金型面にぶつからないように注意してください。これにより、メディアが変形します。
- 金型を青いドットのある面が上を向くようにベンチトップの端に置いてください( 図1E )。アクリルの下に親指を置き、上の最初の指をモールドの内側の端に向けます。
- モールドスペーサーをその下縁部の周りに旋回させるように、ゆっくりと注意深く親指でモールドを押し上げます( 図1F )。定数を適用するゆっくりと圧力を増加させる。ユーザーは、上部ガラスがモールドスペーサを覆っているラインに沿ってブレークし、気泡が現れます。
- 最初のブレークラインを見た後、親指で押し続け、一定の圧力を加えます。この時点で、寒天はガラスから裂け始めるはずです( 図1F )。モールドを上方に旋回させ続けます。ガラスを滑らせることなくガラスを持ち上げます。寒天がガラスから剥がれている線は、最初の破断線から離れるように移動し続けるはずです。
注:この時点で、寒天はガラスの底部と上部の両方に粘着しています。これは時には左端で発生します。変形した領域が酵母が見つかった領域にない限り、これはうまくいくはずです。 - ガラスは完全に自由になるので、それをつかんで型から完全に取り除きます。同様のモーションを使用して他のモールドピースを取り外し、寒天を動かさずにピースを自由に持ち上げます。スライドを底に滅菌高純度水を入れた滅菌チップボックス。次の日に使用するために、箱を閉じて4°CO / Nで保管してください。より長期間保管すると、成長率に矛盾が生じます。
3. ODELAY文化の準備
- O / N増殖のために96ウェルプレートに株を配置する。
- 翌日、一晩培養した20μLを200μLの培地に希釈し、新しいプレートの全容量220μLにします。
- プレートリーダーで各培養液の600 nm(OD 600)での光学密度を測定する。プレートリーダーと液体ハンドリングロボットを使用して、3.3.1〜3.3.6の自動希釈プロトコールに従います。プレート中の培養液を手動で約0.1 OD600(オプション)に希釈する。
- プレートリーダーで、「新規作成」の下の「実験」を押します。 ODELAYDilution.expを選択し、実験を実行します。実験名をODELAY「日付」「時間」「実験名」の繰り返しとして入力します。
- のをクリックしてtatisticsタブをクリックし、Excelアイコンをクリックします。データをサムドライブに保存し、液体ハンドリングロボットコンピュータに転送します。
- ロボットのレイアウトとメソッドエディタを開きます。メソッドファイル "ODELAYDilution_v1.med"を開きます。実行ファイル "Convert_SynergyFiles.exe"を実行します。目標OD600に0.09を入力します。
- "Glu Correction"と "Gal Correction"をクリックすると0.05になります。同じプレートの空のメディアを測定する。 "Generate File"をクリックしてください。メソッドエディタでファイルを選択します。ストップライトのアイコンをクリックしてランタイム希釈プログラムを開く方法を開始します。
- チューブのキャップを外し、プレートに蓋をはずし、ダストカバーをチップから取り外します。デッキのレイアウトに示されているように、プレート、チューブ、チップを液体ハンドリングロボットのデッキにロードします。
- 希釈プログラムを実行するには、「再生」ボタンをクリックします。正しい50μLのチップ数を選択してください。 300μLのヒントの正しい数を選択してください。お待ちくださいプロセスが実行されるまで12分。
- ロボットから希釈プレートを取り出し、チップを覆い、15 mLの培地チューブをまとめます。プレートを30℃で5〜6時間培養する。
- 2回目の希釈を開始する約1〜2時間前に、顕微鏡のインキュベーションチャンバーを必ずオンにしてください。実験に必要な温度または温度で平衡させる。
- 希釈ステップ3.3~3.4を繰り返すが、培養物をアガローススライド上でスポットするために0.01~0.02のOD600に希釈する。
- 希釈プレートを金属製のフリーザーシールで覆います。
- 希釈プレートを氷浴中で30秒間、プレートを氷水中に浮遊させ、プレートを保持するための遠心分離金属バケットフィッティングを使用して超音波洗浄する( 図2A )。希釈プレートから音波処理した培養液を平底プレートに移す。 4×96ウェル平底プレート1,2,3および4に標識する( 図2B )。
- 転送150&ウェルA01〜D06から希釈プレートの#181; Lをプレート1のウェルC04〜F09に移す。次いで、150μLの希釈プレートをウェルA07〜D12からプレート2のウェルC04〜F09に移す。次いで、150μL希釈プレートのウェルC04〜F09へのウェルE01〜H06からの希釈プレートのウェルE07〜H12からの希釈プレート150μLを、プレート4のウェルC04〜F09に移す。
- 手順4のAgar Spottingに進みます。
4.自動液体スポッティングロボットを用いた寒天上でのスポッティング
- 加湿滅菌ピペットボックスから4°CO / N(ステップ2.19から)で保存したアガローススライドを取り除きます。
- 必要に応じて、クリーンなカミソリの刃でアガロース培地のコーナーをトリムし、スライドチャンバーに収まるようにします。
- スライドクランプをマウントから取り外します。寒天プレートを慎重にステージチャンバーマウントの窪んだ領域に置きます。
注:またはスライドの表示は、実験から実験まで一貫しています。 - クランプがチャンバーの底面と同じ高さにあることを確認してください。曲がっている場合は、スライドが凹んだ部分に完全に装着されていない可能性があります。スポッティングロボットの中央プレート位置にレベリングスペーサーを置きます。このスペーサーは、スライドチャンバーが先端で平らになるように、レベリングスクリューとの接触を提供する。
- プレートを四分円の順にテーブルの上に置きます。プレート1,2,3および4は、左から右に順序づけられている( 図2B )。
- 内側の24ウェルC04〜F09が4つの空のチップボックスにチップで埋まるようにチップを配置します。 5番目のボックスには、C10の位置に1つの先端と、A01、A12、H01、およびH12の位置で端が切り取られた4つの先端が必要です。これらの4つのカットオフチップは、チッププレートクランプの安定性を提供します( 図2C および2D )。
- slからトップカバーを取り外しますideチャンバマウント。
- 最初のチップパンチをロボット制御スポットプログラムの開始位置に配置します。これは、後で原点座標を整列させるために使用されるアガロースに穴をあける必要があります。プレート1を液体ハンドリングロボットに載せて、第1象限を見つけます。蓋が外されていることを確認し、スポッティングプログラムを続行します。
- すべてのスポットが存在することを確認してください。また、乾燥するまで30秒待ってください。スポットの直径が約1mmである場合、プログラムは継続することができる。バイオハザード容器に使用済みのチップを空にして、ロボットに新しい先端を置きます。プレート1を2象限プレートに交換します。
- 第3象限について繰り返す。 第 4象限でもう一度繰り返す。
- スポットが乾いたら、スライドチャンバーのカバーを元に戻し、装置を裏返しにします。
- エアーフィルタを使用して配管接続を取り付けます。
- チャンバーの上面にスライドガラスを置きます。
注:このスライドは縮小のために重要です熱フラックスを寒天に添加し、チャンバーの対物カバースリップ側への結露の形成を最小にする。このカバースリップを忘れないでください。顕微鏡の構成に応じて、このカバースリップは、照明側からの加熱が対物レンズ側に結露を生じさせないようにする。 - 熱い空気をチャンバの対物側に吹き付けるファンを配置します。このファンは、カバースリップに結露が形成されるのを防止します。バブラーを通る空気流量を10 mL / minに設定します。
5.顕微鏡でODELAYを実行する
- スクリプト "ODELAY_Microscope_Control.m"を実行します。
- 「シャッター」をクリックして送信された光シャッターを開き、「フォーカス」ボタンを押して高いカメラレートを開始します( 図3A 、赤い矢印)。
- "Go Origin"をクリックしてステージを動かし、寒天に穿孔された原点マークを見つけます。
- 次に、右に少し動いて領域E07に見られる酵母細胞に焦点を合わせる。
- 原点パンチに戻って視野の中心に移動します。
- 「設定」ボタン( 図3A 、青い矢印)を押して原点をこの値に設定します。次に、位置H18に移動し、その位置に最も近い六角ネジを使用してフォーカスを合わせます。次に、位置L07に移動し、その位置に最も近い六角ねじを使用して焦点を合わせます。次に位置E07に移動し、その位置に最も近い六角ネジを使用してフォーカスを合わせます。
- それらの位置が焦点に留まるまで、必要に応じてステップ5.5〜5.7を繰り返します。
- スポットE12、H12、L12の中央と端のピントを確認してください。 Z値で示されるフォーカスZ値が±オートフォーカス範囲よりも大きい場合は、オートフォーカス範囲を調整します( たとえば 、±スポットよりも大きい中心点のZ値を60μmに設定します40μm)。
- リセットボタンを押すと、ボタンのプロパティが有効になります。ODELAY( 図3A 、緑色の矢印)。データを保存するディレクトリを選択します。十分なドライブスペースがあることを確認してください。
注:顕微鏡は48時間またはプログラムが終了するまでデータを収集します。
6. ODELAYデータの処理
- ODELAY_IPT.exeを開くか、スクリプトODELAY_Image_Processing_Tool_v7.mスクリプトを使用します( 図3C )。
- * ODELAYExpDisc.xlsxスプレッドシートを用意してください。
- セルの名前をB1とします。
- イメージファイルE07 - H18が格納されているイメージディレクトリを選択します。
- データが書き込まれるデータディレクトリを選択します。
- セルB04に実験が開始された日付を記入してください。 MM / DD / YYYYの形式を使用します。
- 希釈時間をセルC04に書き込んでください。この時間は、最初の画像が収集される約5分前です。 HH:MMpmの形式を使用してください.HHはh、MMは分です。
- tに従って系統名を追加するoソースプレート(ステップ3.1)。菌株が検出される方法のために、それらはODELAYアガローススライド上に再配置される。スプレッドシートB31-B126の細胞はソースプレートであり、細胞C31-C126はODELAY寒天プレートのスポット位置である。
- その後、 "Process Data"ボタンを押して、準備された* ODELAYExpDisc.xlsxを選択します。
- データの処理に使用したコンピュータシステムによっては16〜24時間待ってください。
- イメージが処理されると、「ODELAY Well Data」という名前のディレクトリと「* _Index_ODELAYData.mat」というファイルが表示されます。 "Load Data"ボタンを押して、生成されたばかりの "* _Index_ODELAYData.mat"ファイルを選択します。これで、処理されたばかりのデータセットがロードされます。ファイル名の「*」は、Excelスプレッドシートに入力された実験名に従って表示されます。
- データを読み込んだ後、タイムバーを使って点検し、画像の四角をクリックして拡大曲線f左のリストに興味のある井戸を見つけて、そのリストの画像をロードしてください。
- "Violin Plot"ボタンを押して、人口増加パラメータのヒストグラムを生成します。これにより、 図4または図6に示すプロットが生成されます 。
結果
タイムラプス顕微鏡法で増殖する酵母の例示的な画像を図3Bに示す。時間経過画像を処理した後、酵母株BY4741およびBY4742を比較する代表的なデータセットを図4に示す。この例のデータセットでは、プレート上の異なる位置の間の倍加時間にはほとんど変化がありません。アガロース培地が十分に調製されていない場合、アガロースゲルの変形領域と一致するスポット位置において、倍加時間および遅延時間の両方の明らかな偏差が明らかであろう。倍加時間は比較的均一であるように見えるが、この実施例は遅延時間測定の変化を示す。より一貫性のあるデータセットを図6に示します 。このデータセットでは、ラグタイムとダブリングタイムの両方が均一です。
files / ftp_upload / 55879 / 55879fig1.jpg "/>
図1:寒天モールドアセンブリ。
寒天鋳型の成分を( A )に示す。 ( B )に示すようにベースを組み立て、小さなバインダークリップでベースを固定します。より長い垂直の部分をベースのキャビティ( C )に置き、( D )に示すようにスライドを金型にキャンプキャンプします。スライドガラス( E )からの寒天の一貫した分離に必要な金型の角度および型切れの方向を示す側面図。親指と人差し指の位置、および寒天の直線をスライド( F )から分離し、水平の矢印に注意してください。分離線は、垂直の矢印の方向に均等に移動する必要があります。 この図の拡大版を見るには、ここをクリックしてください。
= "jove_content" fo:keep-together.within-page = "1"> 
図2:音波処理およびスポッティング法。
プレートを氷水中で超音波処理し、プレート( A )を支持するために遠心分離バケットホルダーを使用する。アガロースプレート( B )上にスポッティングするために、3.8.1のステップのプレートを置きます。また、チップの最左端にC10の位置にチップが1つ、他の4つの先端が切断されてプレートホルダー( C )が破損しないようにヒントを配置します。内側の24の先端位置が占有されるように残りの先端を4つのボックスに配置する( D )。 この図の拡大版を見るには、ここをクリックしてください。
55879fig3.jpg "/>
図3:ODELAYグラフィカルユーザインタフェース。
"ODELAY_Microscopecontrol.m"( A )のグラフィカルユーザーインターフェイスのスクリーンショット。このインターフェースは、カメラの監視を可能にし、落射蛍光及び明視野モードの顕微鏡照明設定を調整する。赤い矢印は、カメラを起動して画像をすばやく取得し、送信された光シャッターを開くための[フォーカス]ボタンと[送信]ボタンを示しています。青い矢印は、原点のステージを移動させ、「原点移動」ボタンと「設定」ボタンを使用して原点を設定するために使用されます。緑色の矢印は「リセット」と「ODELAY !!!」を指します。 ODELAY画像モードを現在の状態にリセットし、ODELAY画像収集を開始するボタン。スポッティング後0,3,6、および9時間で固体培地上で増殖する酵母の経時的画像( B )。 "ODELAY_IPT.m"またはthのグラフィカルユーザーインターフェイスのスクリーンショットイメージ処理ツール( C )。 この図の拡大版を見るには、ここをクリックしてください。

図4:ODELAY出力の例
このデータセットは、YPD培地上のBY4741株およびBY4742株を比較する。この図は、十分に調製されたアガローススライドの例である。しかし、オートフォーカスの設定は最適ではありません。各列には、左から右に提示されるデータは次のとおりです。倍加時間、分で与えられる;遅れ時間は、minで与えられる。この例では、寒天スライド上のすべてのスポットの倍加時間は、カラムに向かう少量の倍加時間を伴って上がります。しかし、このデータセットでは、遅延時間がかなり異なる。_upload / 55879 / 55879fig4large.jpg "target =" _ blank ">この図の拡大版を見るには、ここをクリックしてください。
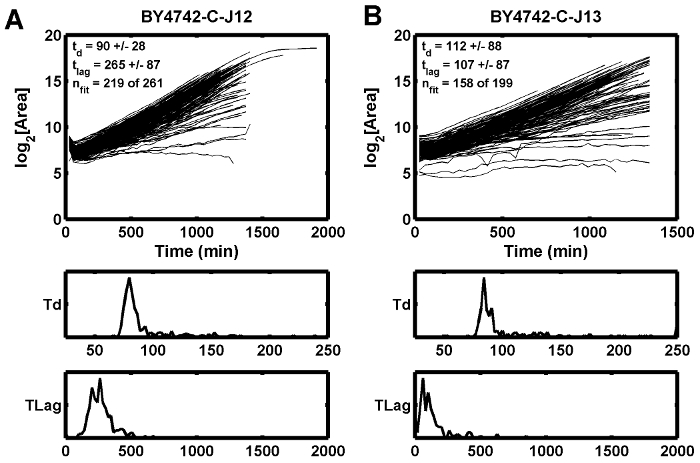
図5:成長曲線の例
この例は、不十分な初期焦点が、どのように隣接する位置がより短い遅延時間( B )を示す一方で、推定遅延時間(t lag )を増加させる( A )かを示す。 t dは分単位の倍加時間であり、t lagは分単位の遅延時間である。 この図の拡大版を見るには、ここをクリックしてください。
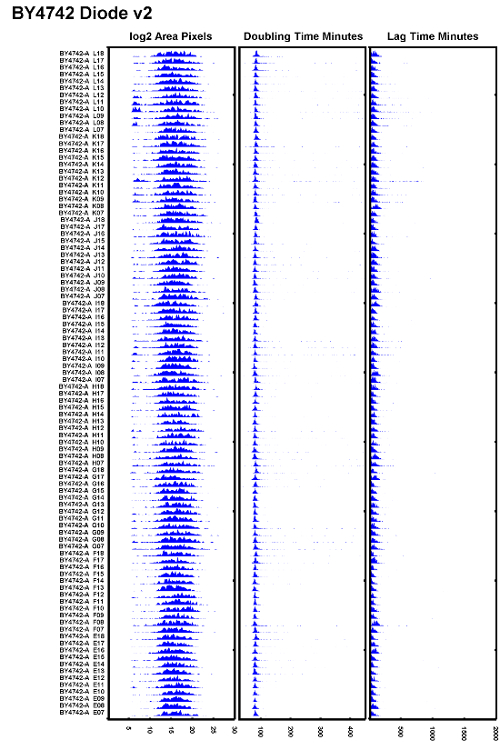
図6:よく実行されたテスト実験の例
電子タングステンハロゲンバルブをダイオードイルミネータに交換し、オートフォーカスが正しく設定されていることを確認した後に試験されたBY4742株の一例。すべての倍加時間はよく重なるように見え、遅れ時間は一貫しているように見える。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
ODELAYアッセイは、再現可能で信頼できる表現型測定を確実にするためにいくつかの重要な点を有する。第1の重要な点は、酵母培養物の一貫した調製である。酵母細胞を対数増殖から収穫するように注意しなければならない。培養物が飽和していると、それらの集団の異種性が増加し、遺伝的または環境的( 例えば、炭素源)因子11によって引き起こされる異質性を不明瞭にすることがある11 。第2の重要な点は、メディアの一貫した準備です。一般に、多量の10倍ストック培地溶液を生成し、経時的に使用してバッチ効果を最小限に抑える必要があります。可能であれば、培地を重量で処方することは、寒天の密度およびアガロースの全水分含量を注意深く監視することによって、時間の経過とともに培地の一貫性を改善するのに役立つ。第3の重要な点は、アガロースの機械的変形を最小化または排除することである直径培地の機械的変形は、ガラススライドからのアガロースの分離中に最も一般的に起こる。多くの実験技術と同様に、このステップを習得するためには練習が必要です。
図4に示すラグタイムの変動は、アガロース培地の機械的変形、寒天の厚さの変化、または不安定な光源の3つの要因の1つに関連することがよくあります。アガロース媒体がスポットアレイ内でZ高さが変化する場合、高さの変動はオートフォーカスルーチンの範囲を圧倒し、初期画像にわずかに焦点が合わないことがあります。このため、中央の複数のスポットで、フォーカスされたアレイのエッジに沿ってフォーカスの高さを確認し、オートフォーカスルーチンがフォーカスを見つけるのに十分なZ範囲を持つことを確認します。必要に応じて、オートフォーカスパネルを使用してフォーカス範囲を広げ、フォーカスのステップ数を増やします。
3番目に可能な条件イオンは、不安定またはちらつきのある光源であり、特定のZ高さについて計算された焦点スコアを乱す可能性があります。タングステンハロゲン電球は電球が燃える前によくちらつく傾向があります。弱い焦点の効果は、第1および第2の時点( 図 5A )の間に成長曲線がディップし、隣接する点が同じディップを有さない( 図 5B )一例で観察される。この場合、タングステンハロゲン光源を交換することにより、不十分な焦点条件が緩和された。
実際には、100Wのタングステンハロゲン電球のちらつきを低減するためには、顕微鏡を大量に使用している場合、電球を500時間ごとまたはおよそ2ヶ月に1回交換する必要があることが実証されている。ちらつき球からのフォーカスの問題を避けるため、タングステンハロゲン光源を頻繁に交換するか、ハロゲン球をダイオード光源に交換してください。アン倍加時間のばらつきが小さく、より均一なラグタイムを示すデータセットの例を図6に示します 。このデータセットは、オートフォーカスを実行しながら時間の経過とともにより安定した照明を提供するダイオードイルミネータで撮影されました。
文献では、メディアの準備を最適化するためにここで述べた多くの点が明白であるように見えるかもしれませんが、最も大規模なスクリーンはお互いにうまく複製しません8,11。したがって、より再現性のある表現型のスクリーニングが生成されるように、我々は培養およびアガロース培地の調製を注意深く記述した。
ODELAYアッセイは、現在のところ、合成遺伝子アレイまたはScan-O-Maticアッセイなどのピニングに基づくアッセイと比較した場合、スループットが制限されている。これらの方法は、測定される菌株の数を増加させるが、個々の細胞を分解する能力が欠如しているしたがって、クローン酵母株内で観察される集団の異種性を測定することはできない。この集団の異質性の起源は現在理解されていませんが、ここに示されている技術と計算の融合は、基礎となる細胞メカニズムを客観的に扱う機会を提供します12 。
著者はODELAYは現在特定の顕微鏡ブランドとボディタイプにのみ最適化されていることに注意したい。他の顕微鏡システム用にODELAYを変更することは簡単ですが、オープンソースAPI 13の知識が必要です。しかし、APIおよびODELAYスクリプトの両方は、異なるシステムおよび実験的アッセイに容易に適合するように書かれている。
ODELAYはもともと酵母用に開発されましたが、 Mycobacterium smegmatisの増殖を観察するためにそのまま使用することができました。他のコロニー形成微生物の観察は提供されたソースコードに変更を加えることが可能です。一般に、ODELAYは、異なる環境条件および遺伝的撹乱下で増殖した微生物を比較するための強力かつ柔軟なツールである。
開示事項
著者は何も開示することはない。
謝辞
著者らは、米国国立衛生研究所からのJDAへのU54 RR022220およびP50 GM076547の付与により、この研究の支持を認めている。 FDMは、カナダ研究所の健康研究の博士研究員です。また、ルクセンブルグのシステムバイオメディシンセンターとルクセンブルグ大学のサポートにも感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Agarose UltraPure | ThermoFisher | 16500500 | Gel Temp 36C, Gel Strength (1%) 1.2 g/sq cm |
| Yeast Extract Peptone (YEP) | Fisher Scientific | BP1422-2 | |
| Complete Suplement Mixture (CSM) | Fisher Scientific | MP114560222 | |
| Polyethylene Glycol 3350 (av. mol. wt. 3000-3700) | SigmaAldrich | P2906 | |
| Yeast Strain BY4741 | ThermoFisher | 95400.BY4741 | |
| Yeast Strain BY4742 | ThermoFisher | 95400.BY4742 | |
| 50 mL Falcon tubes | Corning | 430291 | 1 case |
| 15 mL Falcon tubes | Corning | 352096 | |
| 2 x 3 inch 1.0 mm thick slides 1/2 gross | VWR | 48382-179 | |
| 96-well plate flat bottom | Corning | 353072 | |
| Hydra liquid handleing robot | Thermo | 1096-DT-100 | |
| Hamilton Microlab Star Liquid Handleing Robot | Hamilton | ||
| hydra 100 mL tips Extended Length DARTS | Thermo | 5527 | |
| Synergy H4 Plate Reader | Biotek | H4MLFAD | |
| Leica DMI6000 B Microscope | Leica | ||
| Leica 10X/0.3NA objective | Leica | 11506289 | |
| Hamamatsu ORCA Flash 4.0 Camera | Hamamatsu | C11440-22CU | |
| MATLAB with image processing tool box | Mathworks | ||
| MicroManager | Open Imaging | https://micro-manager.org/ | |
| ODELAY Microscope Control (MATLAB scripts and GUI) | www.aitchisonlab.com\ODELAY for Matlab scripts and software | ||
| ODELAY Microscope Chamber | www.aitchisonlab.com\ODELAY for Mechanincal Drawings | ||
| ODELAY Agar Molds | www.aitchisonlab.com\ODELAY for mold drawings |
参考文献
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van't Riet, K. Modeling of the bacterial growth curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Sellick, C. A., Campbell, R. N., Reece, R. J. Galactose metabolism in yeast-structure and regulation of the leloir pathway enzymes and the genes encoding them. Int Rev Cell Mol Biol. 269, 111-150 (2008).
- Yoshikawa, K., et al. Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res. 9 (1), 32-44 (2009).
- Bryan, A. K., Goranov, A., Amon, A., Manalis, S. R. Measurement of mass, density, and volume during the cell cycle of yeast. Proc Natl Acad Sci U S A. 107 (3), 999-1004 (2010).
- Baryshnikova, A., et al. Quantitative analysis of fitness and genetic interactions in yeast on a genome scale. Nat Methods. 7 (12), 1017-1024 (2010).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327 (5964), 425-431 (2010).
- Collins, S. R., et al. Functional dissection of protein complexes involved in yeast chromosome biology using a genetic interaction map. Nature. 446 (7137), 806-810 (2007).
- Zackrisson, M., et al. Scan-o-matic: High-Resolution Microbial Phenomics at a Massive Scale. G3 (Bethesda). 6 (9), 3003-3014 (2016).
- Bean, G. J., Jaeger, P. A., Bahr, S., Ideker, T. Development of ultra-high-density screening tools for microbial 'omics'. PloS One. 9 (1), e85177 (2014).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS Biol. 10 (5), e1001325 (2012).
- Herricks, T., et al. One-Cell Doubling Evaluation by Living Arrays of Yeast. ODELAY! G3 (Bethesda). 7 (1), 279-288 (2017).
- Mast, F. D., Ratushny, A. V., Aitchison, J. D. Systems cell biology. J Cell Biol. 206 (6), 695-706 (2014).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. J Biol Methods. 1 (2), e10 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved