Method Article
ODELAY: um método em larga escala para a quantificação multiparamétrica do crescimento de fermento
Neste Artigo
Resumo
Apresentamos um método para quantificar fenótipos de crescimento de células de levedura individuais à medida que crescem em colônias em meios sólidos usando microscopia de lapso de tempo denominada, avaliação de dobramento de uma célula de Living Arrays of Yeast (ODELAY). A heterogeneidade da população de células geneticamente idênticas que crescem em colônias pode ser observada e quantificada diretamente.
Resumo
Os fenótipos de crescimento de microorganismos são um forte indicador de sua condição genética subjacente e podem ser segregados em 3 regimes de crescimento: fase de desfase, fase logarítmica e fase estacionária. Cada fase de crescimento pode revelar diferentes aspectos da aptidão que estão relacionados a várias condições ambientais e genéticas. Medições de alta resolução e quantitativas de todas as 3 fases de crescimento geralmente são difíceis de obter. Aqui, apresentamos um método detalhado para caracterizar todas as 3 fases de crescimento em meios sólidos usando um ensaio chamado Avaliação de Duplicação de uma célula de Living Arrays of Yeast (ODELAY). ODELAY quantifica fenótipos de crescimento de células individuais crescendo em colônias em meios sólidos usando microscopia de lapso de tempo. Este método pode observar diretamente a heterogeneidade da população com cada parâmetro de crescimento em células geneticamente idênticas que crescem em colônias. Essa heterogeneidade de população oferece uma perspectiva única para a compreensão da regulação genética e epigenética e respostas aPerturbações genéticas e ambientais. Embora o método ODELAY seja demonstrado com levedura, ele pode ser utilizado em qualquer microrganismo formador de colônias que seja visível por microscopia de campo brilhante.
Introdução
Os fenótipos de crescimento de microorganismos são um forte indicador de sua aptidão genética subjacente a uma determinada condição ambiental. O crescimento é classicamente segregado em 3 regimes de crescimento diferentes: fase retardada, fase logarítmica e crescimento da fase estacionária 1 . Cada fase de crescimento pode revelar diferentes aspectos da aptidão que dependem de várias condições ambientais e genéticas. Por exemplo, o tempo de atraso ou o período de tempo que um organismo gasta em fase de atraso antes do início do crescimento exponencial, pode ser indicativo da capacidade de um organismo responder a condições ambientais alteradas 2 . O tempo de duplicação durante o crescimento da fase logarítmica, a métrica mais comum da aptidão celular, revela a eficiência geral da capacidade de divisão de um organismo ao metabolizar e utilizar materiais ambientais para replicação. A fase estacionária, onde o crescimento após a fase logarítmica é rapidamente reduzida, é outro indicador de aptidão, que é regularUsado como um ponto final de crescimento em testes de crescimento de leveduras baseados em manchas.
Vários ensaios de crescimento de levedura estão atualmente disponíveis e considerados métodos padrão para avaliação de fenótipos de crescimento em leveduras 3 , 4 , 5 . Estes ensaios baseiam-se principalmente em métodos de crescimento de fermento quer em meios sólidos quer em meios líquidos. Em meios sólidos, os ensaios de fixação de colônia transferem um pequeno número de células em agar sólido com um pino e as células de fermento podem crescer por um período de tempo definido. As colônias são então formadas e os seus tamanhos são comparados em um terminal terminal 6 . Esses ensaios de fixação de colônias provaram ser robustos e escaláveis para gerar telas genômicas. Mais recentemente, imagens periódicas usando escaneadores de cama plana e câmeras de reflexão de lente única (SLR) foram incorporadas nestes ensaios para registrar o crescimento de colônias ao longo do tempo 7 , 8, 9 . No entanto, a resolução desses dispositivos os impede de detectar células únicas e, portanto, esses ensaios de fixação de colônia não observam diretamente o tempo de latência e não podem observar variações entre as células individuais que crescem em colônias.
Os ensaios de crescimento baseados em líquidos também foram utilizados para realizar telas 3 do genoma. O acoplamento de um teste de crescimento líquido com microscopia em lapso de tempo revelou heterogeneidade populacional no tempo de duplicação de células individuais geneticamente idênticas, o que oferece uma perspectiva importante para a compreensão da regulação genética e da adaptação ambiental. No entanto, este ensaio não mede outros aspectos do crescimento, como tempo de atraso e capacidade de carga 10 . Aqui, apresentamos um método para caracterizar as três fases de crescimento de microorganismos formadores de colônias em meio sólido utilizando um ensaio que denominamos ODELAY 11 . ODELAY é composto por utiliMicroscópio de lapso de tempo de alto rendimento zing para registrar imagens de células únicas que crescem em colônias em mídia sólida. Esta população de células individuais que crescem em colônias revela a heterogeneidade da população subjacente, que não é detectada por outras medidas menos sensíveis, como a pontuação terminal final. Nós demonstramos o método em levedura, mas ODELAY pode ser aplicado a qualquer organismo que mostre contraste em microscopia de campo brilhante.
Protocolo
1. Preparação do Agarose Gel Stock
- Pesar 2 g de agarose de alta pureza.
- Adicione a agarose a uma garrafa de 500 mL e grave a massa combinada.
- Calcule a massa alvo da garrafa mais 2 g de agarose com 150 g de água ultra pura, em seguida adicione 150 g de água ultra pura até 0,1 g dessa massa alvo.
- Observe a massa do frasco mais a agarose e a água.
- Coloque a garrafa em um microondas e certifique-se de encaixar a garrafa com uma tampa solta na parte superior para minimizar a evaporação da água ao aquecer a agarose.
- Faça o microondas na garrafa em rajadas de 15 a 20 s seguido de rodar brevemente a garrafa para misturar a agarose e a água. Repita este procedimento até a solução estar fervendo e a mistura é homogênea.
CUIDADO: Tenha cuidado para evitar a pele escaldante com o vapor que escapa da garrafa. Além disso, a garrafa ficará quente ao toque e uma proteção apropriada, como uma luva de autoclave, é necessária para evitar lesões. - Depois que a agarose fundida é homogênea, pesa novamente a garrafa e adicione água ultrapura a 0,1 g da massa original. Isso irá substituir qualquer perda de água devido à evaporação.
- Antes de solidificar a agarose fundida, faça um remendo para misturar na água adicionada para garantir a homogeneidade.
- Alíquota 15,2 g de agarose em tubos de plástico de 9 a 50 mL.
- Refrigere os tubos até que seja necessário.
2. Preparando ODELAY Agarose Media
- Aqueça 400 mL de água desionizada para ferver numa taça coberta, em uma placa quente sob agitação suave com uma barra de agitação magnética.
- Adicione 2 mL de meio 10X ( p . Ex ., Peptone de Extração de Levedura (YEP) ou Mistura de Suplemento Completo (CSM)) a uma alíquota de agarose de 15,2 g em um tubo cônico de 50 mL a partir do passo 1.10.
NOTA: O meio CSM tende a manter as lâminas de vidro. Se estiver usando formulações de mídia CSM, adicione 5 μL de polietilenoglicol (PEG) a 50% em peso em água estéril para a formulação do meio. O PEG impede aA partir de colar as lâminas de vidro durante a libertação do molde e não inibe o crescimento da levedura. - Adicione suplementos de nutrientes 100X adicionais, se necessário, e use água para levar o volume total adicionado desse passo para 1 mL.
- Pesar a alíquota de agarose com meios e suplementos adicionados antes de colocar o tubo cônico de 50 mL em água fervente do passo 2.1.
- Após 16 min, retire o tubo de 50 mL e homogeneize a mistura usando um vórtice. Mantenha a tampa presa no tubo cônico de 50 mL.
NOTA: Uma tampa no copo ajuda a aquecer o tubo inteiro de forma uniforme, caso contrário, uma película de agarose sólida irá formar e possivelmente não derreter. Também durante este tempo, é conveniente montar o molde de agarose ( Figura 1 ). - Homogeneizar a mistura usando um vórtice.
- Ferva por mais 2 min para garantir que todo agar seja misturado e derretido.
- Pesar o tubo e substituir qualquer perda de massa com água ultra-pura e estéril.
- Adicione 2 mL de 10X de carbono-azedo(Por exemplo , 20% p / v de glicose) e vortex para obter solução de meio de agarose.
NOTA: Separação de lâminas de vidro: Ao montar o molde, deve-se ter cuidado para garantir que os espaçadores longos sejam colocados no molde com a orientação correta. Isso ocorre porque, à medida que o laser corta o acrílico, ele tende a cortar como um cone deixando a peça com lados ligeiramente angulados em vez de exatamente os lados de 90 °. Então, quando o molde é colocado na bancada para liberar o copo do ágar, a borda do espaçador deve estar em um ângulo agudo com o ágar. O ângulo agudo ajuda a comprimir a borda do ágar longe do pedaço superior de vidro, uma vez que o bordo externo do espaçador do molde é girado sobre a borda inferior (ver Figura 1 ). O resultado é uma separação mais consistente do agar do pedaço superior de vidro.
NOTA: Os agentes de liberação de moldes aplicados nos óleos de vidro, pulverizadores de silício ou até mesmo tratamentos de janelas comerciais não devem ser usados porque contaminam o s Urface do agar e possivelmente inibe o crescimento. Esses métodos levam alguma prática a ser consistente. - Limpe quatro lâminas de vidro de 2 em x 3 em x 1 mm de espessura com 70% de etanol e seque usando ar forçado.
- Limpe os moldes de acrílico com 70% de etanol, seque e monte, como mostrado na Figura 1 . Pegue as três partes inferiores, como mostrado, e montá-las para que as duas peças idênticas formem a terceira peça ( Figura 1B ). Aperte as peças de base de cada lado usando dois clipes de pasta pequenos ( Figura 1C ). Coloque os montantes no molde, certificando-se de que o laser kerf está corretamente posicionado ( Figura 1E ).
- Coloque o limpador de vidro limpo e seco no molde e segure-o no lugar enquanto coloca um segundo slide de vidro do outro lado. Aperte o conjunto com um grampo de pasta maior ( Figura 1D ). Aperte as duas lâminas com grampos maioresLass = "xfig"> Figura 1D). Certifique-se de que o grampo do gravador superior esteja em contato com o slide de vidro sobreposto com o acrílico.
- Adicione os restantes clipes da pasta. Novamente, certifique-se de que as braçadeiras entrem em contato com o slide onde ele sobrepõe o acrílico ( Figura 1D ).
NOTA: Antes de encher o molde montado com agar em fusão, assegure-se de que os bordos são selados por pipetagem de cerca de 70 μL de meio de agar em fusão ao longo do lado interno do molde. Este agar rapidamente se solidificará e evitará vazamentos. - Encha o molde com ágar fundido, assegurando-se de evitar a captura de bolhas de ar no molde.
NOTA: Isto pode ser conseguido por pipetagem lentamente do ágar fundido ao longo da borda do molde. Depois de ser enchido, deixe o molde arrefecer durante 40 min a 1 h a uma temperatura ambiente de cerca de 23 ° C. Se for permitido esfriar muito tempo, o ágar pode fractura no molde.
NOTA: Separação do molde: a remoção adequada do molde do ágar fundido é essencial para garantir um sólido uniformeAlmofada de agar para crescimento de levedura. A falta de assegurar a separação eficiente do molde nesta etapa causará diferenças de crescimento que são atribuíveis a imperfeições na almofada de ágar sólida. Praticar esse passo algumas vezes é recomendado. - Comece, removendo o clipe do gravador inferior. Remova a parte inferior do molde que consiste nas três peças de molas. Segure as lâminas compactando-as e, em seguida, remova os grampos da pasta. Certifique-se de não colidir os lados do molde enquanto retira os grampos da pasta. Isso irá deformar a mídia.
- Coloque o molde na borda da bancada de modo que o lado do molde com o ponto azul esteja voltado para cima e no canto inferior esquerdo ( Figura 1E ). Coloque os polegares debaixo do acrílico e o primeiro dedo na parte superior em direção ao bordo interno do molde.
- Lentamente e cuidadosamente empurre com o polegar contra o molde, como se girasse o espaçador do molde em sua borda inferior ( Figura 1F ). Aplicar constanteMas aumentando lentamente a pressão. Os usuários verão uma pausa e a bolha de ar aparecerá ao longo da linha onde o vidro superior cobre o espaçador do molde.
- Depois de ver a linha de ruptura inicial, continue empurrando com os polegares e aplique uma pressão constante. O agar deve começar a se separar do vidro neste ponto ( Figura 1F ). Continue a girar o molde para cima. Isso levará o vidro sem deslizar. Uma linha em que o ágar está descascando do vidro deve continuar a se afastar da linha de ruptura inicial.
NOTA: Neste ponto, o agar fica aderente tanto ao fundo como ao topo do copo. Isso ocasionalmente ocorrerá com o limite mais à esquerda. Enquanto a área deformada não estiver na área onde o fermento é manchado, isso deve estar bem. - Como o vidro é completamente gratuito, pegue-o e remova-o completamente do molde. Em seguida, retire a outra peça do molde usando um movimento semelhante para levantar a peça livre sem mover o ágar. Coloque os slides em umCaixa de ponta estéril com água estéril de alta pureza no fundo. Feche a caixa e guarde a 4 ° CO / N para uso no dia seguinte. Se armazenados por mais tempo, as taxas de crescimento se tornarão inconsistentes.
3. ODELAY Cultura Preparação
- Coloque as estirpes em uma placa de 96 poços para crescimento de O / N.
- No dia seguinte, diluir 20 μL de cultura durante a noite em 200 μL de meio para 220 μL de volume total em uma nova placa.
- Medir a densidade óptica a 600 nm (OD600) de cada cultura em um leitor de placas. Usando um leitor de placas e um robô de manipulação de líquidos, siga o protocolo de diluição automatizado das etapas 3.3.1 - 3.3.6. Diluir manualmente as culturas na placa até aproximadamente 0,1 OD600 (opcional).
- No leitor de placas, toque em "Experiência" em "criar novo". Escolha ODELAYDilution.exp e execute o experimento. Digite o nome da experiência como ODELAY "Data" "Hora" "Itinerário do Nome da Experiência".
- Clique no sGuia tatistics e depois clique no ícone do Excel. Salve os dados em uma unidade de polegar e transfira-o para um computador robô de manipulação de líquidos.
- Abra o Layout e o Editor de métodos do Robot. Abra o arquivo de método "ODELAYDilution_v1.med". Execute o executável "Convert_SynergyFiles.exe". Digite 0.09 para OD600 alvo.
- Clique em "Correção Glu" e "Correção Gal" para 0,05. Mude a mídia em branco em uma placa idêntica. Clique em "Gerar arquivo". Selecione o arquivo no editor de métodos. Clique no ícone do semáforo para iniciar o método para abrir o programa de diluição em tempo de execução.
- Certifique-se de que os tubos não estejam tapados e as placas tenham removido as tampas e as tampas de pó sejam removidas das pontas. Coloque placas, tubos e pontas no deck do robô de tratamento de líquidos, conforme indicado pelo layout do convés.
- Clique no botão "Reproduzir" para executar o programa de diluição. Selecione o número correto de dicas de 50 μL. Selecione o número correto de dicas de 300 μL. Espere sobre12 min para que o processo seja executado.
- Pegue a placa de diluição do robô, cubra as dicas e recupere os tubos de mídia de 15 mL. Cultive a placa por 5 a 6 h a 30 ° C.
- Cerca de 1 a 2 h antes de iniciar a segunda diluição, certifique-se de ligar as câmaras de incubação para o microscópio. Permitir que eles se equilibrem a ° C ou a temperatura necessária para o experimento.
- Repita as etapas de diluição 3.3 - 3.4, mas dilua culturas para uma OD600 de 0,01 a 0,02 para detectar as culturas em lâminas de agarose.
- Cubra a placa de diluição com uma vedação de congelador de metal.
- Sonicate a placa de diluição em um banho de gelo durante 30 s com a placa flutuando em água gelada usando uma balde de metal centrífuga para segurar a placa ( Figura 2A ). Transfira as culturas sonicadas da placa de diluição para uma placa de fundo plano. Rotule placas de fundo plano de 4 x 96 poços 1, 2, 3 e 4 ( Figura 2B ).
- Transferência 150 &# 181; L da placa de diluição dos poços A01 - D06 nos poços C04 - F09 da placa rotulada 1. Transfira então 150 μL da placa de diluição dos poços A07 - D12 para os poços C04 - F09 da placa rotulada 2. Transfira então 150 μL Da placa de diluição dos poços E01 - H06 nos poços C04 - F09 da placa rotulada 3. Finalmente, transferir 150 μL da placa de diluição dos poços E07 - H12 para os poços C04 - F09 da placa rotulada 4.
- Avança para o passo 4, Spotting on Agar.
4. Spotting on Agar usando um Robô Automático de Spotting Líquido
- Remova as lâminas de agarose armazenadas a 4 ° CO / N (do passo 2.19) das caixas de pipeta estéril humidificadas.
- Se necessário, corte os cantos do meio de agarose com uma lâmina de barbear limpa para garantir que eles se encaixam na câmara de deslizamento.
- Remova a braçadeira deslizante do suporte. Coloque cuidadosamente a placa de ágar na área embutida da montagem da câmara de estágio.
NOTA: Certifique-se de que o ouA orientação do slide é consistente de experiência para experiência. - Certifique-se de que o grampo esteja nivelado com a parte inferior da câmara. Se estiver torto, então o slide pode não estar totalmente encaixado na área rebaixada. Coloque o espaçador de nivelamento na posição da placa central do robô manchado. Este espaçador fornece contato para os parafusos de nivelamento para que a câmara deslizante possa ser nivelada com as pontas.
- Coloque as placas na mesa em ordem de seu quadrante. As placas 1, 2, 3 e 4 ordenaram da esquerda para a direita ( Figura 2B ).
- Coloque as dicas para que os 24 poços internos C04 - F09 estejam ocupados com dicas em 4 caixas de dica vazias. Uma quinta caixa precisará ter uma dica na posição C10, bem como 4 dicas com suas extremidades cortadas nas posições A01, A12, H01 e H12. Essas 4 dicas de corte fornecem estabilidade para o grampo da placa da ponta ( Figura 2C e 2D ).
- Remova a tampa superior do slMontagem de câmara ide.
- Coloque o primeiro perfurador de ponta no local de início do programa de controle de controle do robô. Isso deve perfurar um buraco na agarose que será usado mais tarde para alinhar a coordenada de origem. Coloque a placa 1 no robô de manipulação de líquido para detectar o primeiro quadrante. Verifique se a tampa é removida e continue com o programa de manchas.
- Verifique se todos os pontos estão presentes. Além disso, aguarde ~ 30 s para secar. Quando as manchas têm cerca de 1 mm de diâmetro, o programa pode continuar. Esvazie as dicas usadas no recipiente de risco biológico e coloque dicas frescas sobre o robô. Troque a placa 1 para a placa do 2º quadrante.
- Repita para o terceiro quadrante. E repita novamente para o 4º quadrante.
- Quando as manchas estiverem secas, substitua a tampa da câmara deslizante e atire o aparelho.
- Instale as conexões da tubulação com um filtro de ar.
- Coloque um slide de vidro no lado superior da câmara.
NOTA: Este slide é crucial para reduciO fluxo de calor no ágar e minimiza a formação de condensação no lado de deslizamento da tampa do objetivo da câmara. Não esqueça desta capa. Dependendo da configuração do microscópio, este deslizamento de cobertura evita que o aquecimento do lado da iluminação cause condensação no lado do objetivo. - Posicione um ventilador para soprar ar quente no lado objetivo da câmara. Este ventilador evita a formação de condensação na tampa deslizante. Ajuste a taxa de fluxo de ar através do borbulhador para 10 mL / min.
5. Executando ODELAY no microscópio
- Execute o script "ODELAY_Microscope_Control.m".
- Clique no "Obturador" para abrir o obturador de luz transmitida e depois o botão "Foco" para iniciar a alta velocidade da câmera ( Figura 3A , setas vermelhas).
- Clique em "Go Origin" e mova o palco para encontrar a marca de origem que foi perfurada no agar.
- Em seguida, mova-se ligeiramente para a direita paraFoco em células de fermento manchadas na área E07.
- Volte para o soco de origem e centre-o no campo de visão.
- Defina a origem para esse valor pressionando o botão "set" ( Figura 3A , Blue Arrows). Agora, mova-se para posicionar H18 e focalize usando o parafuso hexagonal mais próximo dessa localização. Em seguida, mova-se para a posição L07 e concentre-se usando o parafuso hexagonal mais próximo dessa localização. Em seguida, mude para a posição E07 e concentre-se usando o parafuso hexagonal mais próximo dessa localização.
- Repita as etapas 5.5 - 5.7, conforme necessário, até que essas posições permaneçam focadas.
- Verifique o foco no centro e nas bordas nos pontos E12, H12, L12. Ajuste a faixa de focagem automática se os valores Z de foco, conforme indicado pelo valor Z, são maiores do que ± a faixa de focagem automática ( por exemplo , ajuste a faixa de focagem automática para 60 μm o valor Z para um ponto central superior a ± 40 μm).
- Pressione o botão de reinicialização, pois isso ativará as propriedades do botão e, em seguida, pressioneODELAY ( Figura 3A , setas verdes). Escolha o diretório para salvar os dados. Certifique-se de que o espaço disponível no disco rígido esteja disponível.
NOTA: O microscópio coleta dados por 48 h, ou até o programa estar fechado.
6. Processando dados ODELAY
- Abra o ODELAY_IPT.exe ou use o script ODELAY_Image_Processing_Tool_v7.m ( Figura 3C ).
- Prepare uma planilha de cálculo * ODELAYExpDisc.xlsx excel.
- Nomeie o experimento na célula B1.
- Selecione o Diretório de imagens onde os arquivos de imagem E07 - H18 são armazenados.
- Selecione o Diretório de Dados onde os dados serão gravados.
- Escreva a data em que o experimento foi iniciado na célula B04. Use o formato MM / DD / AAAA.
- Escreva o tempo de diluição na célula C04. Esta vez é aproximadamente cinco minutos antes da primeira imagem ser coletada. Use o formato HH: MMpm onde HH é para h e MM é para min.
- Adicione os nomes da tensão de acordo com tO a placa de origem (passo 3.1). Devido à forma como as cepas são manchadas, elas são rearranjadas no slide de agarose ODELAY. As células na planilha B31-B126 são a placa fonte, enquanto as células C31-C126 são as localidades na placa de ágar ODELAY.
- Em seguida, pressione o botão "Process Data" e selecione o * ODELAYExpDisc.xlsx que foi preparado.
- Aguarde 16-24 h dependendo do sistema de computador usado para processar dados.
- Quando as imagens são processadas, um diretório chamado "ODELAY Well Data" e um arquivo "* _Index_ODELAYData.mat" aparecerão. Pressione o botão "Carregar dados" e selecione o arquivo "* _Index_ODELAYData.mat" que acabou de ser gerado. Isso irá carregar o conjunto de dados que acabou de ser processado. O "*" no nome do arquivo será listado de acordo com o nome da experiência inserido na planilha do Excel.
- Depois de carregar os dados, inspecione-o usando a barra de tempo encontrada na parte inferior, clique em um quadrado de imagem para ver as curvas de crescimento fOu aquele ponto, ou encontre um interesse na lista à esquerda e depois carregue as imagens para essa lista.
- Gerar histogramas de parâmetros de crescimento populacional pressionando o botão "Violin Plot". Isso gerará um gráfico mostrado na Figura 4 ou Figura 6 .
Resultados
As imagens de exemplo de crescimento de fermento em microscopia de lapso de tempo são mostradas na Figura 3B . Após o processamento das imagens de lapso de tempo, um conjunto de dados representativo que compara as tensões de levedura BY4741 e BY4742 é mostrado na Figura 4 . Neste conjunto de dados de exemplo, há muito pouca variação no tempo de duplicação entre diferentes posições na placa. Se o meio de agarose for bem preparado, então um desvio óbvio em tempo de duplicação e tempo de atraso seria aparente nas posições de mancha que coincidem com a região deformada do gel de agarose. Enquanto os tempos de duplicação parecem ser relativamente uniformes, este exemplo mostra variações nas medidas do tempo de atraso. Um conjunto de dados mais consistente é mostrado na Figura 6 . Neste conjunto de dados, o tempo de atraso e o tempo de duplicação são uniformes.
Arquivos / ftp_upload / 55879 / 55879fig1.jpg "/>
Figura 1: Montagem do molde Agar.
Os componentes do molde de ágar são mostrados em ( A ). Monte a base como mostrado em ( B ) e, em seguida, prenda a base com pequenos grampos de pasta. Coloque os pedaços verticais mais longos na cavidade da base ( C ) e acampe as lâminas para o molde conforme mostrado em ( D ). Uma vista lateral mostrando o ângulo do molde e a orientação do molde kerf necessário para a separação consistente do ágar da lâmina de vidro ( E ). Observe a posição do polegar e dos dedos da frente, bem como a linha reta do ágar que se separa do slide ( F ) e observe a seta horizontal. A linha de separação deve se mover uniformemente na direção das setas verticais. Clique aqui para ver uma versão maior dessa figura.
= "Jove_content" fo: keep-together.within-page = "1"> 
Figura 2: Método de Sonicação e Spotting.
Sonicate a placa na água gelada e use um suporte de balde centrífugo para ajudar a suportar a placa ( A ). Coloque as placas dos passos 3.8.1 para a mancha na placa de agarose ( B ). Além disso, organize as dicas para que a caixa de ponta mais à esquerda tenha uma dica na posição C10 e, em seguida, outras quatro pontas com as extremidades cortadas para que não colam o suporte da placa ( C ). Coloque as dicas restantes em quatro caixas para que as posições internas de 24 pontas estejam ocupadas ( D ). Clique aqui para ver uma versão maior dessa figura.
55879fig3.jpg "/>
Figura 3: Interface gráfica de usuário ODELAY.
Uma captura de tela da Interface Gráfica do Usuário para "ODELAY_Microscopecontrol.m" ( A ). Esta interface permite o monitoramento da câmera e para ajustar as configurações de iluminação do microscópio para modos de campo epifluorescente e brilhante. As setas vermelhas apontam para os botões Foco e Transmissão que ativam a câmera para adquirir imagens rapidamente e abre o obturador leve transmitido, respectivamente. As setas azuis são usadas para mover o palco para a origem e depois definir a origem com o botão "Go Origin" e o botão "Set". As setas verdes apontam para "Redefinir" e "ODELAY !!!" Botões que reiniciam os modos de imagem ODELAY nas condições atuais e iniciam a coleta de imagens ODELAY. Imagens de lapso de tempo de crescimento de fermento em meio sólido a 0, 3, 6 e 9 h após a mancha ( B ). Uma captura de tela da interface gráfica do usuário para "ODELAY_IPT.m" ou th E ODELAY Ferramenta de processamento de imagem ( C ). Clique aqui para ver uma versão maior dessa figura.

Figura 4: Exemplo de saída ODELAY.
Este conjunto de dados compara as tensões BY4741 e BY4742 na mídia YPD. Esta figura é um exemplo de um slide de agarose bem preparado; No entanto, as configurações de focagem automática não são otimizadas. Os dados apresentados em cada coluna, da esquerda para a direita, são: a capacidade de carga no Log 2 da área da colônia; Tempo de duplicação, dado em min; E tempo de atraso, dado em min. Neste exemplo, o tempo de duplicação de todos os pontos na corrediça de ágar se alinha bem com uma pequena quantidade de tempo de duplicação aumentado em direção à coluna. No entanto, os tempos de atraso variam consideravelmente neste conjunto de dados._upload / 55879 / 55879fig4large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
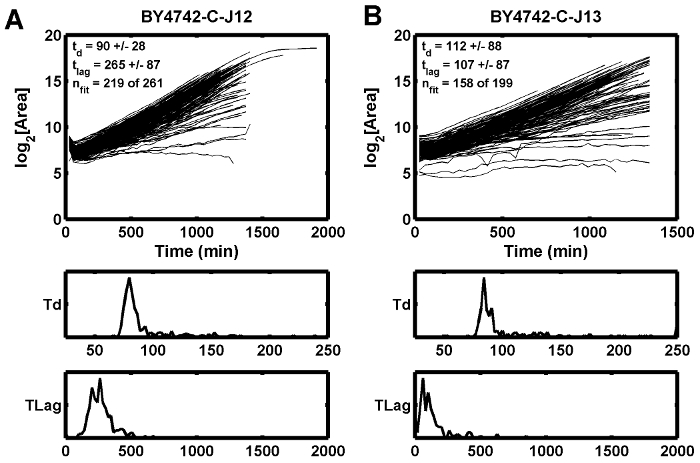
Figura 5: Exemplos de curva de crescimento.
Este exemplo demonstra como o foco inicial fraco pode causar o tempo de atraso estimado (t lag ) para aumentar ( A ), enquanto a posição adjacente mostra um tempo de latência menor ( B ). T d é o tempo de duplicação em min, e t lag é o tempo de atraso em min. Clique aqui para ver uma versão maior dessa figura.
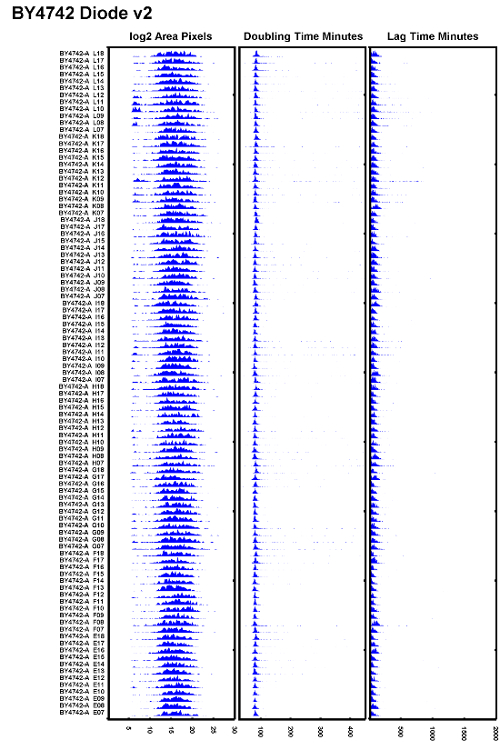
Figura 6: Exemplo de experiência de teste bem executada.
Um eXample da estirpe BY4742 testada depois de substituir uma lâmpada de halogéneo de tungstênio por um iluminador de diodo e garantir que o foco automático esteja configurado corretamente. Todos os tempos de duplicação parecem se sobrepor bem e os tempos de atraso parecem ser consistentes. Clique aqui para ver uma versão maior dessa figura.
Discussão
O teste ODELAY tem vários pontos críticos para garantir medições fenotípicas reprodutíveis e confiáveis. O primeiro ponto crítico é a preparação consistente das culturas de fermento. Deve-se ter cuidado para colher as células de levedura do crescimento logarítmico. Se as culturas estiverem saturadas, então a sua heterogeneidade populacional aumentará, o que pode ofuscar a heterogeneidade causada por fatores genéticos ou ambientais ( por exemplo, fontes de carbono) 11 . O segundo ponto crítico é a preparação consistente da mídia. Em geral, um grande volume de solução de mídia de estoque 10X deve ser gerado e, em seguida, usado ao longo do tempo para minimizar os efeitos do lote. Formular meios de comunicação, em peso, sempre que possível, ajuda a melhorar a consistência do meio ao longo do tempo, assegurando a densidade de ágar e o teor global de água da agarose podem ser monitorados de perto. O terceiro ponto crítico envolve minimizar ou eliminar qualquer deformação mecânica da agarose meDia. A deformação mecânica da mídia geralmente ocorrerá durante a separação da agarose das lâminas de vidro. Tal como acontece com muitas técnicas de laboratório, a prática é necessária para dominar esta etapa.
A variação no tempo de atraso, conforme ilustrado na Figura 4 , está frequentemente relacionada a um dos três fatores: deformação mecânica do meio de agarose, variação na espessura de ágar moldada ou fonte de luz instável. Se o meio de agarose variar em altura Z em toda a matriz manchada, a variação de altura pode sobrecarregar o alcance da rotina de focagem automática, fazendo com que as imagens iniciais estejam ligeiramente fora de foco. Por esse motivo, verifique a altura do foco em vários pontos no centro e ao longo das bordas da matriz manchada para garantir que a rotina de focagem automática tenha alcance Z suficiente para encontrar o foco. Se necessário, use o painel Autofocus para aumentar o alcance de foco e aumentar o número de etapas de focagem.
Uma terceira condição possívelO íon que pode levar a um foco fraco é uma fonte de luz instável ou cintilante, que pode interromper a pontuação de foco calculada para uma altura Z específica. As lâmpadas de halogéneo de tungstênio tendem a cintilar bem antes que as lâmpadas se queimem. O efeito do foco fraco é observado em um exemplo em que as curvas de crescimento mergulham entre o primeiro e o segundo tempo ( Figura 5 A ), enquanto o ponto adjacente não tem o mesmo mergulho ( Figura 5 B ). Neste caso, a má condição de foco foi atenuada pela substituição da fonte de luz de halogênio de tungstênio.
Na prática, os autores descobriram que, para reduzir a cintilação de 100W de lâmpadas halógenas de tungstênio, as lâmpadas precisam ser substituídas a cada 500 h ou aproximadamente a cada 2 meses quando os microscópios estão em uso intenso. Para evitar problemas de focagem fracos de uma lâmpada cintilante, substitua a fonte de luz halógena de tungstênio frequentemente ou substitua a lâmpada halógena por uma fonte de luz de diodo. AO exemplo de um conjunto de dados que mostra pouca variação nos tempos de duplicação bem como tempos de atraso mais uniformes é mostrado na Figura 6 . Este conjunto de dados foi tomado com um iluminador de diodo que fornece uma iluminação mais estável ao longo do tempo enquanto executa o autofoco.
Embora muitos dos pontos mencionados aqui para otimizar a preparação da mídia possam parecer óbvios, na literatura as telas de maior escala não se replicam bem umas com as outras 8 , 11 . Portanto, descrevemos cuidadosamente a preparação de culturas e meios de agarose para que possam ser geradas telas fenotípicas mais reprodutíveis.
O ensaio ODELAY está atualmente limitado em termos de produção quando comparado aos ensaios baseados em fixação, tais como matrizes genéticas sintéticas ou o ensaio Scan-O-Matic. Embora esses métodos aumentem o número de cepas que são medidas, eles não possuem capacidade para resolver células individuais.Nd, portanto, não pode medir a heterogeneidade da população que observamos dentro das cepas de fermento clonal. A origem dessa heterogeneidade populacional não é atualmente compreendida, mas a fusão de tecnologia e computação, como demonstrado aqui, oferece uma oportunidade para abordar objetivamente os mecanismos celulares subjacentes 12 .
Os autores desejam notar que o ODELAY atualmente é otimizado apenas para uma marca específica de microscópio e tipo de corpo. Modificar o ODELAY para outros sistemas de microscópio é direto, mas exigirá conhecimento da API 13 de código aberto. No entanto, tanto a API como os scripts ODELAY são escritos para serem facilmente adaptados a diferentes sistemas e ensaios experimentais.
Embora o ODELAY tenha sido originalmente desenvolvido para fermento, conseguimos utilizá-lo sem modificações para observar o crescimento de Mycobacterium smegmatis . A observação dos outros microrganismos formadores de colônias éPossível com alterações no código fonte fornecido 11 . Em geral, a ODELAY é uma ferramenta poderosa e flexível para comparar microorganismos cultivados sob diferentes condições ambientais e perturbações genéticas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem o apoio a este trabalho através das subvenções U54 RR022220 e P50 GM076547 à JDA dos Institutos Nacionais de Saúde dos EUA. FDM é um colega pós-doutorado dos Institutos canadenses de pesquisa em saúde. Também agradecemos o apoio do Centro Luxemburgo para Sistemas de Biomedicina e da Universidade do Luxemburgo.
Materiais
| Name | Company | Catalog Number | Comments |
| Agarose UltraPure | ThermoFisher | 16500500 | Gel Temp 36C, Gel Strength (1%) 1.2 g/sq cm |
| Yeast Extract Peptone (YEP) | Fisher Scientific | BP1422-2 | |
| Complete Suplement Mixture (CSM) | Fisher Scientific | MP114560222 | |
| Polyethylene Glycol 3350 (av. mol. wt. 3000-3700) | SigmaAldrich | P2906 | |
| Yeast Strain BY4741 | ThermoFisher | 95400.BY4741 | |
| Yeast Strain BY4742 | ThermoFisher | 95400.BY4742 | |
| 50 mL Falcon tubes | Corning | 430291 | 1 case |
| 15 mL Falcon tubes | Corning | 352096 | |
| 2 x 3 inch 1.0 mm thick slides 1/2 gross | VWR | 48382-179 | |
| 96-well plate flat bottom | Corning | 353072 | |
| Hydra liquid handleing robot | Thermo | 1096-DT-100 | |
| Hamilton Microlab Star Liquid Handleing Robot | Hamilton | ||
| hydra 100 mL tips Extended Length DARTS | Thermo | 5527 | |
| Synergy H4 Plate Reader | Biotek | H4MLFAD | |
| Leica DMI6000 B Microscope | Leica | ||
| Leica 10X/0.3NA objective | Leica | 11506289 | |
| Hamamatsu ORCA Flash 4.0 Camera | Hamamatsu | C11440-22CU | |
| MATLAB with image processing tool box | Mathworks | ||
| MicroManager | Open Imaging | https://micro-manager.org/ | |
| ODELAY Microscope Control (MATLAB scripts and GUI) | www.aitchisonlab.com\ODELAY for Matlab scripts and software | ||
| ODELAY Microscope Chamber | www.aitchisonlab.com\ODELAY for Mechanincal Drawings | ||
| ODELAY Agar Molds | www.aitchisonlab.com\ODELAY for mold drawings |
Referências
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van't Riet, K. Modeling of the bacterial growth curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Sellick, C. A., Campbell, R. N., Reece, R. J. Galactose metabolism in yeast-structure and regulation of the leloir pathway enzymes and the genes encoding them. Int Rev Cell Mol Biol. 269, 111-150 (2008).
- Yoshikawa, K., et al. Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res. 9 (1), 32-44 (2009).
- Bryan, A. K., Goranov, A., Amon, A., Manalis, S. R. Measurement of mass, density, and volume during the cell cycle of yeast. Proc Natl Acad Sci U S A. 107 (3), 999-1004 (2010).
- Baryshnikova, A., et al. Quantitative analysis of fitness and genetic interactions in yeast on a genome scale. Nat Methods. 7 (12), 1017-1024 (2010).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327 (5964), 425-431 (2010).
- Collins, S. R., et al. Functional dissection of protein complexes involved in yeast chromosome biology using a genetic interaction map. Nature. 446 (7137), 806-810 (2007).
- Zackrisson, M., et al. Scan-o-matic: High-Resolution Microbial Phenomics at a Massive Scale. G3 (Bethesda). 6 (9), 3003-3014 (2016).
- Bean, G. J., Jaeger, P. A., Bahr, S., Ideker, T. Development of ultra-high-density screening tools for microbial 'omics'. PloS One. 9 (1), e85177 (2014).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS Biol. 10 (5), e1001325 (2012).
- Herricks, T., et al. One-Cell Doubling Evaluation by Living Arrays of Yeast. ODELAY! G3 (Bethesda). 7 (1), 279-288 (2017).
- Mast, F. D., Ratushny, A. V., Aitchison, J. D. Systems cell biology. J Cell Biol. 206 (6), 695-706 (2014).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. J Biol Methods. 1 (2), e10 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados