Method Article
Determinación de arsénico inorgánico en una amplia gama de alimentos Matrices mediante generación de hidruros - espectrometría de absorción atómica.
En este artículo
Resumen
Se demuestra la utilidad de un método analítico para determinar arsénico inorgánico en una amplia gama de matrices de alimentos. El método consiste en la extracción selectiva de arsénico inorgánico en cloroformo con una determinación final por espectrometría de absorción atómica-generación de hidruros.
Resumen
La autoridad de seguridad alimentaria europea (EFSA) de subrayó en su opinión científica sobre arsénico en alimentos que para apoyar una evaluación de la exposición sonora a arsénico inorgánico a través de la dieta, información sobre la distribución de las especies de arsénico en varios tipos de alimentos debe ser generados. Un método, previamente validado en un ensayo de colaboración, se ha aplicado para determinar arsénico inorgánico en una amplia variedad de matrices de alimentos, que abarcan cereales, setas y alimentos de origen marino (31 muestras en total). El método se basa en la detección por espectrometría de absorción atómica-generación de hidruro de inyección flujo de iAs selectivamente extraído en cloroformo después de la digestión de las proteínas con ácido clorhídrico concentrado. El método se caracteriza por un límite de cuantificación de 10 μg/kg de peso en seco que permite cuantificación de arsénico inorgánico en una gran cantidad de matrices de alimentos. La información está siempre sobre puntuaciones de rendimiento dados a los resultados obtenidos con este método y que fueron divulgados por diferentes laboratorios en varias pruebas de aptitud. El porcentaje de resultados satisfactorios obtenidos con el método discutido es mayor que la de los resultados obtenidos con otros métodos analíticos.
Introducción
Desde enero de 2016 máximos de arsénico inorgánico (iAs) en varios productos de arroz han sido incluidos en Comisión Reglamento (CE) 1881/2006 Ajuste niveles máximos para determinados contaminantes en los productos alimenticios1 0,10 μg/l para arroz destinado a la producción de alimentos para lactantes y niños pequeños, 0.20 μg/L para no-molido arroz vaporizado (arroz blanco o pulido), 0.25 μg/L para el arroz descascarillado y arroz precocido y 0.30 μg/L para waffles de arroz, obleas, galletas de arroz y pasteles de arroz de arroz. Esta actualización de la legislación europea de contaminantes en los alimentos la opinión científica sobre arsénico en alimentos de la autoridad europea de seguridad alimentaria (EFSA)2 en que se estima que la exposición a través de la dieta a las NIC para los consumidores de medias y altas en Europa es tal que puede suponer un riesgo para algunos consumidores, teniendo en cuenta que la exposición crónica a iAs causa cáncer de pulmón, piel y vejiga y las lesiones de piel. En el informe científico de EFSA sobre exposición al arsénico inorgánico en la población europea3, publicado en el año 2014, se concluye que los principales contribuyentes al NIC en la dieta de los consumidores de todas las edades son productos procesados hechos de cereales que arroz y también el arroz, leche, productos lácteos y agua potable contribuyen significativamente a la ingesta de iAs, con leche y productos lácteos siendo los principales contribuyentes para niños pequeños y bebés.
En 2010 el laboratorio de referencia de la Unión Europea para los metales pesados en piensos y alimentos, EURL-HM, funcionó un competencia de prueba, IMEP-107, para la determinación de IA en arroz, demostrando que era posible determinar iAs en el arroz con suficiente exactitud, independientemente de la método analítico había utilizado4.
Varios métodos analíticos han sido validados para la determinación de IA en los productos alimenticios. China fue el primer país para introducir en su legislación un nivel máximo de iAs en el arroz. Para hacer posible la aplicación de la legislación un método estándar se publicó en 2003 para la determinación de lo que en el estándar se llama "abio-arsénico"5. El Comité Europeo de normalización (CEN), publicó en 2008 un método estandarizado, EN 15517:2008, para la determinación de IA en el alga marina6. Los dos métodos se basan en el uso de condiciones optimizadas para generar arsina solamente de NIC. En que no es necesaria la separación de manera de iAs de otras especies de arsénico también pueden generar hidruro de arsénico. La determinación final se realiza por fluorescencia atómica5 o por espectrometría de absorción atómica de generación de hidruro, HG-AAS6. Sin embargo, es difícil establecer las condiciones exactas para generar el hidruro de arsénico sin sufrir de interferencia de otros compuestos de arsénico y todas las iAs fracciones masa en algas en IMEP-112 (PT organizado por el EURL-HM) obtienen con los dos métodos , se calificaron como insuficiente7. Organoarsenic especies, como el ácido monomethylarsonic (MMA), ácido dimethylarsinic (DMA) y arsenosugars presentes en las muestras de algas, pueden generar también hidruros volátiles y podrían interferir en la determinación de Ia hacia un sesgo positivo en los resultados8 .
CEN había publicado recientemente, un nuevo método estándar, EN 16802:2016, para la determinación de IA en los alimentos de origen marino y vegetal utilizando HPLC-ICP-MS9. No todos los laboratorios están equipados con este tipo de instrumentación y se necesitan métodos no caro, directa, en particular en los países con menos infraestructuras de laboratorio desarrollado.
En 2012 CEN estandarizado un método para la determinación de IA en animales alimenticios HG-AAS después de la extracción de microondas y off-line separación de IA por extracción en fase sólida (SPE), EN 16278:201210. Este método que demostró estar en forma para el análisis de la NIC en la alimentación podría carecer de la sensibilidad necesaria para determinar iAs en alimentos de origen no marino, que según EFSA parece ser los principales responsables dietéticos en Europa3. Sin embargo, el mismo grupo que había desarrollado y había validado EN 16278:2012 probado con éxito aplicado y validado el método para determinar iAs en pescados y mariscos y el arroz en un ensayo colaborativo11,12.
Un método alternativo para la determinación de IA en matrices de alimentos después de la extracción selectiva de iAs en cloroformo y cuantificación más HG-AAS, recientemente fue validado por el centro común de investigación (CCI) en un ensayo colaborativo13. La selectividad del método es mejor que la de HG-AAS directas y fácil de implementar que no requieren el uso de instrumentación sofisticada como HPLC-ICP-MS. En este manuscrito, la viabilidad de utilizar este método para determinar iAs en una amplia gama de matrices de alimentos: verduras, cereales, setas y alimentos de origen marino, ha sido evaluado. Además, se describe el funcionamiento de los laboratorios que utilizan el método de pruebas de competencia organizadas por el EURL-HM y el CCI cubriendo varias matrices.
Protocolo
Nota: todo el material utilizado debe ser descontaminados con el 10% (m/v) HNO 3 y enjuagar al menos dos veces con agua desionizada.
1. hidrólisis
- pesar con precisión aprox. 0.5 a 1 g de muestra liofilizada (o la cantidad equivalente de muestra homogeneizada recién por ejemplo 1 a 4 g) en un tubo de centrífuga de polipropileno de 50 mL con tornillo cap.
- Agregar 4,1 mL de agua desionizada.
- Agitación con un agitador mecánico por unos 5 min hasta que la muestra esté completamente húmeda.
- Añadir 18.4 mL de ácido clorhídrico concentrado (HCl), no menos que el 37% m / v.
- Agitación con un agitador mecánico durante 15 min.
- Dejar reposar durante 12-15 h (por ejemplo durante la noche).
2. Extracción
- añadir 2 mL de ácido bromhídrico (HBr) no menos que 48% m/v y 1 mL de sulfato de hidracina (N 2 H 6 SO 4) solución (15 mg/mL) a la muestra hidrolizada.
- Agitar durante 30 s con un agitador mecánico.
- Añadir 10 mL de cloroformo (CHCl 3).
- Agitar durante 5 min con un agitador mecánico.
- Centrifugar durante 5 minutos a 800 x g.
- Pipetear la fase de cloroformo (fase inferior) en otro tubo de centrífuga de polipropileno de 50 mL.
- Añadir otra vez 10 mL de cloroformo a la restante fase ácida y repetir la extracción. Al final unos 20 mL de cloroformo deben han sido recogido. Tenga cuidado de evitar la contaminación cruzada de la fase ácida.
3. Limpiar de la fase de cloroformo
- centrífuga de las fases de cloroformo agrupado durante 5 minutos a 800 x g. El tiempo de centrifugación o velocidad puede aumentarse si es necesario para lograr una clara separación de las dos fases.
- Elimine los residuos de ácido de la fase restante en el cloroformo con una pipeta de 1 mL. Este paso es crucial. Los residuos de ácido de la fase restante en la fase de cloroformo dará lugar a resultados de iAs sobrestimada porque todas las especies de arsénico en la muestra están presentes en la fase ácida.
- Filtro a través de una membrana PTFE hidrofóbica (25 mm de diámetro) para eliminar los residuos restantes de la fase sólida o ácido presentes en la fase de cloroformo y recoger la fase de cloroformo en un tubo de centrífuga de polipropileno de 50 mL.
4. Extracción de la parte posterior
- añadir 10 mL de 1 M de HCl para extraer nuevamente iAs de la fase de cloroformo recogidos después del paso de filtración.
- Agitar durante 5 min con un agitador mecánico.
- Centrifugar durante 5 minutos a 800 x g.
- Pipetear el ácido fase (fase superior) y vierta en un vaso de cristal 250 mL (por ejemplo Pyrex) por mineralización.
- Repetir la extracción de la parte posterior y combinar las fases recogidas de HCl.
5. Mineralización de la muestra
Nota: este paso permite la eliminación de interferencias y de la concentración en muestras de que la fracción de masa de iAs está cerca o por debajo del límite de cuantificación, y se omite con frecuencia por los laboratorios que utilizan este protocolo con ICP-MS para la determinación final en vez de HG-AAS.
- Suspender 20 g de nitrato de magnesio hexahidratado [Mg (NO 3) 2 6 H 2 O] y 2 g de óxido de magnesio (MgO) en 100 mL de agua desionizada. Añadir 2,5 mL de esta suspensión en el vaso de vidrio. Agitar la suspensión añadiendo para evitar precipitación.
- Añadir 10 mL de concentrado HNO 3 de al menos 65% m/v y evaporar a sequedad en un baño de arena (o una placa térmica), evitando cualquier proyecciones. Para verificar que las muestras estén totalmente secas, coloque un vidrio de reloj sobre el vaso de vidrio y compruebe que no hay condensación se forma.
- Cubrir los vasos con los vidrios de reloj y coloque en un horno mufla a una temperatura inicial no superior a 150 º c y aumentar progresivamente la temperatura de 425 ± 25 ° C a una velocidad de 50 ° C/h. mantener a 425 ° C por 12 h. Este paso es vital. Para evitar cualquier proyecciones la tasa de aumento de temperatura debe ser aplicada estrictamente.
- Permitir que las cenizas se enfríe a temperatura ambiente.
- Añadir 0,5 mL de agua desionizada mojar la ceniza y luego añadir 5 mL de HCL de 6 M. Tenga cuidado de recuperar las cenizas de las paredes del vaso de vidrio. Disolver las cenizas completamente, temblando si es necesario.
- Añadir 5 mL de la reducción de agente, que se prepara disolviendo 5 g de yoduro de potasio (KI) y 5 g de ácido ascórbico en 100 mL de agua desionizada, y esperar 30 minutos para lograr una reducción cuantitativa de iAs de as (III).
- La solución a través de un papel de Whatman número 1 o equivalente del filtro y recoger en un tubo de centrífuga de polipropileno de 50 mL. Enjuagar el vaso de cristal dos veces con 6 M HCl. recoger los líquidos de enjuague de 25 mL del tubo y hacen hasta un volumen final con 6 M de HCl
Nota: cuando la concentración de NIC en una muestra se espera que sea cerca o por debajo del límite de cuantificación del método (0,010 mg/kg) , o por el contrario, alta, los pasos de mineralización 5.5-5.7 deben modificarse utilizando los volúmenes dados en la tabla 1, que proporcionaría un límite inferior de cuantificación. Nuevamente disueltas y reducidas previamente muestras son estables durante 24 h a 4 ° C. Por lo menos dos espacios en blanco de reactivo deben ser usados para el proceso analítico general.
6. Calibración
Nota: para propósitos de cuantificación utilizan una curva de calibración externa de as (III) en el rango 0.5 - 10 μg/L. Use un as (v) disponibles en el mercado certificada solución estándar de 1000 mg/L para la construcción de la calibración curva aplicando diluciones subsecuentes.
- Preparar un 10 mg/L de solución estándar de as (v) Pipetear 1 mL de la solución estándar de 1000 mg/L en un matraz aforado de 100 mL y enrasar con 6 M de HCl.
- Preparar un 0,1 mg/L solución estándar de as (v) Pipetear 1 mL de la solución estándar de as (v) en un matraz aforado de 100 mL 10 mg/L y llenar hasta la marca con 6 M de HCl.
- Preparar un 25 μg/L as (v) solución Pipetear 25 mL de la solución estándar de as (v) en un matraz aforado de 100 mL 0,1 mg/L y llenar hasta la marca con 6 M de HCl.
- Preparar la curva de calibración de as (III) como sigue: pipetear de 25 μg/L solución estándar de as (v) los volúmenes dados en la tabla 2 en matraz aforado de 50 mL, añadir 10 mL de la solución de la reducción en cada Fiola, esperar 30 min, luego llenar hasta la marca con 6 M de HCl. Otros volúmenes son convenientes siempre que mantienen las proporciones descritas.
- Preparar una blanco de calibración como sigue: Pipetear 10 mL 6 M de HCl y 10 mL previamente reducir la solución en un matraz aforado de 50 mL. Espere 30 minutos y llene a la marca con 6 M.
- Utilizar los estándares marcados como QC1 y QC2 en la tabla 2 como control de calidad: QC1 asegura que la cuantificación a nivel de baja concentración es correcta y QC2, asegura que la respuesta es estable en altas concentraciones, con ninguna deriva significativa en tiempo.
7. Determinación
espectrómetro de absorción de- uso una atómica equipado con un muestreador automático, un sistema de generación de hidruro de inyección de flujo y una célula electro-térmica de calefacción de cuarzo para fines de detección y cuantificación, siguiendo el instrumental condiciones para la cuantificación de iAs FI-HG-AAS que se enumeran en la tabla 3.
8. Cuantificación
- calcular el iAs fracción de masa en las muestras analizadas (expresada en mg/kg), utilizando la siguiente ecuación:

donde:
C x: concentración en el extracto (μg/L), calculada a partir de la curva de calibración
C BI: concentración en la muestra en blanco de reactivo (μg/L), extrapolada de la curva de calibración
V: volumen Final de la etapa de mineralización de muestra (5.7), generalmente V = 25 mL
w: peso de muestra ( en gramos)
Resultados
El método fue aplicado para determinar la fracción de masa de iAs en varios alimentos básicos adquiridos de distintos mercados españoles. Los resultados obtenidos con este método una serie de matrices diferentes se clasifican en la tabla 4 después de las categorías utilizadas por EFSA3 en un informe en que se evalúa la exposición al arsénico inorgánico en la población europea en el base de datos reportados por los laboratorios de Control oficial (OCL). Los resultados en la tabla 4 representan la media de tres repeticiones ± la desviación estándar de reproducibilidad (SR) para las categorías de alimentos diferentes, calculadas durante el ensayo colaborativo en el que el presente método fue validado13. Los resultados que se muestran en la tabla 4 están en acuerdo con otros previamente publicados en similares matrices11,12,14.
De particular relevancia son los resultados obtenidos para IA en diferentes tipos de arroz debido a límites máximos están incluidos para ellos en la legislación europea de contaminantes en alimentos1. Los valores más altos obtenidos por arroz integral y la más baja de arroz blanco, de acuerdo con los resultados de la OCLs3. Los niveles más altos se encontraron la hierba de mar Hizikia fusiforme, cuyo consumo ha sido desalentado por varias autoridades como se indica en el informe de la EFSA.
El funcionamiento de los laboratorios que participaron en el PTs organizado por el EURL-HM y el CCI y que utiliza este método para la determinación de iAs, se ha comparado el rendimiento de los laboratorios usando otros métodos. La mayoría de los otros métodos se basa en HPLC-ICP-MS (alrededor del 50% de los resultados evaluados) y el HG-AAS sin separación previa de la NIC de otras especies de arsénico (25% del total), figura 1. Otros enfoques utilizan (alrededor del 15% de los resultados evaluados), se basaron en atomización electrotérmica (ETAAS), detección de fluorescencia y ICP acoplada a espectroscopia de emisión atómica (ICP-AES), con y sin generación de hidruros y se evalúan conjuntamente bajo el nombre de "Otros métodos" porque los números individuales sería muy pocos de cualquier significación estadística.
Algunos de los laboratorios que han utilizado el método evaluado introdujo algunas variaciones en el protocolo original y utilizan ICP-MS en lugar de FI-HG-AAS. Con frecuencia los laboratorios no se aplica el paso de digestión seca (paso 5 en el protocolo) y acaba de introducir la etapa de ácido clorhídrico de 1 M en el ICP-MS. El PTs evaluado cubierto diversas matrices:15,16arroz, trigo, espinacas, algas17 chocolate18.
El funcionamiento de los laboratorios fue expresado como puntaje z:

Donde:
xlab es el resultado de la medición por un participante en un PT
Xref es el valor asignado (usado para los laboratorios de referencia). En todos los PTs tratados en este documento el valor asignado fue establecido por un grupo de laboratorios especializados en el campo del análisis de iAs diferentes métodos analíticos.
Σ es la desviación estándar para la evaluación de competencia, fijada por el proveedor de PT teniendo en cuenta el estado del arte en una determinada área de análisis. En los puntos considerados en este trabajo σ era el 15% del valor asignado de arroz y trigo, 22% en las algas y el 25% de espinacas y chocolate.
La interpretación de la puntuación z se realiza según ISO 17043: 201019:
| puntuación de | ≤ 2 satisfactorio (S) rendimiento
2 < | puntuación | < 3 cuestionable desempeño de (Q)
| puntuación de | ≥ 3 desempeño insatisfactorio (U)
Setenta y cinco por ciento de los resultados obtenidos con el método descrito anteriormente, tiene un z-score satisfactorio. La determinación de la fracción de masa de iAs en las algas resultó ser un reto como era de esperar, teniendo en cuenta la compleja distribución de las especies de arsénico en matrices de origen marino. Dos de los tres valores registrados en IMEP-112 para IA en las algas, utilizando este método, consiguieron una puntuación z insatisfactoria. La misma dificultad se observó entre los resultados obtenidos con otros métodos. Excluyendo los resultados registrados de iAs en las algas, el 85% de los resultados obtenidos con el método evaluado fueron satisfactorio.
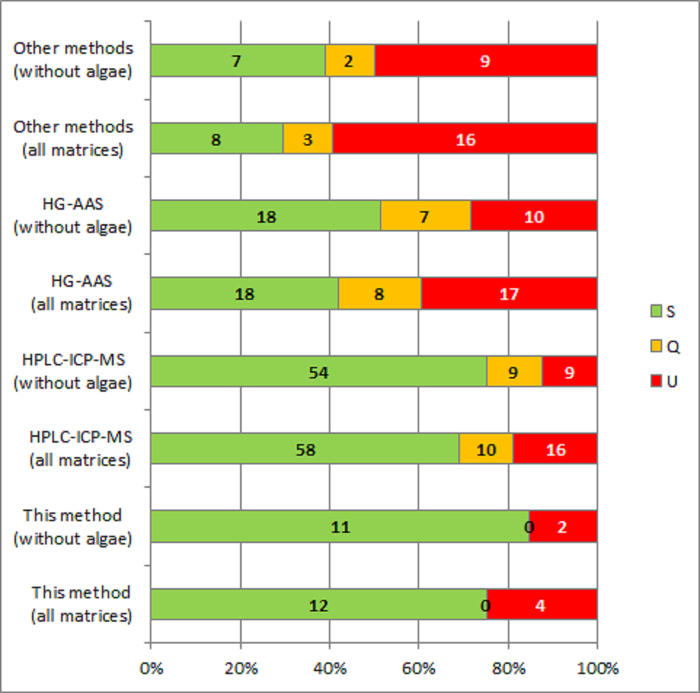
Figura 1: Comparación de actuaciones (expresado en puntajes z) de laboratorios tomando parte en PTs (IMEP-107, 112 IMEP, EURL-HM-20 e IMMR-PT-43) con el método descrito en este artículo y con otros métodos comúnmente aplicados. S:, p: cuestionable y U: insatisfactoria. Haga clic aquí para ver una versión más grande de esta figura.
| Fracción de masa esperada NIC inferior a 0,010 mg/kg | Fracción de masa esperada NIC superior a lo que está cubierto por la curva de calibración | |
| volumen de ácido clorhídrico 6 mol L-1 utilizada para volver a disolver las cenizas (mL) | 2 | 10 |
| La reducción de volumen (mL) de agente | 2 | 10 |
| Volumen final (mL) | 10 | 50 |
Tabla 1: modificaciones del protocolo cuando se esperan analizar muestras muy baja o muy alta iAs concentraciones.
| Concentración en el curva de calibración (μg/L) | Alícuota (mL) |
| 0.5 | 1 |
| 1 | 2 (QC1) |
| 2.5 | 5 |
| 5 | 10 (QC2) |
| 7.5 | 15 |
| 10 | 20 |
| Todas as (III) las soluciones estándar de calibración serán elaboradas recién antes de cada calibración. | |
Tabla 2: Alícuotas a tomar de los 25 μg/L de solución estándar de as (v) construir la curva de calibración de as (III) en un volumen final de 50 mL.
Generación de hidruros · Ejemplo de bucle: 0,5 mL (para ser adaptado cuando el volumen de reconstitución de la solución final de la reducción es diferente de 25 mL). · Agente reductor: 0,2% (p/v) de NaBH4 0.05% (p/v) de NaOH; 5 mL/min de caudal. · Disolución de HCl 10% (v/v), 10 mL/min de caudal. · Gas portador: argón, 100 mL/min de caudal. Absorción atómica
Espectrómetro de · Longitud de onda: 193.7 nm · Paso de banda espectral: 0.7 nm · Lámpara de descarga sin electrodos sistema 2 · Ajuste actual de la lámpara: 400 mA · Temperatura de la célula: 900 ° C
Tabla 3: Condiciones instrumentales utilizados para Ia cuantificación HG-AAS.
| Alimentos | yo-como (μg/kg peso fresco) | |
| Cereales y productos a base de grano | ||
| Arroz | Blanco | ± 113 18 |
| 73 ± 12 | ||
| 56 ± 9 | ||
| Marrón | 197 ± 32 | |
| 125 ± 20 | ||
| 275 ± 44 | ||
| Vaporizado | 134 ± 21 | |
| 159 ± 25 | ||
| Obleas | 162 ± 26 | |
| 127 ± 20 | ||
| Productos vegetales y verduras | ||
| Setas deshidratadas | Boletus edulis | 174 ± 10 |
| Galocybe gambosa | 74 ± 4 | |
| Marasmius oreades | 104 ± 6 | |
| Cantharellus lutescens | 16 ± 1 | |
| Lentinula edodes | 96 ± 6 | |
| Algas marinas | Hizikia fusiforme | 97000 ± 14550 |
| 44943 ± 6742 | ||
| Fucus vesiculosus | 288 ± 43 | |
| 433 ± 65 | ||
| Pescados y otros mariscos | ||
| Carne de pescado | Pardete | 53 ± 12 |
| 21 ± 5 | ||
| Anguila europea | 72 ± 16 | |
| 42 ± 9 | ||
| Cangrejos de río | 33 ± 7 | |
| 20 ± 4 | ||
| Atún | 11 ± 2 | |
| 5 ± 1 | ||
| Moluscos | Almeja | 243 ± 54 |
| 133 ± 29 | ||
| Mejillones | ± 32 32 | |
| 139 ± 31 | ||
Tabla 4: Resultados obtenidos para una gama de diferentes Matrices aplicando el método descrito.
Discusión
Un paso crítico en el protocolo descrito es el limpiar de la fase de cloroformo (paso 3.2) porque cualquier fase ácida residuos restantes en la fase de cloroformo conducirá a resultados de iAs sobrestimada puesto que todas las especies de arsénico en la muestra están presentes en el ácido fase. Esto es de particular relevancia cuando se analizan muestras marinas debido a la presencia de una gran cantidad de especies orgánicas, que podrían explicar la mayor parte de la fracción de masa de arsénico presente en la muestra. El uso de una membrana hidrofóbica de PTFE (3.3) es de suma importancia. Si una emulsión se forma durante la extracción de iAs en cloroformo, puede aumentarse la velocidad de centrifugación (3.1). También pueden aplicarse otros métodos tradicionales para eliminar las emulsiones. Otro paso fundamental es la mineralización (paso 5.3). La tasa de aumento de temperatura debe ser aplicada estrictamente para evitar cualquier proyecciones que reducirían la recuperación de iAs conduce a un sesgo negativo sin control y podrían ser peligroso para el analista.
Como se mencionó anteriormente algunos laboratorios han utilizado el método evaluado utilizando ICP-MS en lugar de FI-HG-AAS. En tal caso no es necesario el paso de digestión seca (paso 5 en el protocolo) y la fase de HCl de 1 M puede introducirse en el ICP-MS. En el caso de HG-AAS, debido a su mayor límite de detección, es necesario un paso de la concentración que también elimina posibles interferencias.
El porcentaje de resultados satisfactorios obtenidos con el método descrito en este papel, con y sin los resultados registrados de las algas, es comparable a la de HPLC-ICP-MS y mayor que la del HG-AAS. La última técnica (HG-AAS) está extensamente disponible pero propenso a interferencias de especies arsenicales orgánicas, especialmente en alimentos básicos con un patrón de distribución de las especies de arsénico complejos. El menor porcentaje de resultados satisfactorios caracteriza a los obtenidos con "Otros métodos", pero debe tenerse en cuenta que abarca diversos enfoques analíticos, cada uno de ellos representado por una pequeña cantidad de los resultados, figura 1. El método presentado en este trabajo es una alternativa al más sofisticado/costoso HPLC-ICP-MS, todavía se caracteriza por un rendimiento similar en matrices complejas. Con frecuencia el uso de técnicas de guión, como HPLC-ICP-MS, requiere operadores altamente calificados e infraestructuras costosas. El método presentado en este trabajo se puede implementar por cualquier Analista de capacitación en química analítica básica.
Existen algunos inconvenientes principales asociados al método. Es tiempo ya que se deben seguir varios pasos para separar iAs de otras especies de arsénico y a iAs pre-concentrado a niveles incluso sub-ppm. Implica el uso de cloroformo. Hay una tendencia a evitar el uso de compuestos clorados en los laboratorios, debido a los efectos negativos que podría tener. Sin embargo, si se mantienen buenas prácticas de laboratorio y las muestras se manejan en campanas, podrían evitarse los efectos negativos. MMA interfieren en la determinación de NIC. Esto se debe tener en cuenta al analizar las muestras en que MMA podría estar presente, como las algas, pescados y otros mariscos. Sin embargo, MMA es normalmente presente en pequeñas cantidades que serían cubiertas por la incertidumbre asociada a los resultados obtenidos para NIC.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a Dr. F. Cordeiro del CCI para las discusiones útiles sobre tratamiento estadístico de los datos. Laboratorios especializados en el análisis de la NIC en matrices biológicas que proporcionaron resultados para ser utilizado como asignaron valor en PTs y son reconocidos laboratorios que participaron en el estudio PTs.
Materiales
| Name | Company | Catalog Number | Comments |
| Deionised water | Any available | 18.2 MΩ cm | |
| Concentrated hydrochloric acid (HCl). | Any available | Not less than 37 % m/v, c(HCl) = 12 mol/L, with a density of approx. ρ (HCl) 1.15 g/L | |
| Concentrated nitric acid (HNO3) | Any available | Not less that 65 % m/v, c(HNO3) = 14 mol/L, with a densitiy of approx. ρ 1.38 g/L | |
| Chloroform | Any available | Harmful by inhalation and if swallowed. Irritating to skin. Wear suitable protective clothing and gloves. | |
| Hydrogen bromide (HBr) | Any available | Not less than 48 % m/v | |
| Hydrazine sulphate (N2H6SO4) | Any available | Harmful if swallowed. Causes burns. May cause cancer. | |
| Magnesium nitrate hexahydrate [Mg(NO3)6H2O] | Any available | ||
| Magnesium oxide (MgO) | Any available | ||
| Potassium iodide (KI) | Any available | ||
| Ascorbic acid (C6H8O6) | Any available | ||
| Sodium hydroxide (NaOH) | Any available | ||
| Sodium borohydride (NaBH4) | Any available | ||
| Arsenic (V) standard solution | Any available | 1,000 mg/L Use certified standard solutions commercially available | |
| Centrifuge | Any available | ||
| Mechanical shaker | Any available | ||
| Sand bath | Any available | ||
| Muffle furnace | Any available | ||
| Polypropylene centrifuge (PC) tubes | Any available | 50 mL with screw cap | |
| Syringe filters with hydrophobic PTFE membrane | Any available | 25 mm diameter | |
| Pyrex glass beaker | Any available | Tall form 250 mL, capable of withstanding 500 °C | |
| Watch glasses | Any available | ||
| Volumetric flasks | Any available | 10, 25, 100 or 200, Class A. | |
| Plastic funnels | Any available | ||
| Whatman n° 1 paper or equivalent | Any available | ||
| Atomic absorption spectrometer equipped with a flow injection system (FI-AAS) | Any available |
Referencias
- European Commission. Commission Regulation (EC) 1881/2006 setting maximum levels for certain contaminants in foodstuffs. , OJ, L364/5 (2006).
- EFSA Panel on Contaminants in the Food Chain (CONTAM). Scientific Opinion on Arsenic in Food. EFSA J. 7 (10), 1351(2009).
- European Food Safety Authority. Dietary exposure to inorganic arsenic in the European population. EFSA J. 12 (3), 3597(2014).
- de la Calle, M. B., et al. Does the determination of inorganic arsenic in rice depend on the method? TrAC. 30 (4), 641-651 (2011).
- GB/T5009.11-2003. Determination of total arsenic and abio-arsenic in foods. , (2003).
- European Committee for Standardisation. EN 15517:2008 "Determination of trace elements-Determination of inorganic As in seaweed by hydride generation atomic absorption spectrometry (HG-AAS) after digestion". , (2008).
- de la Calle, M. B., et al. Is it possible to agree on a value for inorganic arsenic in food? The outcome of IMEP-112. Anal Bioanal Chem. 404 (8), 2475-2488 (2012).
- Schmeisser, E., Goessler, W., Kienzl, N., Francesconi, K. Volatile analytes formed from arsenosugars: determination by HPLC-HG-ICPMS and implications for arsenic speciation analyses. Anal. Chem. 76 (2), 418-423 (2004).
- EN 16802:2016. Foodstuffs. Determination elements and their chemical species. Determination of inorganic arsenic in foodstuffs of marine and plant origin by anion-exchange HPLC-ICP-MS. , BSI Standards Publication. (2016).
- European Committee for Standardisation. Animal feeding stuffs – Determination of inorganic arsenic by hydride generation atomic absorption spectrometry (HG-AAS) after microwave extraction and separation by solid phase extraction (SPE). , (2012).
- Rasmussen, R. R., Qian, Y., Sloth, J. J. SPE HG-AAS method for the determination of inorganic arsenic in rice. Results from method validation studies an a survey on rice products. Anal Bioanal Chem. 405 (24), 7851-7857 (2013).
- Rasmussen, R. R., Hedegaard, R. V., Larsen, E. H., Sloth, J. J. Development and validation of a method for the determination of inorganic arsenic in rice. Results from method validation studies and a survey on rice products. Anal Bioanal Chem. 403, 2825-2834 (2012).
- Fiamegkos, I. Accuracy of a method based on atomic absorption spectrometry to determine inorganic arsenic in food: Outcome of the collaborative trial IMEP-41. Food Chem. 213, 169-179 (2016).
- Llorente-Mirandes, T., Barbero, M., Rubio, R., López-Sánchez, J. F. Occurrence of inorganic arsenic in edible Shiitake (Lentinula edodes) Products. Food Chem. 158, 207-215 (2014).
- de la Calle, M. B., Linsinger, T., Emteborg, H., Charoud-Got, J., Verbist, I. Report of the seventh interlaboratory comparison organised by the European Union-Reference Laboratory for Heavy Metals in Feed and Food. IMEP-107: Total and inorganic As in rice. , EUR 24314 EN (2010).
- Cordeiro, F., Cizek-Stroh, A., de la Calle, B. Determination of total and inorganic arsenic in rice. IRMM-PT-43 Proficiency Test Report. , EUR 28100 EN (2016).
- de la Calle, M. B., et al. IMEP-112: Total and inorganic arsenic in wheat, vegetable food and algae. , EUR 24937 EN (2011).
- Fiamegkos, I. Determination of total As, Cd, Pb, Hg and inorganic arsenic in chocolate. EURL-HM-20 Proficiency test Report. , JRC 98502 (2015).
- ISO-Geneva (CH), International Organization for Standardization. ISO 17043: Conformity assessment - General requirements for proficiency testing. , (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados