Method Article
Determinazione dell'arsenico inorganico in una vasta gamma di matrici alimentari mediante la generazione di idruro - spettrofotometria di assorbimento atomico.
In questo articolo
Riepilogo
È dimostrata l'utilità di un metodo analitico per determinare arsenico inorganico in una vasta gamma di matrici alimentari. Il metodo consiste nell'estrazione selettiva di arsenico inorganico in cloroformio con una determinazione finale mediante spettrometria di assorbimento atomico per la generazione di idruro.
Abstract
Il cibo sicurezza autorità europea (EFSA) ha sottolineato nel suo parere scientifico sull'arsenico negli alimenti che, al fine di sostenere una valutazione audio esposizione ad arsenico inorganico attraverso la dieta, informazioni sulla distribuzione delle specie di arsenico in vari tipi di alimenti devono essere generati. Un metodo, precedentemente validato in un processo collaborativo, è stato applicato per determinare arsenico inorganico in una vasta gamma di matrici alimentari, che comprende cereali, funghi e cibo di origine marina (31 campioni in totale). Il metodo si basa sulla rilevazione mediante spettrometria di assorbimento atomico per la generazione di iniezione-idruro flusso degli iAs estratti selettivamente in cloroformio dopo la digestione delle proteine con HCl concentrato. Il metodo è caratterizzato da un limite di quantificazione di 10 µ g/kg di peso secco, che ha permesso di quantificazione di arsenico inorganico in una grande quantità di matrici alimentari. Informazioni sono fornite su punteggi di prestazione dati ai risultati ottenuti con questo metodo e che sono stati segnalati da diversi laboratori in diversi esami di abilità linguistica. La percentuale di risultati soddisfacenti ottenuti con il metodo discusso è superiore a quello dei risultati ottenuti con altri approcci analitici.
Introduzione
Poiché massime di gennaio 2016 di arsenico inorganico (iAs) in diverse materie prime di riso sono state incluse nel regolamento (CE) 1881/2006 della Commissione impostazione tenori massimi di alcuni contaminanti nei prodotti alimentari1 con 0.10 µ g/L per riso destinati per il produzione di alimenti per lattanti e bambini, 0,20 µ g/L per il riso lavorato parboiled non (riso o bianco lucido), 0,25 µ g/L per il riso parboiled e riso semigreggio e 0.30 µ g/L per cialde di riso, riso wafer, cracker di riso e dolci di riso. Questo aggiornamento della legislazione europea per contaminanti nei prodotti alimentari ha seguito il parere scientifico sull'arsenico negli alimenti dell' autorità europea per la sicurezza alimentare (EFSA)2 in cui è stimato che l'esposizione attraverso la dieta allo iAs per il consumatore medio e alti in Europa è tale che può costituire un rischio per alcuni consumatori, tenendo presente che l'esposizione cronica a iAs provoca il cancro del polmone, della pelle e della vescica e lesioni cutanee. Nella relazione scientifica dell'EFSA sull'esposizione alimentare ad arsenico inorganico nella popolazione europea3, pubblicato nel 2014, si conclude che i principali contributori allo iAs nella dieta per i consumatori di tutte le età sono prodotti procedati fatti diversi da quelli di cereali riso e che anche riso, latte, prodotti lattiero-caseari e acqua potabile contribuiscono significativamente all'ingestione di iAs, con latte e derivati, essendo i principali contributori per bimbi e neonati.
Nel 2010 il laboratorio di riferimento dell'Unione europea per i metalli pesanti nei mangimi e negli alimenti, EURL-HM, correva un proficiency test, IMEP-107, per la determinazione degli iAs in riso, dimostrando che era possibile determinare iAs in riso con sufficiente precisione, indipendentemente dal fatto il Metodo analitico utilizzato4.
Diversi metodi analitici sono stati convalidati per la determinazione degli iAs nei prodotti alimentari. Cina è stata il primo paese a introdurre nella sua legislazione un livello massimo per il servizio iAs in riso. Per rendere possibile l'attuazione della legislazione, un metodo standard è stato pubblicato nel 2003 per la determinazione di ciò che nello standard è chiamato "abio-arsenico"5. Comitato europeo di normalizzazione (CEN), pubblicato nel 2008 un metodo standardizzato, EN 15517:2008, per la determinazione degli iAs in alghe6. I due metodi si basano sull'uso di condizioni ottimizzate per generare arsina solo dagli iAs. In che modo separazione degli iAs da altre specie di arsenico che può anche generare idruro di arsenico non è necessaria. La determinazione finale avviene tramite fluorescenza atomica5 mediante spettrometria di assorbimento atomico generazione di idruro, HG-AAS6. Tuttavia, è difficile impostare le condizioni esatte per generare idruro di arsenico senza subire interferenze di altri composti di arsenico e tutte le frazioni di massa in iAs nelle alghe segnalate in IMEP-112 (PT organizzato da EURL-HM) ottengono con questi due metodi , sono stati segnati come insoddisfacente7. Specie di organico dell'arsenico, come l'acido monomethylarsonic (MMA), acido dimethylarsinic (DMA) e arsenozuccheri presenti in campioni di alghe, può generare anche idruri volatili e potrebbero interferire nella determinazione degli iAs che conduce ad una polarizzazione positiva nei risultati8 .
Recentemente, CEN ha pubblicato un nuovo metodo standard, EN 16802:2016, per la determinazione degli iAs negli alimenti di origine marina e vegetale mediante HPLC-ICP-MS9. Non tutti i laboratori sono attrezzati con quel tipo di strumentazione e metodi non costoso, straight-forward sono necessari, in particolare nei paesi con meno infrastrutture di laboratorio sviluppato.
Nel 2012 CEN standardizzato un metodo per la determinazione degli iAs in animali d'alimentazione di HG-AAS dopo l'estrazione del forno a microonde e off-line separazione di iAs mediante estrazione in fase solida (SPE), EN 16278:201210. Questo metodo che ha dimostrato di essere in forma per l'analisi di iAs nei mangimi potrebbe mancare la sensibilità necessaria per determinare iAs negli alimenti di origine non Marina, che, secondo l'EFSA, sembra essere i principali contributori dietetici in Europa3. Tuttavia, lo stesso gruppo che ha sviluppato e convalidato EN 16278:2012 testato e correttamente applicato e validato il metodo per determinare iAs in pesce e riso in una prova collaborativa11,12.
Un metodo alternativo per la determinazione degli iAs in matrici alimentari dopo estrazione selettiva degli iAs in cloroformio e ulteriore quantificazione di HG-AAS, recentemente è stato convalidato da centro comune di ricerca (CCR) in una prova collaborativa13. La selettività del metodo è migliore di quella di HG-AAS diretto ed è facile da implementare non richiedere l'uso di strumentazione sofisticata come HPLC-ICP-MS. In questo manoscritto, la fattibilità dell'utilizzo di questo metodo per determinare iAs in una vasta gamma di matrici alimentari: verdure, cereali, funghi e cibo di origine marina, è stata valutata. Inoltre, le prestazioni dei laboratori che ha utilizzato il metodo a proficiency test organizzato da EURL-HM e il CCR che copre diverse matrici sono descritto.
Protocollo
Nota: tutto il materiale utilizzato deve essere decontaminati con 10% (m/v) HNO 3 e sciacquato almeno due volte con acqua deionizzata.
1. idrolisi
- pesare accuratamente ca. 0,5 a 1 g del campione liofilizzato (o l'equivalente quantità di campione fresco omogeneizzato per esempio da 1 a 4 g) in una provetta da centrifuga polipropilene 50 mL con vite Cap.
- Aggiungere 4,1 mL di acqua deionizzata.
- Agitare con l'agitatore meccanico per circa 5 minuti fino a quando il campione è completamente bagnato.
- Aggiungere 18,4 mL di acido cloridrico concentrato (HCl), non meno di 37% m / v.
- Agitare con l'agitatore meccanico per 15 min.
- Lasciare riposare per 12-15 h (per esempio durante la notte).
2. Estrazione
- aggiungere 2 mL di acido bromidrico (HBr) non meno di 48% m/v e 1 mL di solfato di idrazina (N 2 H 6 SO 4) soluzione (15 mg/mL) al campione idrolizzato.
- Agitare per 30 s con un agitatore meccanico.
- Aggiungere 10 mL di cloroformio (CHCl 3).
- Agitare per 5 minuti con un agitatore meccanico.
- Centrifugare per 5 min 800 x g.
- Pipetta la fase di cloroformio (fase inferiore) in un'altra provetta di polipropilene centrifuga da 50 mL.
- Aggiungere ancora 10 mL di cloroformio per la rimanente fase acida e ripetere l'estrazione. Alla fine circa 20 mL di cloroformio dovrebbe sono stati raccolti. Prestare attenzione per evitare la contaminazione incrociata dalla fase acida.
3. Clean-up della fase di cloroformio
- centrifuga le fasi di cloroformio in pool per 5 min a 800 x g. Il tempo di centrifugazione o la velocità può essere aumentata se necessario per ottenere una netta separazione delle due fasi.
- Rimuovere tutti i residui di acido fase rimanente sul cloroformio con una pipetta da 1 mL. Questo passaggio è cruciale. Eventuali residui di acido fase rimanente nella fase di cloroformio porterà a sopravvalutati iAs risultati perché tutte le altre specie di arsenico nel campione sono presenti nella fase acida.
- Filtrare attraverso una membrana in PTFE idrofobica (25 mm di diametro) per rimuovere i residui restanti di fase solida o acido presenti nella fase di cloroformio e raccogliere la fase di cloroformio in un tubo di centrifuga in polipropilene da 50 mL.
4. Retro-estrazione
- aggiungere 10 mL di 1 M HCl per estrarre indietro iAs dalla fase di cloroformio raccolti dopo la fase di filtrazione.
- Agitare per 5 minuti con un agitatore meccanico.
- Centrifugare per 5 min 800 x g.
- Pipetta la fase acida (fase superiore) e versare in un bicchiere di vetro 250 mL (ad es. Pyrex) per mineralizzazione.
- Ripetere il retro-estrazione e combinare le fasi di HCl raccolte.
5. Mineralizzazione di esempio
Nota: questo passaggio permette l'eliminazione delle interferenze e pre-concentrazione in campioni in cui la frazione di massa di iAs è vicino a o sotto il limite di quantificazione, e viene spesso omesso dai laboratori che utilizzano questo protocollo con ICP-MS per la determinazione finale invece di HG-AAS.
- Sospendere 20 g di nitrato di magnesio esaidrato [Mg (NO 3) 2 6 H 2 O] e 2 g di ossido di magnesio (MgO) in 100 mL di acqua deionizzata. Aggiungere 2,5 mL della sospensione per il bicchiere di vetro. Agitare la sospensione mentre lo si aggiunge per evitare la precipitazione.
- Aggiungere 10 mL di concentrato HNO 3 di almeno 65% m/v ed evaporare a secchezza in un bagno di sabbia (o una lastra termica), evitando eventuali proiezioni. Per verificare che i campioni siano completamente asciutti, mettere un vetro da orologio sopra il bicchiere di vetro e verificare che nessuna condensa.
- Coprire il becher con vetri da orologio e metterli in un forno a muffola a temperatura iniziale non superiore a 150 º c e aumentare progressivamente la temperatura a 425 ± 25 ° C a una velocità di 50 ° C/h. Maintain a 425 ° C per 12 h. Questo passaggio è fondamentale. Per evitare eventuali proiezioni il tasso di aumento della temperatura deve essere rigorosamente implementato.
- Consentire la cenere si raffreddi a temperatura ambiente.
- Aggiungere 0,5 mL di acqua deionizzata per bagnare la cenere e poi aggiungere 5 mL di HCL 6 M. Fare attenzione a recuperare tutta la cenere dalle pareti del bicchiere di vetro. Sciogliere la cenere completamente, agitazione se necessario.
- Aggiungere 5 mL di pre-riduzione agente, preparato da sciogliere 5 g di ioduro di potassio (KI) e 5 g di acido ascorbico in 100 mL di acqua deionizzata, e attendere 30 minuti per ottenere una riduzione quantitativa degli iAs per fosfatici.
- Filtrare la soluzione attraverso una carta numero 1 Whatman o equivalente e raccoglierlo in una provetta da centrifuga polipropilene 50 mL. Sciacquare il bicchiere di vetro due volte con 6 M HCl. raccogliere i liquidi risciacquo in 25 mL di un tubo e rendono fino a un volume finale con 6 M HCl
Nota: quando la concentrazione di iAs in un campione dovrebbe essere nelle vicinanze o sotto il limite di quantificazione del metodo (0,010 mg/kg) , o al contrario, alta, i passaggi di mineralizzazione 5.5-5.7 dovrebbero essere modificati utilizzando i volumi riportati nella tabella 1, che fornirebbe un limite inferiore di quantificazione. Ri-disciolti e pre-ridotti campioni sono stabili per 24 h a 4 ° C. Almeno due spazi vuoti di reagente devono essere utilizzati per il processo intero analitico.
6. Taratura
Nota: quantificazione fini uso una curva di calibrazione esterna di fosfatici nell'intervallo 0,5 - 10 µ g/L. utilizzare un 1000 mg/L pentavalente commercialmente disponibile soluzione standard certificata per costruire la calibrazione curva applicando successive diluizioni.
- Preparare un 10 mg/L di soluzione standard pentavalente Pipettare 1 mL della soluzione standard di 1.000 mg/L in un matraccio tarato da 100 mL e riempire fino alla tacca con 6 M HCl.
- Preparare un 0,1 mg/L di soluzione standard pentavalente Pipettare 1 mL di 10 mg/L pentavalente soluzione standard in un matraccio tarato da 100 mL e riempire fino alla tacca con 6 M HCl.
- Preparare una 25 µ g/L pentavalente standard soluzione pipettaggio 25 mL di 0,1 mg/L pentavalente soluzione standard in un matraccio tarato da 100 mL e riempire fino alla tacca con 6 M HCl.
- Preparare la curva di taratura di fosfatici come segue: pipetta da 25 µ g/L soluzione standard pentavalente i volumi indicati nella tabella 2 in matraccio tarato da 50 mL, aggiungere 10 mL della soluzione di pre-riduzione in ciascun matraccio, aspettare 30 min, quindi riempire fino alla tacca con 6 M HCl. Altri volumi sono adatti a condizione che mantengono le proporzioni sopra descritte.
- Preparare una calibrazione vuota come segue: Pipettare 10 mL 6 M HCl e 10 mL pre-riducendo la soluzione in un matraccio tarato da 50 mL. Attendere 30 min e riempire quindi alla tacca con 6 M.
- Utilizzare gli standard contrassegnati come QC1 e QC2 in tabella 2 come controllo di qualità: QC1 assicura che la quantificazione a livello di bassa concentrazione sia corretta e DC2, assicura che la risposta è stabile alle alte concentrazioni, con nessuna significativa deriva in tempo.
7. Determinazione
- uso un'atomica spettrometro di assorbimento munito con un auto-campionatore, un sistema di generazione di iniezione-idruro di flusso e una cella di quarzo elettro-termica riscaldata a fini di rilevazione e quantificazione, seguendo la strumentale condizioni per la quantificazione degli iAs da FI-HG-AAS, come elencato nella tabella 3.
8. Quantificazione
- calcolare la iAfrazione s massa nei campioni analizzati (espressa in mg/kg), utilizzando la seguente equazione:

dove:
C x: concentrazione nell'estratto (µ g/L), calcolata sulla curva di calibrazione
C BI: concentrazione nel campione in bianco del reagente (µ g/L), estrapolati dalla curva di taratura
v: volume finale del passaggio di mineralizzazione del campione (5,7), solitamente V = 25 mL
w: peso del campione ( in grammi)
Risultati
Il metodo è stato applicato per determinare la frazione di massa di iAs in diversi prodotti alimentari acquistati da vari mercati spagnoli. I risultati ottenuti con questo metodo per una serie di diverse matrici sono classificati in tabella 4 seguendo le categorie utilizzate da EFSA3 in un report in cui viene valutata l'esposizione alimentare all'arsenico inorganico nella popolazione europea il base di dati riportati da laboratori di controllo ufficiale (OCL). I risultati nella tabella 4 rappresentano la media dei tre repliche ± la deviazione standard di riproducibilità (SR) per le categorie di alimenti diversi, calcolate durante il processo collaborativo in cui il presente metodo è stato convalidato13. I risultati mostrati nella tabella 4 sono in buon accordo con altri precedentemente pubblicati in simili matrici11,12,14.
Di particolare rilevanza sono i risultati ottenuti per il servizio iAs in diversi tipi di riso perché limiti massimi sono inclusi per loro nella legislazione europea per i contaminanti negli alimenti1. I valori più alti essendo ottenuti per riso integrale e il più basso per il riso bianco, in accordo con i risultati del OCLs3. I livelli elevati sono stati trovati per l'erba di mare Hizikia fusiforme, cui il consumo è stato scoraggiato dalle diverse autorità come indicato nella relazione dall'EFSA.
Le prestazioni dei laboratori che hanno partecipato a PTs organizzato da EURL-HM e il CCR e che usa questo metodo per la determinazione degli iAs, è stato confrontato con le prestazioni dei laboratori utilizzando altri metodi. La maggior parte degli altri metodi si basano su HPLC-ICP-MS (circa il 50% dei risultati valutati) e HG-AAS senza separazione precedente di iAs da altre specie di arsenico (25% del totale), Figura 1. Altri approcci utilizzati (circa il 15% dei risultati valutati), erano basati su atomizzazione elettrotermica (ETAAS), rilevazione della fluorescenza e ICP accoppiato alla spettroscopia di emissione atomica (ICP-AES), con e senza generazione di idruri e vengono valutati insieme sotto il nome di "Altri metodi" perché i numeri individuali sarebbero troppo pochi per essere di qualsiasi significato statistico.
Alcuni dei laboratori che hanno utilizzato il metodo valutato introdotto alcune varianti del protocollo originale e 4x0 FI-HG-AAS, ICP-MS. Spesso tali laboratori non si applica il passaggio asciutto lampeggiante (punto 5 del protocollo) e appena introdotto la fase di HCl 1 M in ICP-MS. Il PTs valutato coperto diverse matrici: riso15,16, grano, spinaci, alghe17 e cioccolato18.
Le prestazioni dei laboratori è stata espressa come punteggio z:

Dove:
xlab è il risultato della misurazione segnalato da un partecipante in un PT
Xref è il valore assegnato (utilizzato per il benchmarking laboratori). In tutti i PTs trattate nell'ambito di questa carta il valore assegnato è stato fondato da un gruppo di laboratori specializzati nel campo dell'analisi di iAs utilizzando diversi metodi analitici.
Σ è la deviazione standard per la valutazione di competenza, fissato dal provider PT prendendo in considerazione lo stato dell'arte in una certa area di analisi. Nel PTs considerato in questa carta σ era 15% del valore assegnato per riso e grano, 22% nelle alghe e 25% per spinaci e cioccolato.
L'interpretazione del punteggio z avviene secondo ISO 17043: 201019:
| Punteggio | ≤ 2 soddisfacente (S) performance
2 < | Punteggio | < 3 discutibile delle prestazioni (Q)
| Punteggio | ≥ 3 insoddisfacenti (U)
Settantacinque per cento dei risultati ottenuti con il metodo descritto in precedenza, ha ottenuto uno z-score soddisfacente. La determinazione della frazione massa iAs nelle alghe si è rivelato essere difficile come previsto, tenendo in considerazione la complessa distribuzione delle specie di arsenico in matrici di origine marina. Due su tre valori riportati nei IMEP-112 per il servizio iAs in alghe, utilizzando questo metodo, ha ottenuto un punteggio z insoddisfacente. La stessa difficoltà è stata osservata tra i risultati ottenuti con altri metodi. Escludendo i risultati segnalati per il servizio iAs in alghe, 85% dei risultati ottenuti con il metodo valutato erano soddisfacenti.
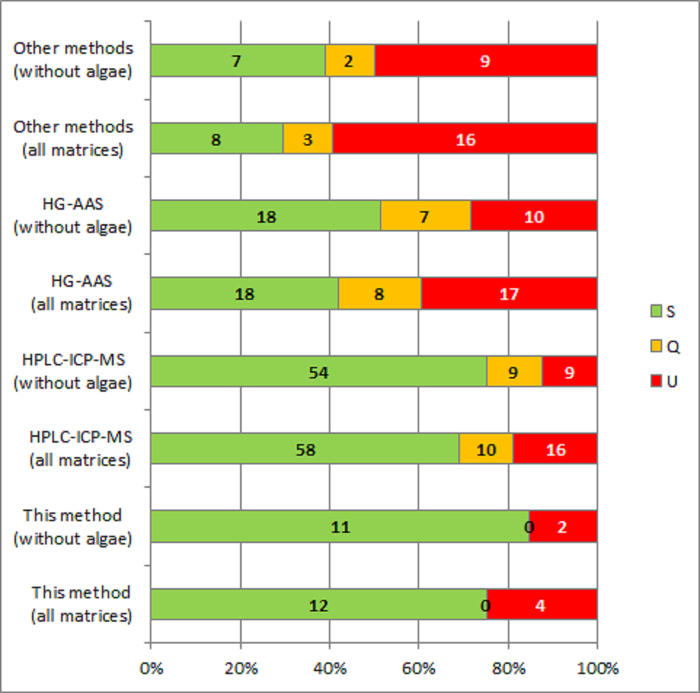
Figura 1: Confronto di prestazioni (espresso come z-score) dei laboratori prendendo parte a PTs (IMEP-107, IMEP-112, EURL-HM-20 e IRMM-PT-43) con il metodo descritto in questo documento e con altri metodi comunemente applicato. S: soddisfacente, q: discutibile e u: insoddisfacente. Clicca qui per visualizzare una versione più grande di questa figura.
| Frazione di massa iAs previsto inferiore a 0,010 mg/kg | Frazione di massa iAs previsto superiore a ciò che è coperto dalla curva di calibrazione | |
| volume HCL 6 mol L-1 utilizzato per ri-sciogliere le ceneri (mL) | 2 | 10 |
| Pre-riduzione agente volume (mL) | 2 | 10 |
| Volume finale (mL) | 10 | 50 |
Tabella 1: modifiche del protocollo quando l'analisi di campioni in cui molto bassa o molto alta iAs concentrazioni sono attesi.
| Concentrazione nella curva di taratura (µ g/L) | Aliquota (mL) |
| 0,5 | 1 |
| 1 | 2 (QC1) |
| 2.5 | 5 |
| 5 | 10 (DC2) |
| 7.5 | 15 |
| 10 | 20 |
| Tutte le soluzioni standard di taratura fosfatici devono essere preparate fresca prima di ciascuna taratura. | |
Tabella 2: Aliquote da prelevare da 25 µ g/L soluzione standard pentavalente per costruire la curva di calibrazione fosfatici in un volume finale di 50 mL.
Generazione di idruri · Esempio di ciclo: 0,5 mL (per essere adattato quando il volume di ricostituzione della soluzione pre-riduzione finale è diverso da 25 mL). · Agente riducente: 0,2% (w/v) NaBH4 a 0,05% (p/v) NaOH; 5 mL/min di portata. · Soluzione di HCl 10% (v/v), 10 mL/min di portata. · Gas vettore: Argon, 100 mL/min di portata. Assorbimento atomico
spettrometro · Lunghezza d'onda: 193.7 nm · Passa-banda spettrale: 0,7 nm · Sistema di lampade a Scarica senza elettrodi 2 · Impostazione corrente di lampada: 400 mA · Temperatura della cella: 900 ° C
Tabella 3: Condizioni strumentali utilizzati per il servizio iAs quantificazione di HG-AAS.
| Cibo | Io-come (µ g/kg di peso fresco) | |
| Cereali e prodotti a base di grano | ||
| Riso | Bianco | 113 ± 18 |
| 73 ± 12 | ||
| 56 ± 9 | ||
| Brown | 197 ± 32 | |
| 125 ± 20 | ||
| 275 ± 44 | ||
| Parboiled | 134 ± 21 | |
| 159 ± 25 | ||
| Wafer | 162 ± 26 | |
| 127 ± 20 | ||
| Prodotti vegetali e verdure | ||
| Fungo disidratato | Boletus edulis | 174 ± 10 |
| Galocybe gambosa | 74 ± 4 | |
| Marasmius oreades | 104 ± 6 | |
| Cantharellus lutescens | 16 ± 1 | |
| Lentinula edodes | 96 ± 6 | |
| Alghe di mare | Hizikia fusiforme | 97000 ± 14550 |
| 44943 ± 6742 | ||
| Fucus vesiculosus | 288 ± 43 | |
| 433 ± 65 | ||
| Pesce e frutti di mare | ||
| Carne di pesce | Flathead cefalo | 53 ± 12 |
| 21 ± 5 | ||
| Anguilla europea | 72 ± 16 | |
| 42 ± 9 | ||
| Gamberi di fiume | 33 ± 7 | |
| 20 ± 4 | ||
| Tonno | 11 ± 2 | |
| 5 ± 1 | ||
| Molluschi | Vongola | 243 ± 54 |
| 133 ± 29 | ||
| Cozza | 32 ± 32 | |
| 139 ± 31 | ||
Tabella 4: Risultati ottenuti per una gamma di differenti matrici applicando il metodo descritto.
Discussione
Un passo fondamentale nel protocollo descritto è il clean-up della fase di cloroformio (punto 3.2), perché qualsiasi fase acida residui restanti nella fase di cloroformio porterà a sopravvalutati iAs risultati poiché tutte le altre specie di arsenico nel campione sono presenti nell'acido fase. Questo è di particolare importanza quando si analizzano campioni marini dovuta alla presenza di una pletora di specie organiche, che potrebbero spiegare la maggior parte della frazione di massa di arsenico presente nel campione. L'uso di una membrana idrofobica di PTFE (3.3) è di fondamentale importanza. Se durante l'estrazione degli iAs in cloroformio si forma un'emulsione, si può aumentare la velocità di centrifugazione (3.1). Possono essere applicati anche altri approcci tradizionali per eliminare le emulsioni. Un altro punto critico è la mineralizzazione (punto 5.3). Il tasso di aumento della temperatura deve essere rigorosamente implementato per evitare eventuali proiezioni che ridurrebbero il recupero di iAs che conduce a un incontrollato bias negativo e potrebbero essere pericoloso per l'analista.
Come accennato in precedenza alcuni laboratori hanno utilizzato il metodo valutato mediante ICP-MS invece di FI-HG-AAS. In tal caso non è necessario il passaggio asciutto lampeggiante (punto 5 del protocollo) e la fase di HCl 1 M può essere introdotta nella ICP-MS. Nel caso di HG-AAS, a causa del relativo più alto limite di rilevazione, un passaggio di pre-concentrazione che elimina anche le possibili interferenze, è necessario.
La percentuale di risultati soddisfacenti ottenuti con il metodo descritto in questo documento, sia con che senza i risultati segnalati per le alghe, è paragonabile a quella di HPLC-ICP-MS e superiore a quella di HG-AAS. La seconda tecnica (HG-AAS) è ampiamente disponibile, ma soggetto a interferenze da specie di arsenico organiche, soprattutto in prodotti alimentari con un modello di distribuzione di specie complesse arsenico. La più bassa percentuale di risultati soddisfacenti caratterizza quelli ottenuti con "Altri metodi", ma deve essere tenuto a mente che copre diversi approcci analitici, ognuna di esse è rappresentata da una piccola quantità di risultati, Figura 1. Il metodo presentato in questa carta è un'alternativa al più sofisticato/costoso HPLC-ICP-MS, ancora caratterizzato da una simile performance anche in matrici complesse. Frequentemente l'utilizzo di tecniche ifenate, quali HPLC-ICP-MS, richiede operatori altamente qualificati e costose infrastrutture. Il metodo presentato in questa carta può essere implementato da qualsiasi analista addestrato a base chimica analitica.
Ci sono alcuni svantaggi principale associati al metodo. È che richiede tempo in quanto diversi passaggi devono essere seguite per separare iAs da altre specie di arsenico e allo iAs pre-concentrato fino a livelli anche sub-ppm. Essa implica l'uso di cloroformio. C'è una tendenza ad evitare l'uso di composti clorurati nei laboratori, a causa degli effetti negativi sulla salute che potevano avere. Tuttavia, se sono tenute buone pratiche di laboratorio e campioni vengono gestiti in cappe, potrebbero essere evitati quegli effetti negativi. MMA interferirà nella determinazione dell'iAs. Questo deve essere tenuto a mente quando si analizzano campioni in cui MMA potrebbe essere presente, come alghe, pesce e frutti di mare. Tuttavia, MMA è normalmente presente in piccole quantità che sarebbero coperti dall'incertezza associata ai risultati ottenuti per il servizio iAs.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano il Dr. F. Cordeiro del CCR per le utili discussioni sul trattamento statistico dei dati. Laboratori specializzati nell'analisi degli iAs in matrici biologiche che ha fornito risultati da utilizzare come assegnato valore in PTs e laboratori che hanno preso parte il PTs studiato sono riconosciuti.
Materiali
| Name | Company | Catalog Number | Comments |
| Deionised water | Any available | 18.2 MΩ cm | |
| Concentrated hydrochloric acid (HCl). | Any available | Not less than 37 % m/v, c(HCl) = 12 mol/L, with a density of approx. ρ (HCl) 1.15 g/L | |
| Concentrated nitric acid (HNO3) | Any available | Not less that 65 % m/v, c(HNO3) = 14 mol/L, with a densitiy of approx. ρ 1.38 g/L | |
| Chloroform | Any available | Harmful by inhalation and if swallowed. Irritating to skin. Wear suitable protective clothing and gloves. | |
| Hydrogen bromide (HBr) | Any available | Not less than 48 % m/v | |
| Hydrazine sulphate (N2H6SO4) | Any available | Harmful if swallowed. Causes burns. May cause cancer. | |
| Magnesium nitrate hexahydrate [Mg(NO3)6H2O] | Any available | ||
| Magnesium oxide (MgO) | Any available | ||
| Potassium iodide (KI) | Any available | ||
| Ascorbic acid (C6H8O6) | Any available | ||
| Sodium hydroxide (NaOH) | Any available | ||
| Sodium borohydride (NaBH4) | Any available | ||
| Arsenic (V) standard solution | Any available | 1,000 mg/L Use certified standard solutions commercially available | |
| Centrifuge | Any available | ||
| Mechanical shaker | Any available | ||
| Sand bath | Any available | ||
| Muffle furnace | Any available | ||
| Polypropylene centrifuge (PC) tubes | Any available | 50 mL with screw cap | |
| Syringe filters with hydrophobic PTFE membrane | Any available | 25 mm diameter | |
| Pyrex glass beaker | Any available | Tall form 250 mL, capable of withstanding 500 °C | |
| Watch glasses | Any available | ||
| Volumetric flasks | Any available | 10, 25, 100 or 200, Class A. | |
| Plastic funnels | Any available | ||
| Whatman n° 1 paper or equivalent | Any available | ||
| Atomic absorption spectrometer equipped with a flow injection system (FI-AAS) | Any available |
Riferimenti
- European Commission. . Commission Regulation (EC) 1881/2006 setting maximum levels for certain contaminants in foodstuffs. , (2006).
- EFSA Panel on Contaminants in the Food Chain (CONTAM). Scientific Opinion on Arsenic in Food. EFSA J. 7 (10), 1351 (2009).
- European Food Safety Authority. Dietary exposure to inorganic arsenic in the European population. EFSA J. 12 (3), 3597 (2014).
- de la Calle, M. B., et al. Does the determination of inorganic arsenic in rice depend on the method?. TrAC. 30 (4), 641-651 (2011).
- . GB/T5009.11-2003. Determination of total arsenic and abio-arsenic in foods. , (2003).
- European Committee for Standardisation. . EN 15517:2008 "Determination of trace elements-Determination of inorganic As in seaweed by hydride generation atomic absorption spectrometry (HG-AAS) after digestion". , (2008).
- de la Calle, M. B., et al. Is it possible to agree on a value for inorganic arsenic in food? The outcome of IMEP-112. Anal Bioanal Chem. 404 (8), 2475-2488 (2012).
- Schmeisser, E., Goessler, W., Kienzl, N., Francesconi, K. Volatile analytes formed from arsenosugars: determination by HPLC-HG-ICPMS and implications for arsenic speciation analyses. Anal. Chem. 76 (2), 418-423 (2004).
- . . EN 16802:2016. Foodstuffs. Determination elements and their chemical species. Determination of inorganic arsenic in foodstuffs of marine and plant origin by anion-exchange HPLC-ICP-MS. , (2016).
- European Committee for Standardisation. . Animal feeding stuffs – Determination of inorganic arsenic by hydride generation atomic absorption spectrometry (HG-AAS) after microwave extraction and separation by solid phase extraction (SPE). , (2012).
- Rasmussen, R. R., Qian, Y., Sloth, J. J. SPE HG-AAS method for the determination of inorganic arsenic in rice. Results from method validation studies an a survey on rice products. Anal Bioanal Chem. 405 (24), 7851-7857 (2013).
- Rasmussen, R. R., Hedegaard, R. V., Larsen, E. H., Sloth, J. J. Development and validation of a method for the determination of inorganic arsenic in rice. Results from method validation studies and a survey on rice products. Anal Bioanal Chem. 403, 2825-2834 (2012).
- Fiamegkos, I. Accuracy of a method based on atomic absorption spectrometry to determine inorganic arsenic in food: Outcome of the collaborative trial IMEP-41. Food Chem. 213, 169-179 (2016).
- Llorente-Mirandes, T., Barbero, M., Rubio, R., López-Sánchez, J. F. Occurrence of inorganic arsenic in edible Shiitake (Lentinula edodes) Products. Food Chem. 158, 207-215 (2014).
- de la Calle, M. B., Linsinger, T., Emteborg, H., Charoud-Got, J., Verbist, I. Report of the seventh interlaboratory comparison organised by the European Union-Reference Laboratory for Heavy Metals in Feed and Food. IMEP-107: Total and inorganic As in rice. , (2010).
- Cordeiro, F., Cizek-Stroh, A., de la Calle, B. Determination of total and inorganic arsenic in rice. IRMM-PT-43 Proficiency Test Report. , (2016).
- de la Calle, M. B., et al. . IMEP-112: Total and inorganic arsenic in wheat, vegetable food and algae. , (2011).
- Fiamegkos, I. Determination of total As, Cd, Pb, Hg and inorganic arsenic in chocolate. EURL-HM-20 Proficiency test Report. , (2015).
- ISO-Geneva (CH), International Organization for Standardization. . ISO 17043: Conformity assessment - General requirements for proficiency testing. , (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon