Method Article
Ablación de Taquicardia Ventricular isquémica usando un catéter Multipolar y el sistema de asignación 3-dimensional para la reconstrucción anatómica Electro alta densidad
En este artículo
Resumen
Con el siguiente protocolo, ofrecemos un acercamiento a la ablación de Taquicardia Ventricular (VT) con mapas de alta densidad con un catéter multipolar y sistema de mapeo 3D mejora el éxito del procedimiento.
Resumen
Taquicardia ventricular (VT) en pacientes con miocardiopatía isquémica resulta fundamentalmente de las cicatrices los infarto de miocardio; las cicatrices representan zonas de conducción lenta que permiten la aparición y mantenimiento de circuitos de reentrada. Ablación del catéter permite la modificación del substrato de las zonas de baja tensión y por lo tanto puede ayudar a alterar el tejido cicatricial de tal manera que las arritmias no pueden aparecer nunca más. Disminución de hospitalizaciones de los pacientes afectados, calidad de vida y aumento de resultados. Por lo tanto, la ablación VT representa un campo creciente en electrofisiología, especialmente para los pacientes con Canal auriculoventricular cicatrices en cardiopatía isquémica, infarto de miocardio. Sin embargo, la ablación de la taquicardia ventricular sigue siendo uno de los procedimientos más difíciles en el laboratorio de electrofisiología. Definición precisa de la cicatriz y la localización de potenciales anormales son críticos para el éxito de la ablación. El siguiente manuscrito describe el uso de un catéter de mapeo multipolar y 3 dimensiones sistema de mapeo (3D) para crear un mapa de electro anatómica de alta densidad del ventrículo izquierdo incluyendo una representación precisa de la cicatriz, así como asignación de fraccionado y potenciales finales para permitir una modificación del sustrato altamente preciso.
Introducción
Enfermedad coronaria e infarto de miocardio siguen siendo causas importantes de morbilidad y mortalidad en los países industrializados1. Cicatrices miocardio después del infarto transmural representan áreas de baja tensión y así zonas de lenta conducción eléctrica y facilitan la aparición y mantenimiento de circuitos de macro-reentrante. Taquicardias ventriculares (TV) están responsables de repetidas hospitalizaciones, crisis dolorosas de defibrillators implantables del cardioverter (ICD) y así disminuyen la calidad de vida y causan mal resultado2,3. Ablación con catéter puede reducir la ocurrencia de VT, especialmente en la cardiopatía isquémica4y debe ser considerada en pacientes con arritmias ventriculares y enfermedad cardíaca estructural subyacente en presencia de un ICD (clase de recomendación IIa B) 5. en pacientes con cardiopatía estructural con arritmias ventriculares ya sufren choques de CIE, se recomienda ablación (clase I recomendación B)5. Sin embargo, ablación con catéter es todavía un procedimiento de alto riesgo, teniendo en cuenta el estado a menudo pobres de la salud de los pacientes afectados con sobre todo la fracción de eyección ventricular izquierda reducida y múltiples comorbilidades. Además, la precisa Localización de cicatrices y potencial anormal puede ser difícil, pero son crítica para el éxito de la ablación. El uso de sistemas de mapas 3D y catéteres multipolares permiten mapeo electro anatómica de alta densidad y puede facilitar considerablemente la adquisición de información eléctrica y así mejorar la calidad y la validez del modelo 3D y en consecuencia mejorar ablación éxito y paciente el resultado. Hasta ahora, existen 3 sistemas diferentes mapas 3D disponibles, lo cual comúnmente se utiliza para ablación de VT. El siguiente protocolo describe un acercamiento a la ablación de VT isquémica Canal auriculoventricular mediante un sistema de mapeo 3 D menos comunes en el campo de la ablación de VT y un catéter multipolar (véase Tabla de materiales) para la reconstrucción anatómica electro alta densidad.
Protocolo
El siguiente protocolo cumple con las directrices del Comité de ética de investigación del Departamento de medicina interna/Cardiología del Hospital Hietzing en Viena.
1. medidas preliminares
- Administrar al paciente quien ablación VT está prevista en la sala de al menos 2 días antes del procedimiento.
- Adquirir el muestreo, radiografía del tórax y la ecocardiografia transtorácica de la sangre. En el caso conocido la fibrilación auricular (paroxística o persistente), realizar una ecocardiografía transesofágica un día antes del procedimiento.
- En el día de la ablación de VT, suspenda anticoagulantes orales (en caso de que el paciente toma algunos para la fibrilación atrial u otras comorbilidades que requieren el uso de anticoagulantes orales) y administrar antibióticos i.v..
2. paciente elaboración durante el procedimiento
- Aplicar electrodos autoadhesivos de ECG de ECG de 12 derivaciones (en el pecho - ver figura 1 complementaria - y las extremidades en una posición estándar) parches superficiales, electrodo neutro y un electrodo de referencia de sistema compatible con el 3D designado sistema de mapeo (véase Tabla de materiales) y un electrodo neutro para el catéter de ablación en una posición normal a la piel de patient´s (véase también suplementario Figura 2).
- Aplicar parches desfibrilador autoadhesivos a la piel de patient´s en la posición aconsejada (debajo de la clavícula derecha y en el ápex ventricular izquierdo) y encienda el desfibrilador.
- Desactivar las terapias de taquicardia del ICD con el programador adecuado, desactivar opcionalmente todas las funciones de dispositivo que puedan interferir con la ablación actual.
Nota: Terapias de taquicardia del ICD permanece desactivadas durante todo el procedimiento. Garantía cierre monitoreo y constante preparación del desfibrilador externo. - Utilizar un oxímetro de pulso para monitorizar la saturación de oxígeno.
- Introducir una envoltura a través de la arteria radial izquierda para monitorización invasiva de presión arterial, mediante técnica de Seldinger6 o con un arterial puntura sistema con una cánula integrada (véase Tabla de materiales).
- Desinfectar piel patient´s en ambas ingles con propanol 75% (véase Tabla de materiales) y cubren el cuerpo de patient´s con un paño estéril, escasamente las ingles.
Nota: En este punto, todas las personas entrar en el laboratorio de catéter y trabajando en proximidad cercana al paciente tienen que usar máscaras y capuchas.
3. punción y colocación de catéter en la ingle
- Aplicar anestesia local (Xilocaína) en ambas ingles por inyección subcutánea e introducir un catéter venoso central a través de la vena femoral izquierda y 3 vainas (5, 6 y 12 Fr) a través de la vena femoral derecha con técnica de Seldinger6.
- Colocar un catéter tetrapolar en el ápice del ventrículo derecho y un catéter orientable 8-polar en el seno coronario mediante fluoroscopia (viga posiciones: AP, RAO 30 ° y 60 ° de LAO).
Nota: Tan pronto como el equipo de rayos x está activado, todas las personas entrar en el laboratorio de catéter tienen que usar protección de plomo. - Conectar catéteres diagnóstico al sistema de electrofisiología y estimulador (véase tabla de materiales).
- Comprobar que el catéter tetrapolar en el ventrículo derecho tiene captura suficiente mediante la estimulación con una longitud de ciclo del ms 600 (o menos, si el paciente es tachycardic) y buscar la respuesta adecuada.
- Administrar heparina de 5000 IU a través de una vaina venoso en la ingle. Realizar las mediciones del tiempo (la ley) coagulación activado cada media hora con un dispositivo apropiado (véase Tabla de materiales, objetivo de la ley: por encima de 300 s).
- Introducir una vaina larga orientable (véase Tabla de materiales) vía la derecha femoral venosa a la aurícula derecha del corazón y realizar la punción trans-septal mediante una aguja apropiada conectada a una línea de sensores de presión (viga posiciones AP y LAO 90 ° o RAO 20 ° y LAO 50 ° según el investigador). Después de pinchar el tabique inter auricular del corazón, desconecte la línea del sensor de presión y aplicar medio de contraste a través de la aguja para comprobar la posición correcta dentro de la aurícula izquierda. A continuación, haga avanzar la vaina sobre el dilatador bajo control de fluoroscopia y coloque el extremo distal de la vaina larga orientable en el atrio izquierdo apuntando hacia el ventrículo izquierdo.
- Iniciar la anestesia general por la administración de propofol y remifentanilo.
4. Electro-anatómicas reconstrucción del ventrículo izquierdo
- Introducir un catéter de mapeo multipolar (catéter 16 poste dirigible, espacio 3-3-3, longitud de electrodo electrodo 1 mm, ver Tabla de materiales) en el ventrículo izquierdo a través de la vaina dirigible y recogemos datos anatómicos y eléctricos de la fibroelastosis ventrículo izquierdo mediante el sistema de mapeo 3D (véase Tabla de materiales) y el catéter multipolar.
- Definir voltaje de señal ventricular como sigue: cicatriz zona bajo 0,5 mV, baja tensión entre 0,5 y 1,5 mV y tensión normal por encima de 1.5 mV. Tenga cuidado de tomar en consideración sólo ventriculares del mismo tipo: ya sea intrínseca activación ventricular en ritmo sinusal o estimulado ventricular latidos si el paciente es dependiente del marcapasos. No utilice los complejos ventriculares prematuros. Usar la morfología característica de juego para resolver complejos ventriculares no deseados (ver figura 1).
- Opcionalmente, baje el límite de voltaje inferior a 0,2 mV para identificar tejido viable realizar dentro de la cicatriz (ver figura 2 y 3).
- Preste atención a fraccionada (activación ventricular con más de un componente) y finales (activación ventricular segunda claramente separada de la primera activación ventricular en un electrodo dado) potenciales y les anotar por separado (por ejemplo,. con etiquetas especiales, ver Figura 4A).
- Opcionalmente, ritmo del ventrículo derecho para separar claramente el potencial de finales de la primera activación ventricular (ver Figura 4B).
- Retire el catéter de mapeo multipolar e introducir un catéter de ablación de punta irrigada con sensor (espaciamiento de electrodo 2-2-2, véase Tabla de materiales) conectado a una bomba de refrigeración en el ventrículo izquierdo. Completar el mapa electroanatómico con el catéter de ablación agregando falta anatomía (electroanatómicos recoger puntos en lugares donde no podría colocar el catéter de multipoloar) y verificación de zonas de alto interés (es decir, zonas con muy fraccionado y finales potenciales, esas zonas de la etiqueta por separado, ver figuras 1-2).
5. programar la estimulación Ventricular (VP)
-
Realizar PVS7 vía el catéter en el apex ventricular derecho y el estimulador EP (véase tabla de materiales) utilizando un protocolo predefinido de hasta 9 pasos o hasta que se induce una VT sostenida:
- Comenzar con un tren de la impulsión de 6-beat (10 V durante 2 ms) con longitud de ciclo de 500 ms y añadir un estímulo extra de 350 ms intervalo de acoplamiento después del último estímulo del tren de la impulsión. Entonces, después de una pausa de al menos 5 s, repita esta maniobra por disminuir el intervalo de acoplamiento del estímulo extra cada ciclo de 10 ms hasta que se alcance el tiempo refractario del ventrículo derecho.
- Luego, añadir un estímulo extra segundo (empezando con ms de 350 intervalo de acoplamiento) y repetir el protocolo antes mencionado hasta el momento refractario ventricular. Par el primer estímulo extra con el siguiente intervalo: tiempo refractario más 20-30 ms, según corresponda (Asegúrese de que el primer estímulo extra captura el ventrículo derecho).
- Reducir el tren de la impulsión a 430 m, entonces 370 ms y en el pasado ms de 330 y repita los pasos antes mencionados.
- Por último, añadir un estímulo extra 3rd al tren de la impulsión de 500 ms y repita el protocolo antes mencionado.
- Repita el protocolo en el tacto de salida de ventrículo derecho (RVOT) si no VT sostenida puede ser inducida.
- Asegúrese de que el desfibrilador externo está listo para ofrecer una descarga en cualquier momento durante todo el procedimiento y vuelva a verificar antes de PVS.
-
En el caso de una VT sostenida monomorfa puede ser inducida (también se aplica lo siguiente si VT ocurre durante el mapeo o ablación):
- Crear un mapa de activación del ventrículo izquierdo mediante el sistema de asignación de 3 D (LAT-mapa: tiempo de activación local) si el VT es hemodinámicamente estable. Opcionalmente, realizar mapas de arrastre.
- Detener el VT por el estímulo de overdrive a través del catéter en el apex ventricular derecho o, si eso falla, por cardioversión/desfibrilación externa, si el VT es hemodinámicamente inestable.
- Marcar y anotar cada VT que puede ser inducida y compara que espontáneamente ocurre VTs o utilizarlo para pace mapping.
- Si no VT sostenida puede ser inducida, continuar con la modificación del sustrato (punto 6) en caso de una cicatriz bien definida en la miocardiopatía isquémica. Sin embargo, sin VT inducible en el inicio del procedimiento, no existe punto final claro y control del éxito de la terapia de ablación.
6. ablación
- Ablación de la radiofrecuencia de arranque regada con 35 a 45 W usando el catéter de ablación. Opcionalmente, use un catéter de fuerza de contacto que proporciona información de contacto de tejido. Aplicar energía por lesión hasta un fuerza-tiempo-integral de gs 450. Rodear las zonas cicatriciales por lesiones de ablación. Entonces, ablar todos los potenciales anormales previamente asignados (modificación del sustrato). Coincidir con ritmo trazado en eléctricamente interesantes regiones VTs previamente marcados.
- Preste especial atención a la impedancia del catéter de ablación (generalmente entre 90 y 150 ohmios), sonda temperatura (máximo 43 ° C) y patient´s (en comparación con el valor inicial) de la presión de la sangre. Inmediatamente detener la ablación si impedancia desciende o se eleva considerablemente en comparación con el valor inicial.
7. post ablación
-
Después de la ablación, repita PVS.
- Si arritmias ventriculares pueden ser inducidas, reevaluar el sustrato y continuar con la ablación (ver puntos 5 y 6).
- Si no puede inducirse ninguna arritmia, detener el procedimiento.
- Deje de anestesia general (opcionalmente un anestesiólogo de anestesia general y discontinúa gradualmente todos los agentes sedantes al final del procedimiento).
- Quite todos los catéteres y las envolturas del corazón.
- Volver a activar las terapias de taquicardia del ICD y restaurar antes desactivadas todas las funciones.
- Realizar ecocardiografía transtorácica para excluir la efusión pericardial.
- Tomar una medida final de la ley y administrar protamina, si procede.
- Retirar las vainas de la ingle derecha y aplicar un vendaje de compresión. Sigue siendo el catéter venoso central en la ingle izquierda.
- Tan pronto como el paciente está despierto y extubados, llevarlo a la unidad de cuidados intensivos para la vigilancia de otros.
Resultados
El protocolo describe en detalle ablación de taquicardia ventricular monomórfica en un paciente con cardiopatía isquémica después de infarto del miocardio anterior con oclusión de la arteria descendiente anterior izquierda proximal. El paciente sufrió de múltiples entregas de choque ICD. La ecocardiografía transtorácica demostró una función ventricular izquierda sistólica severamente reducida (fracción de eyección 30%) con un aneurysm grande del ápice. Ablación de VT fue realizada usando un sistema de mapeo 3D (véase Tabla de materiales) y un catéter multipolar de mapeo orientable (16 polos) (véase Tabla de materiales, tamaño del electrodo 1 mm, electrodos espaciado 3-3-3). Adquisición simultánea de numerosos puntos de asignación permite una reconstrucción electroanatómica rápida y precisa del ventrículo izquierdo (ver figuras 1, 2 y 3). El espaciamiento de electrodo cerca del catéter multipolar hizo posible la detección de señales críticas como potenciales fragmentados y finales. Estimulación adicional desde el ventrículo derecho claramente separado el potencial de finales de la primera activación ventricular y así identificado el área asignado como una zona de conducción lenta y por lo tanto de gran importancia con respecto a la aparición y mantenimiento de arritmias ventriculares (ver figura 4). Áreas que no se alcanzaba con el catéter multipolar donde abordó con el catéter de ablación (véase Tabla de materiales), que también tiene un espaciamiento de electrodo cerca de 2-2-2.
Por medio de todas las estrategias de asignación antes mencionados, se pudo generar un mapa muy preciso, mostrando un área de la cicatriz en el ápex ventricular izquierda y áreas adyacentes (ver figuras 1, 2 y 3, cicatriz area 54 cm2). Sin embargo, tiempo de asignación podría limitarse a 27 min.
Durante la ablación y la estimulación ventricular programada, se podía inducir un total de 4 VTs. Uno de ellos (ver figura 3de complementaria ) podría arrastrado y quitado por ablación con éxito en la zona de borde lateral de la cicatriz. Además, modificación del sustrato fue realizada por alrededor de la cicatriz, separándose todos los finales potenciales anormales y sitios de ablación de ritmo mapas que empareja el VTs inducido.
Al final del procedimiento, no se podía inducir VT con las secuencias de estimulación que el VTs al principio del procedimiento. Sólo un VT con origen presumiblemente epicárdico se podía inducir con estimulación muy agresiva. Decidimos dejar el procedimiento en ese momento.
El método descrito ayuda a mejorar el éxito de la ablación y el resultado del paciente.
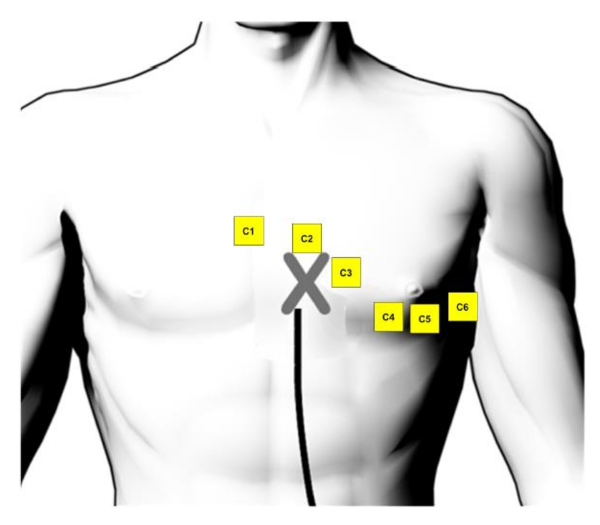
Suplementario Figura 1: colocación de los electrodos ECG. La posición de los electrodos de ECG superficiales en el pecho (tomado y adaptado de manual de usuario de 3D mapping system8). Haga clic aquí para ver una versión más grande de esta figura.
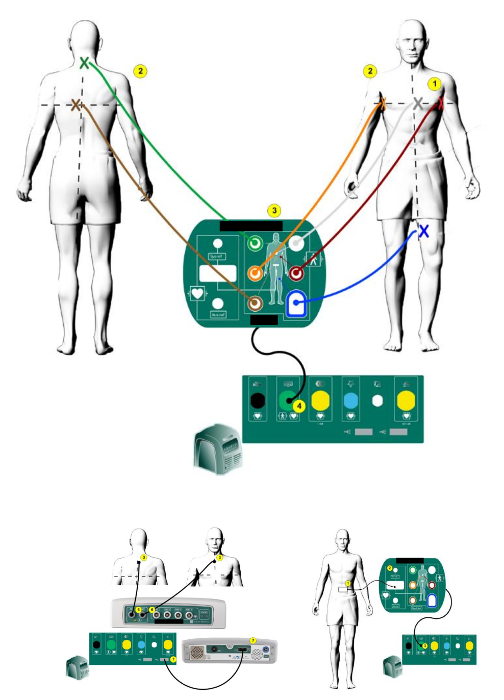
Suplementario Figura 2: posición de parche de sistema de mapeo 3D. La posición de los parches de EnSite Precision™ en el cuerpo (tomado y modificado del manual de usuario de 3D mapping system8). Haga clic aquí para ver una versión más grande de esta figura.
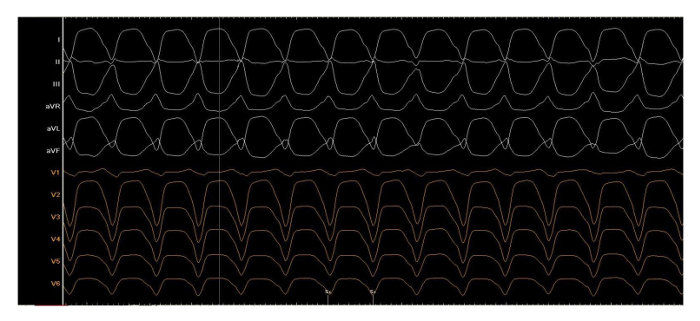
Suplementario Figura 3: taquicardia clínica. Uno de los cuatro induce taquicardias ventriculares durante el procedimiento, escrito con 50 mm/s, ciclo largo 440 Sra. haga clic aquí para ver una versión más grande de esta figura.
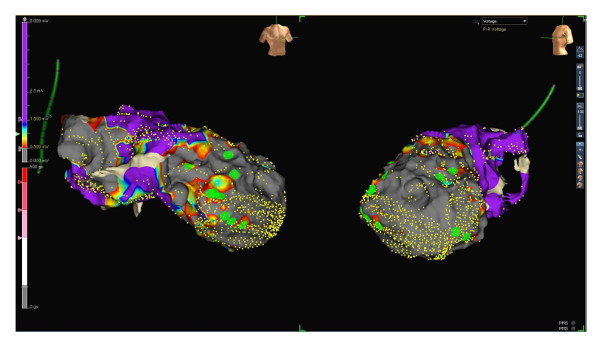
Figura 1 : Mapa de voltaje rango 0.5 a 1.5 mV. RAO (lado izquierdo) y proyecciones de LAO (lado derecho) de un mapa de la tensión del ventrículo izquierdo endocárdico. Pequeños puntos amarillos representan puntos de mapeo electro anatómico. El voltaje de señal ventricular se define como la cicatriz por debajo de 0.5 mV (gris), la tensión baja entre 0.5 y 1.5 mV (de rojo a azul) y la tensión normal por encima de 1.5 mV (púrpura, ver la escala en el lado izquierdo de la figura). Grandes puntos verdes representan potenciales finales. Haga clic aquí para ver una versión más grande de esta figura.
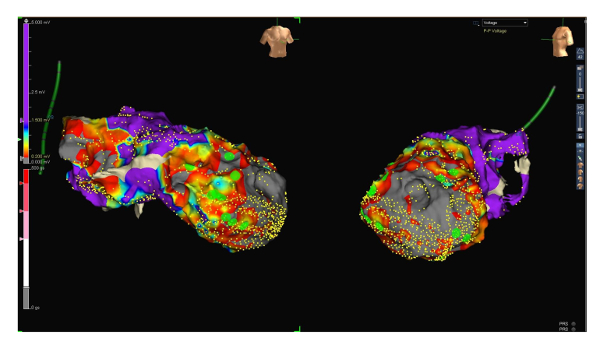
Figura 2 : Mapa de voltaje rango 0.2 a 1.5 mV. Mapa de RAO (lado izquierdo) y Laos (lado derecho) proyecciones de la misma tensión, esta vez con una gama de bajo voltaje entre 0,2 y 1,5 mV. Tenga en cuenta el tejido aún viable y por lo tanto llevando a cabo ahora desigual dentro de la cicatriz. Finales potenciales (puntos verdes) se encuentran aquellas áreas que probablemente representan zonas de conducción lenta. Haga clic aquí para ver una versión más grande de esta figura.
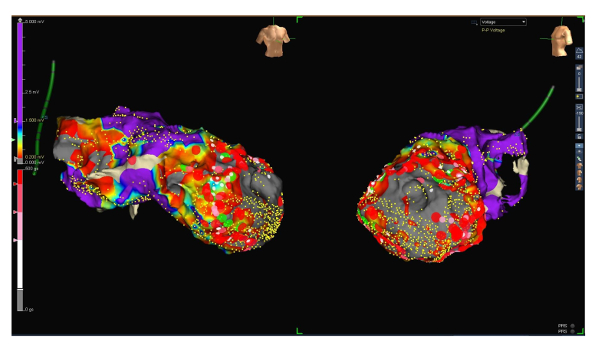
Figura 3 : Mapa de voltaje con las lesiones de ablación. RAO (lado izquierdo) y proyecciones de LAO (derecha) del mapa de tensión del ventrículo izquierdo endocárdico (rango de bajo voltaje entre 0,2 y 1,5 mV) incluyendo lesiones de ablación (puntos rojos grandes). Haga clic aquí para ver una versión más grande de esta figura.
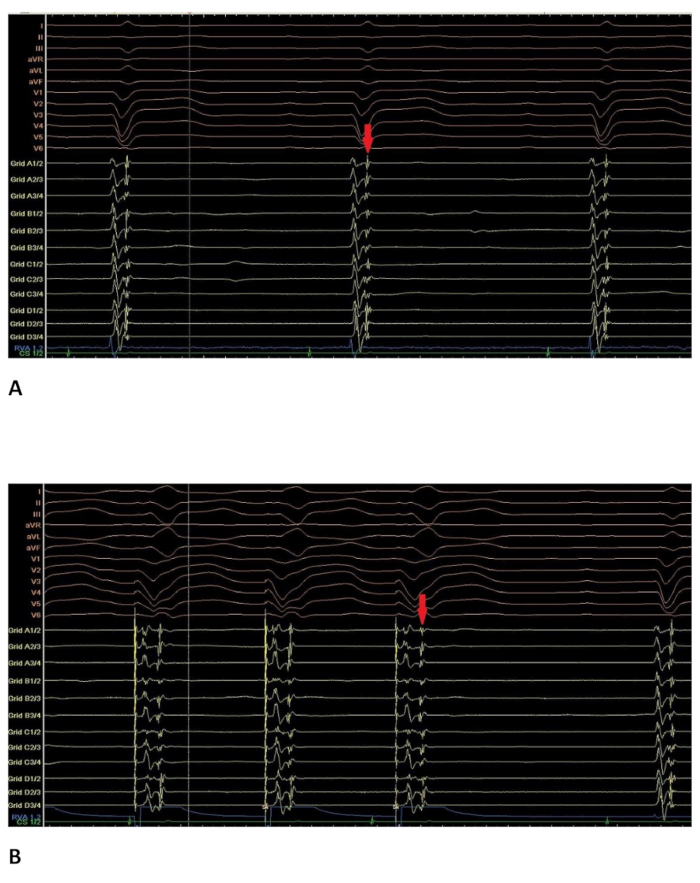
Figura 4 : Electrograma intracardiaco con finales potenciales. Electrograma intracardiaco en un sitio donde podrían grabarse finales potenciales. ECG de 12 derivaciones en la cima de la pantalla; RVAd: catéter en el ápice del ventrículo derecho; Rejilla: catéter multipolar (16 polos); CS: catéter de 8 polos en el seno coronario. (A) en ritmo sinusal. El potencial último visible en el catéter multipolar (marcado con la flecha roja) se encuentra directamente después de la primera activación ventricular. (B) durante la estimulación de la RVA en el mismo sitio. El potencial último visible en el catéter multipolar (flecha roja) ahora está claramente separado de la primera activación ventricular. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El uso de sistemas de mapas 3D en procedimientos electrofisiológicos complejos es un método bien establecido para adquirir información anatómica detallada y precisa y reducir el tiempo de radiación y permite la creación de sustrato y activación mapas9. Sin embargo, la adquisición de datos puede ser difícil debido al movimiento del catéter difícil, especialmente en el ventrículo izquierdo. Además, mapa punto por punto la adquisición lleva mucho tiempo y así prolongates el procedimiento electrofisiológico. Espaciamiento de electrodo ancho en la punta del catéter de mapeo reduce la resolución y la calidad del mapa creado, señales críticas pueden ser pasado por alto. El uso de un catéter multipolar para el mapeo del ventrículo soluciona los problemas antes mencionados: varios puntos de la cartografía se pueden tomar al mismo tiempo; disminuye el tiempo del procedimiento. Los electrodos espaciados estrecho garantizan una muy alta resolución del mapa, importante las señales no son tan fácilmente perder ya.
Actualmente, existen 3 sistemas de diferentes mapas 3D disponibles, todas ellas permitiendo el uso de catéteres de mapeo multipolar.
Hasta ahora, uno de ellos usando un campo magnético es ampliamente utilizado, especialmente en ablación de VT, debido a su fácil manejo y reconstrucción electroanatómica altamente preciso. Un catéter de mapeo adecuado, un catéter orientable de 20 polos con espaciamiento de electrodo estrecho, puede acceder incluso difíciles anatomías debido a su especial configuración (forma de estrella) y proporciona alta densidad precisa mapas10.
Un novedoso sistema de mapeo 3D también permite una adquisición muy rápida y precisa de varios puntos de la cartografía por medio de un catéter de mapeo de 64 electrodos con una cesta forma11,12.
El sistema de mapeo 3D utilizado en el protocolo (véase Tabla de materiales) combina la tecnología de impedancia y el campo magnético y así permite la navegación precisa y seguimiento precisa de catéteres de mapeo y ablación, ya sea convencional o sensor activado. Los mapas electro anatómico creados son altamente exactos y don´t necesita más post-proceso en comparación con versiones anteriores del sistema de asignación. Una gran ventaja para la asignación exacta es la función que empareja de morfología, que permite la continua comparación de la morfología QRS durante la adquisición de mapa. El catéter adecuado mapeo de 16 polos (véase Tabla de materiales) permite la adquisición de puntos múltiples simultáneamente y hace posible de alta resolución y la detección de las señales críticas incluso pequeñas debido a su espaciamiento de electrodo estrecho (3-3-3).
Para más lejos mejorar la calidad del mapa e identificar potenciales críticos, hemos cambiado la gama de baja tensión de 0.5-1.5 mV a 0.2-1.5 mV (para identificar el tejido viable y llevando a cabo dentro de la cicatriz). Curiosamente, más tardíos potenciales fueron detectados en zonas viables dentro de la cicatriz (ver figura 1 y figura 2).
Por estimulación del catéter en el ventrículo derecho, finales potenciales claramente podrían ser separados de la primera activación ventricular (ver Figura 4B).
A pesar de la 4.Extended del catéter de mapeo de 16 polos, no nos podríamos acceder a todas las regiones del ventrículo izquierdo. Estos sitios debían abordarse con el catéter de ablación, que también tiene espaciamiento de electrodo cercano (2-2-2), así como un sensor pressor para garantizar el contacto con la pared adecuada.
A pesar de todas las mencionadas ventajas, la más sofisticadas que obtiene un método, más propensa es a los disturbios. Ruido del catéter puede ocurrir y hacer muy difícil la interpretación de señales. Artefactos pueden simular potenciales eléctricamente interesantes y confundir al investigador. Catéteres multipolares requieren más cables que se pueden dañar, la conexión puede ser perturbada, solución de problemas de tiempo de los costos.
A pesar de esas desventajas, catéteres multipolares, si utiliza correctamente y por investigadores experimentados, son muy útiles para procedimientos electrofisiológicos complejos y tiene un gran potencial en el futuro. Reducción del tiempo de procedimiento ayuda a prevenir los eventos adversos en estos pacientes a menudo muy malos. La información eléctrica adicional proporcionada ha de ser interpretado con cuidado y junto con otros parámetros disponibles
Divulgaciones
Ninguno.
Agradecimientos
Ninguno.
Materiales
| Name | Company | Catalog Number | Comments |
| NaVX EnSite Precision 3 D mapping system | Saint Jude Medical | ||
| EnSite Precision Surface Electrode Kit | St. Jude Medical | EN0020-P | |
| Ampere RF Ablation generator | St. Jude Medical | H700494 | |
| EP-4, Cardiac Stimulator | St. Jude Medical | EP-4I-4-110 | |
| LabSystem PRO EP recording system, v2.4a | Boston Scientific | ||
| octapolar diagnostic catheter, EP-XT | Bard | 200797 | electrode spacing 2-10-2 |
| supreme quadripolar diagnostic catheter | St. Jude Medical | 401441 | electrode spacing 5-5-5 |
| Agilis NxT 8.5F, 71/91 cm steerable sheath, large curl | St. Jude Medical | G408324 | |
| BRK transseptal needle, 98 cm | St. Jude Medical | 407206 | |
| Advisor HD Grid mapping catheter, sensor enabled | St. Jude Medical | D-AVHD-DF16 | electrode spacing 3-3-3 |
| quadripolar irrigated tip ablation catheter, TactiCath SE | St. Jude Medical | A-TCSE-F | electrode spacing 2-2-2 with pressure sensor |
| Cool Point pump for irrigated ablation | St. Jude Medical | IBI-89003 | |
| Cool Point tubing set | St. Jude Medical | 85785 | |
| GEM PCL Plus Instrumentation laboratory | IL Werfen India Pvt. Ltd. | activated clotting time measurement device | |
| X-ray equipment | Philips | ||
| Heartstart XL defibrillator and associated patches | Philips | ||
| 12 F Fast-Cath sheath | St. Jude Medical | 406128 | |
| 6 F sheath | Johnson-Johnson | ||
| 5 F sheath | Johnson-Johnson | ||
| BD Floswitch™ | Becton Dickinson | ||
| Isozid®-H gefärbt | Novartis |
Referencias
- The top 10 causes of death. Health Organization Organization. , fact sheet Nr 310 (2007).
- Poole, J. E., et al. Prognostic importance of defibrillator shocks in patients with heart failure. N. Engl. J. Med. 359 (10), 1009-1017 (2008).
- Kamphuis, H. C., de Leeuw, J. R., Derksen, R., Hauer, R. N., Winnubst, J. A. Implantable cardioverter defibrillator recipients: quality of life in recipients with and without ICD shock delivery: a prospective study. Europace. 5 (4), 381-389 (2003).
- Stevenson, W. G., et al. Irrigated radiofrequency catheter ablation guided by electroanatomic mapping for recurrent ventricular tachycardia after myocardial infarction: the multicenter thermocool ventricular tachycardia ablation trial. Circulation. 118 (25), 2773-2782 (2008).
- The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart. 36 (41), 2793-2867 (2015).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography; a new technique. Acta radiol. 39 (5), 368-376 (1953).
- Kossaify, A., Refaat, M. Programmed ventricular stimulation - indications and limitations: a comprehensive update and review. Hellenic J Cardiol. 54, 39-46 (2013).
- Figures taken and modified from the user handbook of the EnSite Precision Cardiac Mapping System. , Available from: https://manuals.sjm.com (2017).
- Tsuchiya, T. Three-dimensional mapping of cardiac arrhythmias - string of pearls. Circ J. 76 (3), 572-581 (2012).
- Cano, O., et al. Utility of high density multielectrode mapping during ablation of scar-related ventricular tachycardia. J Cardiovasc Electrophysiol. 28 (11), 1306-1315 (2017).
- Schaeffer, B., et al. Characterization, mapping and ablation of complex atrial tachycardia: initial experience with a novel method of ultra-high-density 3D mapping. J Cardiovasc Electrophysiol. 27 (10), 1139-1150 (2016).
- Latcu, D. G., et al. Selection of critical isthmus in scar-related atrial tachycardia using a new automated ultrahigh resolution mapping system. Circ Arrhythm Electrophysiol. 10 (1), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados