Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo de escala de laboratorio para evaluar olor y concentraciones de Gas emitidas por profundo camas Pack abono
En este artículo
Resumen
Un protocolo ha sido desarrollado para medir gases, olores y composición nutricional en los paquetes de abono con escala de laboratorio, que puede utilizarse para estudiar formas de mejorar la calidad del aire en instalaciones de ganado comercial usando paquetes de estiércol de cama profunda.
Resumen
Se desarrolló un modelo simulado camas paquete de escala de laboratorio para estudiar la calidad del aire y composición nutricional de los paquetes de camas profunda utilizada en las instalaciones de mono-cuesta de ganado. Este protocolo ha sido utilizado para evaluar eficazmente muchos materiales de ropa de cama de diferentes variables ambientales (temperatura, humedad) y potencial tratamiento de mitigación que puede mejorar calidad del aire en instalaciones de mono-pendiente de camas profundas comerciales. El modelo es dinámico y permite a los investigadores recoger fácilmente muchas mediciones químicas y físicas de la unidad camas. Las mediciones semanales, recogidas en el transcurso de seis a siete semanas, permite tiempo suficiente para ver cambios en las mediciones de calidad de aire en el tiempo a medida que madura el paquete de camas. Los datos recogidos de los paquetes de camas simulados dentro de la gama de concentraciones previamente mide en instalaciones comerciales de camas profundas mono-pendiente. Estudios anteriores han demostrado que 8-10 unidades experimentales por tratamiento son suficientes para detectar diferencias estadísticas entre los paquetes de camas simulados. Los paquetes de camas son fáciles de mantener, que requieren menos de 10 minutos de mano de obra por camas paquetes por semana agregar orina, heces y cama. Toma de muestras utilizando el sistema de muestreo de gas requiere de 20-30 minutos por paquete camas, dependiendo de las medidas que se están recopilando. El uso de paquetes dobles de escala de laboratorio permite al investigador y control de variables como temperatura, humedad y fuente de ropa de cama que son difíciles o imposibles de controlar en una investigación o centro comercial. Mientras que no una simulación perfecta de condiciones "reales", el simulado camas paquetes sirven como un buen modelo para los investigadores estudiar las diferencias de tratamiento entre los paquetes de camas. Varios estudios de laboratorio pueden realizarse para eliminar posibles tratamientos antes de tratar en una investigación o centro comercial de tamaño.
Introducción
Instalaciones de confinamiento de bovinos para carne son una opción de vivienda popular en el medio oeste y superior Great Plains. Instalaciones de confinamiento son más comunes en esta región que las planicies del sur porque la región recibe más precipitación anual, que crea más escurrimiento de feedlot que debe contener. Muchos productores optaron por construir graneros mono pendiente para bovinos de carne. Las principales razones citadas por los productores para la selección de una instalación mono pendiente era la capacidad de eliminación de horario laboral y el abono y un rendimiento mejorado en comparación con abierta muchos corrales de engorda1. La mayoría de productores de ganado bovino (72,2%) con graneros de mono-cuesta mantener un paquete de camas para una vuelta de ganado o más, usando un sistema de gestión de la ropa de cama profunda para el lecho y residuos1. El material de cama más común usado es el rastrojo del maíz, aunque informe de productores con rastrojo de soja, paja de trigo, mazorcas de maíz y polvo1. Debido a la demanda regional para cama de rastrojo de maíz, muchos productores estaban interesados en materiales de lecho alternativo que podrían ser utilizados en instalaciones mono-pendiente. Además de economía y el confort animal, productores cuestionaron cómo el material del lecho impactaría el medio ambiente de la instalación, incluyendo la producción de gases olorosos, composición en nutrientes del estiércol/lecho resultante y la presencia de patógenos.
Pocos estudios se han realizado para medir la calidad del aire resultante de la ropa de cama de diferentes materiales utilizados en los alojamientos del ganado, con mayoría enfocando sólo amoníaco. La mayoría de las anteriores evaluaciones de la calidad del aire incluyen la recolección de datos en la granja con una o dos unidades experimentales por tratamiento se analizaron a la vez2,3,4,5. Tener limitado el número de unidades experimentales requiere el estudio se repita varias veces, añadiendo variables adicionales tales como condiciones climáticas, la edad o etapa de la producción de los animales, y tal vez lecho materiales producidos en diferentes temporadas de crecimiento .
Con ningún modelo de escala laboratorio conocido para estudiar factores que afectan la calidad del aire y composición en nutrientes del estiércol/lecho mezcla resultante de carne camas profunda mono-cuesta las instalaciones, los investigadores primero intentó utilizar instalaciones de ganado comercial utilizando un sistema de camas profundas6,7,8. Cámaras de flujo estático se utilizaron para medir las concentraciones de3 de NH en la superficie de instalaciones de ganado camas profunda pendiente de mono sobre un período de 18 meses6. Se midieron dos plumas en cada uno de los dos graneros. Tallos de maíz picaditos eran el material recomendado: ropa de cama, pero también se utilizaron tallos de soja y paja de trigo para el lecho durante breves períodos de este proyecto. Ropa de cama uso varió de 1.95-3,37 kg por animal por día y pluma de densidad varió de 3.22-6.13 m2 por animal. Estudios posteriores miden las emisiones de amoníaco y sulfuro de hidrógeno desde el galpon7y las concentraciones de partículas fuera del granero8. Estos estudios se llevaron a cabo durante un período de 2 años usando dos a cuatro lugares de granero. El desafío con la recopilación de datos en la granja es la falta de control que tiene la investigación sobre el sistema. Productores cambian las dietas de ganado, trasladar animales de pluma, usan de materiales de ropa de cama de diferentes fuentes y limpiarán y volver a la cama de plumas como su producción y mano de obra permite, confundiendo así muchas variables. Investigación en finca también implica gastos de viaje y grandes cantidades de tratamientos experimentales (como material del lecho). El objetivo de este proyecto fue desarrollar un modelo a escala de laboratorio que podría utilizarse para estudiar factores que afectan la calidad del aire y manejo de nutrientes en las instalaciones de mono-cuesta camas profundas de ganado.
Protocolo
El estudio está diseñado para llevarse a cabo durante 42 días con colección de datos semanal. Todos los procedimientos animales fueron revisados y aprobados por la Comisión de uso y de nosotros carne Animal investigación centro institucional Animal Care.
1. construcción de simulado camas paquetes
- Comenzar con contenedores de plástico cilindro 0,42 m de altura con un diámetro de 0,38 m.
Nota: En este estudio, fue de una particular 10 galones comerciales basurero utilizado (véase Tabla de materiales), pero otros envases de plástico de tamaño similar sería conveniente. - Seis orificios de 1 cm igualmente espacian alrededor de la circunferencia del envase plástico en cada envase de plástico aproximadamente 5 cm la parte superior del envase plástico. Quitar cualquier remanente plástico del envase.
- Tarar el recipiente de plástico y registre la masa del lado el envase de plástico. Peso 320 g de material de las camas en bandeja de pesaje con una balanza y añadir ropa de cama de material para el envase de plástico.
Nota: Cualquier material de lecho consideró conveniente para uso en instalaciones ganaderas se pueden utilizar9,10,11,12,13,14,15. Para el modelado de servicios ganados con cama profunda en las grandes llanuras superior, rastrojo de maíz es considerado el más común lecho material1 pero rastrojo de soja, paja y virutas de madera también han sido usados1. Si utiliza este sistema al modelo cama profunda cerdos o productos lácteos instalaciones, paja del trigo, paja de cebada, paja de la avena, heno, virutas de madera, virutas de madera, aserrín, periódico, mazorcas de maíz, rastrojo de soja, arroz cáscaras o arena puede ser más conveniente16,17 ,18. - Peso 320 g de ganado fresco heces sobre un plástico mediante el equilibrio de la placa y agregar al contenedor de plástico.
Nota: Orina y heces son recogidas y mantenidas como se describió anteriormente11. - Medida 320 mL de orina de ganado fresco en el cilindro graduado de 1000 mL. Vacíe el contenido en el recipiente de plástico. Con una varilla (5,08 cm de circunferencia), mezcle la mezcla de material de lecho ligeramente para 30 s.
Nota: en este caso, se utilizó una varilla de acero hueco con una tapa de plástico en el extremo. Alternativamente, podría utilizarse cualquier tipo de barra. - Limpie el extremo de la varilla entre cada paquete camas utilizando un paño antiséptico disposición a evitar la contaminación de microbios.
Nota: Un cubo de agua jabonosa tibia puede utilizarse también para limpiar la varilla. Una bolsa de plástico sándwich también puede asegurada con una banda elástica para el extremo de la varilla y reemplazada después de cada uno con camas paquete para evitar la contaminación cruzada. - Pesar y registrar la masa final de la mezcla de ropa de cama. Coloque el envase de plástico en el medio ambiente de la cámara19 a una temperatura ambiente de 18-20 ° C con un punto de rocío de 12 ° C.
2. mantener el simulado camas paquetes
- Cuarenta y ocho horas antes de añadir las heces y la orina, retirar congeladas heces y orina del congelador y dejar para descongelar a temperatura ambiente (20-25 ° c).
- Menos de una hora antes de añadir orina a paquete de camas, medir el pH de la orina.
- Colóquese equipo de protección personal (guantes, gafas de seguridad) necesarias para el manejo de 6 M NaOH.
- Verter 25 mL 6 M de hidróxido de sodio (NaOH) en el cilindro graduado. Revolver la mezcla, luego prueba el pH con una sonda de pH. Repita hasta que la orina llega a pH 7,4, el pH fisiológico20.
- Una vez ajustado el pH de la orina, reemplace la tapa sobre el envase de la orina cuando no esté en uso para prevenir la volatilización de nitrógeno de la orina.
- Pesar y registrar la masa del paquete de camas. Si fresca ropa de cama debe ser agregado en este día, peso 320 g de seleccionado material del lecho en cacerola de aluminio con balanza y añadir material de lecho a los respectivos paquetes de camas. Si no hay ropa de cama debe ser agregado en este día, seguir paso 2.7.
- Peso 320 g de ganado descongelada las heces en un plástico mediante el equilibrio de la placa y añadir al paquete de camas.
Nota: El día 21, utilizar estiercol en lugar de heces descongeladas. - Medida 320 mL de orina de bovinos descongelados en probeta graduada de 1000 mL. Vacíe el contenido en el paquete de camas.
Nota: El día 21, usar orina fresca en lugar de orina descongelada. - Con una varilla, revolver la mezcla de pack de ropa de cama ligeramente durante 30 segundos. Limpie el extremo de plástico de la varilla entre cada paquete camas para evitar la contaminación de microbios. Pesar y registrar la masa final de la mezcla de ropa de cama.
- Devolver el envase de plástico en el compartimiento ambiental.
- Repita los pasos 2.1-2.10 en el lunes, el miércoles y el viernes de cada semana, con lecho de material que se agrega (paso 2.6) y muestras de aire recolectadas cada miércoles.
3. recogida de muestras de los paquetes de camas simulados
Nota: Las muestras se recogen de los paquetes de camas simulados una vez semanalmente, antes de añadir las heces, la orina y la ropa de cama fresca.
- Preparando para recoger muestras del aire de espacios vacíos de cada paquete camas simulado.
- Encender todo el equipo de muestreo aire y deje que se caliente según las indicaciones del fabricante, aproximadamente 1 hora.
Nota: Ver Tabla de materiales para el amoníaco (NH3), sulfuro de hidrógeno (H2S), metano (CH4), óxido nitroso (N2O) y analizadores de gases de dióxido de carbono (CO2) utilizados en este estudio. - Mida la distancia desde la parte superior del paquete camas simulado en la parte superior del envase plástico sosteniendo el paquete camas simulado utilizando una regla.
- Calcular el volumen de la zona de espacio libre mediante la siguiente fórmula:
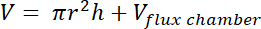
donde r = radio del recipiente plástico,
h = distancia desde la parte superior del paquete de camas a la parte superior del envase de plástico, y
Vcámara de flujo = volumen de la cámara de flujo situada en la parte superior del envase de plástico.
Nota: Las cámaras de flujo utilizadas en este estudio tenían un volumen interno de 0,007 m3 con una superficie de 0,064 m21,22. - Empuje una estaca de metal aproximadamente de 5 cm en la superficie del paquete de camas en el centro de la manada. Enrosque la tubería inerte 0,64 cm a través de uno de los orificios de 1 cm en la parte superior de cada envase paquete camas simulado y seguro en una estaca de metal de 12,5 cm 1,3 cm por encima de la superficie del paquete de ropa de cama. Colocar acero inoxidable flujo estático hemisférica cámaras21,22 con faldas de goma encima de cada paquete camas simulada (figura 1).
Nota: Faldas de goma son 61 cm cuadrados hechas de goma suave y elástico con agujeros de 22,9 cm de diámetro en el centro. El agujero se coloca sobre la cámara de flujo y las faldas forman un sello en la parte superior del envase de plástico cuando se coloca en el recipiente. - Fije el tubo inerte 0,64 cm a las cámaras de flujo mediante accesorios de compresión inerte.
Nota: La tubería inerte esté conectada al colector de muestras de gas que alimenta al equipo de muestreo de aire. El sistema de muestreo del gas es controlado por un relé de lógica programable de 24 voltios (véase Tabla de materiales) señal multi posicionales solenoides 3 vías para apertura y cierre de líneas de entrada de aire de ocho en el colector de muestras de gas. Una línea se abre a la vez para permitir el muestreo de aire individual de cada paquete de camas. - Comenzar a limpiar el aire ambiente de la habitación a través de la tubería a una velocidad de 5 L min-1 durante 30 minutos.
Nota: Ver Tabla de materiales para la bomba usada para purgar el aire a través de las líneas de muestra.
- Encender todo el equipo de muestreo aire y deje que se caliente según las indicaciones del fabricante, aproximadamente 1 hora.
- Medir la concentración de amoníaco, dióxido de carbono, metano y sulfuro de hidrógeno en espacios vacíos de los paquetes de camas simulados.
- Después de limpiar adecuadamente el simulado camas paquetes, abra la llave de paso en línea de la muestra para atraer aire ambiente de la sala a inerte muestra líneas conectadas al colector de muestreo de gas.
- Activar el relé programable de la lógica para comenzar a tirar el aire dentro del equipo de muestreo de aire. Grabamos mediciones de aire ambiente durante 20 minutos determinar la concentración de gases medidos en el aire ambiente. Esto se utilizará como una concentración del aire de fondo. Cuando haya terminado de recolectar el aire ambiente, cerrar la llave de paso en la línea de muestra.
- Activar el relé lógico programable para comenzar el aire de las líneas muestra inerte conectado a cada cámara de flujo de muestreo. Medidas de registro de cada línea de la muestra durante 20 minutos determinar las concentraciones de los gases medidos en los espacios vacíos de cada paquete de camas.
- Resultados pueden ser registrados como la concentración promedio del gas (NH3, CO2, N2O, CH4, H2S) en las muestras de aire (mg kg-1 o ppm), o se puede calcular la densidad de flujo (tasa de emisión) del gas en una masa por unidad área por base de tiempo de unidad utilizando la siguiente ecuación:
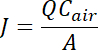
donde J = el flujo en μg m-2 min-1,
A = área de la fuente (m2) dentro de la cámara,
Q = el barrido aire flujo tasa m3 min-1, y
Caire = la concentración de compuestos orgánicos volátiles dejando la cámara (μg m-3)23.
- Medir la concentración de los compuestos orgánicos volátiles en el espacio de los paquetes de camas simulados.
- Colóquese guantes desechables de látex o de nitrilo.
- Después de limpiar adecuadamente el simulado camas paquetes, retire latón almacenamiento tapas de acero inoxidable previo tubos absorbentes.
Nota: Los tubos sorbentes utilizados en este estudio fueron 89 x 6,4 mm que OD lleno de Tenax TA absorbente (véase Tabla de materiales). Casquillos de latón tienen virolas de polythtrafluorethylene (PTFE). - Conecte el extremo anotado del tubo absorbente para el puerto de entrada de la cámara de flujo con tubo de goma flexible y el otro extremo del tubo adsorbente para una bomba de vacío.
Nota: La bomba de vacío usada en este estudio (véase Tabla de materiales) tira aire por los tubos absorbentes con un caudal de 75 mL min-1. - Permita que la bomba que tire aire en el tubo absorbente durante 5 minutos para un volumen de muestra de 0,375 L, entonces la bomba y desconecte el tubo absorbente. Vuelva a colocar las tapas de almacenamiento de información de latón en los extremos de los tubos absorbentes.
- Repita los pasos 3.3.1 - 3.3.4 para recoger un tubo absorbente para cada paquete de camas.
- Almacenar tubos absorbentes hasta su análisis por desorción térmica-gas cromatografía-espectrometría de masa (TD-GC-MS). Los tubos se pueden almacenar a temperatura ambiente (20-25 ° c) por < 24 h. Si almacena > 24 h, tienda en el refrigerador.
- Inmediatamente antes del análisis de la muestra en el sistema TD-GC-MS, quitar tapones de latón almacenamiento de tubos absorbentes y reemplazar con PTFE tapas analítica23.
- Analizar tubos de solvente para compuestos orgánicos volátiles24 (ácido acético, ácido butírico, ácido propiónico, ácido isobutírico, ácido isovalérica, ácido valeriánico, ácido hexanoico, ácido heptanoico, fenol, p-cresol, indol, skatole, Dimetilo disulfuro y dimetil Trisulfuro) con TD-GC-MS23,24,25.
- Resultados pueden ser registrados como concentración de COV en las muestras de aire (μg m-3), o se puede calcular la densidad de flujo (tasa de emisión) de la VOC en una masa por unidad de área por base de tiempo de unidad utilizando la siguiente ecuación:
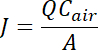
donde J = el flujo en μg m-2 min-1,
A = área de la fuente (m2) dentro de la cámara,
Q = el barrido aire flujo tasa m3 min-1, y
Caire= la concentración de compuestos orgánicos volátiles dejando la cámara (μg m-3)23.
- Recoger las mediciones físicas y químicas de los paquetes de camas simulados.
Nota: Temperatura, pH y pérdida de agua por evaporación se miden cada vez materiales adicionales fueron agregados a los paquetes de camas simulados. Composición de nutrientes se determina en el día 0 y día 42. Espacio de aire libre se determina sólo en el día 42.- Determinar la temperatura de las camas mediante la inserción de una sonda de temperatura en el centro de la manada camas, aproximadamente 7,6 cm debajo de la superficie del paquete simulado de camas. Permita que la temperatura se estabilice y anote.
- Determinar la pérdida de agua por evaporación estimada
- Coloque el envase de plástico en el equilibrio.
- Mida y registre la masa del paquete camas simulado antes y después de cada adición de heces/orina/ropa de cama al paquete simulado de camas.
- Calcular la pérdida de agua por evaporación estimada restando masa de comienzo del día actual de masa final de la jornada anterior. La diferencia es la masa estimada de agua que se evaporó de la unidad camas entre los días y puede utilizarse para comparar las diferencias relativas entre paquete de camas, aunque no refleja pérdida absoluta.
- Determinar pH del paquete camas simulado
- Recoger una muestra representativa de 5-10 g de cada paquete camas simulado desde el centro de la manada a una profundidad de aproximadamente 7,6 cm debajo de la superficie del paquete de camas. Coloca la muestra en un tubo cónico de plástico 50 mL, tapa y etiqueta.
- Calibrar el pH-metro con pH buffer 4 y 7 según las instrucciones del fabricante.
- Determinar la masa de cada cónica.
- Diluir cada muestra 1:2 en una base de masa con agua destilada y desionizada. Agite el cónico para mezclar el material de agua y ropa de cama. Inserte la sonda de pH en el cónico, medir y registrar el pH de la muestra.
- En los días 0 y 42 solamente, determinar contenido de nutrientes del paquete camas simulado.
- Recoger una muestra representativa de 50 g de cada paquete camas simulado desde el centro de la manada a una profundidad de aproximadamente 7,6 cm debajo de la superficie del paquete de camas. Colocar en una bolsa de muestra de suelo de papel.
- Transporte a un laboratorio para análisis de nutrientes dentro de las 24 horas. Almacenar en el refrigerador hasta que las muestras pueden ser transportadas a un laboratorio para análisis de nutrientes.
Nota: Pueden analizarse cualquier macro o micro nutrientes. Analizamos para nitrógeno total26, fósforo y azufre análisis27 en un laboratorio comercial.
- En el día 42 solamente, determinar espacio de aire libre en paquete camas simulado.
- Coloque el envase de plástico en una balanza y registrar la masa. Llene lentamente con agua hasta la superficie del agua es incluso con la superficie del paquete camas simulado. Permita que el agua resolver hasta que no más burbujas vienen el paquete camas simulado, a continuación, registrar la masa del envase plástico
- Determinar el porcentaje de espacio de aire libre con el siguiente cálculo:
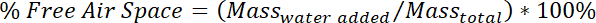
- Después de completar los datos deseados todos pasos (pasos 3.1 - 3.4), de la colección Añadir las heces, la orina y la ropa de cama a los paquetes de camas simulados siguiendo pasos 2.1 - 2.10.
Resultados
Hasta la fecha, siete investigaciones estudios han sido publicaron9,10,11,12,13,14,15 usando este procedimiento, con las modificaciones y hacer ajustes mejorar el modelo y reflejar los objetivos de los experimentos específicos. Este procedimiento se ha utili...
Discusión
La adición frecuente de orina y heces a los paquetes de camas es un paso crítico. Experimentamos con la adición de la orina y las heces sólo una vez por semana, pero descubrió que el paquete con una corteza, que atrapados gases en el interior del paquete y no era representante de instalaciones comerciales. El uso de estiercol al principio del estudio asegura que los paquetes de camas se inocula con poblaciones bacterianas comunes encontradas instalaciones de ganado. También es importante, al agregar la orina, para ...
Divulgaciones
Esta investigación fue financiada por fondos federales asignados al servicio de investigación agrícola de USDA, proyecto de investigación número 3040-41630-001-00D.
Mención de nombres comerciales o productos comerciales en este artículo es únicamente con el propósito de proporcionar información específica y no implica recomendación o aval por el USDA.
USDA es un proveedor de igualdad de oportunidades y el empleador.
Agradecimientos
El autor desea reconocer a Alan Kruger, Todd Boman, Shannon Ostdiek, Elaine Berry y Ferouz Ayadi que ayudaron con la recolección de datos utilizando los paquetes de camas simulados. El autor también reconoce Tami Brown-Brandl y Dale Janssen para su ayuda mantener los compartimientos ambientales.
Materiales
| Name | Company | Catalog Number | Comments |
| 10 gallon plastic cylinder containers | Rubbermaid | Model 2610 | Other similar-sized plastic containers are suitable |
| Mass balance | Any | Capable of measuring 0.1 gram | |
| Electric drill with 1 cm bit | Any | ||
| Methane analyzer | Thermo Fisher Scientific | Model 55i Methane/Non-methane Analyzer | |
| Hydrogen sulfide analyzer | Thermo Fisher Scientific | Model 450i | |
| Ammonia analyzer | Thermo Fisher Scientific | Model 17i | |
| Carbon dioxide analyzer | California Analytical | Model 1412 | |
| Nitrous oxide analyzer | California Analytical | Model 1412 | |
| Programmable Logic Relay | TECO | Model SG2-020VR-D | |
| Stainless steel flux chambers | Any | Constructed using the parts list and directions cited at Woodbury et al., 2006 | |
| Rubber skits | Any | Constructed from flexible rubber material. Cut into squares (61 cm x 61 cm) with 22.9 cm diameter hole in center. | |
| pH meter | Spectrum Technologies | IQ150 | |
| thermometer | Spectrum Technologies | IQ150 | |
| Ruler or tape measure | Any | Capable of measuring in cm | |
| Sorbent tubes | Markes International | Tenax TA | |
| Pocket pumps | SKC Inc. | Series 210 | |
| Inert sampling line | Teflon | 0.64 cm diameter | |
| Pump | Thomas | 107 series | Used to flush air through sample lines |
Referencias
- Doran, B., Euken, R., Spiehs, M. Hoops and mono-slopes: What we have learned about management and performance. Feedlot Forum 2010. , 8-16 (2010).
- Andersson, M. Performance of bedding materials in affecting ammonia emissions from pig manure. J. Agric. Engng. Res. 65, 213-222 (1996).
- Jeppsson, K. H. Volatilization of ammonia in deep-litter systems with different bedding materials for young cattle. J. Agric. Engng. Res. 73, 49-57 (1999).
- Powell, J. M., Misselbrook, T. H., Casler, M. D. Season and bedding impacts on ammonia emissions from tie-stall dairy barns. J. Environ. Qual. 37, 7-15 (2008).
- Gilhespy, S. L., Webb, J., Chadwick, D. R., Misselbrook, T. H., Kay, R., Camp, V., Retter, A. L., Bason, A. Will additional straw bedding in buildings housing cattle and pigs reduce ammonia emissions. Biosystems Engng. , 180-189 (2009).
- Spiehs, M. J., Woodbury, B. L., Doran, B. E., Eigenberg, R. A., Kohl, K. D., Varel, V. H., Berry, E. D., Wells, J. E. Environmental conditions in beef deep-bedded mono-slope facilities: A descriptive study. Trans ASABE. 54, 663-673 (2011).
- Cortus, E. L., Spiehs, M. J., Doran, B. E., Al Mamun, M. R. H., Ayadi, F. Y., Cortus, S. D., Kohl, K. D., Pohl, S., Stowell, R., Nicolai, R. . Ammonia and hydrogen sulfide concentration and emission patterns for mono-slope beef cattle facilities in the Northern Great Plains. , (2014).
- Spiehs, M. J., Cortus, E. L., Holt, G. A., Kohl, K. D., Doran, B. E., Ayadi, F. Y., Cortus, S. D., Al Mamun, M. R., Pohl, S., Nicolai, R., Stowell, R., Parker, D. Particulate matter concentration for mono-slope beef cattle facilities in the Northern Great Plains. Trans. ASABE. 57, 1831-1837 (2014).
- Ayadi, F. Y., Cortus, E. L., Spiehs, M. J., Miller, D. N., Djira, G. D. Ammonia and greenhouse gas concentrations at surfaces of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 783-795 (2015).
- Ayadi, F. Y., Spiehs, M. J., Cortus, E. L., Miller, D. N., Djira, G. D. Physical, chemical, and biological properties of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 797-811 (2015).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Effect of bedding materials on concentration of odorous compounds and Escherichia coli in beef cattle bedded manure packs. J. Environ. Qual. 42, 65-75 (2013).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A., Berry, E. D., Wells, J. E. Use of wood-based materials in beef bedded manure packs: 1. Effect on ammonia, total reduced sulfide, and greenhouse gas concentrations. J. Environ. Qual. 43, 1187-1194 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Berry, E. D., Wells, J. E., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A. Use of wood-based materials in beef bedded manure packs: 2. Effect on odorous volatile organic compounds, odor activity value, Escherichia coli, and nutrient concentration. J. Environ. Qual. 43, 1195-1206 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Ammonia, total reduced sulfides, and greenhouse gases of pine chip and corn stover bedding packs. J. Environ. Qual. 45, 630-637 (2016).
- Spiehs, M. J., Berry, E. D., Wells, J. E., Parker, D. B., Brown-Brandl, T. M. Odorous volatile organic compounds, Escherichia coli, and nutrient concentrations when kiln-dried pine chips and corn stover bedding are used in beef bedded manure packs. J. Environ. Qual. 46, 722-732 (2017).
- Herbert, S., Hashemi, M., Chickering-Sears, C., Weis, S. . Bedding options for livestock and equine. , (2008).
- Effects of bedding on pig performance. Iowa State Research Farm Progress Reports Available from: https://lib.dr.iastate.edu/farms_reports/134/ (2012)
- Brown-Brandl, T. M., Nienaber, J. A., Eigenberg, R. A. Temperature and humidity control in indirect calorimeter chambers. Trans. ASABE. 54, 685-692 (2011).
- Abney, C. S., Vasconcelos, J. T., McMeniman, J. P., Keyser, S. A., Wilson, K. R., Vogel, G. J., Galyean, M. L. Effects of ractophamine hydrochlodride on performance, rate and variation in feed intake, and acid-base balance in feedlot cattle. J. Anim. Sci. 85, 3090-3098 (2007).
- Miller, D. N., Woodbury, B. L. A solid-phase microextraction chamber method for analysis of manure volatiles. J. Environ. Qual. 35, 2383-2394 (2006).
- Woodbury, B. L., Miller, D. N., Eigenberg, R. A., Nienaber, J. A. An inexpensive laboratory and field chamber for manure volatile gas flux analysis. Trans. ASABE. 49, 767-772 (2006).
- Koziel, J. A., Spinhirne, J. P., Lloyd, J. D., Parker, D. B., Wright, D. W., Kuhrt, F. W. Evaluation of sample recovery of malodorous livestock gases from air sampling bags, solid-phase microextraction fibers, Tenax TA sorbent tubes, and sampling canisters. J. Air Waste Manag. Assn. 55, 1147-1157 (2005).
- Parker, D. B., Gilley, J., Woodbury, B., Kim, K., Galvin, G., Bartelt-Hunt, S. L., Li, X., Snow, D. D. Odorous VOC emission following land application of swine manure slurry. Atmos. Environ. 66, 91-100 (2013).
- Parker, D. B., Koziel, J. A., Cai, L., Jacobson, L. D., Akdeniz, N. Odor and odorous chemical emissions from animal buildings: Part 6. Odor activity value. Trans. ASABE. 55, 2357-2368 (2012).
- Watson, M., Wolf, A., Wolf, N., Peters, J. Total nitrogen. Recommended methods of manure analysis. , 18-24 (2003).
- Wolf, A., Watson, M., Wolf, N., Peters, J. Digestion and dissolution methods for P, K, Ca, Mg, and trace elements. Recommended methods of manure analysis. , 30-38 (2003).
- Euken, R. A survey of manure characteristics from bedded confinement buildings for feedlot beef productions: Progress report. Animal Industry Report. , (2009).
- Li, L., Li, Q. -. F., Wang, K., Bogan, B. W., Ni, J. -. Q., Cortus, E. L., Heber, A. J. The National Air Emission Monitoring Study's southeast layer site: Part I. Site characteristics and monitoring methodology. Trans. ASABE. 56, 1157-1171 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados