É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Laboratório-escala modelo para avaliar o Odor e as concentrações de gases emitidas pelo profundo com camas Pack estrume
Neste Artigo
Resumo
Um protocolo foi desenvolvido para medir gases, odores e composição de nutrientes em embalagens de esterco com cama dimensionado para laboratório, que pode ser usado para estudar maneiras de melhorar a qualidade do ar nas instalações de gado comercial usando pacotes de estrume com camas profundas.
Resumo
Foi desenvolvido um modelo de laboratório-escalada simulado bloco com cama para estudar a qualidade do ar e composição de nutrientes dos packs com camas profundas utilizados em instalações de mono-ladeira do gado. Este protocolo tem sido usado para avaliar eficazmente muitos materiais de cama diferentes variáveis ambientais (temperatura, umidade) e potencial tratamentos de mitigação que podem melhorar a qualidade em instalações comerciais de mono-ladeira com camas profundas do ar. O modelo é dinâmico e permite que os pesquisadores facilmente coletar muitas medições físicas e químicas do bloco com cama. Medições semanais, coletadas ao longo de seis ou sete semanas, permite tempo suficiente para ver mudanças nas medições de qualidade do ar ao longo do tempo à medida que amadurece o pack com cama. Os dados coletados dos pacotes de camas simulados é dentro do intervalo de concentrações anteriormente medidos em instalações comerciais de mono-ladeira com camas profundas. Após estudos têm demonstrado que 8-10 unidades experimentais por tratamento são suficientes para detectar diferenças estatísticas entre os pacotes de camas simulados. Os pacotes de camas são fáceis de manter, exigindo menos de 10 minutos de trabalho por camas pacotes por semana para adicionar urina, fezes e roupa de cama. Coleta de amostra, usando o sistema de amostragem de gás requer 20-30 minutos pelo bloco com cama, consoante as medidas que estão sendo coletados. O uso de pacotes com cama dimensionado para laboratório permite o pesquisador para controle de variáveis como temperatura, umidade e fonte de roupa de cama que são difíceis ou impossíveis de controle em uma investigação ou instalações comerciais. Enquanto não é uma perfeita simulação das condições do "mundo real", o simulado com camas pacotes de servem como um bom modelo para pesquisadores usar para examinar as diferenças de tratamento entre pacotes de camas. Vários estudos de laboratório-escala podem ser conduzidos para eliminar possíveis tratamentos antes de experimentá-las em uma investigação ou instalações de tamanho comercial.
Introdução
Instalações de confinamento de gado de corte são uma opção de habitação popular no Midwest e Upper grandes planícies. Instalações de confinamento são mais comuns nesta região do planícies do Sul, porque a região recebe mais precipitação anual, que cria mais escoamento de confinamento que deve ser contido. Muitos produtores decidiram construir celeiros de mono-ladeira dos bovinos. As principais razões citadas pelos produtores para selecionar uma instalação de mono-inclinação foi a capacidade de remoção de cronograma do trabalho e estrume e melhor desempenho comparado a abrir muito confinamentos1. A maioria dos produtores de gado (72,2%) usando mono-ladeira celeiros manter um bloco com cama para uma volta de gado ou mais, usando um sistema de gestão do fundo-roupa de cama para o fundamento e resíduos1. O material da cama mais comum usado é a palha de milho, apesar de relatório produtores usando palha de soja, palha de trigo, espigas de milho e serragem1. Por causa da demanda regional para o fundamento de caules e folhas de milho, muitos produtores estavam interessados em materiais de cama alternativos que poderiam ser usados em instalações de mono-ladeira. Além de economia e conforto animal, produtores questionaram como o material da cama teria impacto no ambiente da instalação, incluindo a produção de gases odoríferos, composição de nutrientes do estrume/fundamento resultante e a presença de agentes patogénicos.
Alguns estudos têm sido realizados para medir a qualidade do ar resultante de camas diferentes materiais utilizados na carcaça de gado, com maioria focando apenas amônia. A maioria das avaliações anteriores da qualidade do ar incluem a coleta de dados na exploração com uma ou duas unidades experimentais por tratamentos sendo analisados de uma só vez2,3,4,5. Ter limitado o número de unidades experimentais requer o estudo a ser repetido várias vezes, assim adicionando variáveis adicionais, tais como condições climáticas, idade ou fase de produção de animais, e talvez o fundamento materiais produzidos em diferentes estações de crescimento .
Com nenhum modelo conhecido de escala de laboratório para estudar os fatores que afetam a qualidade do ar e composição de nutrientes do estrume/fundamento mistura resultante da carne com camas profundas mono-ladeira instalações, os pesquisadores primeiro tentou utilizar instalações de gado comercial usando um com camas profundas sistema6,7,8. Câmaras de fluxo estático foram usadas para medir concentrações de NH3 na superfície das instalações mono-inclinação profunda camas gado ao longo de um período de 18 meses6. Duas canetas em cada um dos dois celeiros foram medidas. Hastes do milho picadas eram o material preferido do fundamento, mas talos de soja e palha de trigo também foram utilizados para o fundamento durante breves períodos deste projeto. Fundamento do uso variou de 1.95-3,37 kg por animal por dia e caneta densidade variou 3,22-6,13 m2 por animal. Estudos posteriores medido emissões de amônia e sulfeto de hidrogênio do celeiro7e as concentrações de partículas em suspensão do lado de fora do celeiro8. Estes estudos foram conduzidos durante um período de 2 anos usando locais de celeiro de dois a quatro. O desafio com coleta de dados na fazenda é a falta de controle que a pesquisa tem sobre o sistema. Produtores mudam dietas de gado, mover animais da caneta a caneta, use materiais de cama, de diferentes fontes e limpa e re-cama canetas como sua produção e força de trabalho permite, confundindo assim a muitas variáveis. Pesquisa na exploração envolve também as despesas de viagem e grandes quantidades de tratamentos experimentais (como fundamento material). O objetivo deste projeto foi desenvolver um modelo de escala de laboratório que poderia ser usado para estudar os fatores que afetam a qualidade do ar e gestão de nutriente em instalações de mono-ladeira gado com camas profundas.
Protocolo
O estudo foi concebido para ser conduzido durante 42 dias com coleta de dados semanal. Todos os procedimentos de animais foram revistos e aprovados pelo Comitê de uso e nos carne Animal Research Center institucional Cuidado Animal.
1. construir simulada com camas Packs
- Começar com recipientes de cilindro de plástico que são 0,42 m de altura com um diâmetro de 0,38 m.
Nota: Neste estudo, um recipiente especial 10 galões de lixo comercial foi utilizado (ver Tabela de materiais), mas outro recipientes de plástico de tamanho semelhante seria adequado. - Seis furos de 1 cm espaçados em torno da circunferência do recipiente plástico em cada recipiente plástico aproximadamente 5 cm do topo do recipiente plástico. Remova quaisquer vestígios de plástico do recipiente.
- Tara do recipiente de plástico e gravar a massa na lateral do recipiente de plástico. Pan de pesar com uma balança, pesar 320 g de material selecionado do fundamento e adicionar fundamento material para o recipiente de plástico.
Nota: Qualquer fundamento material considerado adequado para uso em instalações de gado pode ser usado9,10,11,12,13,14,15. Para modelagem de instalações de gado com cama profunda em Upper Great Plains, palha de milho é considerada o material mais comum da cama1 mas caules e folhas de soja, palha de trigo e lascas de madeira também foram utilizados1. Se utilizar este sistema para instalações de suína ou laticínios modelo com camas profundas, palha de trigo, palha de cevada, palha de aveia, feno, aparas de madeira, lascas de madeira, serragem, jornal, espigas de milho, palha de feijão de soja, cascas de arroz, ou areia pode ser mais adequado16,17 ,18. - Peso 320 g de gado fresco fezes em um plástico da placa usando equilíbrio e adicionem ao recipiente plástico.
Nota: Urina e fezes são coletados e mantidos como descrito anteriormente,11. - Medida 320 mL de urina de gado fresco no cilindro graduado de 1000 mL. Conteúdo vazio dentro do recipiente de plástico. Usando uma haste de agita (5,08 cm de circunferência), misture a mistura de fundamento material ligeiramente por 30 s.
Nota: neste caso, utilizou-se uma haste de aço oca com uma tampa de plástico na extremidade. Alternativamente, pode ser usado qualquer tipo de haste. - Limpe a extremidade da haste de agitação entre cada bloco com cama usando uma compressa com eliminação anti-séptico para evitar a contaminação cruzada dos micróbios.
Nota: Um balde de água morna e sabão também pode ser usado para limpar a haste de agita. Saco plástico também pode ser fixado com um elástico à extremidade da haste e substituído após cada um com camas pacote para evitar contaminação cruzada. - Pesar e registar a massa final da mistura de roupa de cama. Coloque o recipiente de plástico na câmara ambiental19 conjunto para uma temperatura ambiente de 18-20 ° C com um ponto de orvalho de 12 ° C.
2. manter o simulado com camas Packs
- Quarenta e oito horas antes de adicionar a fezes e urina, remover congelados de fezes e urina do congelador e deixar para descongelar à temperatura ambiente (20-25 ˚ c).
- Menos de uma hora antes de adicionar urina ao pacote de cama, medir o pH da urina.
- Coloque equipamento de protecção adequado (luvas, óculos de segurança) necessários para a manipulação de 6 M de NaOH.
- Despeje o cilindro graduado 25 mL de 6 M de hidróxido de sódio (NaOH). Agitar a mistura e, em seguida, testar o pH com uma sonda de pH. Repita até que a urina atinge pH 7,4, pH fisiológico20.
- Uma vez que o pH da urina é ajustado, recoloque a tampa no recipiente quando não estiver em uso para evitar a volatilização do nitrogênio da urina urina.
- Pesar e registar a massa do pacote de cama. Se cama fresca é a ser adicionado neste dia, pesa 320g de selecionado do fundamento material em panela de alumínio com balança e adicionar material de cama para os respectivos pacotes de camas. Se não há fundamento para ser adicionado neste dia, continuam a passo 2.7.
- Peso 320 g de gado descongelados fezes em um plástico da placa usando equilíbrio e adicionem ao pacote com cama.
Nota: No dia 21, use fezes frescas em vez de fezes descongelados. - Medida 320 mL de urina de gado descongelado no cilindro graduado de 1000 mL. Conteúdo vazio para o pacote de cama.
Nota: No dia 21, use urina fresca em vez de urina descongelada. - Usando uma haste de agita, agite a mistura de pacote de fundamento ligeiramente por 30 segundos. Limpe a extremidade de plástico da haste de agitação entre cada bloco com cama para evitar a contaminação cruzada dos micróbios. Pesar e registar a massa final da mistura de roupa de cama.
- Retorne o recipiente plástico na câmara ambiental.
- Repita os passos 2.1-2.10 na segunda, quarta e sexta-feira de cada semana, com o fundamento material sendo adicionado (passo 2.6) e amostras de ar coletadas a cada quarta-feira.
3. colheita de amostras da simulado Packs com cama
Nota: As amostras são coletadas da simulado packs com cama uma vez por semana, antes da adição de fezes, urina e roupa de cama fresca.
- Preparando-se para recolher amostras de ar de headspace de cada pacote de cama simulado.
- Todos os equipamentos de amostragem de ar e deixe aquecer conforme as instruções do fabricante, aproximadamente 1 hora.
Nota: Consulte a Tabela de materiais para amônia (NH3), sulfeto de hidrogênio (H2S), metano (CH4), óxido nitroso (N2O) e analisadores de gases de dióxido de carbono (CO2) utilizados neste estudo. - Medir a distância da parte superior da embalagem com cama simulada para o topo do recipiente plástico segurando o pacote cama simulado usando uma régua.
- Calcule o volume da área por "headspace" usando a seguinte fórmula:
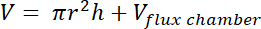
onde r = raio do recipiente plástico,
h = distância da parte superior do bloco com cama para o topo do recipiente plástico, e
Câmara de fluxo de V = volume da câmara de fluxo localizada no topo do recipiente de plástico.
Nota: As câmaras de fluxo usadas neste estudo tem um volume interno de 0,007 m3 , com uma área de superfície de 0,064 m21,22. - Empurre uma estaca de metal aproximadamente 5 cm na superfície do bloco com cama no centro aproximado da embalagem. Segmento de 0,64 cm tubulação inerte através de um dos furos de 1 cm na parte superior de cada recipiente de pacote com cama simulado e seguro em uma estaca de metal 12,5 cm 1,3 cm acima da superfície da embalagem, roupa de cama. Coloque o aço inoxidável hemisférica fluxo estático câmaras21,22 com saias de borracha em cima de cada bloco com cama simulado (Figura 1).
Nota: Saias de borracha são 61 cm quadrados feitos de borracha macia, elástica, com buracos de 22,9 cm de diâmetro, cortados no centro. O buraco se encaixa sobre a câmara de fluxo e as saias de formam um selo na parte superior do recipiente de plástico, quando colocado no recipiente. - Anexe tubos inertes 0,64 cm para as câmaras de fluxo usando acessórios de compressão inerte.
Nota: A tubulação inerte está ligada ao tubo de amostragem de gás que alimenta o equipamento de amostragem de ar. O sistema de amostragem de gás é controlado por um relé de lógica programável de 24 volts (ver Tabela de materiais) que sinaliza multi-posições solenoides 3 vias para abrir e fechar uma das linhas de entrada oito ar no colector de amostragem de gás. Uma linha é aberta em um tempo de amostragem de ar individuais de cada pacote de cama. - Começam a descarga de ar ambiente da sala através da tubulação a uma taxa de 5 L min-1 por 30 minutos.
Nota: Consulte a Tabela de materiais para bomba usada para lavar o ar através das linhas de amostra.
- Todos os equipamentos de amostragem de ar e deixe aquecer conforme as instruções do fabricante, aproximadamente 1 hora.
- Medir a concentração de amônia, dióxido de carbono, metano e sulfeto de hidrogênio em headspace de pacotes com cama simulados.
- Após lavagem adequadamente o simulado com camas pacotes, abra a torneira na linha de amostra de ar ambiente da sala de para linhas de amostra inerte ligadas ao colector de amostragem de gás.
- Ative o relé programáveis para começar a puxar o ar dentro do equipamento de amostragem de ar. Registros medições do ar ambiente por 20 minutos determinar a concentração de gases medidos no ar ambiente. Isso será usado como uma concentração de ar residual. Quando terminar de coletar a concentração do ar ambiente, feche a torneira de passagem na linha de amostra.
- Ative o relé programáveis para iniciar a amostragem de ar a partir das linhas de amostra inerte anexado a cada câmara de fluxo. Registros medições de cada linha de amostra por 20 minutos determinar as concentrações de gases medidos no headspace de cada pacote de cama.
- Os resultados podem ser relatados como a concentração média do gás (NH3, CO2, N2O, CH4, H2S) nas amostras de ar (mg kg-1 ou ppm) ou a densidade de fluxo (taxa de emissão) do gás pode ser calculada sobre uma massa por unidade área por base de tempo de unidade usando a seguinte equação:
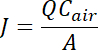
onde J = o fluxo em µ g m-2 min-1,
A = área da fonte (m2) no interior da câmara,
Q = a varredura ar fluxo taxa m3 min-1, e
Car = a concentração de COV, deixando a câmara (µ g m-3)23.
- Medir a concentração de compostos orgânicos voláteis odoríferos, no headspace de pacotes com cama simulados.
- Ponha luvas descartáveis de látex ou nitrilo.
- Após lavagem adequadamente o simulado com camas pacotes, remova tampas de armazenamento de bronze de adsorvente tubos inox instintiva.
Nota: Os tubos adsorvente utilizados neste estudo foram 89 mm × 6,4 mm que OD preenchido com Tenax TA adsorvente (ver Tabela de materiais). Caps de bronze têm virolas de polythtrafluorethylene (PTFE). - Anexe marcou final do tubo adsorvente para a porta de entrada na câmara de fluxo, usando o tubo flexível de borracha e a outra extremidade do tubo adsorvente para uma bomba de vácuo.
Nota: A bomba de vácuo utilizada neste estudo (ver Tabela de materiais) puxou o ar através dos tubos do adsorvente com um caudal de 75 mL min-1. - Permitir que a bomba puxar o ar para dentro do tubo adsorvente por 5 min para um volume de amostra de 0,375 L, em seguida, desligue a bomba e desconecte o tubo adsorvente. Substitua as tampas de armazenamento de bronze nas extremidades dos tubos adsorvente.
- Repita as etapas 3.3.1 - 3.3.4 coletar um tubo adsorvente para cada pacote de cama.
- Armazenar os tubos adsorvente até análise por dessorção térmica-gás cromatógrafo--espectrometria de massa (TD-GC-MS). Os tubos podem ser armazenados à temperatura ambiente (20-25 ˚ c) para < 24 h. Se armazenar > 24 h, loja na geladeira.
- Imediatamente antes da análise de amostra no sistema TD-GC-MS, remova tampas de armazenamento de bronze de tubos adsorvente e substituir com PTFE tampões analítico23.
- Analisar o adsorvente tubos para compostos orgânicos voláteis24 (ácido acético, ácido butírico, ácido propiônico, ácido isobutírico, Ácido isovalérico, Ácido valérico, ácido hexanoico, ácido heptanoico, fenol, p-cresol, indol, escatol, dissulfeto dimetil e dimetil trissulfureto e) usando o TD-GC-MS23,24,25.
- Os resultados podem ser relatados como concentração de VOC nas amostras de ar (µ g m-3), ou a densidade de fluxo (taxa de emissão) de VOC pode ser calculada sobre uma massa por unidade de área por base de tempo de unidade usando a seguinte equação:
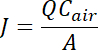
onde J = o fluxo em µ g m-2 min-1,
A = área da fonte (m2) no interior da câmara,
Q = a varredura ar fluxo taxa m3 min-1, e
Car= a concentração de COV, deixando a câmara (µ g m-3)23.
- Recolha as medições físicas e químicas dos pacotes com cama simulados.
Nota: Temperatura, pH e a perda de água por evaporação são medidos cada vez materiais adicionais foram adicionados para os pacotes de camas simulados. Composição de nutrientes é determinada no dia 0 e 42 dias. Espaço livre do ar é determinado em 42 dias apenas.- Determine a temperatura do bloco com cama através da inserção de uma sonda de temperatura para o centro do bloco com cama, aproximadamente 7,6 cm abaixo da superfície do bloco com cama simulado. Permitir que a temperatura estabilize e gravar.
- Determinar a perda de água por evaporação estimado
- Coloque o recipiente de plástico sobre o equilíbrio.
- Medir e registrar a massa do bloco com cama simulado antes e após cada adição de fezes/urina/fundamento para o pacote de cama simulado.
- Calcule a perda de água por evaporação estimado subtraindo a massa do início do dia atual da missa de encerramento do dia anterior. A diferença é que a massa estimada de água que evaporou do bloco com cama entre os dias e pode ser usada para comparar as diferenças relativas entre cama pacote, embora ele não reflete perda absoluta.
- Determinar o pH do simulado pack com cama
- Colete uma amostra representativa 5-10 g de cada bloco com cama simulado do centro do pacote a uma profundidade de aproximadamente 7,6 cm abaixo da superfície do bloco com cama. Colocar a amostra em um tubo cônico de plástico-50ml, tampa e rótulo.
- Calibre o medidor de pH pH amortecedores 4 e 7 de acordo com as instruções do fabricante.
- Determine a massa de cada cônica.
- Dilua cada amostra 1:2 em uma base de massa com água destilada, deionizada. Agite o cónico para misturar o material de água e roupa de cama. Inserir a sonda de pH o cónico, medir e registrar o pH da amostra.
- Nos dias 0 e apenas 42, determine o teor de nutrientes do simulado com cama pack.
- Colete uma amostra representativa de 50g de cada bloco com cama simulado do centro do pacote a uma profundidade de aproximadamente 7,6 cm abaixo da superfície do bloco com cama. Coloque em um saco de amostra de solo de papel.
- Transporte para um laboratório para análise de nutrientes dentro de 24 horas. Guarde na geladeira até amostras podem ser transportadas para um laboratório para análise de nutrientes.
Nota: Qualquer macro ou micro nutrientes podem ser analisados. Analisamos para azoto total26, fósforo e enxofre análise27 em um laboratório comercial.
- No dia 42 somente, determine o espaço de ar livre no simulado pack com cama.
- Coloque o recipiente de plástico em um equilíbrio e gravar a massa. Lentamente, encha com água até a superfície da água é mesmo com a superfície da embalagem, cama simulada. Permitir que a água repousar até que não mais bolhas estão vindo do simulado pack com cama e, em seguida, gravar a massa do recipiente plástico
- Determine a porcentagem de espaço livre de ar usando o seguinte cálculo:
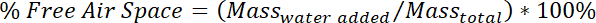
- Depois de concluir todos desejados dados passos de coleção (passos 3.1 - 3.4), adicionar fezes, urina e roupa de cama para os pacotes de camas simulados passos 2.1 - 2.10 a seguir.
Resultados
Até à data, pesquisa sete estudos foram publicados9,10,11,12,13,14,15 usando este procedimento, com modificações e ajustamentos melhorar o modelo e reflectem objectivos das experiências específicas. Este procedimento tem sido usado para avaliar o efeito...
Discussão
A adição frequente de urina e fezes para os pacotes de camas é um passo crítico. Experimentamos com adição de urina e fezes, só uma vez semanal, mas achei que o pacote de cama desenvolveu uma crosta, que preso gases dentro da embalagem e não era representativa de instalações comerciais. O uso de fezes frescas no início do estudo assegura que os pacotes de camas é inoculado com populações bacterianas comuns, encontradas em instalações de gado. Também é importante, ao adicionar a urina, lembre-se de ajust...
Divulgações
Esta pesquisa foi financiada por fundos Federal adequados para o serviço de pesquisa agrícola do USDA, número do projeto de pesquisa 3040-41630-001-00D.
Menção de nomes comerciais ou produtos comerciais neste artigo é exclusivamente com o propósito de fornecer informações específicas e não implica em recomendação ou endosso pelo USDA.
USDA é um provedor de igualdade de oportunidades e o empregador.
Agradecimentos
O autor deseja reconhecer Alan Kruger, Todd Boman, Shannon Ostdiek, Elaine Berry e Ferouz Ayadi que ajudou com a coleta de dados, usando os pacotes de camas simulados. O autor também reconhece Tami Brown-Brandl e Dale Janssen por sua assistência mantendo as câmaras ambientais.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 gallon plastic cylinder containers | Rubbermaid | Model 2610 | Other similar-sized plastic containers are suitable |
| Mass balance | Any | Capable of measuring 0.1 gram | |
| Electric drill with 1 cm bit | Any | ||
| Methane analyzer | Thermo Fisher Scientific | Model 55i Methane/Non-methane Analyzer | |
| Hydrogen sulfide analyzer | Thermo Fisher Scientific | Model 450i | |
| Ammonia analyzer | Thermo Fisher Scientific | Model 17i | |
| Carbon dioxide analyzer | California Analytical | Model 1412 | |
| Nitrous oxide analyzer | California Analytical | Model 1412 | |
| Programmable Logic Relay | TECO | Model SG2-020VR-D | |
| Stainless steel flux chambers | Any | Constructed using the parts list and directions cited at Woodbury et al., 2006 | |
| Rubber skits | Any | Constructed from flexible rubber material. Cut into squares (61 cm x 61 cm) with 22.9 cm diameter hole in center. | |
| pH meter | Spectrum Technologies | IQ150 | |
| thermometer | Spectrum Technologies | IQ150 | |
| Ruler or tape measure | Any | Capable of measuring in cm | |
| Sorbent tubes | Markes International | Tenax TA | |
| Pocket pumps | SKC Inc. | Series 210 | |
| Inert sampling line | Teflon | 0.64 cm diameter | |
| Pump | Thomas | 107 series | Used to flush air through sample lines |
Referências
- Doran, B., Euken, R., Spiehs, M. Hoops and mono-slopes: What we have learned about management and performance. Feedlot Forum 2010. , 8-16 (2010).
- Andersson, M. Performance of bedding materials in affecting ammonia emissions from pig manure. J. Agric. Engng. Res. 65, 213-222 (1996).
- Jeppsson, K. H. Volatilization of ammonia in deep-litter systems with different bedding materials for young cattle. J. Agric. Engng. Res. 73, 49-57 (1999).
- Powell, J. M., Misselbrook, T. H., Casler, M. D. Season and bedding impacts on ammonia emissions from tie-stall dairy barns. J. Environ. Qual. 37, 7-15 (2008).
- Gilhespy, S. L., Webb, J., Chadwick, D. R., Misselbrook, T. H., Kay, R., Camp, V., Retter, A. L., Bason, A. Will additional straw bedding in buildings housing cattle and pigs reduce ammonia emissions. Biosystems Engng. , 180-189 (2009).
- Spiehs, M. J., Woodbury, B. L., Doran, B. E., Eigenberg, R. A., Kohl, K. D., Varel, V. H., Berry, E. D., Wells, J. E. Environmental conditions in beef deep-bedded mono-slope facilities: A descriptive study. Trans ASABE. 54, 663-673 (2011).
- Cortus, E. L., Spiehs, M. J., Doran, B. E., Al Mamun, M. R. H., Ayadi, F. Y., Cortus, S. D., Kohl, K. D., Pohl, S., Stowell, R., Nicolai, R. . Ammonia and hydrogen sulfide concentration and emission patterns for mono-slope beef cattle facilities in the Northern Great Plains. , (2014).
- Spiehs, M. J., Cortus, E. L., Holt, G. A., Kohl, K. D., Doran, B. E., Ayadi, F. Y., Cortus, S. D., Al Mamun, M. R., Pohl, S., Nicolai, R., Stowell, R., Parker, D. Particulate matter concentration for mono-slope beef cattle facilities in the Northern Great Plains. Trans. ASABE. 57, 1831-1837 (2014).
- Ayadi, F. Y., Cortus, E. L., Spiehs, M. J., Miller, D. N., Djira, G. D. Ammonia and greenhouse gas concentrations at surfaces of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 783-795 (2015).
- Ayadi, F. Y., Spiehs, M. J., Cortus, E. L., Miller, D. N., Djira, G. D. Physical, chemical, and biological properties of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 797-811 (2015).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Effect of bedding materials on concentration of odorous compounds and Escherichia coli in beef cattle bedded manure packs. J. Environ. Qual. 42, 65-75 (2013).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A., Berry, E. D., Wells, J. E. Use of wood-based materials in beef bedded manure packs: 1. Effect on ammonia, total reduced sulfide, and greenhouse gas concentrations. J. Environ. Qual. 43, 1187-1194 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Berry, E. D., Wells, J. E., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A. Use of wood-based materials in beef bedded manure packs: 2. Effect on odorous volatile organic compounds, odor activity value, Escherichia coli, and nutrient concentration. J. Environ. Qual. 43, 1195-1206 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Ammonia, total reduced sulfides, and greenhouse gases of pine chip and corn stover bedding packs. J. Environ. Qual. 45, 630-637 (2016).
- Spiehs, M. J., Berry, E. D., Wells, J. E., Parker, D. B., Brown-Brandl, T. M. Odorous volatile organic compounds, Escherichia coli, and nutrient concentrations when kiln-dried pine chips and corn stover bedding are used in beef bedded manure packs. J. Environ. Qual. 46, 722-732 (2017).
- Herbert, S., Hashemi, M., Chickering-Sears, C., Weis, S. . Bedding options for livestock and equine. , (2008).
- Effects of bedding on pig performance. Iowa State Research Farm Progress Reports Available from: https://lib.dr.iastate.edu/farms_reports/134/ (2012)
- Brown-Brandl, T. M., Nienaber, J. A., Eigenberg, R. A. Temperature and humidity control in indirect calorimeter chambers. Trans. ASABE. 54, 685-692 (2011).
- Abney, C. S., Vasconcelos, J. T., McMeniman, J. P., Keyser, S. A., Wilson, K. R., Vogel, G. J., Galyean, M. L. Effects of ractophamine hydrochlodride on performance, rate and variation in feed intake, and acid-base balance in feedlot cattle. J. Anim. Sci. 85, 3090-3098 (2007).
- Miller, D. N., Woodbury, B. L. A solid-phase microextraction chamber method for analysis of manure volatiles. J. Environ. Qual. 35, 2383-2394 (2006).
- Woodbury, B. L., Miller, D. N., Eigenberg, R. A., Nienaber, J. A. An inexpensive laboratory and field chamber for manure volatile gas flux analysis. Trans. ASABE. 49, 767-772 (2006).
- Koziel, J. A., Spinhirne, J. P., Lloyd, J. D., Parker, D. B., Wright, D. W., Kuhrt, F. W. Evaluation of sample recovery of malodorous livestock gases from air sampling bags, solid-phase microextraction fibers, Tenax TA sorbent tubes, and sampling canisters. J. Air Waste Manag. Assn. 55, 1147-1157 (2005).
- Parker, D. B., Gilley, J., Woodbury, B., Kim, K., Galvin, G., Bartelt-Hunt, S. L., Li, X., Snow, D. D. Odorous VOC emission following land application of swine manure slurry. Atmos. Environ. 66, 91-100 (2013).
- Parker, D. B., Koziel, J. A., Cai, L., Jacobson, L. D., Akdeniz, N. Odor and odorous chemical emissions from animal buildings: Part 6. Odor activity value. Trans. ASABE. 55, 2357-2368 (2012).
- Watson, M., Wolf, A., Wolf, N., Peters, J. Total nitrogen. Recommended methods of manure analysis. , 18-24 (2003).
- Wolf, A., Watson, M., Wolf, N., Peters, J. Digestion and dissolution methods for P, K, Ca, Mg, and trace elements. Recommended methods of manure analysis. , 30-38 (2003).
- Euken, R. A survey of manure characteristics from bedded confinement buildings for feedlot beef productions: Progress report. Animal Industry Report. , (2009).
- Li, L., Li, Q. -. F., Wang, K., Bogan, B. W., Ni, J. -. Q., Cortus, E. L., Heber, A. J. The National Air Emission Monitoring Study's southeast layer site: Part I. Site characteristics and monitoring methodology. Trans. ASABE. 56, 1157-1171 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados