Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle de laboratoire pour évaluer les odeurs et les Concentrations de gaz émises par Deep lits Pack fumier
Dans cet article
Résumé
Un protocole a été développé pour mesurer les gaz, les odeurs et la composition nutritionnelle en meute à bractées lab lités du fumier, qui peut être utilisé pour étudier les moyens d’améliorer la qualité de l’air dans des installations de bétail commercial à l’aide de packs de fumier lits profonds.
Résumé
A développé un modèle de pack lités simulé-mise à l’échelle laboratoire afin d’étudier la qualité de l’air et de la composition nutritionnelle des packs de profonds lits utilisés dans les installations de mono pente de bovins. Ce protocole a été utilisé pour évaluer efficacement les nombreux literie différents matériaux, les variables environnementales (température, humidité) et le potentiel traitements d’atténuation qui peuvent améliorer la qualité en mono pente de commerces lits profonds de l’air. Le modèle est dynamique et permet aux chercheurs de recueillir facilement plusieurs mesures chimiques et physiques du Pack lité. Des mesures hebdomadaires, recueillies au cours des six ou sept semaines, laisse suffisamment de temps voir les modifications apportées aux mesures de qualité d’air au fil du temps comme le pack lité mûrit. Les données recueillies depuis les packs lités simulés sont dans la gamme des concentrations précédemment mesurées en mono pente lits profonds de commerces. Des études antérieures ont démontré que les 8-10 unités expérimentales par traitement sont suffisantes pour détecter des différences statistiques parmi les packs lités simulées. Les packs lités sont faciles à entretenir, nécessitant moins de 10 minutes de travail par lités paquets par semaine pour ajouter urine, matières fécales et literie. Prélèvement d’échantillons en utilisant le système de prélèvement de gaz nécessite 20 à 30 minutes par paquet lité, selon les mesures qui sont recueillies. L’utilisation des packs lités à bractées lab permet au chercheur de variables de contrôle tels que la température, l’humidité et source de literie qui sont difficiles ou impossibles à contrôler dans une recherche ou un établissement commercial. Bien que pas une simulation parfaite des conditions de « monde réel », la simulation de lits packs servent un bon modèle pour les chercheurs d’examiner les différences de traitement entre les packs lités. Plusieurs études en laboratoire peuvent être effectués afin d’éliminer les traitements possibles avant de les essayer dans une recherche ou une installation de taille commerciale.
Introduction
Installations de confinement de bovins de boucherie sont une option de logement populaire dans le Midwest et la partie supérieure des grandes plaines. Installations de confinement sont plus fréquentes dans cette région que les plaines du Sud parce que la région reçoit plus de précipitations annuelles, qui crée plus ruissellement de parcs d’engraissement qui doit être contenue. Bon nombre de producteurs a choisi de construire des granges mono pente pour bovins de boucherie. Les principales raisons citées par les producteurs pour choisir une installation mono pente a été la capacité de l’horaire du travail et du fumier enlèvement et amélioration des performances par rapport pour ouvrir beaucoup de parcs d’engraissement1. La majorité des éleveurs de bovins (72,2 %) à l’aide de granges mono pente maintenir un pack lité pour un tour de bovins ou plus, en utilisant un système de gestion de profond-literie pour la literie et des déchets1. La litière couramment utilisée est la canne de maïs, bien que rapport de producteurs à l’aide de chaume de soja, paille de blé, épis de maïs et de sciure de bois1. En raison de la demande régionale pour la literie de canne de maïs, de nombreux producteurs souhaitaient literie alternatifs qui pourrait être utilisés dans des installations mono pente. Outre l’économie et le confort animal, les producteurs ont contesté comment la litière serait influent sur l’environnement de l’installation, y compris la production de gaz odorants, composition nutritionnelle de la résultante du fumier/literie et la présence d’agents pathogènes.
Peu d’études ont été menées pour mesurer la qualité de l’air résultant de literie différents matériaux utilisés dans des logements du bétail, la plupart se focaliser uniquement sur l’ammoniac. La plupart des précédentes évaluations de la qualité de l’air comprennent la collecte de données à la ferme avec une ou deux unités expérimentales par les traitements actuellement analysés à la fois2,3,4,5. Ayant limité le nombre d’unités expérimentales nécessite l’étude être répété plusieurs fois, ajoutant ainsi des variables supplémentaires tels que les conditions météorologiques, l’âge ou le stade de la production d’animaux, et peut-être des matériaux de literie produites dans différentes saisons de croissance .
Avec aucun modèle connu-mise à l’échelle laboratoire afin d’étudier les facteurs qui influent sur la qualité de l’air et de la composition nutritionnelle de la linge de lit/fumier mélange résultant de boeuf lits profonds mono pente des installations, les chercheurs, tout d’abord tenté d’utiliser des installations de bétail commercial en utilisant un système lits profonds6,7,8. Chambres à flux statique ont été utilisées pour mesurer les concentrations de3 NH sur la surface des installations mono pente profondeur lités bovins au cours d’une période de 18 mois6. Deux stylos dans chacune des deux granges ont été mesurés. Hachés des tiges de maïs ont été la préféré de la litière, mais les tiges de paille et de soya blé ont également été utilisés pour la literie pendant de brèves périodes de ce projet. Literie d’utilisation varie de 1,95-3,37 kg par animal par jour et un stylo densité varie entre 3.22-6,13 m2 par animal. Des études ultérieures mesuré les émissions d’ammoniac et le sulfure d’hydrogène de la grange7et les concentrations de particules à l’extérieur de la grange8. Ces études ont été menées sur une période de 2 ans à l’aide de deux à quatre emplacements de grange. Le défi lié à la collecte de données à la ferme est le manque de contrôle par la recherche sur le système. Producteurs changent l’alimentation du bétail, déplacent les animaux du stylo à plume, utilisent des matériaux de litière provenant de différentes sources et nettoyez et permet de re-lit stylos comme leur production et de la population active, ainsi les nombreuses variables confondantes. Recherche sur la ferme implique aussi des frais de voyage et de grandes quantités de traitements expérimentaux (tels que matériel de literie). L’objectif de ce projet était d’élaborer un modèle de laboratoire qui pourrait servir à étudier les facteurs qui influent sur la qualité de l’air et de la gestion des éléments nutritifs dans les installations de mono pente lits profonds bovins.
Protocole
L’étude vise à mener pendant 42 jours avec collecte hebdomadaire. Toutes les procédures d’animaux ont été examinés et approuvés par le Comité de l’emploi et de nous viande Animal Research Centre institutionnel animalier.
1. la construction simulé lits Packs
- Commencer avec des conteneurs de cylindre en plastique qui sont 0,42 m de haut avec un diamètre de 0,38 m.
Remarque : Dans cette étude, un conteneur particulier corbeille commerciale 10 gallons est utilisé (voir Table des matières), mais autres contenants de plastique de taille semblable serait approprié. - Percer six trous de 1 cm également espacement autour de la circonférence du conteneur en plastique dans chaque récipient en plastique environ 5 cm du haut du conteneur en plastique. Retirer des restes de plastique du contenant.
- Tarer le conteneur en plastique et noter la masse sur le côté du conteneur en plastique. Peser 320 g de litière sélectionné dans pan de pesée à l’aide d’une balance, puis ajouter literie matériaux vers le conteneur en plastique.
Remarque : Tout matériel de literie jugé convenable pour utilisation dans des installations d’élevage peut être utilisé9,10,11,12,13,14,15. Pour la modélisation des installations de bétail lités profonde dans la Upper Great Plains, canne de maïs est considéré comme la plus courante matériel de literie1 mais la canne de soja, la paille de blé, et copeaux de bois ont également été utilisés1. Si vous utilisez ce système pour les installations de porcs ou de produits laitiers modèle lités profonds, paille de blé, paille d’orge, paille d’avoine, foin, copeaux de bois, copeaux, sciure, Journal, épis de maïs, chaume de soja, de riz coques, ou sable est peut-être plus adapté16,17 ,,18. - Poids 320 g de frais bovins excréments sur un plastique plaque à l’aide de la balance et ajouter dans le récipient en plastique.
NOTE : Urine et les selles sont recueillies et maintenus comme décrit précédemment11. - Mesure 320 mL d’urine de bovins frais dans le cylindre gradué 1000 mL. Videz le contenu dans le récipient en plastique. À l’aide d’un agitateur (5,08 cm de circonférence), mélanger le mélange de matière de literie légèrement pendant 30 s.
Remarque : dans ce cas, une tige d’acier creuse avec un couvercle en plastique sur l’extrémité a été utilisée. Sinon, n’importe quel type de tige pourrait servir. - Nettoyer l’extrémité de la tige d’agitation entre chaque pack lité à l’aide d’une lingette antiseptique disposition pour prévenir la contamination croisée des microbes.
Remarque : Un seau d’eau savonneuse tiède peut également servir pour nettoyer l’agitateur. Un sac à sandwich en plastique peut également être fixé avec un élastique à l’extrémité de la tige et remplacé après que chaque lits pack pour éviter toute contamination croisée. - Pesez et consignez la messe finale du mélange literie. Placer le récipient en plastique dans la chambre environnementale19 régler à une température ambiante de 18 à 20 ° C avec un point de rosée de 12 ° C.
2. maintenir la simulation lits Packs
- Quarante-huit heures avant d’ajouter les excréments et l’urine, sortir congelés excréments et l’urine du congélateur et laisser pour décongeler à température ambiante (20-25 ° c).
- Moins d’une heure avant d’ajouter l’urine au pack lité, mesurer le pH de l’urine.
- Mettre sur les équipement de protection individuelle approprié (gants, lunettes de sécurité) nécessaires pour le traitement des 6 M NaOH.
- Verser 25 mL 6 M d’hydroxyde de sodium (NaOH) dans l’éprouvette graduée. Remuer le mélange, puis tester le pH à l’aide d’une sonde de pH. Répétez jusqu'à ce que l’urine atteint pH 7,4, pH physiologique20.
- Une fois que le pH de l’urine est ajusté, replacer le capuchon sur le contenant de l’urine quand pas en service pour empêcher la volatilisation de l’azote dans l’urine.
- Pesez et consignez la masse du bloc-lité. Si des litières fraîches doit être ajouté à ce jour, peser 320 g de sélectionné le matériel de literie dans le moule en aluminium à l’aide de la balance et ajoutez litière pour les packs lits respectifs. Si aucune literie ne doit être ajouté à ce jour, passez à étape 2.7.
- Environ 320 g de bétail décongelé excréments sur un plastique plaque à l’aide de la balance et ajouter au pack lité.
Remarque : Le jour 21, utiliser fèces fraîches au lieu de selles décongelées. - Mesure 320 mL d’urine de bétail décongelés dans l’éprouvette graduée 1000 mL. Videz le contenu dans le pack lité.
Remarque : Le jour 21, utilisez urines fraîches au lieu d’urine décongelé. - À l’aide d’un agitateur, remuez le mélange de pack literie légèrement pendant 30 secondes. Nettoyer le bout en plastique de l’agitateur entre chaque pack lité à prévenir la contamination croisée des microbes. Pesez et consignez la messe finale du mélange literie.
- Retourner le récipient en plastique dans la chambre.
- Répétez les étapes 2.1-2.10 les lundi, mercredi et vendredi de chaque semaine, avec literie matériaux étant ajoutés (étape 2.6) et échantillons d’air prélevés chaque mercredi.
3. le prélèvement d’échantillons de la Packs litée simulée
NOTE : Échantillons sont prélevés de la packs litée simulée une fois par semaine, avant d’ajouter les fèces, l’urine et des litières fraîches.
- Préparation recueillir des échantillons d’air d’espace libre de chaque pack lité simulée.
- Tourner sur tous les équipements de prélèvement d’air et laisser pour chauffer selon les instructions du fabricant, environ 1 heure.
Remarque : Consultez la Table des matières pour l’ammoniac (NH3), le sulfure d’hydrogène (H2S), méthane (CH4), l’oxyde nitreux (N2O) et des analyseurs de gaz de dioxyde de carbone (CO2) utilisés dans cette étude. - Mesurez la distance entre le haut du sac lité simulée vers le haut du conteneur en plastique maintenant le pack lité simulé à l’aide d’une règle.
- Calculer le volume de la zone d’espace de tête à l’aide de la formule suivante :
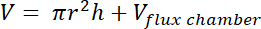
où r = rayon du récipient en plastique,
h = distance entre le dessus du bloc-lité vers le haut du conteneur en plastique, et
Vchambre de flux = volume de la chambre de flux située sur le dessus du conteneur en plastique.
Remarque : Les chambres de flux utilisés dans cette étude avaient un volume intérieur de 0,007 m3 d’une superficie de 0,064 m21,22. - Enfoncer un pieu métallique environ 5 cm surface du pack lit au centre approximatif du pack. Enfiler un tube inerte 0,64 cm à travers un des trous de 1 cm en haut de chaque conteneur pack lités simulé et sûr sur un pieu de métal 12,5 cm 1,3 cm au-dessus de la surface du pack literie. Placer en acier inoxydable flux statique hémisphérique chambres21,22 avec des jupes en caoutchouc sur le dessus de chaque pack lité simulée (Figure 1).
Remarque : Les jupes en caoutchouc sont 61 cm carrés en caoutchouc doux et élastique avec 22,9 cm de diamètre trous découpés dans le centre. Le trou s’adapte au-dessus de la chambre de flux et les jupes forment un joint sur le dessus le récipient en plastique lorsqu’il est placé sur le réservoir. - Fixez 0,64 cm tube inerte aux chambres à flux à l’aide de raccords à compression inerte.
Remarque : Le tube inerte est fixé sur le collecteur d’échantillonnage de gaz qui alimente le matériel d’échantillonnage de l’air. Le système de prélèvement de gaz est contrôlé par un relais 24 volts de la logique Programmable (voir Table des matières) qui signale plusieurs positionnels solénoïdes 3 voies pour ouvrir et fermer une des lignes d’arrivée d’air huit sur le collecteur des gaz d’échantillonnage. Une ligne est ouverte à la fois pour permettre à l’échantillonnage d’air individuel de chaque pack lité. - Commencer le rinçage à l’air ambiant de la pièce à travers la tubulure à raison de 5 L min-1 pendant 30 minutes.
Remarque : Consultez la Table des matières pour pompe utilisée pour purger l’air à travers les lignes de l’échantillon.
- Tourner sur tous les équipements de prélèvement d’air et laisser pour chauffer selon les instructions du fabricant, environ 1 heure.
- Mesurer la concentration d’ammoniac, dioxyde de carbone, le méthane et le sulfure d’hydrogène dans l’espace de tête des packs lités simulées.
- Après que rinçage adéquatement la simulation lits packs, ouvrir le robinet d’arrêt sur la ligne d’échantillonnage pour aspirer l’air ambiant de la salle en lignes échantillon inerte connectés au collecteur de gaz d’échantillonnage.
- Activer le relais logique programmable pour commencer tirant l’air dans le matériel d’échantillonnage de l’air. Mensurations Records de l’air ambiant pendant 20 minutes afin de déterminer la concentration des gaz mesurés dans l’air ambiant. Cela servira une concentration atmosphérique de fond. Lorsque vous avez terminé la collecte de concentration dans l’air ambiant, fermer le robinet d’arrêt sur la ligne de l’échantillon.
- Activer le relais logique programmable pour commencer l’échantillonnage à vol d’oiseau de l’inerte exemples de ligne attaché à chaque chambre de flux. Records Mensurations de chaque ligne de l’échantillon pendant 20 minutes déterminer les concentrations de gaz mesurées dans l’espace libre de chaque pack lité.
- Résultats peuvent être présentés sous forme de la concentration moyenne du gaz (NH3, CO2, N2O, CH4, H2S) dans les échantillons d’air (mg kg-1 ou ppm), ou la densité de flux (taux d’émission) de gaz peut être calculée sur une masse par unité de zone par unité de temps à l’aide de l’équation suivante :
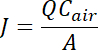
où J = le flux en µg m-2 min-1,
A = la surface de la source (m2) à l’intérieur de la chambre,
Q = le balayage air débit taux m3 min-1, et
Cair = la concentration de COV laissant la chambre (µg m-3)23.
- Mesurer la concentration d’odorants composés organiques volatils dans l’espace de tête des packs lités simulées.
- Enfilez des gants jetables en latex ou nitrile.
- Après que rinçage adéquatement la simulation lits packs, retirez bouchons de stockage en laiton préconditionnés inox tubes absorbants.
NOTE : Les tubes absorbants utilisés dans cette étude étaient de 89 mm × 6,4 mm QU'OD rempli de Tenax TA sorbant (voir Table des matières). Capuchons en laiton ont des embouts de polythtrafluorethylene (PTFE). - Attachez la fin a reçu de la tube à adsorption à l’orifice d’entrée de la chambre de flux à l’aide de tuyaux flexibles en caoutchouc et l’autre extrémité du tube absorbant pour une pompe à vide.
Remarque : La pompe à vide utilisée dans cette étude (voir Table des matières) tiré d’air à travers les tubes absorbants à un débit de 75 mL min-1. - Laisser la pompe expulser l’air dans le tube de sorbant pendant 5 min pour un volume d’échantillon de 0,375 L, puis éteignez la pompe et débrancher le tube à adsorption. Replacer les couvercles de rangement de laiton sur les extrémités des tubes absorbants.
- Répétez les étapes 3.3.1 - 3.3.4 pour recueillir un tube à adsorption pour chaque pack lité.
- Conserver le sorbants tubes jusqu'à l’analyse par désorption thermique-gaz chromatographe-spectrométrie de masse (TD-GC-MS). Tubes peuvent être conservés à température ambiante (20-25 ° c) pour < 24h. Si vous entreposez > 24h, magasin dans le réfrigérateur.
- Immédiatement avant l’analyse de l’échantillon sur le système de TD-GC-MS, retirer les capuchons de stockage laiton des tubes absorbants et remplacez par PTFE casquettes analytique23.
- Analyser les tubes absorbants pour les composés organiques volatils24 (acide acétique, butyrique, acide propionique, acide isobutyrique, acide isovalérique, acide valérique, hexanoïque acide, acide heptanoïque, phénol, p-crésol, indole, skatole, disulfure de diméthyle et diméthyl trisulfure) à l’aide de TD-GC-MS23,24,25.
- Résultats peuvent être présentés sous forme de concentration de COV dans les échantillons d’air (µg m-3), ou la densité du flux de la VOC (taux d’émission) peut être calculée sur une masse par unité de surface par unité de temps à l’aide de l’équation suivante :
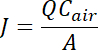
où J = le flux en µg m-2 min-1,
A = la surface de la source (m2) à l’intérieur de la chambre,
Q = le balayage air débit taux m3 min-1, et
Cair= la concentration de COV laissant la chambre (µg m-3)23.
- Recueillir des mesures physiques et chimiques des packs lités simulées.
Remarque : La température, le pH et la perte d’eau par évaporation sont mesurées chaque fois matériaux supplémentaires ont été ajoutés pour les packs lités simulées. Composition nutritionnelle est déterminée au jour 0 et 42 jours. Espace air libre est déterminé au jour 42 seulement.- Déterminer la température du pack lité en insérant une sonde de température au centre du bloc-lité, environ 7,6 cm sous la surface du pack lité simulé. Laissez la température se stabiliser et d’enregistrer.
- Déterminer la perte estimée par évaporation de l’eau
- Placer un récipient en plastique sur la balance.
- Mesurer et noter la masse de la simulation lits pack avant et après chaque ajout de lit/urine/feces au pack lité simulé.
- Calculer la perte d’eau par évaporation estimé en soustrayant la masse de début de la journée en cours de la Messe de fin de la journée précédente. La différence est la masse estimée de l’eau qui s’évapore de la meute litée entre les jours et peut être utilisé pour comparer les différences relatives entre les lit pack, bien qu’il ne reflète pas la perte absolue.
- Déterminer le pH du pack lité simulé
- Prélever un échantillon représentant 5 à 10 g de chaque pack lité simulé depuis le centre de la meute à une profondeur d’environ 7,6 cm sous la surface du pack lité. Placer l’échantillon dans un tube conique en plastique de 50 mL, bouchon et étiquette.
- Calibrer le pH mètre avec pH tampons 4 et 7 selon les instructions du fabricant.
- Déterminer la masse de chaque conique.
- Diluer chaque échantillon 1:2 de manière massive avec de l’eau distillée, déminéralisée. Secouez la conique pour mélanger le matériau de l’eau et de la literie. Insérer la sonde pH dans la conique, mesurer et enregistrer le pH de l’échantillon.
- Les jours 0 et 42 seulement, déterminer teneur en éléments nutritifs du pack lité simulé.
- Prélever un échantillon représentatif de 50 g de chaque pack lité simulé depuis le centre de la meute à une profondeur d’environ 7,6 cm sous la surface du pack lité. Placer dans un sac de prélèvement de sol papier.
- Transport vers un laboratoire pour l’analyse des éléments nutritifs dans les 24 heures. Conserver au réfrigérateur jusqu'à ce que les échantillons peuvent être transportés à un laboratoire pour l’analyse des éléments nutritifs.
Remarque : Toute macro ou micro nutriments peuvent être analysés. Nous analysons pour azote total26, phosphore et soufre analyse27 dans un laboratoire commercial.
- Sur les 42 jours seulement, déterminer libre espace aérien simulé Pack lité.
- Placer le récipient en plastique sur un équilibre et noter la masse. Remplir lentement avec de l’eau jusqu'à ce que la surface de l’eau est même avec la surface du pack lité simulée. Laissez l’eau s’installer jusqu'à ce qu’aucune bulle plus ne viennent le pack lité simulé, puis enregistrer la masse du récipient en plastique
- Déterminer le pourcentage d’espace d’air libre selon le calcul suivant :
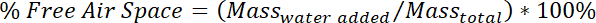
- Après avoir terminé les données souhaitées tout étapes de collecte (étapes 3.1 - 3.4), ajouter fèces, urine et literie pour les packs lités simulés suivant étapes 2.1 - 2.10.
Résultats
A ce jour, recherche sept études ont été publiées9,10,11,12,13,14,15 à l’aide de cette procédure, sous réserve de modifications et ajustements apportés pour améliorer le modèle et tenir compte des objectifs des expériences spécifiques. Cette pro...
Discussion
L’ajout fréquent de l’urine et les selles pour les packs lits est une étape cruciale. Nous avons expérimenté avec l’ajout d’urine et les fèces juste une fois par semaine, mais trouve que le pack lité mis au point une croûte, pris au piège de gaz à l’intérieur du pack, qui n’était pas représentative des installations commerciales. L’utilisation de fèces fraîches au début de l’étude assure que les packs lits est inoculé à des populations bactériennes communes trouvées dans des installati...
Déclarations de divulgation
Cette recherche a été financée par des fonds votés par le gouvernement fédéral à l’USDA Agricultural Research Service, recherche numéro du projet 3040-41630-001-00D.
La mention de noms commerciaux ou des produits commerciaux dans cet article est uniquement dans le but de fournir des informations spécifiques et n’implique pas de recommandation ou une approbation par l’USDA.
USDA est un fournisseur de l’égalité des chances et l’employeur.
Remerciements
L’auteur tient à remercier Alan Kruger, Todd Boman, Shannon Ostdiek, Elaine Berry et Ferouz Ayadi qui ont aidé à la collecte de données en utilisant les packs lités simulées. L’auteur reconnaît également Tami Brown-Brandl et Dale Janssen pour leur aide à maintenir les chambres environnementales.
matériels
| Name | Company | Catalog Number | Comments |
| 10 gallon plastic cylinder containers | Rubbermaid | Model 2610 | Other similar-sized plastic containers are suitable |
| Mass balance | Any | Capable of measuring 0.1 gram | |
| Electric drill with 1 cm bit | Any | ||
| Methane analyzer | Thermo Fisher Scientific | Model 55i Methane/Non-methane Analyzer | |
| Hydrogen sulfide analyzer | Thermo Fisher Scientific | Model 450i | |
| Ammonia analyzer | Thermo Fisher Scientific | Model 17i | |
| Carbon dioxide analyzer | California Analytical | Model 1412 | |
| Nitrous oxide analyzer | California Analytical | Model 1412 | |
| Programmable Logic Relay | TECO | Model SG2-020VR-D | |
| Stainless steel flux chambers | Any | Constructed using the parts list and directions cited at Woodbury et al., 2006 | |
| Rubber skits | Any | Constructed from flexible rubber material. Cut into squares (61 cm x 61 cm) with 22.9 cm diameter hole in center. | |
| pH meter | Spectrum Technologies | IQ150 | |
| thermometer | Spectrum Technologies | IQ150 | |
| Ruler or tape measure | Any | Capable of measuring in cm | |
| Sorbent tubes | Markes International | Tenax TA | |
| Pocket pumps | SKC Inc. | Series 210 | |
| Inert sampling line | Teflon | 0.64 cm diameter | |
| Pump | Thomas | 107 series | Used to flush air through sample lines |
Références
- Doran, B., Euken, R., Spiehs, M. Hoops and mono-slopes: What we have learned about management and performance. Feedlot Forum 2010. , 8-16 (2010).
- Andersson, M. Performance of bedding materials in affecting ammonia emissions from pig manure. J. Agric. Engng. Res. 65, 213-222 (1996).
- Jeppsson, K. H. Volatilization of ammonia in deep-litter systems with different bedding materials for young cattle. J. Agric. Engng. Res. 73, 49-57 (1999).
- Powell, J. M., Misselbrook, T. H., Casler, M. D. Season and bedding impacts on ammonia emissions from tie-stall dairy barns. J. Environ. Qual. 37, 7-15 (2008).
- Gilhespy, S. L., Webb, J., Chadwick, D. R., Misselbrook, T. H., Kay, R., Camp, V., Retter, A. L., Bason, A. Will additional straw bedding in buildings housing cattle and pigs reduce ammonia emissions. Biosystems Engng. , 180-189 (2009).
- Spiehs, M. J., Woodbury, B. L., Doran, B. E., Eigenberg, R. A., Kohl, K. D., Varel, V. H., Berry, E. D., Wells, J. E. Environmental conditions in beef deep-bedded mono-slope facilities: A descriptive study. Trans ASABE. 54, 663-673 (2011).
- Cortus, E. L., Spiehs, M. J., Doran, B. E., Al Mamun, M. R. H., Ayadi, F. Y., Cortus, S. D., Kohl, K. D., Pohl, S., Stowell, R., Nicolai, R. . Ammonia and hydrogen sulfide concentration and emission patterns for mono-slope beef cattle facilities in the Northern Great Plains. , (2014).
- Spiehs, M. J., Cortus, E. L., Holt, G. A., Kohl, K. D., Doran, B. E., Ayadi, F. Y., Cortus, S. D., Al Mamun, M. R., Pohl, S., Nicolai, R., Stowell, R., Parker, D. Particulate matter concentration for mono-slope beef cattle facilities in the Northern Great Plains. Trans. ASABE. 57, 1831-1837 (2014).
- Ayadi, F. Y., Cortus, E. L., Spiehs, M. J., Miller, D. N., Djira, G. D. Ammonia and greenhouse gas concentrations at surfaces of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 783-795 (2015).
- Ayadi, F. Y., Spiehs, M. J., Cortus, E. L., Miller, D. N., Djira, G. D. Physical, chemical, and biological properties of simulated beef cattle bedded manure packs. Trans. ASABE. 58, 797-811 (2015).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Effect of bedding materials on concentration of odorous compounds and Escherichia coli in beef cattle bedded manure packs. J. Environ. Qual. 42, 65-75 (2013).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A., Berry, E. D., Wells, J. E. Use of wood-based materials in beef bedded manure packs: 1. Effect on ammonia, total reduced sulfide, and greenhouse gas concentrations. J. Environ. Qual. 43, 1187-1194 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Berry, E. D., Wells, J. E., Parker, D. B., Miller, D. N., Jaderborg, J. P., Diconstanzo, A. Use of wood-based materials in beef bedded manure packs: 2. Effect on odorous volatile organic compounds, odor activity value, Escherichia coli, and nutrient concentration. J. Environ. Qual. 43, 1195-1206 (2014).
- Spiehs, M. J., Brown-Brandl, T. M., Parker, D. B., Miller, D. N., Berry, E. D., Wells, J. E. Ammonia, total reduced sulfides, and greenhouse gases of pine chip and corn stover bedding packs. J. Environ. Qual. 45, 630-637 (2016).
- Spiehs, M. J., Berry, E. D., Wells, J. E., Parker, D. B., Brown-Brandl, T. M. Odorous volatile organic compounds, Escherichia coli, and nutrient concentrations when kiln-dried pine chips and corn stover bedding are used in beef bedded manure packs. J. Environ. Qual. 46, 722-732 (2017).
- Herbert, S., Hashemi, M., Chickering-Sears, C., Weis, S. . Bedding options for livestock and equine. , (2008).
- Effects of bedding on pig performance. Iowa State Research Farm Progress Reports Available from: https://lib.dr.iastate.edu/farms_reports/134/ (2012)
- Brown-Brandl, T. M., Nienaber, J. A., Eigenberg, R. A. Temperature and humidity control in indirect calorimeter chambers. Trans. ASABE. 54, 685-692 (2011).
- Abney, C. S., Vasconcelos, J. T., McMeniman, J. P., Keyser, S. A., Wilson, K. R., Vogel, G. J., Galyean, M. L. Effects of ractophamine hydrochlodride on performance, rate and variation in feed intake, and acid-base balance in feedlot cattle. J. Anim. Sci. 85, 3090-3098 (2007).
- Miller, D. N., Woodbury, B. L. A solid-phase microextraction chamber method for analysis of manure volatiles. J. Environ. Qual. 35, 2383-2394 (2006).
- Woodbury, B. L., Miller, D. N., Eigenberg, R. A., Nienaber, J. A. An inexpensive laboratory and field chamber for manure volatile gas flux analysis. Trans. ASABE. 49, 767-772 (2006).
- Koziel, J. A., Spinhirne, J. P., Lloyd, J. D., Parker, D. B., Wright, D. W., Kuhrt, F. W. Evaluation of sample recovery of malodorous livestock gases from air sampling bags, solid-phase microextraction fibers, Tenax TA sorbent tubes, and sampling canisters. J. Air Waste Manag. Assn. 55, 1147-1157 (2005).
- Parker, D. B., Gilley, J., Woodbury, B., Kim, K., Galvin, G., Bartelt-Hunt, S. L., Li, X., Snow, D. D. Odorous VOC emission following land application of swine manure slurry. Atmos. Environ. 66, 91-100 (2013).
- Parker, D. B., Koziel, J. A., Cai, L., Jacobson, L. D., Akdeniz, N. Odor and odorous chemical emissions from animal buildings: Part 6. Odor activity value. Trans. ASABE. 55, 2357-2368 (2012).
- Watson, M., Wolf, A., Wolf, N., Peters, J. Total nitrogen. Recommended methods of manure analysis. , 18-24 (2003).
- Wolf, A., Watson, M., Wolf, N., Peters, J. Digestion and dissolution methods for P, K, Ca, Mg, and trace elements. Recommended methods of manure analysis. , 30-38 (2003).
- Euken, R. A survey of manure characteristics from bedded confinement buildings for feedlot beef productions: Progress report. Animal Industry Report. , (2009).
- Li, L., Li, Q. -. F., Wang, K., Bogan, B. W., Ni, J. -. Q., Cortus, E. L., Heber, A. J. The National Air Emission Monitoring Study's southeast layer site: Part I. Site characteristics and monitoring methodology. Trans. ASABE. 56, 1157-1171 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon