Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento Inmunomagnética rápida y específica de los oligodendrocitos primarios de ratón
En este artículo
Resumen
Describimos el aislamiento Inmunomagnética de los oligodendrocitos primario de ratón, que permite el aislamiento rápido y específico de las células para el cultivo en vitro .
Resumen
El aislamiento eficiente y robusto y la cultura de los oligodendrocitos primarios (OLs) es una herramienta valiosa para el estudio en vitro del desarrollo de oligodendroglia, así como la biología de demyelinating enfermedades como la esclerosis múltiple y Enfermedad de Pelizaeus-Merzbacher-como (PMLD). Aquí, presentamos un simple y método de selección para el aislamiento de Inmunomagnética de etapa tres O4+ las células preoligodendrocytes de crías de ratones neonatales. Desde OL inmaduro constituyen más del 80% de la materia blanca de cerebro de roedor en el día postnatal 7 (P7) este método de aislamiento no sólo asegura alto rendimiento celular, sino también el aislamiento específico de OLs ya comprometida con el linaje oligodendroglial, disminuyendo la posibilidad de aislar células contaminantes tales como astrocitos y otras células del cerebro de ratón. Este método es una modificación de las técnicas divulgado previamente y proporciona pureza de oligodendrocyte preparación superior al 80% en aproximadamente 4 horas.
Introducción
Oligodendrocitos (OLs) son las células myelinating del sistema nervioso central (SNC)1. El aislamiento y la cultura de los oligodendrocitos primarios en un entorno fuertemente regulado es una valiosa herramienta para el estudio en vitro del desarrollo de oligodendroglia, así como la biología de enfermedades como la esclerosis múltiple2 desmielinizantes . Esto requiere de un eficiente y robusto del oligodendrocyte aislamiento y cultura método3. En este estudio, aprovechó de la expresión de un marcador superficial de la célula oligodendrocyte distintivo para aplicar una técnica de aislamiento modificado que es rápida y específica.
Se han identificado cuatro diferentes etapas de maduración del oligodendrocyte, cada uno caracterizado por la expresión de marcadores de superficie celular distintiva para cada etapa del desarrollo (figura 1). Estos marcadores de superficie celular pueden ser reconocidos por anticuerpos específicos4,5y se pueden utilizar para aislar OLs en etapas específicas. En la primera etapa, las células del precursor de oligodendrocyte (OPC) tienen la capacidad de proliferar, migrar y específicamente del factor de crecimiento derivado de plaquetas del receptor (PDGF-Rα)6, gangliósido A2B5, proteoglicanos NG27,8 , polysialic ácido-de los nervios de la célula molécula de adhesión9 y grasos ácido proteína-7 (FABP7)10. OPC tiene morfología bipolar con pocos procesos cortos que emanan de los polos opuestos del cuerpo celular, que es característica de precursores neuronales células11.
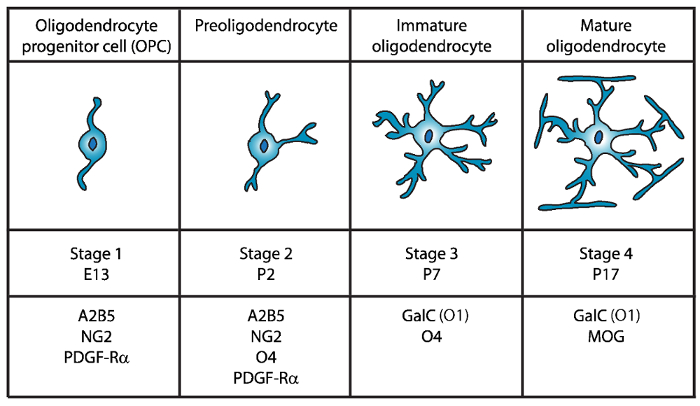
Figura 1: expresión de marcadores de superficie celular durante el desarrollo del ratón oligodendrocyte. OLs marcadores de superficie de la célula como A2B5, GalC (O1), NG2, O4 y PDGF-Rα pueden utilizarse para aislar específicamente oligodendrocitos en etapa de desarrollo específica mediante el uso de anticuerpos específicos. Haga clic aquí para ver una versión más grande de esta figura.
En la segunda etapa, OPC dan lugar a preoligodendrocytes y expresan en la membrana celular no sólo marcadores OPC, pero también del sulfatide (un galactolipid sulfatada) reconocido por el anticuerpo O412,13y la proteína GPR1714, que persiste hasta la etapa de oligodendrocyte inmaduros (OL). En esta etapa, preoligodendrocytes extender procesos cortos multipolares. Preoligodendrocytes son el escenario OL principales en el día postnatal 2 (P2) en la materia blanca cerebral de rata y ratón con una menor población de inmaduros OLs15.
Durante la tercera etapa, OLs inmaduras continúan express O4, pierden la expresión de marcadores A2B5 y NG2 y comienzan a expresar galactocerebrósido C16. En esta etapa, OLs apuestan por el linaje oligodendroglial y convertirse en células post mitóticas con ramas largas ramificadas17,18. OL inmaduro constituyen más del 80% de la materia blanca roedor en P7, y en este momento se observan las primeras células MBP+ 15,19,20,21. Por lo tanto, el aislamiento de OLs en P7 podría garantizar alto rendimiento celular.
En la cuarta y última etapa del desarrollo de OL, maduro OLs myelinating expresa proteínas (proteína básica de mielina (MBP), proteína del proteolípido (PLP), glicoproteína de la mielina asociada (MAG) y del myelin oligodendrocyte glicoproteína (MOG)22,23 ,24,25,26. En esta etapa, madurados OLs extienden las membranas compacto forma enwrapping vainas alrededor de los axones y son capaces de myelinate. Esto coincide con la observación que en cerebro de rata y ratón, MBP+ células se convierten en cada vez más abundantes en la P1419,20,21.
Desde el primer aislamiento de oligodendrocyte Fewster y colegas en 196727, se han implementado varios métodos para el aislamiento de OLs de roedores CNS incluyendo immunopanning28,29,30, celular activado por fluorescencia (FACS) de clasificación aprovechamiento celular antígenos de superficie específicos28,31, centrifugación diferencial de gradiente32,33,34,35 y agitación método basado en la adhesión diferencial de diferentes CNS glia36,37. Sin embargo, los métodos existentes de cultura tienen limitaciones, particularmente en términos de pureza, rendimiento y tiempo necesario para realizar los procedimientos38. Por lo tanto, se requieren métodos más eficientes de aislamiento de oligodendrocitos.
En este trabajo presentamos una simple y método de selección para el aislamiento de Inmunomagnética de etapa tres O4+ las células preoligodendrocytes de crías de ratones neonatales. Este método es una modificación de las técnicas reportadas por Emery et al. 39 y Dincman et al. 40 y una pureza de la preparación de oligodendrocyte superiores al 80% en aproximadamente 4 horas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los ratones utilizados en este estudio fueron atendidos según las directrices del número de protocolo de SUNY Downstate Medical Center División de laboratorio Animal recursos (DLAR) 15-10492.
Nota: Oligodendrocitos primarios fueron aislados de neonatal (P5-P7-tipo C57Bl/6N) ratones. En esta etapa, OLs inmaduros constituyen más del 80% de la materia blanca roedor garantizar alto rendimiento celular. Todos los buffer y composiciones de reactivo están disponibles al final de la Tabla de materiales.
1. cubreobjetos preparación
Nota: Poly-D-lisina (PDL) / cubreobjetos laminina revestido deben estar preparado antes de aislamiento OL.
- Lugar #1 alemán cubreobjetos de vidrio en un tubo cónico de 50 mL y añadir 35 mL de 70% EtOH para limpiarlos.
- Cierre el tubo y colocar en un mezclador oscilante incubar a temperatura ambiente durante al menos 30 minutos mientras mecerse suavemente. Cubreobjetos pueden ser incubadas durante la noche.
- Deseche el EtOH 70%.
- Lavar los cubreobjetos 3 veces con agua desionizada, quitar el agua cada vez con bomba aspirativa.
- Añadir 30-35 mL de PDL 50 μg/mL para el cubreobjetos en el tubo de 50 mL, suficiente para cubrir el cubreobjetos.
- Coloque el tubo de 50 mL que contiene el cubreobjetos en un mezclador oscilante e incubar a temperatura ambiente durante al menos 30 minutos mientras mecerse suavemente.
- Lavar los cubreobjetos 3 veces con agua desionizada, quitando el agua cada vez con bomba aspirativa.
- Transferir el cubreobjetos en platos de Petri de 60 mm con agua desionizada.
- Utilice una pipeta de P200 para arreglar el cubreobjetos como una capa que cubre toda la superficie de la placa de Petri.
- Con cuidado, retire el agua de los platos con bomba aspirativa.
- Retirar el exceso de agua en el cubreobjetos y deje secar durante la noche con la tapa abierta y debajo de UV luz en la capilla.
Nota: PDL revestido vidrio cubreobjetos pueden almacenarse a 4 ° C en placas de Petri estériles hasta por tres meses. - Coloque el cubreobjetos en placas de 24 pocillos, uno por cada bien, con unas pinzas finas.
- Mover el cubreobjetos hasta el centro de la bien asegurándose de que los bordes no toquen la pared del pozo.
- Añada 100 μl de 10 laminina μg/mL diluido en B27NBMA (véase la Tabla de materiales) comenzando en el centro de cada cubreobjetos y mover en forma circular hacia los bordes para cubrir toda el área.
Nota: Puesto que laminina está involucrado en el mantenimiento OL y promueve la diferenciación en OLs madurados, es un factor importante de la supervivencia del OL en vitro cultura41,42,43,44. - Incube la placa en una incubadora de 37 ° C en 5% CO2 durante al menos 1 hora o hasta que están listos para la galjanoplastia OLs.
2. ratón cerebro corteza disociación
- Postnatal 5-7-día viejo C57Bl/6N ratón cachorros de sacrificio por decapitación rápida con tijeras previamente limpiados en etanol al 70%.
Nota: cortezas cerebrales de 5-6 crías de ratones neonatales fueron utilizados para cada preparación. En promedio, un cerebro de ratón rinde 1-1.5 x 106 OLs. - Cortar la piel del cuero cabelludo a lo largo de la línea media con pequeñas tijeras de disección y retraer para exponer el cráneo.
- Corte del cráneo cuidadosamente a lo largo de la línea media a partir de la apertura en la parte posterior del cráneo hacia la zona frontal, levantando con las tijeras para no dañar el cerebro. Luego, con la apertura en la parte posterior del cráneo corte hacia cada zócalo del ojo a lo largo de la base del cráneo.
- Usar pinzas finas para fastidiar las cortezas del mesencéfalo y transferirlas a una placa de cultivo de tejido de 60 mm que contienen 7 mL de B27NBMA. Repita los pasos 2.2 a 2.4 en cada cerebro, agrupación de las cortezas disecadas.
- Transferir las cortezas a un nuevo plato de cultivo de tejidos de 60 mm, 5 ml de tampón de disociación (B27NBMA, 20-30 U/mL papaína y 2.500 U DNasa I).
- Cortar las cortezas en pedazos pequeños de aproximadamente 1 mm3 usando una hoja de bisturí #15 e incubar durante 20 min a 37 ° C, 5% CO2 incubadora.
- Añadir 1 mL de suero de crecimiento bovina (BGS) para detener la reacción enzimática.
- Transferencia de las cortezas junto con los medios de comunicación de disociación a un tubo cónico de 15 mL con una pipeta serológica de 10 mL.
- Suavemente comienza a disociar el tejido cerebral transfiriendo lentamente hacia arriba y hacia abajo de 6 a 8 veces usando una pipeta serológica de 10 mL, usando cuidado para minimizar las burbujas.
- Permitir que los trozos de tejido para 2-3 min y transferir el sobrenadante a un tubo nuevo.
- Añadir 3 mL de B27NBMA contiene 10% BGS/2500 U DNasa I para el tejido de pellets.
- Utilizar una pipeta serológica de 5 mL para disociar suavemente el tejido cerebral al pipetear arriba y abajo 6 - 8 veces. Tenga cuidado minimizar las burbujas.
- Permitir que los trozos de tejido colocar 2-3 minutos.
- Transfiera el sobrenadante a un tubo nuevo. Añadir 3 mL de B27NBMA contiene 10% BGS/DNasa I para el tejido de pellets.
- Disociar el tejido cerebral usando una punta de pipeta P1000, mientras uso la mezcla de medios de comunicación y tejido del cerebro hacia arriba y hacia abajo suavemente. Repetir pasos 2.13 y 2.14 hasta que no queden grandes trozos de tejido o hasta B27NBMA que contiene 10% BGS/DNasa I es agotado, cualquiera viene primero. Tenga cuidado minimizar las burbujas.
- Suspensión de células de piscina con sobrenadantes anteriores.
- Colocar 70 μm células filtro en un tubo de 50 mL. Utilizando una pipeta serológica de 10 mL, pase suavemente la suspensión combinada de células sobre el colador de la célula de 70 μm.
- Lavar el filtro de la célula mediante la adición de 1 mL de B27NBMA contiene 10% BGS/ADNasa I.
- Deseche el filtro de la célula. Llevar el volumen a 30 mL con B27NBMA que contiene 10% BGS/ADNasa I.
- Transferir la suspensión a dos tubos cónicos de 15 mL. Centrifugue la suspensión celular por 10 min a 200 x g.
- Quite el sobrenadante sin salir de las células expuestas al aire. El sobrenadante será nublado debido a restos celulares. Añadir 3 mL de B27NBMA contiene 10% BGS para el pellet.
- Disociar cuidadosamente el sedimento celular utilizando una pipeta P1000. Llevar el volumen a 15 mL con B27NBMA que contiene 10% BGS.
- Pasar la suspensión celular sobre un colador de células frescas de 40 μm.
- Lavar el filtro de la célula mediante la adición de 1mL de B27NBMA contiene 10% BGS. Deseche el filtro de la célula.
- Llevar el volumen a 30 mL con B27NBMA que contiene 10% BGS.
- Transferir la suspensión a tubos cónicos de 2 x 15 mL. Centrifugue la suspensión celular por 10 min a 200 x g.
- Eliminar la mayor parte del sobrenadante sin salir de las células expuestas al aire. Resuspender el pellet celular en 5 mL de hielo frío magnética de la célula clasificación de búfer (MCS).
3. determinación de conteo celular y viabilidad
- Diluir 100 μl de la suspensión de células con 400 μL de solución de azul tripán en un tubo de microcentrífuga de 1,5 mL para alcanzar una dilución de 1:5 en 0,4% (w/v).
- Centro de un vidrio de cubierta en una cámara del hemocitómetro y llenar las dos cámaras con 10 μl de la dilución celular utilizando una pipeta P10 y evitando sobrellenar. La solución pasará bajo el vidrio de cubierta por acción capilar.
- Coloque el hemocitómetro en la platina del microscopio y ajustar el foco de 40 aumentos.
Nota: Las cuentas de célula se registran utilizando un contador de mano en cada una de cinco plazas (cuatro esquinas y un centro). Sólo células no viables absorben el tinte aparecen azules, mientras que vivo y células sanas aparecen redondos y refractiva y no absorben el tinte de color azul, lo que permite determinar el número de células viables y totales por mililitro.
4. aislamiento de O4+ oligodendrocitos
- Centrifugue la suspensión de células a 200 x g durante 10 minutos.
- Eliminar cuidadosamente el sobrenadante usando extracción con bomba aspirativa, evitando la exposición de las células al aire.
- Resuspender el precipitado en 90 μl de tampón de MCS por 1 x 107 células totales seguido por la adición de 10 μl de anti-O4 perlas por 1 x 107 células.
- Mezclar la suspensión de la célula y los granos por sacudiendo suavemente el tubo cónico de 15 mL con el dedo 4 - 5 veces.
- Incubar la mezcla por 15 min a 4 ° C, agitando el tubo cónico de 15 mL con el dedo 4-5 timesevery 5 min.
- Lavar la mezcla suavemente, añadir 2 mL de tampón de MCS por 1 x 107 células al tubo. Centrifugar la mezcla a 200 x g durante 10 minutos.
- Descartar el sobrenadante cuidadosamente utilizando extracción con bomba aspirativa, evitando la exposición de las células al aire. Resuspender el precipitado de células en 500 μl de tampón MCS para cada 1 x 107 células.
- Adjuntar un separador magnético para un soporte separador magnético. Conectar una columna de selección para el separador magnético y colocar un filtro de célula 40 μm en la cima de la columna. Coloque dos 15 mL o un tubo cónico de 50 mL por debajo de la columna de la separación para recoger el flujo a través.
- Preenjuague la columna 40 μm células filtro y separación con 3 mL de tampón de MCS y deje el búfer a través de la columna sin dejarlo secar.
- Añadir la mezcla de la suspensión de la célula y los granos a la coladera de la célula y en la columna de selección.
- Lave el filtro de célula μm 40 con 1 mL de tampón MCS.
- Deseche el filtro de la celda y dejar que la mezcla de células, granos y buffer atraviesan la columna sin dejarlo secar.
- Lavar la columna de la separación 3 veces con 3 mL de tampón de MCS y 1 vez con medios de proliferación de OL.
- Quitar la columna de la separación del separador magnético, rápidamente lo coloca en un tubo cónico de 15 mL y añadir 5 mL de medio de proliferación de OL.
- Coloque el émbolo en la cima de la columna y firmemente empuje para eliminar las células marcadas en el tubo cónico de 15 mL.
- Saque 100 μl de suspensión celular para determinar el recuento y viabilidad con azul de tripán y hemocitómetro como se indica en la sección 3.
Nota: Viabilidad celular superior al 80% se considera aceptable para proceder con la cultura de OLs y viabilidad mayor al 90% es óptima.
5. galjanoplastia de O4 aislado+ oligodendrocitos
- Diluir la suspensión de células al deseo platear densidad (5 x 105 células por cubreobjetos) utilizando medios de proliferación de OL.
Nota: Densidad de siembra es muy importante, para que densidad celular apropiado debe confirmarse mediante un microscopio de cultivo de tejidos antes de proceder. Siembra la densidad por debajo de 10.000 células/cubreobjetos puede conducir a la supervivencia celular pobre. Densidad en 10.000 a 25.000, OL la galjanoplastia diferenciación morfológica es lenta45. Placa de OLs en una densidad de siembra de al menos 50.000 células/cubreobjetos para asegurar la supervivencia de la célula. - Mover las placas de 24 pocillos que contienen cubreobjetos recubierto con laminina de incubadora a la campana de cultivo de tejidos.
- Retire cada cubreobjetos de laminina y reemplazarlo con 100 μl de suspensión OL.
- Incubar OLs en la incubadora de2 °C/5% CO 37 para un máximo de 45 min para promover adherencia OL para el cubreobjetos.
- Después de la incubación, retirar las placas de 24 pocillos de la incubadora. Inundación cada bien de la placa de 24 pocillos con 500 μl de medio de proliferación de OL.
- Vuelva a colocar el OLs en la incubadora de2 °C/5% CO 37 24 h adicionales.
- 24 h después de la galjanoplastia de OLs, eliminar medios de proliferación y sustituir con los medios de diferenciación OL para inducir la diferenciación.
- Vuelva a colocar el OLs en la incubadora y no se retire hasta que están listas para la fijación de las células.
Nota: Cambios en el pH son perjudiciales para la operación y disminuyen la viabilidad celular, por lo tanto debe evitarse la remoción innecesaria de culturas OLs de la incubadora.
6. tinción de inmunofluorescencia
- Para la detección de célula marcadores de superficie (NG2, O1 y O4) quitar los medios de comunicación de los pozos.
- Añadir 250 μl de sobrenadante de hibridoma de ratón que contiene anticuerpos primarios contra O1 (sin diluir)13 y O4 (sin diluir)13 y conejo policlonales contra NG2 (diluido en B27NBMA 1: 150).
Nota: Si se utilizan anticuerpos anti-O1 y O4 anti comercialmente disponibles, es aconsejable utilizar diluciones sugeridas por el fabricante. - Incubar las células con el anticuerpo primario por máxima en un incubador de2 °C/5% CO 37 45 min.
- Lavar dos veces con 0,05% Tween-20 y 1 X PBS. Fijar las células con paraformaldehído al 4% (4% PFA) durante 10 min a temperatura ambiente.
- Lavado tres veces 5 minutos cada uno con 0,05% Tween-20 y 1 X PBS.
- Diluir el conjugado de Alexa 488 cabra anti-ratón IgM o anti-conejo IgG de anticuerpo secundario (1: 400) en B27NBMA.
- Quite el cubreobjetos a 0.05% Tween-20 y 1 X PBS. Incubar las células con el anticuerpo secundario por 1 h a temperatura ambiente en la oscuridad.
- Lavado tres veces 5 minutos cada uno con 0,05% Tween-20 y 1 X PBS.
- Para la doble tinción para la detección de marcadores internos (GFAP), retire el 0.05% Tween-20 y 1 X PBS y bloque/permeabilizar las células con buffer de bloque/permeabilización durante 15 min a temperatura ambiente. De lo contrario continúe con el paso de 6.17.
- Elimine el bloque/permeabilización de tampón y añadir 250 μl pollo anti-GFAP (1: 100) diluido en buffer de bloqueo/permeabilización.
- Incubar las células con anti-GFAP por 1 h a temperatura ambiente. Lavado tres veces 5 minutos cada uno con 0,05% Tween-20 y 1 X PBS.
- Diluir el cabra conjugado con Alexa 594 anti-pollo IgG anticuerpo secundario (1: 400) en B27NBMA.
- Quite el cubreobjetos a 0.05% Tween-20 y 1 X PBS. Incubar las células con el anticuerpo secundario por 1 h a temperatura ambiente en la oscuridad.
- Lavado tres veces 5 minutos cada uno con 0,05% Tween-20 y 1 X PBS.
- Contratinción con 4', 6-diamidino-2-phenylindole (DAPI) y las células de montaje con montaje de medios que contienen DAPI antifade.
- Deje que el cubreobjetos curan durante la noche en la oscuridad a temperatura ambiente.
- Imagen de las células con un microscopio de epifluorescencia.
Nota: En el presente Protocolo, las células fueron reflejadas en 40 aumentos con un tiempo de exposición uniforme.
Access restricted. Please log in or start a trial to view this content.
Resultados
El propósito de este estudio fue establecer un método de aislamiento mejorado de O4+ oligodendrocitos primario de ratón que requieren la manipulación lo menos posible de las células diana. Todo el procedimiento de eutanasia de los cachorros para el revestimiento de las células en cubreobjetos toma aproximadamente 4 horas y datos presentados aquí representan tres experimentos independientes. Después de la disociación del tejido, un promedio de 4,3 ± 0,46 x 107
Access restricted. Please log in or start a trial to view this content.
Discusión
En esta comunicación, presentamos un método para el aislamiento eficaz de ratón inmaduro altamente purificada oligodendrocyte culturas. Comparado con protocolos previamente publicado39,40, este método produjo una mayor pureza con un nivel mucho más bajo de astrocitos GFAP positivas y un porcentaje muy bajo de otras células no caracterizado. Es importante señalar que estos son inmaduros OLs ya comprometidos con el linaje oligodendroglial. Así, estas célul...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen ninguna revelación.
Agradecimientos
Este estudio fue apoyado por subvenciones de la National Multiple Sclerosis Society (RG4591A1/2) y los institutos nacionales de salud (R03NS06740402). Los autores agradecen a Dr. Iván Hernández y los miembros de su laboratorio para proporcionar asesoramiento, equipamiento y espacio de laboratorio.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 10ml serological pipets | Fisher Scientific | 13-676-10J | |
| 10ml syringe Luer-Loc tip | BD, Becton Dickinson | 309604 | |
| 15ml conical tubes | Falcon | 352097 | |
| 24-well tissue culture plates | Falcon | 353935 | |
| 40µm cell strainer | Fisher Scientific | 22368547 | |
| 50ml conical tubes | Falcon | 352098 | |
| 5ml serological pipets | Fisher Scientific | 13-676-10H | |
| 60mm tissue culture plates | Falcon | 353002 | |
| 70µm cell strainer | Fisher Scientific | 22363548 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) secondary antibody | Invitrogen | A11001 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A21042 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A11008 | |
| Alexa Fluor 594 goat anti-chicken IgG (H+L) secondary antibody | Invitrogen | A11042 | |
| Anti-O4 beads- Anti-O4MicroBeads | Miltenyi Biotec | 130-094-543 | |
| Apo-Transferrin human | Sigma | T1147 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1101 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1102 | |
| B27 Supplement | Invitrogen | 17504-044 | |
| Boric acid | Sigma | B7660 | |
| Bovine Growth Serum (BGS) | GE Healthcare Life Sciences | SH30541.03 | |
| BSA | Fisher Scientific | BP-1600-100 | |
| CNTF | Peprotech | 450-50 | |
| d-Biotin | Sigma | B4639 | |
| Desoxyribonuclease I (DNAse I) | Worthington | LS002007 | |
| EDTA | Fisher Scientific | S311 | |
| Epifluorescence microscope with an Olympus DP70 camera | Olympus | Bx51 | |
| Feather disposable scalpels | Andwin Scientific | EF7281C | |
| Forskolin | Sigma | F6886 | |
| German glass coverslips, #1 thickness, 12mm diameter round | NeuVitro | GG-12-oz | |
| GFAP antibody | Aves | GFAP | |
| Glucose | Fisher Scientific | D16-1 | |
| GlutaMAX | Invitrogen | 35050-61 | |
| Insulin | Invitrogen | 12585-014 | |
| Magnetic separator stand - MACS multistand | Miltenyi Biotec | 130-042-303 | |
| Magnetic separator-MiniMACS separator | Miltenyi Biotec | 130-042-302 | |
| Millex PES 0.22µm filter unit | Millipore | SLG033RS | |
| Mounting media- Prolong Gold with DAPI | Thermo Fisher | P36930 | |
| N-acetyl-cysteine (NAC) | Sigma | A8199 | |
| Natural mouse laminin | Invitrogen | 23017-015 | |
| Neurobasal Medium A | Invitrogen | 10888-022 | |
| Neurotrophin-3 (NT-3) | Peprotech | 450-03 | |
| NG2 antibody | Millipore | AB5320 | |
| Papain | Worthington | LS003126 | |
| PBS without Ca2+ and Mg2+ | Sigma | D5652 | |
| PDGF | Peprotech | 100-13A | |
| Petri dishes | Falcon | 351029 | |
| Poly-D-Lysine | Sigma | P6407 | |
| Primocin | Invivogen | ant-pm-2 | |
| Progesterone | Sigma | P8783 | |
| Putrescine | Sigma | P5780 | |
| Selection column-LS columns | Miltenyi Biotec | 130-042-401 | |
| Sodium Selenite | Sigma | S5261 | |
| Trace elements B | Corning | 25-000-CI | |
| Triiodothyronine (T3) | Sigma | T6397 | |
| Triton-X | Sigma | T8787 | |
| Trypan Blue Solution | Corning | 25-900-CI | |
| Tween 20 | Sigma | P1379 | |
| B27NBMA | 487.75 mL Neurobasal Medium A; 10 mL B27 Supplement; 1 mL Primocin; 1.25 mL Glutamax; Filter sterilize and store at 4 °C until use. | ||
| B27NBMA + 10% BGS | 27 mL B27NBMA; 3 mL Bovine growth serum | ||
| CNTF solution stock (10 µg/ml; 1000X) | Order from Peprotech (450-50). Make up at 0.1 to 1 mg/ml according to Manufacturer’s instruction (may vary from lot to lot) in buffer (e.g. DPBS + 0.2% BSA). Store at -80 °C. Working solution (10 µg/ml, 1000X) 1. Make on 0.2% BSA (Fisher scientific BP-1600-100) in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 10µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80 °C. | ||
| d-Biotin stock solution (50 µg/ml; 5000X) | Resuspend d-Biotin (Sigma-B4639) in double-distilled H2O at 50 µg/ml (e.g. 2.5 mg in 50 ml of ddH2O). Resuspension might take fair amount of agitation/vortexing, or mild warming briefly at 37°C. If the d-Biotin still will not solubilize, it is fine to make up a less concentrated (e.g. 10µg/ml), and to add a higher volume to the B27NBMA (1/1000), instead of 1/5000). Store at 4°C. | ||
| DNase I stock solution | 1. Dissolve at 12,500 U Deoxyribonuclease I / ml in HBSS chilled on ice. 2. Filter sterilize on ice 3. Aliquot at 200 µl and freeze overnight at -20°C. 4. Store aliquots at -20 to -30°C. | ||
| Dulbecco’s Phosphate Buffered Saline (w/o Ca2+ and Mg2+) | Dissolve pouch in 1 Liter of water to yield 1 liter of medium at 9.6 grams of powder per liter of medium. Store at 2-8 °C. | ||
| Forskolin stock solution (4.2 mg/ml; 1000X) | Add 1 ml of sterile DMSO to 50 mg Forskolin in bottle (Sigma-F6886) and pipette until resuspended. Transfer to a 15 ml centrifuge tube and add 11 ml of sterile DMSO to bring to 4.2 mg/ml. Aliquot (e.g. 20 µl) and store at -20°C. | ||
| Hank’s balanced salts (HBSS) (Sigma | 1. Measure 900 ml of water (temperature 15-20 °C) in a cylinder and stir gently. 2. Add the power and stir until dissolved. 3. Rinse original package with a small amount of water to remove all traces of the powder. 4. Add to the solution in step 2. 5. Add 0.35 gr of sodium bicarbonate (7.5% w/v) for each liter of final volume. 6. Keep stirring until dissolved. 7. Adjust the pH of the buffer while stirring to 0.1-0.3 units below pH= 7.4 since it may rise during filtration. The use of 1N HCl or 1N NaOH is recommended to adjust the pH. 8. Add additional water to bring the final volume to 1L. 9. Sterilize by filtration using a membrane with a porosity of 0.22 microns. 10. Store at 2-8 °C. | ||
| Insulin stock solution (4000 µg/ml) | Thaw the bottle and aliquot 25 µl per microcentrifuge tube and store at -20°C. | ||
| Laminin solution | Slowly thaw laminin in the cold (2°C to 8°C) to avoid gel formation. Then, aliquot into polypropylene tubes. Store at 5° C to -20° C in aliquots (e.g. 20 µl) and do not freeze/thaw repeatedly. Laminin may be stored at these temperatures for up to six months. | ||
| Magnetic Cell Sorting (MCS) Buffer | Prepare the solution containing phosphate-buffered saline (PBS), pH 7.2, and 0.5% bovine serum albumin (BSA), 0.5 mM EDTA, 5µg/ml Insulin, 1 g/L Glucose. Sterilize and degas by filtration the buffer by passing it through a 0.22 µm Millex filter. Store the buffer at 4°C until use | ||
| N-Acetyl-L-cysteine (NAC) stock solution (5mg/ml; 1000X) | Dissolve N-Acetyl-L-cysteine (Sigma-A8199) at 5 mg/ml in DMEM (e.g. 50 mg NAC in 10 ml B27NBMA). Filter sterilize and aliquot (e.g. 20 µl). Store at -20°C. | ||
| NT3 stock solution (1 µg/ml; 1000X) | Master stock: Order from Peprotech (450-03). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot), in buffer (e.g. DPBS + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1 µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. | ||
| PDGF stock solution (10 µg/ml; 1000X) | Master stock: Order from Peprotech (100-13A). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot) in buffer (e.g. DPBS) + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. | ||
| Poly-D-lysine (1mg/ml; 100X) | Resuspend poly-D-lysine, molecular weight 70-150 kD (Sigma P6407) at 0.5mg/ml in 0.15M boric acid pH 8.4 (e.g. 50mg in 50ml borate buffer). Filter sterilize and aliquot (e.g. 100µl/tube). Store at -20°C. Prior to use, dilute the 100X stock (1mg/ml) to 50 µg/ml in sterile water. | ||
| Oligodendrocyte proliferation media | see Supplementary Table 1 | ||
| Oligodendrocyte differentiation media | see Supplementary Table 1 | ||
| Sato supplement (100X) | see Supplementary Table 1 | ||
| References: the list of reagents and recipes were adopted from the protocols previously described by Emery et. al. 2013 (Emery, B. & Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868, doi:10.1101/pdb.prot073973, (2013)) and Dincman et. al. (Dincman, T. A., Beare, J. E., Ohri, S. S. & Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226, doi:10.1016/j.jneumeth.2012.06.017, (2012)) |
Referencias
- Emery, B. Regulation of oligodendrocyte differentiation and myelination. Science. 330 (6005), 779-782 (2010).
- Yang, Z., Watanabe, M., Nishiyama, A. Optimization of oligodendrocyte progenitor cell culture method for enhanced survival. J Neurosci Methods. 149 (1), 50-56 (2005).
- Niu, J., et al. An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells. J Neurosci Methods. 209 (1), 241-249 (2012).
- Zhang, S. C. Defining glial cells during CNS development. Nat Rev Neurosci. 2 (11), 840-843 (2001).
- Pfeiffer, S. E., Warrington, A. E., Bansal, R. The oligodendrocyte and its many cellular processes. Trends Cell Biol. 3 (6), 191-197 (1993).
- Hart, I. K., Richardson, W. D., Heldin, C. H., Westermark, B., Raff, M. C. PDGF receptors on cells of the oligodendrocyte-type-2 astrocyte (O-2A) cell lineage. Development. 105 (3), 595-603 (1989).
- Nishiyama, A., Lin, X. H., Giese, N., Heldin, C. H., Stallcup, W. B. Interaction between NG2 proteoglycan and PDGF alpha-receptor on O2A progenitor cells is required for optimal response to PDGF. J Neurosci Res. 43 (3), 315-330 (1996).
- Pringle, N. P., Mudhar, H. S., Collarini, E. J., Richardson, W. D. PDGF receptors in the rat CNS: during late neurogenesis, PDGF alpha-receptor expression appears to be restricted to glial cells of the oligodendrocyte lineage. Development. 115 (2), 535-551 (1992).
- Grinspan, J. B., Franceschini, B. Platelet-derived growth factor is a survival factor for PSA-NCAM+ oligodendrocyte pre-progenitor cells. J Neurosci Res. 41 (4), 540-551 (1995).
- Sharifi, K., et al. Differential expression and regulatory roles of FABP5 and FABP7 in oligodendrocyte lineage cells. Cell Tissue Res. 354 (3), 683-695 (2013).
- Chittajallu, R., Aguirre, A., Gallo, V. NG2-positive cells in the mouse white and grey matter display distinct physiological properties. J Physiol. 561 (Pt 1), 109-122 (2004).
- Bansal, R., Warrington, A. E., Gard, A. L., Ranscht, B., Pfeiffer, S. E. Multiple and novel specificities of monoclonal antibodies O1, O4, and R-mAb used in the analysis of oligodendrocyte development. J Neurosci Res. 24 (4), 548-557 (1989).
- Sommer, I., Schachner, M. Monoclonal antibodies (O1 to O4) to oligodendrocyte cell surfaces: an immunocytological study in the central nervous system. Dev Biol. 83 (2), 311-327 (1981).
- Boda, E., et al. The GPR17 receptor in NG2 expressing cells: focus on in vivo cell maturation and participation in acute trauma and chronic damage. Glia. 59 (12), 1958-1973 (2011).
- Dean, J. M., et al. Strain-specific differences in perinatal rodent oligodendrocyte lineage progression and its correlation with human. Dev Neurosci. 33 (3-4), 251-260 (2011).
- Yu, W. P., Collarini, E. J., Pringle, N. P., Richardson, W. D. Embryonic expression of myelin genes: evidence for a focal source of oligodendrocyte precursors in the ventricular zone of the neural tube. Neuron. 12 (6), 1353-1362 (1994).
- Armstrong, R. C., Dorn, H. H., Kufta, C. V., Friedman, E., Dubois-Dalcq, M. E. Pre-oligodendrocytes from adult human CNS. J Neurosci. 12 (4), 1538-1547 (1992).
- Gard, A. L., Pfeiffer, S. E. Oligodendrocyte progenitors isolated directly from developing telencephalon at a specific phenotypic stage: myelinogenic potential in a defined environment. Development. 106 (1), 119-132 (1989).
- Bjelke, B., Seiger, A. Morphological distribution of MBP-like immunoreactivity in the brain during development. Int J Dev Neurosci. 7 (2), 145-164 (1989).
- Hardy, R. J., Friedrich, V. L. Jr Progressive remodeling of the oligodendrocyte process arbor during myelinogenesis. Dev Neurosci. 18 (4), 243-254 (1996).
- Hartman, B. K., Agrawal, H. C., Kalmbach, S., Shearer, W. T. A comparative study of the immunohistochemical localization of basic protein to myelin and oligodendrocytes in rat and chicken brain. J Comp Neurol. 188 (2), 273-290 (1979).
- Wei, Q., Miskimins, W. K., Miskimins, R. Stage-specific expression of myelin basic protein in oligodendrocytes involves Nkx2.2-mediated repression that is relieved by the Sp1 transcription factor. J Biol Chem. 280 (16), 16284-16294 (2005).
- Stolt, C. C., et al. Terminal differentiation of myelin-forming oligodendrocytes depends on the transcription factor Sox10. Genes Dev. 16 (2), 165-170 (2002).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Reynolds, R., Wilkin, G. P. Development of macroglial cells in rat cerebellum. II. An in situ immunohistochemical study of oligodendroglial lineage from precursor to mature myelinating cell. Development. 102 (2), 409-425 (1988).
- Scolding, N. J., et al. Myelin-oligodendrocyte glycoprotein (MOG) is a surface marker of oligodendrocyte maturation. J Neuroimmunol. 22 (3), 169-176 (1989).
- Fewster, M. E., Scheibel, A. B., Mead, J. F. The preparation of isolated glial cells from rat and bovine white matter. Brain Res. 6 (3), 401-408 (1967).
- Gard, A. L., Williams, W. C. 2nd, Burrell, M. R. Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype (O4+GalC-) and response to cytokines using signal transducer LIFR beta. Dev Biol. 167 (2), 596-608 (1995).
- Gard, A. L., Pfeiffer, S. E. Glial cell mitogens bFGF and PDGF differentially regulate development of O4+GalC- oligodendrocyte progenitors. Dev Biol. 159 (2), 618-630 (1993).
- Barres, B. A., Raff, M. C. Proliferation of oligodendrocyte precursor cells depends on electrical activity in axons. Nature. 361 (6409), 258-260 (1993).
- Behar, T., McMorris, F. A., Novotny, E. A., Barker, J. L., Dubois-Dalcq, M. Growth and differentiation properties of O-2A progenitors purified from rat cerebral hemispheres. J Neurosci Res. 21 (2-4), 168-180 (1988).
- Vitry, S., Avellana-Adalid, V., Lachapelle, F., Baron-Van Evercooren, A. Migration and multipotentiality of PSA-NCAM+ neural precursors transplanted in the developing brain. Mol Cell Neurosci. 17 (6), 983-1000 (2001).
- Duncan, I. D., Paino, C., Archer, D. R., Wood, P. M. Functional capacities of transplanted cell-sorted adult oligodendrocytes. Dev Neurosci. 14 (2), 114-122 (1992).
- Goldman, J. E., Geier, S. S., Hirano, M. Differentiation of astrocytes and oligodendrocytes from germinal matrix cells in primary culture. J Neurosci. 6 (1), 52-60 (1986).
- Althaus, H. H., Montz, H., Neuhoff, V., Schwartz, P. Isolation and cultivation of mature oligodendroglial cells. Naturwissenschaften. 71 (6), 309-315 (1984).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Szuchet, S., Yim, S. H. Characterization of a subset of oligodendrocytes separated on the basis of selective adherence properties. J Neurosci Res. 11 (2), 131-144 (1984).
- Chew, L. J., DeBoy, C. A., Senatorov, V. V. Jr Finding degrees of separation: experimental approaches for astroglial and oligodendroglial cell isolation and genetic targeting. J Neurosci Methods. 236, 125-147 (2014).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868 (2013).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226 (2012).
- Buttery, P. C., ffrench-Constant, C. Laminin-2/integrin interactions enhance myelin membrane formation by oligodendrocytes. Mol Cell Neurosci. 14 (3), 199-212 (1999).
- Chun, S. J., Rasband, M. N., Sidman, R. L., Habib, A. A., Vartanian, T. Integrin-linked kinase is required for laminin-2-induced oligodendrocyte cell spreading and CNS myelination. J Cell Biol. 163 (2), 397-408 (2003).
- Colognato, H., Ramachandrappa, S., Olsen, I. M., ffrench-Constant, C. Integrins direct Src family kinases to regulate distinct phases of oligodendrocyte development. J Cell Biol. 167 (2), 365-375 (2004).
- ffrench-Constant, C., Colognato, H. Integrins: versatile integrators of extracellular signals. Trends Cell Biol. 14 (12), 678-686 (2004).
- Oh, L. Y., Yong, V. W. Astrocytes promote process outgrowth by adult human oligodendrocytes in vitro through interaction between bFGF and astrocyte extracellular matrix. Glia. 17 (3), 237-253 (1996).
- Besnard, F., Perraud, F., Sensenbrenner, M., Labourdette, G. Effects of acidic and basic fibroblast growth factors on proliferation and maturation of cultured rat oligodendrocytes. Int J Dev Neurosci. 7 (4), 401-409 (1989).
- Armstrong, R., Friedrich, V. L., Holmes, K. V., Dubois-Dalcq, M. In vitro analysis of the oligodendrocyte lineage in mice during demyelination and remyelination. J Cell Biol. 111 (3), 1183-1195 (1990).
- Grinspan, J. B., Stern, J. L., Franceschini, B., Pleasure, D. Trophic effects of basic fibroblast growth factor (bFGF) on differentiated oligodendroglia: a mechanism for regeneration of the oligodendroglial lineage. J Neurosci Res. 36 (6), 672-680 (1993).
- Mason, J. L., Goldman, J. E. A2B5+ and O4+ Cycling progenitors in the adult forebrain white matter respond differentially to PDGF-AA, FGF-2, and IGF-1. Mol Cell Neurosci. 20 (1), 30-42 (2002).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados