Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Schnelle und spezifische Immunomagnetic Isolierung der Maus primären Oligodendrozyten
In diesem Artikel
Zusammenfassung
Wir beschreiben die Immunomagnetic Isolierung der primäre Maustaste Oligodendrozyten, ermöglicht die schnelle und spezielle Isolierung der Zellen für in-vitro- Kultur.
Zusammenfassung
Die effiziente und robuste Isolierung und Kultur der primären Oligodendrozyten (OLs) ist ein wertvolles Werkzeug für die in-vitro- Studie über die Entwicklung der oligodendrogliazellen sowie die Biologie der demyelinisierenden Erkrankungen wie der multiplen Sklerose und Pelizaeus-Merzbacher-ähnliche Erkrankung (PMLD). Hier präsentieren wir Ihnen eine einfache und effiziente Auswahlmethode für die Immunomagnetic Isolierung der Stufe drei O4+ Preoligodendrocytes Zellen von Neugeborenen Mäusen Welpen. Da unreif OL bilden mehr als 80 % der Nagetier-Gehirn weißen Substanz bei postnatalen 7.Tag (P7) dieser Isolationsmethode sorgt nicht nur für zelluläre Hochzinsanleihen, sondern auch die spezielle Isolierung des OLs bereits verpflichtet, die oligodendroglial Linie, Verringerung der Möglichkeit der Isolierung von kontaminierenden wie Astrozyten und andere Zellen aus dem Gehirn der Maus. Diese Methode ist eine Modifikation der zuvor berichteten Techniken und bietet Oligodendrozyt Vorbereitung Reinheit über 80 % in etwa 4 h.
Einleitung
Oligodendrozyten (OLs) sind die Myelinating Zellen des zentralen Nervensystems (ZNS)1. Die Isolation und die Kultur der primären Oligodendrozyten in einem streng regulierten Umfeld ist ein wertvolles Werkzeug für die in-vitro- Studie über die Entwicklung der oligodendrogliazellen sowie die Biologie der demyelinisierenden Erkrankungen wie der multiplen Sklerose2 . Dies erfordert eine effiziente und robuste Oligodendrozyt Isolation und Kultur Methode3. In dieser Studie nutzten wir den Ausdruck einer unverwechselbaren Oligodendrozyt Zelle Oberfläche Markierung eine modifizierte Isolierung Technik zu implementieren, die schnellen und spezifischen ist.
Vier verschiedene Stadien der Reifung Oligodendrozyt identifiziert worden, jeweils geprägt durch den Ausdruck des unverwechselbaren Zelle oberflächenmarker für jede Entwicklungsstufe (Abbildung 1). Diese Zelle oberflächenmarker durch spezifische Antikörper4,5erkannt werden und können verwendet werden, um die OLs in bestimmten Phasen zu isolieren. In der ersten Stufe haben Oligodendrozyt Vorläuferzellen (OPCs) die Fähigkeit, sich vermehren, migrieren und speziell express Platelet-derived Wachstumsfaktor-Rezeptor (PDGF-Rα)6, Gangliosid A2B5, Proteoglykan NG27,8 , Polysialic Säure-neuronale Zelle Adhäsion Molekül9 und 7 (FABP7)-Fett-Säure-bindendes Protein10. OPCs haben bipolare Morphologie mit wenigen kurzen Prozesse ausgehend von den entgegengesetzten Polen der Zellkörper charakteristisch von neuronalen Vorläufer Zellen11ist.
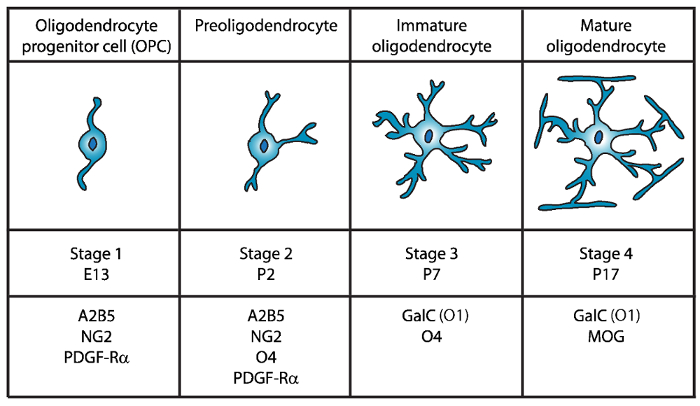
Abbildung 1: Ausdruck der Zelle oberflächenmarker während der Maus Oligodendrozyt Entwicklung. OLs Zelle oberflächenmarker wie z. B. A2B5, GalC (O1) NG2, O4 und PDGF-Rα können verwendet werden, um speziell Oligodendrozyten in bestimmten Entwicklungsstadium isolieren mit spezifischen Antikörpern. Klicken Sie bitte hier, um eine größere Version dieser Figur.
In der zweiten Stufe OPCs geben Anlass zu Preoligodendrocytes und an der Zellmembran express nicht nur OPC Marker, sondern auch die Sulfatide (sulfatierten Galactolipid) von O4 Antikörper12,13, und das GPR17 Protein14anerkannt die weiterhin erst im Stadium der Unreife Oligodendrozyt (OL). Zu diesem Zeitpunkt verlängern Preoligodendrocytes multipolaren kurze Prozesse. Preoligodendrocytes sind die Hauptphase OL postnatale Tag 2 (P2) in der zerebralen weißen Substanz von Ratte und Maus mit einer kleineren Bevölkerung von unreifen OLs15.
Während der dritten Phase weiterhin die unreifen OLs express O4, Ausdruck von A2B5 und NG2 Markern zu verlieren und beginnen Galactocerebroside C16zum Ausdruck bringen. In diesem Stadium OLs oligodendroglial Abstammung verpflichtet und werden nach dem mitotischen Zellen mit langen verzweigten Ästen17,18. Unreife OL bilden mehr als 80 % der Nager weißen Substanz auf P7 und zu diesem Zeitpunkt die ersten Zellen der MBP+ 15,19,20,21eingehalten werden. Daher könnte Isolierung des OLs auf P7 zellulären Hochzinsanleihen sicherstellen.
In der vierten und letzten Ausbaustufe OL express Reife OLs Myelinating Proteine (Myelin basic Protein (MBP), Proteolipid-Protein (PLP), Myelin verbundenen Glykoprotein (MAG) und Myelin Oligodendrozyt Glykoprotein (MOG)22,23 ,24,25,26. In diesem Stadium Reifen OLs Membranen dieser Form kompakt Messgutes Hüllen um die Axone zu erweitern und sind in der Lage zu myelinisieren. Dies deckt sich mit der Beobachtung, dass im Gehirn der Ratte und Maus MBP+ Zellen immer reichlich bei P1419,20,21geworden.
Seit der ersten Isolierung von Oligodendrozyt von Fewster und Kollegen in 196727wurden mehrere Methoden zur Isolierung des OLs von Nagetier CNS einschließlich Immunopanning28,29,30umgesetzt, Fluoreszenz-aktivierte Zellsortierung (FACS) Nutzung Zelle Oberfläche-spezifische Antigene28,31, Differentielle Zentrifugation gradient32,33,34,35 und eine schütteln Methode basiert auf differenzielle Einhaltung von verschiedenen CNS Glia36,37. Bestehende Kultur Verfahren haben jedoch Einschränkungen, insbesondere in Bezug auf Reinheit, Ertrag und Zeitaufwand Verfahren38. Daher sind effizientere Isolationsmethoden für Oligodendrozyten erforderlich.
In diesem Papier stellen wir eine einfache und effiziente Auswahlmethode für die Immunomagnetic Isolierung der Stufe drei O4+ Preoligodendrocytes Zellen von Neugeborenen Mäusen Welpen. Diese Methode ist eine Abwandlung der Techniken von Emery Et Al. berichtet 39 und Dincman Et al. 40 und bietet eine Oligodendrozyt Vorbereitung Reinheit über 80 % in etwa 4 h.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Die Mäuse, die in dieser Studie verwendet wurden nach den Richtlinien der SUNY Downstate Medical Center Division von Labor Tier Ressourcen (DLAR)-Protokoll-Nummer 15-10492 betreut.
Hinweis: Primären Oligodendrozyten wurden isoliert von Neugeborenen (P5-P7 Wildtyp C57Bl/6N) Mäuse. In diesem Stadium bilden unreifen OLs mehr als 80 % der Nager weißen Substanz zellulären ertragreich zu gewährleisten. Alle Puffer und Reagenz Kompositionen stehen am Ende der Tabelle der Materialien.
(1) Deckgläsern Vorbereitung
Hinweis: Poly-D-Lysin (PDL) / Laminin beschichtet Deckgläsern sollten bereit sein, vor dem OL-Isolierung.
- Platz #1 Deutsch Glas Deckgläsern in ein 50 mL konische Röhrchen und 35 mL 70 % EtOH um sie zu reinigen.
- Verschließen Sie das Röhrchen, legen Sie sie in einem Nutating-Mischer und gleichzeitig sanft schaukelnden bei Raumtemperatur für mindestens 30 min inkubieren. Deckgläsern können über Nacht inkubiert.
- 70 % EtOH zu verwerfen.
- Waschen Sie die Deckgläsern 3 Mal mit entionisiertem Wasser, entfernen Sie das Wasser jedes Mal mit Vakuum Aspiration.
- Hinzugeben Sie 30-35 mL PDL 50 µg/mL auf Deckgläsern in der 50 mL Tube genug Deckung der Deckgläsern.
- Legen Sie die 50-mL-Röhrchen mit Deckgläsern auf einem Nutating-Mixer und Inkubation bei Raumtemperatur für mindestens 30 min beim Schaukeln sanft.
- Waschen Sie die Deckgläsern 3 Mal mit entionisiertem Wasser, entfernen das Wasser jedes Mal mit Vakuum Aspiration.
- Übertragen Sie die Deckgläsern in 60 mm Petrischalen mit entionisiertem Wasser.
- Verwenden Sie eine P200 PIPETTENSPITZE um den Deckgläsern als Schicht auf der gesamten Oberfläche der Petrischale anzuordnen.
- Das Wasser vorsichtig von den Gerichten mit Vakuum Aspiration.
- Entfernen Sie das überschüssige Wasser rund um die Deckgläsern und mit geöffnetem Deckel und unter UV-Licht in der Haube über Nacht trocknen lassen.
Hinweis: PDL beschichtet Glasdeckgläser können bis zu drei Monate lang bei 4 ° C in sterile Petrischalen gespeichert werden. - Legen Sie die Deckgläsern in 24-Well-Platten, einer pro Well, mit feinen Pinzette.
- Verschieben Sie die Deckgläsern, in die Mitte der gut, dafür zu sorgen, dass die Kanten die Wand des Brunnens nicht berühren.
- 100 µL 10 µg/mL Laminin verdünnt in B27NBMA hinzufügen (siehe die Tabelle der Materialien) beginnend in der Mitte der einzelnen Deckglas und bewegt sich in eine kreisförmige Art und Weise zu den Rändern hin um den Bereich abzudecken.
Hinweis: Da Laminin OL Wartung beteiligt ist und fördert die Differenzierung in Reife OLs, ist es ein wichtiger OL Überlebensfaktor für in-vitro- Kultur41,42,43,44. - Inkubieren Sie die Platte in einem 37 ° C Inkubator bei 5 % CO2 für mindestens 1 h oder bis zur Beschichtung der OLs bereitstehen.
(2) Maus Gehirn Kortex Dissoziation
- Opfern Sie postnatale 5-7-Tage alten C57Bl/6N Maus Welpen durch schnelle Enthauptung mit der Schere zuvor in 70 % igem Ethanol gereinigt.
Hinweis: Cerebral Cortex von 5-6 Neugeborenen Mäusen Welpen wurden für jede Zubereitung verwendet. Im Durchschnitt ergibt ein Mäusegehirn 1-1.5 x 106 OLs. - Die Kopfhaut entlang der Mittellinie mit kleinen sezierenden Schere geschnitten und einfahren um den Schädel zu entlarven.
- Schneiden Sie den Schädel sorgfältig entlang der Mittellinie die Öffnung auf der Rückseite des Schädels auf den vorderen Bereich, heben Sie mit der Schere zur Vermeidung von Schäden des Gehirns ab. Dann schneiden Sie die Öffnung im hinteren Teil des Schädels mit in Richtung jeder Augenhöhle entlang der Schädelbasis.
- Verwenden Sie feine Pinzette, um sanft zu necken die Rinde vom Mittelhirn und übertragen Sie sie auf eine 60-mm-Gewebe-Kultur-Schale mit 7 mL B27NBMA. Wiederholen Sie die Schritte 2,2 bis 2,4 für jedes Gehirn, Bündelung der seziert Cortex.
- Der Cortex auf eine neue 60-mm-Gewebe-Kultur-Schale mit 5 mL Dissoziation Puffer übertragen (B27NBMA, 20-30 U/mL Papain und 2.500 U DNase ich).
- Würfel der Cortex in kleine Stücke von ca. 1 mm3 mittels einer Skalpellklinge #15 und 20 min in einem 37 ° C, 5 % CO2 Inkubator inkubieren.
- Fügen Sie 1 mL der bovinen Wachstum Serum (BGS), die enzymatische Reaktion zu stoppen.
- Übertragen Sie der Cortex zusammen mit der Dissoziation-Medien auf eine 15 mL konische Rohr mit einer 10 mL serologische pipettieren.
- Vorsichtig beginnen, das Hirngewebe zu trennen, von langsam bis pipettieren und 6-8 Mal mit einer 10 mL serologische pipettieren, mit sorgen um Luftblasen zu minimieren.
- Lassen Sie die Gewebe-Brocken für 2-3 min zu begleichen und den überstand auf eine frische Rohr übertragen.
- Fügen Sie 3 mL B27NBMA mit 10 % BGS/2500 U DNase I, um das Gewebe pellet.
- Verwenden Sie eine serologische 5-mL-Pipette, um sanft das Hirngewebe distanzieren beim pipettieren rauf und runter 6 - 8 Mal. Achten Sie darauf, um Luftblasen zu minimieren.
- Lassen Sie die Gewebe-Stücke für 2-3 min. zu begleichen.
- Übertragen Sie den überstand auf eine frische Rohr. Fügen Sie 3 mL B27NBMA mit 10 % BGS/DNase I, um das Gewebe pellet.
- Sanft distanzieren Sie das Hirngewebe mit einer P1000 pipettieren Spitze, beim pipettieren des Mix aus Medien und Gehirn Sie Gewebe rauf und runter. Wiederholen Sie Schritte 2.13 und 2.14, bis keine großen Stücke des Gewebes bleiben oder B27NBMA mit 10 % BGS/DNase I ist erschöpft, was zuerst eintritt. Achten Sie darauf, um Luftblasen zu minimieren.
- Pool-Zellsuspension mit früheren Überstände.
- Platz 70 µm Zelle Sieb in einen 50-mL-Tube. Mit einer 10 mL serologische pipettieren, übergehen Sie die gepoolten Zellsuspension sanft 70 µm Zelle Sieb.
- Waschen Sie die Zelle Sieb durch Zugabe von 1 mL B27NBMA mit 10 % BGS/DNase ich.
- Entsorgen Sie die Zelle Sieb. 30 mL mit B27NBMA mit 10 % des Volumens bringen BGS/DNase ich.
- Übertragen Sie die Zellsuspension auf zwei 15 mL konische Röhrchen. Zentrifugieren Sie die Zellsuspension für 10 min bei 200 X g.
- Den überstand zu entfernen, ohne die Zellen der Luft ausgesetzt. Der Überstand wird aufgrund zellenrückstand bewölkt sein. Fügen Sie 3 mL B27NBMA mit 10 % BGS zum Pellet.
- Trennen Sie sorgfältig die Zelle Pellet mit einem P1000 pipettieren. Bringen Sie das Volumen 15 ml mit B27NBMA mit 10 % BGS
- Ein frischer 40 µm Zelle Sieb übergehen Sie die Zellsuspension.
- Waschen Sie die Zelle Sieb durch Zugabe von 1mL B27NBMA mit 10 % BGS Entsorgen Sie die Zelle Sieb.
- 30 mL mit B27NBMA mit 10 % des Volumens bringen BGS
- Übertragen Sie die Zellsuspension auf 2 x 15 mL konische Röhrchen. Zentrifugieren Sie die Zellsuspension für 10 min bei 200 X g.
- Entfernen Sie die meisten der Überstand, ohne die Zellen der Luft ausgesetzt. Aufzuwirbeln Sie die Zelle-Pellets in 5 mL Eis kalte magnetische Zelle Sortieren (MCS) Puffer.
3. Bestimmung der Zellzahl und Lebensfähigkeit
- Verdünnen Sie 100 µL Zellsuspension mit 400 µL Trypan blau Lösung in einem 1,5 mL Microcentrifuge Schlauch, eine Verdünnung von 1:5 bei 0,4 % (w/V) zu erreichen.
- Zentrieren Sie ein Deckglas über eine Hemocytometer Kammer und füllen, die die beiden Kammern mit 10 µL der Zelle Verdünnung mit Hilfe einer Pipette P10 und die Vermeidung von Überfüllsicherung. Die Lösung wird unter dem Deckglas durch Kapillarwirkung weitergeben.
- Legen Sie die Hemocytometer auf den Mikroskoptisch und stellen Sie Fokus 40 X Vergrößerung ein.
Hinweis: Zellenzahlen sind mit einem handgeführten Zähler in jedem der fünf Quadrate (vier Ecken und einem Zentrum) aufgenommen. Nur nicht-lebensfähige Zellen absorbieren den Farbstoff und blau, während live angezeigt und gesunde Zellen erscheinen Runde und refraktiven und nicht absorbieren die blau gefärbten Farbstoff, so dass für die Bestimmung der Anzahl der lebensfähigen und total Zellen pro Milliliter.
4. Isolierung von O4+ Oligodendrozyten
- Zentrifugieren Sie die Zellsuspension bei 200 X g für 10 min.
- Sorgfältig entsorgen des Überstands mit Vakuum Aspiration, Vermeidung der Exposition der Zellen in die Luft.
- Aufzuwirbeln Sie das Pellet in 90 µL MCS Puffer pro 1 x 107 total Zellen gefolgt durch die Zugabe von 10 µL Anti-O4 Perlen pro 1 x 107 Zellen.
- Mischen Sie die Zellsuspension und Perlen durch die 15 mL konische Rohr mit dem Finger schnippen sanft 4-5 Mal.
- Inkubieren Sie die Mischung für 15 min bei 4 ° C, schnippte die 15 mL konischen Rohr mit dem Finger 4-5 Timesevery 5 min.
- Waschen Sie die Mischung, indem das Rohr vorsichtig 2 mL MCS Puffer pro 1 x 107 Zellen hinzufügen. Zentrifugieren Sie die Mischung bei 200 X g für 10 min.
- Verwerfen des Überstands vorsichtig mit Vakuum Aspiration, Vermeidung der Exposition der Zellen in die Luft. Aufschwemmen der Zelle Pellet in 500 µL MCS Puffer für jeden 1 x 10-7 -Zellen.
- Legen Sie einen Magnetabscheider auf einem Magnetabscheider Stand. Legen Sie eine Auswahl-Spalte auf den Magnetabscheider und platzieren Sie ein 40 µm Zelle Sieb oben auf die Spalte. Legen Sie zwei 15 mL oder eine 50 mL konische Rohr unterhalb der Trennkolonne die Durchströmung zu sammeln.
- Vorspülen der 40 µm Sieb und Trennung Spalte mit 3 mL MCS Puffer und den Puffer durch die Säule laufen, ohne dass es trocknen zu lassen.
- Fügen Sie die Mischung aus Zellsuspension und Perlen in der Zelle-Sieb und in der Spalte Auswahl.
- Waschen Sie die 40 µm Zelle Sieb mit 1 mL der MCS-Puffer.
- Verwerfen Sie die Zelle Sieb und lassen Sie die Mischung von Zellen, Perlen und Puffer ohne Trocknen durch die Säule laufen.
- Waschen Sie die Trennsäule 3 Mal mit 3 mL MCS Puffer und 1 mal mit OL Verbreitung Medien.
- Entfernen Sie die Trennsäule aus der Magnetabscheider, legen Sie sie schnell in ein 15 mL konische Röhrchen, und sofort 5 mL OL Verbreitung Medien.
- Legen Sie einen Kolben auf der Oberseite der Spalte und fest drücken, um die markierten Zellen in das 15 mL konische Röhrchen auszuspülen.
- Entfernen Sie 100 µL Zellsuspension, Zellzahl und Lebensfähigkeit verwenden Trypan blau und Hemocytometer, wie in Abschnitt 3 zu bestimmen.
Hinweis: Zellviabilität über 80 % gilt als akzeptabel, mit der Kultur des OLs fortzufahren, aber Rentabilität größer als 90 % ist optimal.
5. Beschichtung von isolierten O4+ Oligodendrozyten
- Verdünnen Sie die Zellsuspension auf den Wunsch Beschichtung Dichte (5 x 105 Zellen pro Deckglas) mit OL Verbreitung Medien.
Hinweis: OL Dichte Aussaat ist sehr wichtig, damit entsprechende Zelldichte bestätigt werden sollte, unter Verwendung eines Mikroskops Gewebekultur, bevor Sie fortfahren. Dichte unter 10.000 Zellen/Deckgläsern Aussaat führen zu schlechten Zelle überleben. Dichte bei 10.000 bis 25.000 OL Beschichtung ist morphologischen Differenzierung langsam45. Wir Platte OLs an Aussaatdichte von mindestens 50.000 Zellen/Deckgläsern, Zelle Überleben zu sichern. - Verschieben Sie die 24-Well-Platten mit Deckgläsern mit Laminin aus Inkubator, der Gewebekultur Haube überzogen.
- Jede Deckglas entfernen Sie Laminin und ersetzen Sie es mit 100 µL der OL-Suspension.
- Inkubieren Sie OLs im 37 °C/5% CO2 Inkubator für maximal 45 min OL Adhäsion zu den Deckgläsern zu fördern.
- Entfernen Sie nach der Inkubation die 24-Well-Platten aus dem Inkubator. Jede Flut gut von der 24-Well-Platte mit 500 µL OL Verbreitung Medien.
- Legen Sie die OLs zurück in den 37 °C/5% CO2 Inkubator für weitere 24 h.
- 24 h nach der Beschichtung des OLs, Verbreitung Medien entfernen und ersetzen mit OL Differenzierung Medien, Differenzierung zu induzieren.
- Legen Sie die OLs zurück in den Inkubator und nicht entfernen Sie, bis die Zellen zur Fixierung bereitstehen.
Hinweis: Veränderung des pH-Wertes sind schädlich für OLs und Zellviabilität zu verringern, unnötige Entfernung der OLs-Kulturen aus dem Inkubator sollte daher vermieden werden.
6. Immunfluoreszenz-Färbung
- Für den Nachweis von Zelle oberflächenmarker (NG2, O1 und O4) entfernen Sie das Medium aus dem Brunnen.
- Fügen Sie 250 µL Maus Hybridom Überstände mit primären Antikörper gegen O1 (unverdünnt)13 und O4 (unverdünnt)13 und Kaninchen gegen NG2 polyklonale (1: 150 in B27NBMA verdünnt).
Hinweis: Wenn im Handel erhältlichen Anti-O1 und Anti-O4 Antikörper eingesetzt werden sollen, ist es ratsam Verdünnungen vorgeschlagen vom Hersteller zu nutzen. - Inkubieren Sie die Zellen mit dem Primärantikörper in einem 37 °C/5% CO2 Inkubator maximal 45 min.
- Zweimal mit 0,05 % waschen Sie Tween-20/1 X PBS. Befestigen Sie die Zellen mit 4 % Paraformaldehyd (4 % PFA) für 10 min bei Raumtemperatur.
- Drei Mal für 5 min mit 0,05 % waschen Sie Tween-20/1 X PBS.
- Verdünnen Sie Ziege Alexa 488-konjugierten Anti-Maus IgM oder Anti-Kaninchen IgG Sekundärantikörper (1: 400) in B27NBMA.
- Entfernen Sie die 0,05 % Tween-20/1 X PBS aus den Deckgläsern. Inkubieren Sie die Zellen mit Sekundärantikörper für 1 h bei Raumtemperatur im Dunkeln.
- Drei Mal für 5 min mit 0,05 % waschen Sie Tween-20/1 X PBS.
- Entfernen Sie für doppelte Färbung für die Erkennung von internen Marker (GFAP) die 0,05 % Tween-20/1 X PBS und Block/permeabilize Zellen mit Block/Permeabilisierung Puffer für 15 min bei Raumtemperatur. Fahren Sie andernfalls mit Schritt 6.17.
- Entfernen Sie Block/Permeabilisierung Puffer zu, und fügen Sie 250 µL Huhn Anti-GFAP (1: 100) in Block/Permeabilisierung Puffer verdünnt.
- Inkubieren Sie die Zellen mit Anti-GFAP für 1 h bei Raumtemperatur. Drei Mal für 5 min mit 0,05 % waschen Sie Tween-20/1 X PBS.
- Verdünnen Sie Alexa 594 konjugiert Ziege Anti-Huhn IgG Sekundärantikörper (1: 400) in B27NBMA.
- Entfernen Sie die 0,05 % Tween-20/1 X PBS aus den Deckgläsern. Inkubieren Sie die Zellen mit Sekundärantikörper für 1 h bei Raumtemperatur im Dunkeln.
- Drei Mal für 5 min mit 0,05 % waschen Sie Tween-20/1 X PBS.
- Gegenfärbung mit 4', 6-Diamidino-2-Phenylindole (DAPI) und montieren Sie die Zellen mit Antifade Montage Medium mit DAPI.
- Lassen Sie die Deckgläsern im Dunkeln bei Raumtemperatur über Nacht heilen.
- Bild der gefärbten Zellen mit einem Epifluoreszenz-Mikroskop.
Hinweis: In diesem Protokoll wurden die Zellen bei 40 X Vergrößerung mit einem einheitlichen Belichtungszeit abgebildet.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Der Zweck dieser Studie war es, eine verbesserte Isolationsmethode für O4 etablieren+ primäre Maustaste Oligodendrozyten erfordern die geringst mögliche Manipulation von den Zielzellen. Der gesamte Vorgang von Euthanasie der Welpen auf Beschichtung der Zellen im Deckgläsern dauert ca. 4 Stunden und Darstellung von Daten, die hier gezeigten drei unabhängige Experimenten. Nach Gewebe Dissoziation wurden durchschnittlich 4,3 ± 0,46 x 107 Zellen isoliert für jedes...
Access restricted. Please log in or start a trial to view this content.
Diskussion
In dieser Mitteilung präsentieren wir eine Methode für die effiziente Isolierung hochgereinigte unreifen Maus Oligodendrozyt Kulturen. Im Vergleich zu früher veröffentlichten Protokolle39,40, ergab diese Methode eine höhere Reinheit mit einem viel niedrigeren Niveau der Astroglia-positiven Astrozyten und einen sehr geringen Prozentsatz von anderen Zellen nicht gekennzeichnet. Es ist wichtig, darauf hinzuweisen, dass diese unreifen OLs bereits verpflichtet, d...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Die Autoren haben keine Angaben.
Danksagungen
Diese Studie wurde unterstützt durch Zuschüsse aus dem National Multiple Sclerosis Society (RG4591A1/2) und die National Institutes of Health (R03NS06740402). Die Autoren danken Dr. Ivan Hernandez und seinem Labor-Mitglieder für die Laborfläche, Ausrüstung und Beratung.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| 10ml serological pipets | Fisher Scientific | 13-676-10J | |
| 10ml syringe Luer-Loc tip | BD, Becton Dickinson | 309604 | |
| 15ml conical tubes | Falcon | 352097 | |
| 24-well tissue culture plates | Falcon | 353935 | |
| 40µm cell strainer | Fisher Scientific | 22368547 | |
| 50ml conical tubes | Falcon | 352098 | |
| 5ml serological pipets | Fisher Scientific | 13-676-10H | |
| 60mm tissue culture plates | Falcon | 353002 | |
| 70µm cell strainer | Fisher Scientific | 22363548 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) secondary antibody | Invitrogen | A11001 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A21042 | |
| Alexa Fluor 488 goat anti-rabbit IgM (H+L) secondary antibody | Invitrogen | A11008 | |
| Alexa Fluor 594 goat anti-chicken IgG (H+L) secondary antibody | Invitrogen | A11042 | |
| Anti-O4 beads- Anti-O4MicroBeads | Miltenyi Biotec | 130-094-543 | |
| Apo-Transferrin human | Sigma | T1147 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1101 | |
| Autofil complete bottle top filter assembly, 0.22um filter, 250ml | USA Scientific | 6032-1102 | |
| B27 Supplement | Invitrogen | 17504-044 | |
| Boric acid | Sigma | B7660 | |
| Bovine Growth Serum (BGS) | GE Healthcare Life Sciences | SH30541.03 | |
| BSA | Fisher Scientific | BP-1600-100 | |
| CNTF | Peprotech | 450-50 | |
| d-Biotin | Sigma | B4639 | |
| Desoxyribonuclease I (DNAse I) | Worthington | LS002007 | |
| EDTA | Fisher Scientific | S311 | |
| Epifluorescence microscope with an Olympus DP70 camera | Olympus | Bx51 | |
| Feather disposable scalpels | Andwin Scientific | EF7281C | |
| Forskolin | Sigma | F6886 | |
| German glass coverslips, #1 thickness, 12mm diameter round | NeuVitro | GG-12-oz | |
| GFAP antibody | Aves | GFAP | |
| Glucose | Fisher Scientific | D16-1 | |
| GlutaMAX | Invitrogen | 35050-61 | |
| Insulin | Invitrogen | 12585-014 | |
| Magnetic separator stand - MACS multistand | Miltenyi Biotec | 130-042-303 | |
| Magnetic separator-MiniMACS separator | Miltenyi Biotec | 130-042-302 | |
| Millex PES 0.22µm filter unit | Millipore | SLG033RS | |
| Mounting media- Prolong Gold with DAPI | Thermo Fisher | P36930 | |
| N-acetyl-cysteine (NAC) | Sigma | A8199 | |
| Natural mouse laminin | Invitrogen | 23017-015 | |
| Neurobasal Medium A | Invitrogen | 10888-022 | |
| Neurotrophin-3 (NT-3) | Peprotech | 450-03 | |
| NG2 antibody | Millipore | AB5320 | |
| Papain | Worthington | LS003126 | |
| PBS without Ca2+ and Mg2+ | Sigma | D5652 | |
| PDGF | Peprotech | 100-13A | |
| Petri dishes | Falcon | 351029 | |
| Poly-D-Lysine | Sigma | P6407 | |
| Primocin | Invivogen | ant-pm-2 | |
| Progesterone | Sigma | P8783 | |
| Putrescine | Sigma | P5780 | |
| Selection column-LS columns | Miltenyi Biotec | 130-042-401 | |
| Sodium Selenite | Sigma | S5261 | |
| Trace elements B | Corning | 25-000-CI | |
| Triiodothyronine (T3) | Sigma | T6397 | |
| Triton-X | Sigma | T8787 | |
| Trypan Blue Solution | Corning | 25-900-CI | |
| Tween 20 | Sigma | P1379 | |
| B27NBMA | 487.75 mL Neurobasal Medium A; 10 mL B27 Supplement; 1 mL Primocin; 1.25 mL Glutamax; Filter sterilize and store at 4 °C until use. | ||
| B27NBMA + 10% BGS | 27 mL B27NBMA; 3 mL Bovine growth serum | ||
| CNTF solution stock (10 µg/ml; 1000X) | Order from Peprotech (450-50). Make up at 0.1 to 1 mg/ml according to Manufacturer’s instruction (may vary from lot to lot) in buffer (e.g. DPBS + 0.2% BSA). Store at -80 °C. Working solution (10 µg/ml, 1000X) 1. Make on 0.2% BSA (Fisher scientific BP-1600-100) in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 10µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80 °C. | ||
| d-Biotin stock solution (50 µg/ml; 5000X) | Resuspend d-Biotin (Sigma-B4639) in double-distilled H2O at 50 µg/ml (e.g. 2.5 mg in 50 ml of ddH2O). Resuspension might take fair amount of agitation/vortexing, or mild warming briefly at 37°C. If the d-Biotin still will not solubilize, it is fine to make up a less concentrated (e.g. 10µg/ml), and to add a higher volume to the B27NBMA (1/1000), instead of 1/5000). Store at 4°C. | ||
| DNase I stock solution | 1. Dissolve at 12,500 U Deoxyribonuclease I / ml in HBSS chilled on ice. 2. Filter sterilize on ice 3. Aliquot at 200 µl and freeze overnight at -20°C. 4. Store aliquots at -20 to -30°C. | ||
| Dulbecco’s Phosphate Buffered Saline (w/o Ca2+ and Mg2+) | Dissolve pouch in 1 Liter of water to yield 1 liter of medium at 9.6 grams of powder per liter of medium. Store at 2-8 °C. | ||
| Forskolin stock solution (4.2 mg/ml; 1000X) | Add 1 ml of sterile DMSO to 50 mg Forskolin in bottle (Sigma-F6886) and pipette until resuspended. Transfer to a 15 ml centrifuge tube and add 11 ml of sterile DMSO to bring to 4.2 mg/ml. Aliquot (e.g. 20 µl) and store at -20°C. | ||
| Hank’s balanced salts (HBSS) (Sigma | 1. Measure 900 ml of water (temperature 15-20 °C) in a cylinder and stir gently. 2. Add the power and stir until dissolved. 3. Rinse original package with a small amount of water to remove all traces of the powder. 4. Add to the solution in step 2. 5. Add 0.35 gr of sodium bicarbonate (7.5% w/v) for each liter of final volume. 6. Keep stirring until dissolved. 7. Adjust the pH of the buffer while stirring to 0.1-0.3 units below pH= 7.4 since it may rise during filtration. The use of 1N HCl or 1N NaOH is recommended to adjust the pH. 8. Add additional water to bring the final volume to 1L. 9. Sterilize by filtration using a membrane with a porosity of 0.22 microns. 10. Store at 2-8 °C. | ||
| Insulin stock solution (4000 µg/ml) | Thaw the bottle and aliquot 25 µl per microcentrifuge tube and store at -20°C. | ||
| Laminin solution | Slowly thaw laminin in the cold (2°C to 8°C) to avoid gel formation. Then, aliquot into polypropylene tubes. Store at 5° C to -20° C in aliquots (e.g. 20 µl) and do not freeze/thaw repeatedly. Laminin may be stored at these temperatures for up to six months. | ||
| Magnetic Cell Sorting (MCS) Buffer | Prepare the solution containing phosphate-buffered saline (PBS), pH 7.2, and 0.5% bovine serum albumin (BSA), 0.5 mM EDTA, 5µg/ml Insulin, 1 g/L Glucose. Sterilize and degas by filtration the buffer by passing it through a 0.22 µm Millex filter. Store the buffer at 4°C until use | ||
| N-Acetyl-L-cysteine (NAC) stock solution (5mg/ml; 1000X) | Dissolve N-Acetyl-L-cysteine (Sigma-A8199) at 5 mg/ml in DMEM (e.g. 50 mg NAC in 10 ml B27NBMA). Filter sterilize and aliquot (e.g. 20 µl). Store at -20°C. | ||
| NT3 stock solution (1 µg/ml; 1000X) | Master stock: Order from Peprotech (450-03). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot), in buffer (e.g. DPBS + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1 µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. | ||
| PDGF stock solution (10 µg/ml; 1000X) | Master stock: Order from Peprotech (100-13A). Make up at 0.1 to 1 mg/ml according to manufacturer’s instructions (may vary from lot to lot) in buffer (e.g. DPBS) + 0.2% BSA). Store at -80°C. Working stock (1µg/ml; 1000X): 1. Make on 0.2% BSA in DPBS solution and filter sterilize. 2. Dilute master stock aliquot to 1µg/ml in sterile, chilled 0.2% BSA/DPBS. 3. Aliquot (e.g. 20µl/tube) and snap freeze in liquid nitrogen. 4. Store aliquots at -80°C. | ||
| Poly-D-lysine (1mg/ml; 100X) | Resuspend poly-D-lysine, molecular weight 70-150 kD (Sigma P6407) at 0.5mg/ml in 0.15M boric acid pH 8.4 (e.g. 50mg in 50ml borate buffer). Filter sterilize and aliquot (e.g. 100µl/tube). Store at -20°C. Prior to use, dilute the 100X stock (1mg/ml) to 50 µg/ml in sterile water. | ||
| Oligodendrocyte proliferation media | see Supplementary Table 1 | ||
| Oligodendrocyte differentiation media | see Supplementary Table 1 | ||
| Sato supplement (100X) | see Supplementary Table 1 | ||
| References: the list of reagents and recipes were adopted from the protocols previously described by Emery et. al. 2013 (Emery, B. & Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868, doi:10.1101/pdb.prot073973, (2013)) and Dincman et. al. (Dincman, T. A., Beare, J. E., Ohri, S. S. & Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226, doi:10.1016/j.jneumeth.2012.06.017, (2012)) |
Referenzen
- Emery, B. Regulation of oligodendrocyte differentiation and myelination. Science. 330 (6005), 779-782 (2010).
- Yang, Z., Watanabe, M., Nishiyama, A. Optimization of oligodendrocyte progenitor cell culture method for enhanced survival. J Neurosci Methods. 149 (1), 50-56 (2005).
- Niu, J., et al. An efficient and economical culture approach for the enrichment of purified oligodendrocyte progenitor cells. J Neurosci Methods. 209 (1), 241-249 (2012).
- Zhang, S. C. Defining glial cells during CNS development. Nat Rev Neurosci. 2 (11), 840-843 (2001).
- Pfeiffer, S. E., Warrington, A. E., Bansal, R. The oligodendrocyte and its many cellular processes. Trends Cell Biol. 3 (6), 191-197 (1993).
- Hart, I. K., Richardson, W. D., Heldin, C. H., Westermark, B., Raff, M. C. PDGF receptors on cells of the oligodendrocyte-type-2 astrocyte (O-2A) cell lineage. Development. 105 (3), 595-603 (1989).
- Nishiyama, A., Lin, X. H., Giese, N., Heldin, C. H., Stallcup, W. B. Interaction between NG2 proteoglycan and PDGF alpha-receptor on O2A progenitor cells is required for optimal response to PDGF. J Neurosci Res. 43 (3), 315-330 (1996).
- Pringle, N. P., Mudhar, H. S., Collarini, E. J., Richardson, W. D. PDGF receptors in the rat CNS: during late neurogenesis, PDGF alpha-receptor expression appears to be restricted to glial cells of the oligodendrocyte lineage. Development. 115 (2), 535-551 (1992).
- Grinspan, J. B., Franceschini, B. Platelet-derived growth factor is a survival factor for PSA-NCAM+ oligodendrocyte pre-progenitor cells. J Neurosci Res. 41 (4), 540-551 (1995).
- Sharifi, K., et al. Differential expression and regulatory roles of FABP5 and FABP7 in oligodendrocyte lineage cells. Cell Tissue Res. 354 (3), 683-695 (2013).
- Chittajallu, R., Aguirre, A., Gallo, V. NG2-positive cells in the mouse white and grey matter display distinct physiological properties. J Physiol. 561 (Pt 1), 109-122 (2004).
- Bansal, R., Warrington, A. E., Gard, A. L., Ranscht, B., Pfeiffer, S. E. Multiple and novel specificities of monoclonal antibodies O1, O4, and R-mAb used in the analysis of oligodendrocyte development. J Neurosci Res. 24 (4), 548-557 (1989).
- Sommer, I., Schachner, M. Monoclonal antibodies (O1 to O4) to oligodendrocyte cell surfaces: an immunocytological study in the central nervous system. Dev Biol. 83 (2), 311-327 (1981).
- Boda, E., et al. The GPR17 receptor in NG2 expressing cells: focus on in vivo cell maturation and participation in acute trauma and chronic damage. Glia. 59 (12), 1958-1973 (2011).
- Dean, J. M., et al. Strain-specific differences in perinatal rodent oligodendrocyte lineage progression and its correlation with human. Dev Neurosci. 33 (3-4), 251-260 (2011).
- Yu, W. P., Collarini, E. J., Pringle, N. P., Richardson, W. D. Embryonic expression of myelin genes: evidence for a focal source of oligodendrocyte precursors in the ventricular zone of the neural tube. Neuron. 12 (6), 1353-1362 (1994).
- Armstrong, R. C., Dorn, H. H., Kufta, C. V., Friedman, E., Dubois-Dalcq, M. E. Pre-oligodendrocytes from adult human CNS. J Neurosci. 12 (4), 1538-1547 (1992).
- Gard, A. L., Pfeiffer, S. E. Oligodendrocyte progenitors isolated directly from developing telencephalon at a specific phenotypic stage: myelinogenic potential in a defined environment. Development. 106 (1), 119-132 (1989).
- Bjelke, B., Seiger, A. Morphological distribution of MBP-like immunoreactivity in the brain during development. Int J Dev Neurosci. 7 (2), 145-164 (1989).
- Hardy, R. J., Friedrich, V. L. Jr Progressive remodeling of the oligodendrocyte process arbor during myelinogenesis. Dev Neurosci. 18 (4), 243-254 (1996).
- Hartman, B. K., Agrawal, H. C., Kalmbach, S., Shearer, W. T. A comparative study of the immunohistochemical localization of basic protein to myelin and oligodendrocytes in rat and chicken brain. J Comp Neurol. 188 (2), 273-290 (1979).
- Wei, Q., Miskimins, W. K., Miskimins, R. Stage-specific expression of myelin basic protein in oligodendrocytes involves Nkx2.2-mediated repression that is relieved by the Sp1 transcription factor. J Biol Chem. 280 (16), 16284-16294 (2005).
- Stolt, C. C., et al. Terminal differentiation of myelin-forming oligodendrocytes depends on the transcription factor Sox10. Genes Dev. 16 (2), 165-170 (2002).
- Emery, B., et al. Myelin gene regulatory factor is a critical transcriptional regulator required for CNS myelination. Cell. 138 (1), 172-185 (2009).
- Reynolds, R., Wilkin, G. P. Development of macroglial cells in rat cerebellum. II. An in situ immunohistochemical study of oligodendroglial lineage from precursor to mature myelinating cell. Development. 102 (2), 409-425 (1988).
- Scolding, N. J., et al. Myelin-oligodendrocyte glycoprotein (MOG) is a surface marker of oligodendrocyte maturation. J Neuroimmunol. 22 (3), 169-176 (1989).
- Fewster, M. E., Scheibel, A. B., Mead, J. F. The preparation of isolated glial cells from rat and bovine white matter. Brain Res. 6 (3), 401-408 (1967).
- Gard, A. L., Williams, W. C. 2nd, Burrell, M. R. Oligodendroblasts distinguished from O-2A glial progenitors by surface phenotype (O4+GalC-) and response to cytokines using signal transducer LIFR beta. Dev Biol. 167 (2), 596-608 (1995).
- Gard, A. L., Pfeiffer, S. E. Glial cell mitogens bFGF and PDGF differentially regulate development of O4+GalC- oligodendrocyte progenitors. Dev Biol. 159 (2), 618-630 (1993).
- Barres, B. A., Raff, M. C. Proliferation of oligodendrocyte precursor cells depends on electrical activity in axons. Nature. 361 (6409), 258-260 (1993).
- Behar, T., McMorris, F. A., Novotny, E. A., Barker, J. L., Dubois-Dalcq, M. Growth and differentiation properties of O-2A progenitors purified from rat cerebral hemispheres. J Neurosci Res. 21 (2-4), 168-180 (1988).
- Vitry, S., Avellana-Adalid, V., Lachapelle, F., Baron-Van Evercooren, A. Migration and multipotentiality of PSA-NCAM+ neural precursors transplanted in the developing brain. Mol Cell Neurosci. 17 (6), 983-1000 (2001).
- Duncan, I. D., Paino, C., Archer, D. R., Wood, P. M. Functional capacities of transplanted cell-sorted adult oligodendrocytes. Dev Neurosci. 14 (2), 114-122 (1992).
- Goldman, J. E., Geier, S. S., Hirano, M. Differentiation of astrocytes and oligodendrocytes from germinal matrix cells in primary culture. J Neurosci. 6 (1), 52-60 (1986).
- Althaus, H. H., Montz, H., Neuhoff, V., Schwartz, P. Isolation and cultivation of mature oligodendroglial cells. Naturwissenschaften. 71 (6), 309-315 (1984).
- McCarthy, K. D., de Vellis, J. Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue. J Cell Biol. 85 (3), 890-902 (1980).
- Szuchet, S., Yim, S. H. Characterization of a subset of oligodendrocytes separated on the basis of selective adherence properties. J Neurosci Res. 11 (2), 131-144 (1984).
- Chew, L. J., DeBoy, C. A., Senatorov, V. V. Jr Finding degrees of separation: experimental approaches for astroglial and oligodendroglial cell isolation and genetic targeting. J Neurosci Methods. 236, 125-147 (2014).
- Emery, B., Dugas, J. C. Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. Cold Spring Harb Protoc. 2013 (9), 854-868 (2013).
- Dincman, T. A., Beare, J. E., Ohri, S. S., Whittemore, S. R. Isolation of cortical mouse oligodendrocyte precursor cells. J Neurosci Methods. 209 (1), 219-226 (2012).
- Buttery, P. C., ffrench-Constant, C. Laminin-2/integrin interactions enhance myelin membrane formation by oligodendrocytes. Mol Cell Neurosci. 14 (3), 199-212 (1999).
- Chun, S. J., Rasband, M. N., Sidman, R. L., Habib, A. A., Vartanian, T. Integrin-linked kinase is required for laminin-2-induced oligodendrocyte cell spreading and CNS myelination. J Cell Biol. 163 (2), 397-408 (2003).
- Colognato, H., Ramachandrappa, S., Olsen, I. M., ffrench-Constant, C. Integrins direct Src family kinases to regulate distinct phases of oligodendrocyte development. J Cell Biol. 167 (2), 365-375 (2004).
- ffrench-Constant, C., Colognato, H. Integrins: versatile integrators of extracellular signals. Trends Cell Biol. 14 (12), 678-686 (2004).
- Oh, L. Y., Yong, V. W. Astrocytes promote process outgrowth by adult human oligodendrocytes in vitro through interaction between bFGF and astrocyte extracellular matrix. Glia. 17 (3), 237-253 (1996).
- Besnard, F., Perraud, F., Sensenbrenner, M., Labourdette, G. Effects of acidic and basic fibroblast growth factors on proliferation and maturation of cultured rat oligodendrocytes. Int J Dev Neurosci. 7 (4), 401-409 (1989).
- Armstrong, R., Friedrich, V. L., Holmes, K. V., Dubois-Dalcq, M. In vitro analysis of the oligodendrocyte lineage in mice during demyelination and remyelination. J Cell Biol. 111 (3), 1183-1195 (1990).
- Grinspan, J. B., Stern, J. L., Franceschini, B., Pleasure, D. Trophic effects of basic fibroblast growth factor (bFGF) on differentiated oligodendroglia: a mechanism for regeneration of the oligodendroglial lineage. J Neurosci Res. 36 (6), 672-680 (1993).
- Mason, J. L., Goldman, J. E. A2B5+ and O4+ Cycling progenitors in the adult forebrain white matter respond differentially to PDGF-AA, FGF-2, and IGF-1. Mol Cell Neurosci. 20 (1), 30-42 (2002).
- Schildge, S., Bohrer, C., Beck, K., Schachtrup, C. Isolation and culture of mouse cortical astrocytes. J Vis Exp. (71), (2013).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten