Method Article
Protocolo experimental para examinar los perfiles de respuesta conductual en peces larvales: aplicación a la Neuro-estimulantes cafeína
En este artículo
Resumen
Aquí, presentamos un protocolo para examinar larvales pez cebra y fathead minnow locomotoras actividades y respuestas fotomotor (PMR) utilizando un software de rastreo automatizado. Incorporando en común pruebas biológicas de toxicología, análisis de estos comportamientos ofrecen una herramienta de diagnóstico para examinar productos químico bioactividad. Este protocolo se describe usando cafeína, un neuroestimulante modelo.
Resumen
Peces modelos y comportamientos cada vez más se utilizan en las ciencias biomédicas; sin embargo, peces han sido objeto de estudios ecológicos, fisiológicos y toxicológicos. Uso automatizado de plataformas de rastreo digital, los esfuerzos recientes en Neurofarmacología extrapolando comportamientos locomotor peces larvales para identificar dianas terapéuticas potenciales para nuevas moléculas pequeñas. Similar a estos esfuerzos de investigación en las ciencias ambientales y Farmacología comparada y toxicología está examinando diversos comportamientos de modelos de peces como herramientas de diagnóstico en la evaluación de niveles de contaminantes y el monitoreo en tiempo real de las aguas superficiales para amenazas contaminantes. Mientras que el pez cebra es un modelo popular peces larvales en las ciencias biomédicas, la mojarra de carpita es un modelo común de larvas de peces en ecotoxicología. Por desgracia, larvas de fathead minnow han recibido considerablemente menos atención en estudios de comportamiento. Aquí, se desarrollan y demuestran un protocolo perfil conductual utilizando cafeína como un neuroestimulante modelo. Aunque fotomotor respuestas de piscardos fathead de vez en cuando fueron afectadas por la cafeína, pez cebra eran notablemente más sensible para fotomotor y terminales de aparato locomotoras, que respondió a niveles ambientalmente relevantes. Futuros estudios son necesarios para entender las diferencias de sensibilidad comportamiento comparativo entre peces con edad y hora del día y para determinar si los efectos conductuales similares ocurren en la naturaleza y ser indicativos de los resultados adversos en el individuo o niveles de población de organización biológica.
Introducción
Aunque se utilizan cada vez más modelos de peces para estudios biomédicos, peces han sido rutinariamente utilizados para estudios de Ecología y fisiología, para examinar la contaminación de las aguas superficiales y a entender los umbrales toxicológicos de sustancias químicas. Estos esfuerzos son importantes porque la contaminación química puede afectar a los ecosistemas acuáticos y poner en peligro la calidad de los suministros de agua de fuente1,2. La mayoría de los productos químicos en el comercio, sin embargo, falta aún información de Toxicología básica3.
Ensayos de modelo animal tradicionalmente utilizados en ensayos de toxicidad reguladora son recursos y no puede ofrecer el alto rendimiento, proyección de nivel principios necesario para la toxicidad en el siglo XXI4. Posteriormente, hay un creciente impulso para adoptar y utilizar modelos en vitro que pueden más rápidamente y eficientemente compuestos de actividad biológica3,5. Aunque modelos celulares de base presentan muchas oportunidades, a menudo carecen de complejidad biológica y por lo tanto no tienen en cuenta para muchos procesos importantes de todo organismo, incluyendo metabolismo6.
El pez cebra es un modelo biomédico común que está ganando popularidad como un modelo alternativo en toxicología acuática y Ecotoxicología7,8. Dado su pequeño tamaño, rápida evolución y alta fecundidad, peces modelos se pueden utilizar productos químicos para la bioactividad y toxicidad en el organismo entero escala9a rápidamente y eficientemente. Con la ayuda de software de seguimiento automático, larvas de pez cebra comportamientos proporcionan mayor utilidad de diagnóstico de detección de contaminantes para toxicidad10,11. Estudios en ciencias farmacéuticas han demostrado que extremos locomotoras son informativos de mecanismos químicos de acción, se pueden utilizar para comportamientos de fenotipo y tentativamente pueden identificar objetivos subcelulares para moléculas novela12, 13. Mientras que el pez cebra es un modelo popular peces larvales en las ciencias biomédicas, la mojarra de carpita es un modelo de pez común, importancia ecológica que se utiliza para estudios de Ecotoxicología y durante potenciales (por ejemplo, evaluaciones de nuevos químicos) y evaluaciones ambientales de retrospectiva (monitoreo de descarga de efluentes de aguas residuales o agua superficialpor ejemplo, a temperatura ambiente). Desafortunadamente, las respuestas del comportamiento de pececillos larvas de carpita han recibido considerablemente menos atención que el pez cebra. Nuestra investigación en curso con dos modelos comunes de larvas de peces, el pez cebra y fathead minnow, sugiere que larvas peces nadando patrones aparecen únicos esperados modos o mecanismos de acción de productos químicos diversos. Así, extremos conductuales proporcionan el potencial para rápido y sensible examinar productos químicos de toxicidad y para identificar objetivos subcelulares de industriales químicos y otros contaminantes, particularmente durante las primeras evaluaciones de nivel.
Aquí, Divulgamos un protocolo para examinar los perfiles de respuesta conductual en peces larvales. Demuestran estos métodos usando cafeína, un neuroestimulante modelo y un contaminante acuático común que se introduce a los sistemas acuáticos a través de descarga de plantas de tratamientos de aguas residuales tras el consumo de alimentos, bebidas, y productos farmacéuticos formulados con cafeína14. Examinamos las respuestas del comportamiento a la cafeína en ambos larvales pez cebra y fathead minnow, incluyendo a un cambio repentino en la condición de iluminación, que se refiere a menudo como una respuesta de fotomotor (PMR) en los estudios farmacéuticos con embrionario y larval pez cebra13,15. Nosotros identificar efectos de la cafeína en varios terminales de locomotoras para desarrollar perfiles de respuesta química para cada modelo de peces. Niveles de tratamiento de cafeína utilizados en este estudio representan los centiles superiores de distribuciones de exposición basadas en valores ambientales medidos de cafeína16. También incluimos tratamientos probados para larvas de peces LC50 valores y el valor del riesgo terapéutico (THV), una farmacéutica concentración en el agua que se prevé como resultado niveles de plasma en pescado consistente con una dosis de plasma terapéutico humano.
Protocolo
Estudios en el presente Protocolo general siga diseño experimental estandarizado y directrices para el análisis estadístico se recomienda desde el nosotros Agencia de protección ambiental (EPA Nº 2000.0) para minnows carpita y la organización para la cooperación económica y Desarrollo (OCDE no. 236) de pez cebra. Estos diseños experimentales (p. ej., aumento de la replicación) pueden ser modificados dentro del protocolo actual para futuros estudios. Cultivo de peces en condiciones de seguir previamente publicado literatura17. Todos protocolos de cultivo experimentales procedimientos y pescado seguido protocolos de cuidado de Animal institucional y Comité de uso aprobados en la Universidad de Baylor.
1. exponer los peces a tratamiento químico
- Preparar la cafeína soluciones de exposición mediante la disolución de cafeína en el agua dura reconstituida. Realizar diluciones seriadas adecuadas diluyendo más tratamientos de cafeína con agua dura para producir bajos niveles de tratamiento de la cafeína.
Nota: La tabla 1 resume cada uno de los niveles de tratamiento utilizados en este experimento.
| Pez cebra | Fathead Minnow | ||||
| Tratamiento | Concentración nominal de cafeína (mg/L) | Concentración de cafeína medido (mg/L) | Tratamiento | Concentración nominal de cafeína (mg/L) | Concentración de cafeína medido (mg/L) |
| Control | 0 | < LOD | Control | 0 | < LOD |
| Percentil 75 * | 0.001 | 0.001 | Percentil 75 * | 0.001 | 0.001 |
| Percentil 95 * | 0.039 | 0.013 | Percentil 95 * | 0.039 | 0.009 |
| Percentil 99 * | 0.412 | 0.361 | Percentil 99 * | 0.412 | 0.310 |
| THV | 4.07 | 3.81 | THV | 4.07 | 4.12 |
| 10% LC50 | 48.46 | 46.66 | 10% LC50 | 14.1 | 14.7 |
| CL50 40% | 193.82 | 186.67 | CL50 40% | 56.38 | 53.91 |
Tabla 1: tratamientos de cafeína experimentales para experimentos de pez cebra y fathead minnow. Se dan los valores nominales y medidos de cafeína para cada tratamiento. * Los tratamientos de cafeína utilizados en este estudio representan los centiles superiores de distribuciones de exposición basadas en valores ambientales medidos de cafeína16. LVH: Valor de riesgo terapéutico. LOD: Límite de detección
- Vierta la solución preparada en champers exposición individual. Use vasos de vidrio de 100 mL con 20 mL de solución de exposición para salas de exposición del pez cebra y vasos de precipitado de 500 mL con 200 mL de solución de exposición para cámaras de exposición fathead minnow.
- Usando una pipeta, coloque 10 pez cebra embriones de 4 – 6 h post fertilización (hpf) en cada una de las cuatro cámaras de exposición réplicas por tratamiento.
- Larvas de lugar 10 fathead minnow de años dentro de las 24 h de incubación en cada una de tres cámaras de exposición réplicas por tratamiento. Para acomodar el tamaño de larvas de fathead minnow, corte la punta de la pipeta antes de la transferencia.
- Mantener el pez cebra experimentos en un fotoperiodo de 16:8 h luz: oscuridad y una temperatura constante de 28 ± 1 ° C. Usar el mismo régimen de fotoperíodo para estudios de fathead minnow, pero a una temperatura de 25 ± 1 ° C.
-
Después de 96 h de exposición química, carga cada pez en pocillos distintos de 48 (de pez cebra) y 24 (para minnow fathead) bien las placas.
- Para asegurar que cada una contiene también un volumen igual de solución, transferir las larvas de pez cebra a 48 placas de pozos utilizando una autopipette de 5.000 μl de un volumen de 1.000 μl por pocillo. Utilice el autopipette para retirar y transferir las larvas de pez cebra y exposición solución simultáneamente.
- Debido a su mayor tamaño, transferencia de larvas de carpa fathead usando una pipeta con la punta cortada. Antes de la transferencia de larvas de fathead minnow a pocillos individuales, llene cada uno bien a 2.000 μl utilizando un autopipette. Al transferir las larvas de carpita individuales a pozos, coloque la punta de la pipeta en la solución bien y deje que los peces a nadar desde la punta de la pipeta en el pozo.
2. calibración de parámetros de seguimiento de Video
-
Antes de las medidas conductuales, definir los parámetros de observación y la calibración en el software de la pista de vídeo (véase tabla de materiales).
- Colocar una placa bien en la cámara de grabación con al menos 1 peces larvas en un bien individual. Utilice la placa y peces asociados como representaciones para establecer parámetros de calibración.
- En el pista de vídeo de software, haga clic en "archivo | Generar el protocolo", que abrirá un cuadro de diálogo"Asistente para creación de protocolo". En el campo "cuenta de la localización", introduzca el número de individuos de pozos de la placa de la pozo y haga clic en "Aceptar".
- En la parte superior de la pantalla, haga clic en "vista | Pantalla completa", que emitirá el sistema para mostrar una vista de cámara arriba de la placa de la pozo.
- Haga clic en el icono de "áreas de dibujar", que aparece como tres formas multicolores. A la derecha de la placa bien área de visualización, seleccione el icono de círculo en el campo etiquetado como "Áreas".
- Usa los cursores para delinear el video circular seguimiento área en la parte superior izquierda el pozo de la placa de la pozo. Selecciona "Marca de la parte superior derecha" y luego delinear el área de visualización de la parte superior derecha bien. A continuación, seleccione "Fondo marca" para delinear la parte inferior derecha bien.
Nota: Después de dibujar el contorno circular, su posición probablemente tendrá que ajustarse. Para ajustar la posición del esquema, haga clic en "seleccionar" y luego utiliza los cursores para mover el área contorneado. También, se pueden replicar esquemas haciendo clic en "copiar" y luego "pegar". - Después de la parte superior izquierda, superior derecha, inferior derecha bien seguimiento de áreas se han definido, haga clic en "Build" para pedir el software automáticamente delinear las áreas de visión de los pozos restantes.
- En el área marcado "Calibración", haga clic en "Dibujar la escala". Utilice el cursor para dibujar una línea horizontal a través de la placa. Una vez que se dibuja la línea, aparecerá un cuadro de diálogo etiquetado como "Medida de calibración". Introduzca la longitud de la placa bien y haga clic en "Aceptar".
- Salga del administrador de dibujo haciendo clic en el icono de "áreas de dibujar".
- Haga clic en el icono de "Azulejos". Usando los cursores, poner de relieve todas las casillas que aparecen en la pantalla de visualización de modo que cada caja es de color verde.
Nota: El icono de azulejos aparece como un grupo de seis cuadrados pequeños individuales - "Haga clic en ver | Pantalla completa". A la derecha de la placa de área de visualización, haga clic en "Bkg" en la casilla de "Umbral de detección". Utilice la barra de ajuste de umbral para establecer el umbral de detección de pixel. Una vez, el umbral de detección del pixel correspondiente está seleccionado, haga clic en "Aplicar al grupo".
Nota: Este protocolo define el umbral de detección en 13 en modo negro para observaciones de pez cebra y a 110 de modo transparente para las observaciones de fathead minnow. - En la casilla de "Umbral de movimiento", introduzca la velocidad de movimiento deseada parámetros de seguimiento. Una vez que se establecen parámetros de velocidad, haga clic en "Aplicar a grupo".
Nota: Este protocolo fija pequeños y grandes movimientos en 20 mm/s e inactivos pequeños movimientos a 5 mm/s. Estas selecciones programa el software para rastrear el movimiento de larvas de peces en tres velocidades diferentes: inactivo (congelación) = < 5 mm/s, pequeño (crucero) = 5-20 mm/s y grandes (de explosión) = > 20 mm/s. - Haga clic en "parámetros | Protocolo de parámetros"en el menú desplegable. En el cuadro de diálogo, seleccione la ficha "Tiempo" Enter el tiempo de observación y el tiempo de integración. Después de entraron los parámetros, haga clic en "Ok".
- Para establecer los tiempos de fotoperiodo de luz/oscuridad y la intensidad de la luz para cada fotoperiodo abierta que la configuración del controlador luz diálogo cuadro seleccionando "Conducción de la luz" de los "parámetros" menú desplegable.
Nota: Ver video de protocolo para el establecimiento de varios fotoperíodos de claro-oscuro. - Después de establecer los parámetros de seguimiento video, salvar el protocolo de observación.
Nota: Este protocolo observa comportamiento de peces durante un período de 50 minutos que incluye una fase de aclimatación de 10 min seguida de 4 alterar las fases de luz/oscuridad que consta de dos períodos de luz de 10 minutos y dos períodos oscuros de 10 minutos. El tiempo de integración se establece para medir el comportamiento de cada minuto de la prueba de comportamiento de 50 min.
3. observación de larvas peces Aparato Locomotor y el comportamiento de fotomotor
- Coloque la placa bien que contienen pescados experimentales en la cámara de grabación de comportamiento.
- En el video que sigue el software, abra el protocolo de seguimiento desarrollado en el paso 3.
- En el visor de seguimiento de vídeo, compruebe para asegurarse de que todas las larvas son visibles en la pantalla del ordenador, que sólo una larva individual está presente en cada pozo, y que los pozos estén alineadas dentro de las áreas de observación que se definieron en los pasos 2.1.5 y 2.1.6.
- Haga clic en "experimento | Ejecutar".
Nota: El sistema solicitará al usuario que proporcione un nombre y una ubicación para guardar los datos de observación. - Una vez el nombre y ubicación de la observación de almacenamiento han sido especificados los datos, haga clic en el icono de "Imágenes de vivir varias" para resaltar todas las áreas de visualización predefinidos
Nota: Este icono se encuentra en la parte superior de la pantalla del ordenador y aparece como un cuadro dividido en cuatro cuadrados más pequeños. Haciendo clic en este icono hará hincapié en todas las áreas de visualización predefinidos. - Cierre el panel de la cámara de grabación y haga clic en "fondo | Empezar"en la pantalla del ordenador.
4. Análisis de datos conductuales
- Para recuperar datos de la actividad de larvas de peces, abra la hoja de cálculo, que se compila automáticamente por el software de seguimiento y se encuentra en la carpeta especificada por el usuario antes de iniciar los ensayos conductuales (paso 3.4).
- Se refieren a figuras 1A y 1B para mediciones representativas de actividad locomotora ingenua de pez cebra no expuesta y fathead minnow larvas, respectivamente. Consulte la figuras 1C y 1D para cálculos de PMR, que examinan con eficacia la magnitud de la diferencia de movimiento entre las transiciones de luz a oscuras o de oscuro a claro.
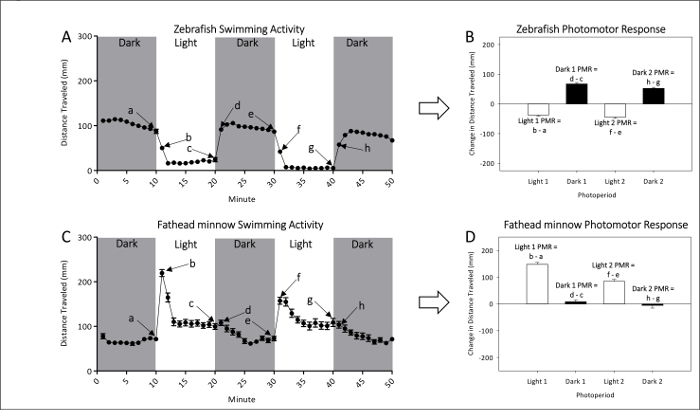
Figura 1: Ejemplo de actividad de la base de pez cebra no expuesta (A y B) y el piscardo fathead (C y D). Nadó la distancia media (± SEM) de pez cebra (A) y minnow fathead (C) está dada por puntos cada que representan intervalos de un minuto de actividad. Se miden dos oscuras y dos períodos luz fotomotor respuestas. La última (a, c, e y g) y (b, d, f y h) minutos de cada fotoperiodo se utilizan para calcular las respuestas de PMRs. Photomotor del pez cebra (B) y minnow fathead (D) se mide como el cambio en la media (±SEM) distancia recorrida entre el último minuto de un fotoperíodo inicial y el primer minuto del período siguiente. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Niveles de cafeína en tratamiento no variaron apreciablemente durante los experimentos de 96 h con el pez cebra y fathead minnows. Por ejemplo, la tabla 1 presenta concentraciones analíticamente verificadas de cada nivel de tratamiento. Este protocolo verificado muestras de agua para niveles de cafeína en tratamiento por dilución isotópica cromatografía líquida espectrometría total en tándem (LC-MS/MS) generalmente siguiente previamente divulgados métodos28. La formación de paraxanthine, el metabolito primario de la cafeína, también se cuantificó. En la información analítica complementaria se ofrece una descripción de los procedimientos analíticos. Debido a las similitudes entre verificación nominal y análisis de tratamientos, niveles de tratamiento nominal se presentan en el resto de este manuscrito. Cafeína había alterado comportamientos de pez cebra y fathead minnow. Sin embargo, pez cebra locomotor respuestas fueron consistentemente más sensibles a la cafeína que minnows fathead. Los extremos de comportamiento más sensibles para larvas de pez cebra y fathead minnow fueron afectados por la cafeína en una concentración de 0,039 mg/L. tabla 2 resume la concentración mínima con efecto observado (LOECs) y las concentraciones de no efecto observado (NOEC) para cada comportamiento extremo en ambos modelos de peces.
| Pez cebra | Minnow de Fathead | ||||
| Punto final | LOEC (mg/L) | NOEC (mg/L) | Punto final | LOEC (mg/L) | NOEC (mg/L) |
| Distancia total oscuridad | 0.412 | 0.039 | Distancia total oscuridad | − | 56.38 |
| Distancia total luz | 48.46 | 4.07 | Distancia total luz | − | 56.38 |
| Total cuenta oscuro | 0.412 | 0.039 | Total cuenta oscuro | − | 56.38 |
| Total cuenta luz | 48.46 | 4.07 | Total cuenta luz | − | 56.38 |
| Ruptura de distancia de oscuro | − | 193.82 | Ruptura de distancia de oscuro | − | 56.38 |
| Estallido de luz de distancia | 193.82 | 48.46 | Estallido de luz de distancia | − | 56.38 |
| Explosión cuenta oscurezca | 193.82 | 48.46 | Explosión cuenta oscurezca | − | 56.38 |
| Estallido de luz de cuentas | 193.82 | 48.46 | Estallido de luz de cuentas | − | 56.38 |
| Llena de oscuridad de duración | 193.82 | 48.46 | Llena de oscuridad de duración | − | 56.38 |
| Estallido de luz duración | − | 193.82 | Estallido de luz duración | − | 56.38 |
| Crucero de distancia de oscuro | 0.412 | 0.039 | Crucero de distancia de oscuro | − | 56.38 |
| Crucero de distancia de luz | 48.46 | 4.07 | Crucero de distancia de luz | − | 56.38 |
| Crucero cuenta oscuro | 0.412 | 0.039 | Crucero cuenta oscuro | − | 56.38 |
| Crucero de las cuentas luz | 48.46 | 4.07 | Crucero de las cuentas luz | − | 56.38 |
| Crucero duración oscuro | 0.412 | 0.039 | Crucero duración oscuro | − | 56.38 |
| Crucero de duración de luz | 48.46 | 4.07 | Crucero de duración de luz | − | 56.38 |
| Distancia de congelación oscuro | 0.412 | 0.039 | Distancia de congelación oscuro | 0.039 | 0.001 |
| Congelación de distancia de luz | 0.039 | 0.001 | Congelación de distancia de luz | − | 56.38 |
| Congelar cuenta oscuro | 0.412 | 0.039 | Congelar cuenta oscuro | − | 56.38 |
| Congelación de las cuentas luz | 48.46 | 4.07 | Congelación de las cuentas luz | − | 56.38 |
| Duración de la congelación oscuro | − | 193.82 | Duración de la congelación oscuro | 56.38 | 14.10 |
| Duración de la congelación ligera | 48.46 | 4.07 | Duración de la congelación ligera | − | 56.38 |
| Oscura 1 PMR | 48.46 | 4.07 | Oscura 1 PMR | 0.039 | 0.001 |
| Luz 1 PMR | 48.46 | 4.07 | Luz 1 PMR | − | 56.38 |
| Oscuro 2 PMR | 48.46 | 4.07 | Oscuro 2 PMR | − | 56.38 |
| Luz 2 PMR | 48.46 | 4.07 | Luz 2 PMR | − | 56.38 |
| Explosión oscura 1 PMR | − | 193.82 | Explosión oscura 1 PMR | − | 56.38 |
| Estallido de luz 1 PMR | − | 193.82 | Estallido de luz 1 PMR | − | 56.38 |
| Explosión oscura 2 PMR | 193.82 | 48.46 | Explosión oscura 2 PMR | − | 56.38 |
| Estallido de luz 2 PMR | − | 193.82 | Estallido de luz 2 PMR | − | 56.38 |
| Crucero oscuro 1 PMR | 48.46 | 4.07 | Crucero oscuro 1 PMR | − | 56.38 |
| Crucero ligero 1 PMR | 48.46 | 4.07 | Crucero ligero 1 PMR | − | 56.38 |
| Crucero oscuro 2 PMR | 48.46 | 4.07 | Crucero oscuro 2 PMR | − | 56.38 |
| Luz de crucero 2 PMR | 193.82 | 48.46 | Luz de crucero 2 PMR | 56.38 | 14.10 |
| Congelación oscuro 1 PMR | 48.46 | 4.07 | Congelación oscuro 1 PMR | − | 56.38 |
| Congelación de la luz 1 PMR | 193.82 | 48.46 | Congelación de la luz 1 PMR | − | 56.38 |
| Oscuro 2 PMR de congelación | 48.46 | 4.07 | Oscuro 2 PMR de congelación | − | 56.38 |
| Congelación de la luz 2 PMR | 193.82 | 48.46 | Congelación de la luz 2 PMR | − | 56.38 |
Tabla 2: pez cebra y fathead minnow comportamiento NOEC y LOECs para cafeína. No hay concentración de efecto observado (NOEC) y valores más bajo observado efecto concentración (LOEC) (mg/L) para cada uno de los oscuros extremos de actividad y fotomotor respuestas de pez cebra y fathead minnows expuestos a la cafeína. Guiones indican que no se observaron efectos en un extremo particular de todos los niveles de tratamiento.
Figura 2 presenta actividad locomotor total y PMRs de pez cebra y fathead minnow 96 h de exposición a la cafeína. Las larvas de carpa Fathead que PMRS alteradas por cafeína en los niveles inferiores de tratamiento (0,038 mg/L) de pez cebra, pero un número notablemente mayor de fotomotor extremos fueron afectadas en el pez cebra. El más alto nivel de tratamiento de cafeína (193,82 mg/L) alterado PMR en el pez cebra, en la que estas respuestas eran exactamente enfrente de los controles. En este nivel de tratamiento elevado, sin embargo, PMRs disminuyeron en oscuridad y aumentaron en condiciones de luz.

Figura 2: Actividad de natación y fotomotor respuestas de pez cebra (A y B) y minnow fathead (C y D) después de la exposición de 96 h a la cafeína. Nadó la distancia media (± SEM) de pez cebra (A) y minnow fathead (C) está dada por puntos cada que representan intervalos de 1 minuto de actividad. Fotomotor respuestas de pez cebra (B) y el piscardo fathead (D) se miden como el cambio en la media (± SE) total distancia recorrida entre el last minutes de un fotoperíodo inicial y el primer minuto del período siguiente. Se midieron dos oscuras y dos de luz fotomotor período de respuestas. Un total de 24 pez cebra (4 repeticiones cada de 6 larvas) y 12 (3 repeticiones cada de 4 larvas) minnows fathead fueron utilizados para la observación conductual. p < 0,10; p < 0.05; p < 0.01. Haga clic aquí para ver una versión más grande de esta figura.
Además de medir el PMRs larvales, actividad locomotor claro y oscura se analizó a través de tres umbrales de velocidad para mover a distancia, número de movimientos y la duración de los movimientos. Estos datos se utilizan para desarrollar perfiles de respuesta conductual de cafeína (figura 3, suplementales figura 1). Tanto de los modelos de peces, actividad de la cafeína inhibida significativamente en todos afectados extremos locomotoras. Ambos peces modelos demostraron aumento de actividad en los umbrales de velocidad estalla después de la exposición a la cafeína, aunque no significativamente. Similar a los resultados de las observaciones de PMR, cafeína había efectuado un mayor número de puntos finales locomotor de pez cebra. De hecho, la cafeína había alterado varias respuestas locomotoras bajo condiciones oscuras en niveles ecológicamente realistas debajo el THV. Sin embargo, actividad locomotor de fathead minnow no fue afectada significativamente bajo condiciones de luz por cualquier nivel de tratamiento.

Figura 3: perfiles de respuesta de larvas peces cebra y fathead minnows después de exposición de 96 h a cafeína. Significa pez cebra oscura (A) y luz (B) natación actividad en comparación con la media minnow de fathead oscuro (C) y actividad de la luz (D) después de la exposición de 96 h a la cafeína. Trazar datos representa actividad en dos fotoperiodos oscuro de 10 min y dos fotoperiodos luz de 10 min para cada modelo de peces. Datos se normalizan al control, que se representa en el eje 0 en cada figura. Parámetros de comportamiento incluyen distancia nado, número de movimientos (cuentas) y la duración de cada movimiento 3 niveles de velocidad, explosión (> 20 mm/s), crucero (5-20 mm/s) y la congelación (< 5 mm/s). Además de patrones de movimiento en cada uno de los límites de velocidad, nadó la distancia total y se representa el número total de movimientos. ↑ representa un aumento significativo en la actividad en comparación con el control y ↓ indica una disminución significativa en la actividad en comparación con el control. Un total de 24 pez cebra (4 repeticiones cada de 6 larvas) y 12 (3 repeticiones cada de 4 larvas) minnow carpita donde en observaciones relativas al comportamiento de cada grupo. p < 0,10; p < 0.05; p < 0.01. Haga clic aquí para ver una versión más grande de esta figura.
Suplementario Figura 1: Fotomotor respuestas de pez cebra (A y B) y el piscardo fathead (C y D) a través de tres umbrales de velocidad. Pez cebra (A, B y C) y fathead minnow larvas (D, E y F) fotomotor respuestas a través de tres umbrales de velocidad (de congelación: 20 mm/s) después de 96 horas de exposición a la cafeína. Fotomotor respuestas de pez cebra y fathead minnow se miden como el cambio en la media (±SE) distancia total viajado entre la last minutes de un fotoperíodo inicial y el primer minuto del período siguiente. Se midieron dos oscuras y dos de luz fotomotor período de respuestas. Un total de 24 pez cebra (4 repeticiones cada de 6 larvas) y 12 (3 repeticiones de 4 larvas) minnows fathead fueron utilizados para la observación conductual. * p < 0.01 haga clic aquí para descargar este archivo.
Discusión
Al seleccionar los niveles de tratamiento químico para estudios de Toxicología conductual, deben considerarse varios factores. Niveles de cafeína en tratamiento en el presente estudio se seleccionaron con base en los valores de percentil superior para los escenarios de exposición ambiental predicha del efluente de las aguas residuales16. Cuando sea posible, seleccionamos rutinariamente los niveles de tratamiento para los estudios de Toxicología acuática mediante evaluaciones probabilísticas de exposición de observaciones ambientales19,20,21. Un THV, que es calculable por medicamentos, también se incluyó como un nivel de tratamiento en el presente estudio. THV valores (ecuación 1)22,23 se definen como concentraciones de agua predijo que a dosis terapéuticas humanas (Cmax) de productos farmacéuticos en pescado23, está inspirado en el plasma inicial modelado esfuerzos24y son calculado en base a la química de la sangre: agua repartir coeficientes (EQ. 2)25.
THV = Cmáximo / log PBW (ecuación 1)
BW de log P = log [(100.73. log Kow · 0.16) + 0.84] (EQ. 2)
Aquí, seleccionamos los niveles subletales de tratamiento en relación con el pez cebra y fathead minnow valores de CL50. Consideramos que este enfoque un útil procedimiento de benchmarking para las respuestas del comportamiento, particularmente cuando se comparan los umbrales de conductas específicas con un modelo de pescado a través de múltiples productos químicos. Además facilita cálculos de aguda a crónica proporciones, que pueden ser útiles de diagnóstico en toxicología acuática para evaluaciones y estudios mecanísticos. Se obtuvieron valores de CL50 de bioensayos de toxicidad preliminar siguiendo las pautas estandarizadas dadas en el paso 2.1.
En este protocolo, se emplean diseños experimentales comunes y técnicas estadísticas recomiendan por la EPA y la OCDE métodos estandarizados para estudios de Toxicología con modelos de peces. Aunque se reporta valores de p (e.g., < 0,01, < 0.05, < 0,10), diferencias significativas (α = 0.10) en actividad se identifican niveles entre tratamientos con análisis de varianza (ANOVA) si normalidad y equivalencia de supuestos de variación se cumplen. Las pruebas post hoc HSD de Dunnett o de Tukey se realizan para identificar diferencias de nivel de tratamiento. Seleccionamos este alfa (α = 0.10) valor a reducir los errores de tipo II, particularmente para los primeros ensayos de nivel y cuando la comprensión del tamaño del efecto biológicamente importante es limitada para extremos de comportamiento estudiados y de organismos modelo26, en vez de empleando los procedimientos más comunes en las ciencias biomédicas para comparaciones múltiples (por ej., corrección de Bonferroni para los datos de RNA-Seq)27. Futuros estudios son necesarios para entender la variabilidad de las respuestas conductuales y potencialmente modificar diseños experimentales (p. ej., aumento de la replicación) según corresponda.
Un número de factores puede influenciar comportamiento de larvas peces además de exposición a sustancias químicas. Por ejemplo, hora del día, edad, tamaño bien, temperatura, condición de iluminación y volumen de solución de exposición en cada pozo representa consideraciones importantes11,30. Por estas razones, deben tomarse precauciones para minimizar los efectos de factores externos que podrían influir en el comportamiento locomotor de los peces larvales durante la experimentación. Observaciones de comportamiento deben realizarse en las ventanas de tiempo estrecho (3 a 4 h) y a través de períodos de tiempo cuando se espera tiempo de efectos día tener mínima influencia sobre larvas comportamiento locomotor11. Además, pescados larvas deben mantenerse a una temperatura constante (28 ± 1 ° C para el pez cebra) y 24 ± 1 ° C para FHM y en un ciclo de luz/oscuridad definida en incubadoras con control de temperatura durante todo el período de exposición. Además, debe mantenerse la temperatura del laboratorio donde se registran comportamientos a condiciones semejantes condiciones experimentales para evitar influencias de temperatura en comportamientos. Además, se deben mantener pozos utilizados durante observaciones relativas al comportamiento en un volumen constante para cada pez individual.
Larvario y embrionario pez cebra que PMRS han sido previamente utilizados en las ciencias biomédicas para identificar dianas terapéuticas potenciales novela compuestos12,13. Este protocolo amplía la investigación comportamiento anterior con el pez cebra utilizando 38 finales para investigar química actividad biológica de los contaminantes ambientales. Aunque la cafeína es un contaminante acuático común con un mecanismo entendido de acción (MoA), muchos compuestos en el comercio carecen de datos mecánicos importantes. Por lo tanto, este protocolo puede ser empleado para ganar la penetración del MOEA para compuestos que carecen de datos sobre la toxicidad, incluyendo comerciales de productos químicos39. Además, el protocolo proporciona métodos para dos de los modelos de peces más utilizados. Como se indicó anteriormente, mientras que el pez cebra es un modelo común de peces biomédica que se está haciendo cada vez más popular en ecotoxicología, fathead minnow es comúnmente usado como un modelo ecológico para los usos de la evaluación ambiental pero ha recibido comparativamente menos atención en estudios de comportamiento con sistemas automatizados en comparación con el pez cebra. Aunque no existe ninguna reglamentación métodos estandarizados para estudios de Toxicología conductual los pescados, este protocolo proporciona un enfoque para apoyar los esfuerzos futuros.
La cafeína produce respuestas conductuales en cada uno de los modelos de peces a niveles que se han detectado en el medio acuático16. Rodriguez-Gil et al. 2018 desarrollado distribuciones de exposición ambiental global en sistemas acuáticos basados en los valores medidos de cafeína16. Específicamente, el 95% de las concentraciones efluentes de aguas residuales previstos caerían por debajo de las LOECs para los extremos conductuales más sensibles del pez cebra y fathead minnow en el presente estudio (tabla 2). Aunque se observaron varios efectos conductuales de la cafeína en el pez cebra (particularmente en condiciones de oscuridad) a niveles ambientalmente relevantes, no está claro si estas modificaciones conductuales podrían ocurrir en las poblaciones de peces naturales o provocar ecológicamente importantes resultados adversos. Aunque útil para propósitos de detección sensible, diagnóstico, umbrales de comportamiento larval de peces pueden no ser representante de otras etapas de la historia de la vida o de pescado en las poblaciones naturales. Se justifica la investigación adicional para determinar si similar umbrales de respuesta conductual ocurren en la naturaleza y ser indicativos de los resultados adversos en el individuo o población los niveles de organización biológica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El apoyo a este estudio fue proporcionado por la National Science Foundation de Estados Unidos (proyecto #:-1339637) con el apoyo adicional de la Agencia de protección ambiental de Estados Unidos. Agradecemos Dr. Jone Corrales, Dr. Lauren Kristofco, Gavin Saari, Samuel Haddad, Bekah Burket y Bridgett Hill soporte general lab.
Materiales
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
Referencias
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados