Method Article
Protocollo sperimentale per l'esame di profili di risposta comportamentale nel pesce larvale: applicazione alla caffeina Neuro-stimolante
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per esaminare larvale attività locomotrice di zebrafish e fathead minnow e photomotor risposte (PMR) utilizzando un software di rilevamento automatizzato. Quando incorporata in comune con le analisi biologiche tossicologia, analisi di questi comportamenti forniscono uno strumento diagnostico per esaminare chimico bioattività. Questo protocollo è descritto usando caffeina, un modello neurostimolante.
Abstract
Pesce modelli e comportamenti sono sempre più utilizzati nelle scienze biomediche; Tuttavia, pesci sono stati a lungo oggetto di studi ecologici, fisiologici e tossicologici. Utilizzando automatico rilevamento digitale piattaforme, i recenti sforzi in neurofarmacologia stanno sfruttando il comportamenti locomotori larvale pesce per identificare potenziali bersagli terapeutici per piccole molecole. Simile a questi sforzi, la ricerca nelle scienze ambientali e comparativa farmacologia e tossicologia sta esaminando diversi comportamenti di modelli di pesce come strumenti diagnostici nella valutazione a più livelli di contaminanti e di monitoraggio in tempo reale delle acque superficiali per minacce di contaminante. Considerando che il pesce zebra è un modello popolare pesce larvale nelle scienze biomediche, il vairone è un modello comune di pesce larvale in ecotossicologia. Purtroppo, le larve fathead minnow hanno ricevuto considerevolmente meno attenzione negli studi comportamentali. Qui, sviluppiamo e dimostrare un protocollo di profilo comportamentale utilizzando caffeina come un modello neurostimolante. Se le risposte di photomotor di pesciolini fathead occasionalmente sono state colpite da caffeina, zebrafish erano nettamente più sensibili per gli endpoint dell'apparato locomotore, che ha risposto a livelli rilevanti per l'ambiente e photomotor. Gli studi futuri sono necessari per capire le differenze di sensibilità comportamentali comparativa tra pesci con l'età e momento della giornata e per determinare se gli effetti comportamentali simili sarebbero si verificano in natura ed essere indicativi di eventuali esiti negativi a livello individuale o livelli di popolazione di organizzazione biologica.
Introduzione
Anche se modelli di pesce sono sempre più utilizzati per studi biomedici, pesce sono state abitualmente impiegate per gli studi di ecologia e fisiologia, per esaminare la contaminazione delle acque superficiali e capire le soglie tossicologiche delle sostanze chimiche. Tali sforzi sono importanti perché contaminazione chimica può compromettere gli ecosistemi acquatici e mettere a repentaglio la qualità della fonte di approvvigionamento idrico1,2. La maggior parte dei prodotti chimici in commercio, tuttavia, la mancanza anche di tossicologia base informazioni3.
Saggi di modello animale tradizionalmente utilizzati nei test di tossicità regolamentazione utilizzano molte risorse e non può fornire il throughput elevato, screening precoce del livello necessario per test in ventunesimo secolo4di tossicità. Successivamente, vi è un crescente slancio di adottare e utilizzare modelli in vitro che possono più rapidamente e in modo efficiente schermo composti per attività biologiche3,5. Anche se modelli cellulari basato offrono molte opportunità, essi spesso mancano di complessità biologica e quindi non conto per molti processi importanti tutto l'organismo, tra cui metabolismo6.
Zebrafish è un comune modello biomedico animale che sta guadagnando popolarità come modello alternativo in tossicologia acquatica ed ecotossicologia7,8. Date le piccole dimensioni, il rapido sviluppo e la alta fecondità, modelli di pesce possono essere utilizzati a rapidamente ed efficientemente schermo prodotti chimici per bioattività e tossicità presso l'intero organismo scala9. Con l'ausilio di software di rilevamento automatizzato, i comportamenti di zebrafish larvale forniscono una maggiore utilità di diagnostica nello screening contaminanti per tossicità10,11. Studi nelle scienze farmaceutiche hanno dimostrato che gli endpoint locomotore sono informativi dei meccanismi chimici di azione, possono essere utilizzato per i comportamenti di fenotipo e quindi provvisoriamente possono identificare bersagli subcellulari per molecole12, 13. Considerando che il pesce zebra è un modello popolare pesce larvale nelle scienze biomediche, il vairone è un modello di pesce comune, ecologicamente importante che viene utilizzato per studi di ecotossicologia e durante futuri (ad es., nuove valutazioni chimico) e valutazioni ambientali retrospettiva (ad es., ambiente acque superficiali o delle acque reflue di scarico degli effluenti monitoraggio). Purtroppo, le risposte comportamentali di pesciolini fathead larvale hanno ricevuto contrassegnato meno attenzione di zebrafish. La nostra ricerca in corso con due comuni modelli di pesce larvale, zebrafish e fathead minnow, suggerisce che larvali pesci nuotare modelli compaiono unici modalità prevista o meccanismi di azione per i diversi prodotti chimici. Così, gli endpoint comportamentali forniscono il potenziale di rapida e sensibile esaminare prodotti chimici per la tossicità e di identificare bersagli subcellulari per contaminanti chimici e altri industriali, specialmente durante le valutazioni di livello iniziale.
Qui, segnaliamo un protocollo per l'esame di profili di risposta comportamentale nel pesce larvale. Dimostriamo questi metodi utilizzando la caffeina, un modello neurostimolante e un agente inquinante comune acquatico che è stato introdotto per sistemi acquatici attraverso lo scarico da impianti di trattamenti delle acque reflue dopo il consumo umano degli alimenti, bevande, e prodotti farmaceutici formulati con caffeina14. Esaminiamo le risposte comportamentali alla caffeina in entrambi larvale zebrafish e fathead minnow, anche a un improvviso cambiamento nella condizione di luce, che è spesso definito come una risposta di photomotor (PMR) durante gli studi farmaceutici con embrionale e larvale zebrafish13,15. Identifichiamo ulteriormente gli effetti della caffeina attraverso diversi endpoint locomotore per sviluppare profili di risposta chimica per ogni modello di pesce. Livelli di trattamento caffeina utilizzati in questo studio rappresentano il percentile superiore delle distribuzioni di esposizione basate su valori ambientali della caffeina16. Includiamo anche trattamenti analizzati ai pesci larvale LC50 valori e il valore terapeutico di pericolo (THV), una concentrazione farmaceutica in acqua che è previsto per provocare i livelli del plasma in pesce coerente con una dose di plasma terapeutico umano.
Protocollo
Studi in questo protocollo generalmente seguire standardizzato disegno sperimentale e analisi statistica le linee guida raccomandate da l'US Environmental Protection Agency (EPA No. 2000.0) di pesciolini fathead e l'organizzazione per la cooperazione economica e Sviluppo (OCSE n ° 236) per zebrafish. Questi disegni sperimentali (ad esempio, aumentando la replica) possono essere modificati all'interno del protocollo attuale per gli studi futuri. Cultura di pesce condizioni seguono precedentemente pubblicato letteratura17. Tutti i protocolli sperimentali di cultura del pesce e procedure seguite protocolli istituzionali Animal Care e Comitato uso approvati presso la Baylor University.
1. esposizione di pesce a trattamento chimico
- Preparare soluzioni di esposizione di caffeina sciogliendo caffeina in acqua dura ricostituita. Eseguire appropriate diluizioni seriali diluendo trattamenti di caffeina superiori con acqua dura per produrre livelli inferiori di trattamento caffeina.
Nota: La tabella 1 riassume i livelli di trattamento utilizzati in questo esperimento.
| Zebrafish | Vairone | ||||
| Trattamento | Concentrazione di caffeina nominale (mg/L) | Concentrazione di caffeina misurato (mg/L) | Trattamento | Concentrazione di caffeina nominale (mg/L) | Concentrazione di caffeina misurato (mg/L) |
| Controllo | 0 | < LOD | Controllo | 0 | < LOD |
| 75 ° Centile * | 0,001 | 0,001 | 75 ° Centile * | 0,001 | 0,001 |
| 95 ° Centile * | 0,039 | 0,013 | 95 ° Centile * | 0,039 | 0,009 |
| 99 ° Centile * | 0,412 | 0.361 | 99 ° Centile * | 0,412 | 0.310 |
| THV | 4,07 | 3,81 | THV | 4,07 | 4.12 |
| 10% LC50 | 48,46 | 46.66 | 10% LC50 | 14.1 | 14,7 |
| 40% LC50 | 193.82 | 186.67 | 40% LC50 | 56,38 | 53,91 |
Tabella 1: trattamenti sperimentali caffeina per gli esperimenti di zebrafish e fathead minnow. Valori nominali e misurati di caffeina per ogni trattamento sono indicati. * I trattamenti di caffeina utilizzati in questo studio rappresentano il percentile superiore delle distribuzioni di esposizione basate su valori ambientali della caffeina16. THV: Valore terapeutico Hazard. LOD: Il limite di rilevazione
- Versare la soluzione preparata stavamo ambientando l'esposizione individuale. È possibile utilizzare bicchieri di vetro 100ml riempiti con 20 mL di soluzione di esposizione per le camere di esposizione di zebrafish e becher da mL 500 con 200 mL di soluzione di esposizione per le camere di esposizione fathead minnow.
- Utilizzando una pipetta di trasferimento, inserire 10 fertilizzazione del post della invecchiato 4-6 h del embrioni di zebrafish (hpf) in ciascuna delle quattro camere a replicare l'esposizione al trattamento.
- Le larve Place 10 fathead minnow invecchiato entro 24 h di schiusa in ciascuna delle tre camere a replicare l'esposizione al trattamento. Per adattare le dimensioni delle larve di fathead minnow, tagliare la punta della pipetta di trasferimento prima del trasferimento.
- Mantenere zebrafish esperimenti presso un fotoperiodo di luce: scuro h 16:8 e una temperatura costante di 28 ± 1 ° C. Utilizzare lo stesso regime di fotoperiodo per gli studi fathead minnow, ma ad una temperatura di 25 ± 1 ° C.
-
Dopo 96 h di esposizione a sostanze chimiche, carico singolo pesce in pozzetti separati di 48 (per zebrafish) e 24 (per vairone) pozzetti.
- Per garantire che ciascun pozzetto contiene un volume uguale di soluzione, trasferire le larve di zebrafish 48 pozzetti utilizzando un autopipette di 5.000 µ l per un volume di 1.000 µ l per pozzetto. Utilizzare il autopipette di prelevare e trasferire l'esposizione e larve di zebrafish soluzione contemporaneamente.
- Dovuto il loro più grande formato, trasferire larve di fathead minnow utilizzando una pipetta di trasferimento con la punta tagliata fuori. Prima di trasferire le larve fathead minnow per singoli pozzetti, riempire ogni bene a 2.000 µ l utilizzando un autopipette. Durante il trasferimento di singoli fathead larve ai pozzi, posizionare la punta della pipetta di trasferimento nella soluzione ben e consentire il pesce a nuotare dalla punta della pipetta nel pozzo.
2. calibrazione dei parametri di Video-monitoraggio
-
Prima misure comportamentali, impostare i parametri di osservazione e calibrazione del software traccia video (Vedi tabella materiali).
- Posizionare un piatto ben nella camera di registrazione con almeno 1 pesce larvale in un singolo pozzo. Utilizzare la piastra e pesce associato come rappresentazioni per impostare i parametri di calibrazione.
- Nel software traccia video, fare clic su "File | Generare il protocollo", che aprirà una finestra di dialogo"Creazione guidata di protocollo". Nel campo "numero di posizione", immettere il numero di individui pozzetti della piastra bene e quindi fare clic su "OK".
- Nella parte superiore dello schermo, fare clic su "Visualizza | Schermo intero", che richiederà il sistema per ottenere una visualizzazione di visuale dall'alto della piastra bene.
- Fare clic sull'icona "Disegnare aree", che appare come tre forme multicolori. A destra della piastra ben area di visualizzazione, selezionare l'icona del cerchio nel campo denominato "Aree".
- Utilizzare il cursore per delineare il video circolare tracciamento area in alto a sinistra il pozzetto della piastra bene. Selezionare "Top-Right Mark" e quindi delineare l'area di visualizzazione della parte superiore destra bene. Quindi, selezionare "Fondo Mark" per delineare bene il fondo.
Nota: Dopo aver disegnato il contorno circolare, la sua posizione sarà probabilmente bisogno di essere regolata. Per regolare la posizione del contorno, fare clic su "Seleziona" e quindi utilizzare il cursore per spostare l'area delineata. Inoltre, i contorni possono essere replicate facendo clic su "copia" e poi "Incolla". - Dopo l'alto a sinistra, destra, superiore e inferiore destra ben monitoraggio delle aree è state definite, fare clic su "Build" per richiedere il software automaticamente delineare le aree visive di pozzetti rimanenti.
- Nella sezione denominata "Calibrazione", fare clic su "Disegnare scala". Utilizzare il cursore per disegnare una linea orizzontale su tutta la piastra. Una volta che la linea è tracciata, apparirà una finestra chiamata "Misura di taratura". Immettere la lunghezza di ben piatto e fare clic su "OK".
- Chiudere gestore disegno facendo clic sull'icona "Disegnare aree".
- Fare clic sull'icona "Piastrelle". Utilizzando il cursore, evidenziare tutte le caselle che appaiono sullo schermo di visualizzazione in modo che ogni scatola è verde.
Nota: L'icona di piastrelle apparirà come un gruppo di sei singoli quadrati piccoli - "Fare clic su Visualizza | Schermo intero". A destra della piastra area di visualizzazione, fare clic su "Bkg" nella casella denominata "Soglia di rilevamento". Utilizzare la barra di regolazione soglia per impostare la soglia di rilevamento di pixel. Una volta, la soglia di rilevamento appropriato pixel è selezionata, fare clic su "Applica al gruppo".
Nota: Il presente protocollo definisce la soglia di rilevamento alle 13 in modalità nero per osservazioni di zebrafish e a 110 in modalità trasparente per le osservazioni fathead minnow. - Nella casella "Soglia di movimento", immettere la velocità di movimento desiderato parametri di rilevamento. Una volta impostati i parametri di velocità, fare clic su "Applica al gruppo".
Nota: Il presente protocollo definisce piccole/grandi movimenti alle 20 mm/s e inattivi/piccoli movimenti a 5 mm/s. Queste selezioni programmare il software per monitorare i movimenti di pesci larvale a tre livelli di velocità differenti: inattivo (congelamento) = < 5 mm/s, piccolo (cruising) = 5 – 20 mm/s e grande (scoppio) = > 20 mm/s. - Fare clic su "parametri | Parametri di protocollo"dal menu a discesa. Nella finestra di dialogo, selezionare la scheda "Tempo" immettere il tempo di osservazione e il tempo d'integrazione. Dopo l'immissione parametri fare clic su "Ok".
- Per impostare i tempi di fotoperiodo di chiaro/scuro e l'intensità della luce per ogni fotoperiodo aprire che finestra di dialogo delle impostazioni del driver luce selezionando "Luce guida" dai "parametri" menu a discesa.
Nota: Vedere video di protocollo per la configurazione più chiaro-scuro fotoperiodi. - Dopo aver impostati i parametri di rilevamento video, salvare il protocollo di osservazione.
Nota: Questo protocollo osserva il comportamento dei pesci su un periodo di 50 min che include una fase di acclimatazione di 10 min seguita da 4 alterando fasi di chiaro/scuro composto da due periodi di luce di 10 min e due 10 min scuro. Il tempo d'integrazione è impostato per misurare il comportamento per ogni minuto della prova del comportamento di 50 min.
3. osservazione del pesce larvale locomotore e Photomotor comportamento
- Posizionare la piastra ben contenenti pesce sperimentale nella camera di registrazione del comportamento.
- Nel video software di monitoraggio, aprire il protocollo di monitoraggio sviluppato nel passaggio 3.
- Nel Visualizzatore di rilevamento video, controllare per assicurarsi che tutte le larve sono visibili sullo schermo del computer, che solo una larva individuo è presente in ciascun pozzetto, e che i singoli pozzetti sono allineati all'interno delle aree di osservazione che sono state definite nei passaggi 2.1.5 e 2.1.6.
- Fare clic su "esperimento | Eseguire".
Nota: Il sistema richiederà all'utente di fornire un nome e un percorso per salvare i dati di osservazione. - Una volta il nome e percorso dell'osservazione di salvataggio sono stati specificati i dati, fare clic sull'icona "Diversi Live Images" per evidenziare tutte le aree di visualizzazione predefiniti
Nota: Questa icona si trova nella parte superiore dello schermo del computer e viene visualizzato come una casella divisa in quattro quadrati più piccoli. Cliccando su questa icona evidenzierà tutte le aree di visualizzazione pre-definiti. - Chiudere il pannello di camera di registrazione e fare clic su "sfondo | Avviare"sul monitor del computer.
4. analisi dei dati comportamentali
- Per recuperare i dati dell'attività larvale pesce, aprire il foglio di calcolo, che viene compilato automaticamente dal software di monitoraggio ed è nella cartella specificata dall'utente prima di iniziare le prove comportamentali (punto 3.4).
- Fare riferimento alle figure 1A e 1B per misurazioni rappresentative di ingenuo attività locomotrice di zebrafish non esposti e fathead minnow larve, rispettivamente. Vedere figure 1 e 1 D per calcoli di PMR, che effettivamente esaminare la grandezza della differenza di movimento tra le transizioni chiaro a scuro o scuro alla luce.
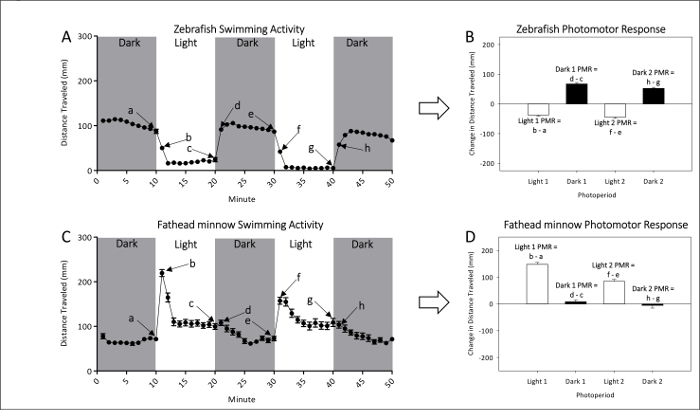
Figura 1: Esempio di attività di base di zebrafish non esposti (A e B) e vairone (C e D). La distanza media (± SEM) nuotato per zebrafish (A) e vairone (C) è dato da punti ogni che rappresentano intervalli di un minuto di attività. Due buio e luce due periodi di photomotor risposte sono misurati. L'ultimo (a, c, e e g) e primo (b, d, f e h) minuto di ogni fotoperiodo vengono utilizzati per calcolare le risposte PMRs. Photomotor di zebrafish (B) e vairone (D) sono misurati come il cambiamento in media (valori) distanza percorsa tra l'ultimo minuto di un fotoperiodo iniziale e il primo minuto del periodo successivo. Clicca qui per visualizzare una versione più grande di questa figura.
Risultati
Livelli di trattamento di caffeina non hanno variato sensibilmente durante gli esperimenti di 96 h con zebrafish e fathead minnows. Ad esempio, la tabella 1 illustra analiticamente verificate concentrazioni di ogni livello di trattamento. Questo protocollo ha verificato campioni di acqua per il trattamento di livelli di caffeina di diluizione dell'isotopo liquido cromatografia spettrometria di massa tandem (LC-MS/MS) generalmente seguendo metodi precedentemente segnalati28. La formazione di paraxanthine, il metabolita primario di caffeina, inoltre è stata quantificata. Le informazioni analitiche supplementare viene fornita una descrizione di queste procedure analitiche. A causa delle somiglianze tra nominale e analitica verifica dei trattamenti, trattamento nominale livelli sono presentati in tutto il resto di questo manoscritto. Caffeina ha alterato significativamente i comportamenti di minnow di zebrafish e vairone. Tuttavia, zebrafish locomotore risposte erano sempre più sensibile alla caffeina di pesciolini fathead. Gli endpoint comportamentali più sensibili per le larve di minnow di zebrafish e fathead hanno risentiti di caffeina ad una concentrazione di 0,039 mg/L. la tabella 2 riassume le concentrazioni più basse effetto osservato (LOECs) e concentrazioni senza effetto osservato (NOECs) per ogni endpoint comportamentale in entrambi i modelli pesce.
| Zebrafish | Vairone | ||||
| Endpoint | LOEC (mg/L) | NOEC (mg/L) | Endpoint | LOEC (mg/L) | NOEC (mg/L) |
| Distanza totale buio | 0,412 | 0,039 | Distanza totale buio | − | 56,38 |
| Distanza totale luce | 48,46 | 4,07 | Distanza totale luce | − | 56,38 |
| Conteggi totali Dark | 0,412 | 0,039 | Conteggi totali Dark | − | 56,38 |
| Conteggi totali luce | 48,46 | 4,07 | Conteggi totali luce | − | 56,38 |
| Distanza Dark di scoppio | − | 193.82 | Distanza Dark di scoppio | − | 56,38 |
| Distanza luce di scoppio | 193.82 | 48,46 | Distanza luce di scoppio | − | 56,38 |
| Scoppio conta scuro | 193.82 | 48,46 | Scoppio conta scuro | − | 56,38 |
| Luce di conteggi di scoppio | 193.82 | 48,46 | Luce di conteggi di scoppio | − | 56,38 |
| Durata buio di scoppio | 193.82 | 48,46 | Durata buio di scoppio | − | 56,38 |
| Scoppio di luce di durata | − | 193.82 | Scoppio di luce di durata | − | 56,38 |
| Crociera distanza Dark | 0,412 | 0,039 | Crociera distanza Dark | − | 56,38 |
| Crociera distanza luce | 48,46 | 4,07 | Crociera distanza luce | − | 56,38 |
| Crociera conta scuro | 0,412 | 0,039 | Crociera conta scuro | − | 56,38 |
| Crociera conteggi luce | 48,46 | 4,07 | Crociera conteggi luce | − | 56,38 |
| Crociera durata Dark | 0,412 | 0,039 | Crociera durata Dark | − | 56,38 |
| Crociera durata luce | 48,46 | 4,07 | Crociera durata luce | − | 56,38 |
| Distanza di congelamento scuro | 0,412 | 0,039 | Distanza di congelamento scuro | 0,039 | 0,001 |
| Congelamento distanza luce | 0,039 | 0,001 | Congelamento distanza luce | − | 56,38 |
| Congelamento conta scuro | 0,412 | 0,039 | Congelamento conta scuro | − | 56,38 |
| Congelamento conta luce | 48,46 | 4,07 | Congelamento conta luce | − | 56,38 |
| Durata di congelamento scuro | − | 193.82 | Durata di congelamento scuro | 56,38 | 14.10 |
| Congelamento durata luce | 48,46 | 4,07 | Congelamento durata luce | − | 56,38 |
| 1 PMR scuro | 48,46 | 4,07 | 1 PMR scuro | 0,039 | 0,001 |
| Luce 1 PMR | 48,46 | 4,07 | Luce 1 PMR | − | 56,38 |
| PMR 2 scuro | 48,46 | 4,07 | PMR 2 scuro | − | 56,38 |
| Luce 2 PMR | 48,46 | 4,07 | Luce 2 PMR | − | 56,38 |
| Scoppio scuro 1 PMR | − | 193.82 | Scoppio scuro 1 PMR | − | 56,38 |
| Scoppio di luce 1 PMR | − | 193.82 | Scoppio di luce 1 PMR | − | 56,38 |
| Scoppio scuro 2 PMR | 193.82 | 48,46 | Scoppio scuro 2 PMR | − | 56,38 |
| Scoppio di luce 2 PMR | − | 193.82 | Scoppio di luce 2 PMR | − | 56,38 |
| Crociera di 1 PMR scuro | 48,46 | 4,07 | Crociera di 1 PMR scuro | − | 56,38 |
| Crociera 1 PMR di luce | 48,46 | 4,07 | Crociera 1 PMR di luce | − | 56,38 |
| Crociera PMR scuro 2 | 48,46 | 4,07 | Crociera PMR scuro 2 | − | 56,38 |
| Luce di crociera 2 PMR | 193.82 | 48,46 | Luce di crociera 2 PMR | 56,38 | 14.10 |
| Congelamento di 1 PMR scuro | 48,46 | 4,07 | Congelamento di 1 PMR scuro | − | 56,38 |
| Congelamento di luce 1 PMR | 193.82 | 48,46 | Congelamento di luce 1 PMR | − | 56,38 |
| Congelamento scuro 2 PMR | 48,46 | 4,07 | Congelamento scuro 2 PMR | − | 56,38 |
| Congelamento di luce 2 PMR | 193.82 | 48,46 | Congelamento di luce 2 PMR | − | 56,38 |
Tabella 2: Zebrafish e fathead minnow NOECs comportamentale e LOECs per caffeina. Nessuna concentrazione di effetto osservato (NOEC) e valori più bassi osservati effetto concentrazione (LOEC) (mg/L) per ogni luce/buio nuoto attività endpoint e photomotor risposte per zebrafish e fathead minnows esposti alla caffeina. Trattini indicano che nessun effetto è stato osservato a un particolare endpoint attraverso tutti i livelli di trattamento.
Figura 2 presenta totale attività locomotrice e PMRs di zebrafish e fathead minnow dopo 96 h esposizione alla caffeina. Larve di Fathead minnow che PMRS sono stati alterati da caffeina a livelli inferiori di trattamento (0,038 mg/L) a zebrafish, ma un numero nettamente maggiore di photomotor endpoint sono state colpite in zebrafish. Il massimo livello di trattamento di caffeina (193,82 mg/L) alterato PMR in zebrafish, in cui queste risposte erano esattamente l'opposto da controlli. A questo livello elevato trattamento, tuttavia, PMRs diminuito nel buio e aumentato in condizioni di luce.

Figura 2: Attività di nuoto e photomotor risposte di zebrafish (A e B) e vairone (C e D) dopo l'esposizione di 96 h alla caffeina. La distanza media (± SEM) nuotato per zebrafish (A) e vairone (C) è dato da punti ogni che rappresentano intervalli di 1 min di attività. Photomotor risposte di zebrafish (B) e vairone (D) sono misurate come il cambiamento in media (± SE) totale distanza percorsa tra il last minutes di un fotoperiodo iniziale e il primo minuto del periodo successivo. Due scuri e due photomotor periodo luce risposte sono state misurate. Un totale di 24 zebrafish (4 repliche ogni di 6 larve) e 12 (3 replicati ogni di 4 larve) pesciolini fathead sono stati usati per l'osservazione del comportamento. p < 0.10; p < 0,05; p < 0.01. Clicca qui per visualizzare una versione più grande di questa figura.
Oltre a misurare PMRs larvale, chiari e scuri attività locomotrice è stata analizzata attraverso tre soglie di velocità per distanza spostata, numero di movimenti e la durata dei movimenti. Questi dati vengono usati per sviluppare profili di risposta comportamentale per caffeina (Figura 3, Supplemental Figura 1). In entrambi i modelli di pesce, caffeina ha inibita l'attività affatto significativamente colpita locomotore endpoint. Entrambi i pesci modelli hanno dimostrato maggiore attività presso le soglie di velocità scoppio dopo esposizione alla caffeina, anche se non significativamente. Simile ai risultati delle osservazioni PMR, caffeina effettuato un maggior numero di endpoint locomotore zebrafish. Infatti, caffeina alterati significativamente diverse risposte locomotore sotto condizioni di buio all'ambiente realistici livelli inferiori la THV. Tuttavia, l'attività locomotrice fathead minnow non era significativamente influenzata da qualsiasi livello di trattamento in condizioni di luce.

Figura 3: profili di risposta di larvale zebrafish e fathead minnows dopo 96 ore di esposizione alla caffeina. Significa zebrafish scuro (A) e (B) luce nuoto attività rispetto a significare vairone scuro (C) e luce (D) attività dopo 96 ore di esposizione alla caffeina. Tracciati dati rappresenta attività su due fotoperiodi scuro 10 min e due fotoperiodi luce 10 min per ogni modello di pesce. Normalizzazione dei dati al controllo, che è rappresentato sull'asse 0 in ogni figura. Parametri comportamentali includono distanza nuotato, numero dei movimenti (conteggi) e la durata di ogni movimento attraverso 3 livelli di velocità, rottura (> 20 mm/s), crociera (5 – 20 mm/s) e il congelamento (< 5 mm/s). Oltre a schemi di movimento in ciascuna delle soglie di velocità, distanza totale nuotato e numero totale dei movimenti è rappresentato. ↑ rappresenta un aumento significativo nell'attività rispetto a controllo e ↓ indica una diminuzione significativa nell'attività rispetto a controllo. Un totale di 24 zebrafish (4 repliche ogni di 6 larve) e 12 (3 replicati ogni di 4 larve) vairone dove usato nelle osservazioni comportamentali per ogni gruppo. p < 0.10; p < 0,05; p < 0.01. Clicca qui per visualizzare una versione più grande di questa figura.
Supplementare figura 1: Photomotor risposte di zebrafish (A e B) e vairone (C e D) attraverso tre soglie di velocità. Zebrafish (A, B e C) e fathead minnow larve (D, E e F) photomotor risposte attraverso tre soglie di velocità (congelamento: 20 mm/s) dopo l'esposizione di 96 ore a caffeina. Photomotor risposte di zebrafish e fathead minnow sono misurate come il cambiamento in media (±SE) totale distanza percorsa tra il last minutes di un fotoperiodo iniziale e il primo minuto del periodo successivo. Due scuri e due photomotor periodo luce risposte sono state misurate. Un totale di 24 zebrafish (4 repliche ogni di 6 larve) e 12 (3 repliche di 4 larve) pesciolini fathead sono stati usati per l'osservazione del comportamento. * p < 0.01 Clicca qui per scaricare questo file.
Discussione
Quando si seleziona livelli di trattamento chimico per gli studi di tossicologia comportamentale, parecchi fattori devono essere considerati. Livelli di trattamento della caffeina nel presente studio sono stati selezionati in base ai valori di centile superiore per gli scenari di esposizione ambientale prevista da acque reflue degli effluenti16. Quando possibile, selezioniamo ordinariamente i livelli di trattamento per gli studi di tossicologia acquatica usando valutazione probabilistica dell'esposizione di osservazioni ambientali19,20,21. Un THV, che è calcolabile per medicinali, è stato anche incluso come un livello di trattamento nello studio presente. THV valori (EQ. 1)22,23 sono definiti come le concentrazioni di acqua previsto che conduce alle dosi terapeutiche umane (Cmax) di prodotti farmaceutici in pesce23, sono ispirati dal plasma iniziale sforzi24di modellazione e sono calcolato in base il sangue: acqua chimico partizionamento coefficienti (EQ. 2)25.
THV = Cmax / log PBW (EQ. 1)
log PBW = log [(100,73. log Kow · 0,16) + 0,84] (EQ. 2)
Qui, selezioniamo anche livelli subletali trattamento riguardante zebrafish e fathead minnow valori LC50. Consideriamo questo approccio una procedura utile benchmarking per le risposte comportamentali, specialmente quando si confrontano le soglie dei comportamenti specifici con un modello di pesce attraverso più sostanze chimiche. Facilita ulteriormente i calcoli di acuta ai rapporti cronici, che possono essere diagnosticamente utili in tossicologia acquatica per valutazioni e studi meccanicistici. LC50 valori sono stati ottenuti dalle analisi biologiche preliminari tossicità seguendo le linee guida standardizzate fornite al punto 2.1.
In questo protocollo, ci avvaliamo di comuni disegni sperimentali e tecniche statistiche raccomandato dalla US EPA e OECD metodi standardizzati per gli studi di tossicologia con modelli di pesce. Anche se Segnaliamo i valori di p (ad es., < 0.01, < 0.05, < 0.10), differenze significative (α = 0.10) in attività i livelli sono identificati tra trattamenti mediante analisi della varianza (ANOVA) se normalità e l'equivalenza delle ipotesi di varianza sono soddisfatte. Di Dunnett o di Tukey HSD test post-hoc vengono eseguiti per identificare le differenze di trattamento. Selezioniamo questa alfa (α = 0.10) valore per ridurre gli errori II tipo, in particolare per i primi saggi di livello e quando una comprensione della dimensione dell'effetto biologicamente importante è limitata per understudied endpoint comportamentale e di organismi modello26, invece di che impiegano le procedure più comuni nelle scienze biomediche per i confronti multipli (per es., la correzione di Bonferroni per dati di RNA-Seq)27. Gli studi futuri sono necessari per comprendere la variabilità di queste risposte comportamentali e potenzialmente modificare disegni sperimentali (ad es., aumento replica) di conseguenza.
Una serie di fattori può influenzare il comportamento dei pesci larvale oltre l'esposizione chimica. Ad esempio, il tempo di giorno, età, ben dimensioni, temperatura, condizione di luce e volume della soluzione di esposizione in ogni ben rappresentano importanti considerazioni11,30. Per questi motivi, si dovrebbero adottare precauzioni per ridurre al minimo gli effetti di fattori esterni che potrebbero influenzare il comportamento motorio del pesce larvale durante la sperimentazione. Osservazioni comportamentali devono essere eseguite in windows tempo stretto (3-4 h) e in diversi periodi di tempo quando il tempo degli effetti di giorno sono tenuti ad avere minimo influenza il comportamento motorio larvale11. Inoltre, larvale pesce dovrebbe essere mantenuta a una temperatura costante (28 ± 1 ° C per zebrafish) e 24 ± 1 ° C per FHM e su un definito ciclo luce/buio in incubatrice a temperatura controllata per tutto il periodo di esposizione. Inoltre, la temperatura del laboratorio dove sono registrati i comportamenti dovrebbe essere effettuata per condizioni ravvicinamento delle condizioni sperimentali per evitare influenze di temperatura sui comportamenti. Ulteriormente, pozzi used durante osservazioni comportamentali devono essere mantenuti un volume costante per ogni singolo pesce.
Zebrafish embrionale e larvale che PMRS precedentemente sono stati usati nelle scienze biomediche per identificare potenziali bersagli terapeutici per romanzo composti12,13. Questo protocollo si espande su precedenti ricerche comportamentali con zebrafish utilizzando 38 endpoint per studiare chimica bioattività di contaminanti ambientali. Anche se la caffeina è un agente inquinante comune acquatico con un comprensibile meccanismo d'azione (MoA), molti composti in commercio mancano di importanti dati meccanicistici. Pertanto, il presente protocollo può essere impiegato per ottenere una visione di MoAs per mancanza di dati sulla tossicità, compresi prodotti chimici commerciali39composti. Inoltre, il protocollo fornisce i metodi per due dei modelli di pesce più comunemente usato. Come osservato in precedenza, considerando che il pesce zebra è un modello biomedico pesce comune che sta diventando sempre più popolare in ecotossicologia, fathead minnow è comunemente usato come un modello ecologico per applicazioni di valutazione ambientale, ma ha ricevuto comparativamente meno attenzione negli studi comportamentali con sistemi automatizzati rispetto al zebrafish. Anche se non rimane metodi standardizzati di regolamentazione per gli studi di tossicologia del comportamento del pesce, questo protocollo fornisce un approccio per sostenere gli sforzi futuri.
La caffeina ha suscitato risposte comportamentali in ognuno dei modelli di pesce a livelli che sono stati rilevati in ambiente acquatico16. Rodriguez-Gil et al 2018 sviluppato distribuzioni di esposizione ambientale globale in sistemi acquatici basate sui valori misurati di caffeina16. In particolare, 95% delle concentrazioni degli effluenti acque reflue previsto sarebbe caduta sotto il LOECs per gli endpoint comportamentali più sensibili di zebrafish e fathead minnow nello studio presente (tabella 2). Anche se parecchi effetti comportamentali di caffeina sono stati osservati in zebrafish (specialmente in condizioni di oscurità) a livelli rilevanti per l'ambiente, non è chiaro se queste modifiche comportamentali potrebbero verificarsi in popolazioni ittiche naturali o comportare ecologicamente importanti esiti negativi. Anche se utile ai fini di screening sensibile, diagnostica, soglie del comportamento larvale pesce potrebbero non essere rappresentante di altre fasi di storia di vita o di pesce nelle popolazioni naturali. Ulteriore ricerca è autorizzata per determinare se simili soglie di risposta comportamentale sarebbero si presentano in natura ed essere indicativi di eventuali esiti negativi a livello individuale o di popolazione dell'organizzazione biologica.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Supporto per questo studio è stato fornito dalla US National Science Foundation (Project #:-1339637) con supporto aggiuntivo da U.S. Environmental Protection Agency. Ringraziamo il Dr. Jone Corrales, Dr. Lauren Kristofco, Gavin Saari, Samuel Haddad, Bekah Burket e Bridgett Hill per supporto generale lab.
Materiali
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
Riferimenti
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon