Method Article
Protocolo experimental pela análise de perfis de resposta comportamental em peixes Larval: aplicação para a Neuro-estimulantes cafeína
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para examinar larval zebrafish e cabeção peixinho locomotoras atividades e respostas photomotor (PMR), usando um software de rastreamento automatizado. Quando incorporado em comum os bioensaios de toxicologia, análises destes comportamentos fornecem uma ferramenta de diagnóstico para examinar a bioatividade química. Este protocolo é descrito usando a cafeína, um modelo neurostimulant.
Resumo
Modelos de peixe e comportamentos são cada vez mais utilizados em ciências biomédicas; no entanto, peixe tem sido objecto de estudos ecológicos, fisiológicos e toxicológicos. Usando automatizado plataformas de controle digital, esforços recentes em Neurofarmacologia estão aproveitando comportamentos locomotor de larvas de peixe para identificar potenciais alvos terapêuticos para pequenas moléculas. Semelhante a esses esforços, pesquisa em ciências ambientais e comparativa farmacologia e toxicologia examinou vários comportamentos dos modelos de peixe como ferramentas de diagnóstico na avaliação hierárquica de contaminantes e monitoramento em tempo real das águas de superfície para ameaças de contaminante. Considerando que o peixe-zebra é um modelo popular peixe larval em ciências biomédicas, vairão cabeção é um modelo comum de larvas de peixes em ecotoxicologia. Infelizmente, as larvas de peixe cabeçudo receberam consideravelmente menos atenção em estudos comportamentais. Aqui, podemos desenvolver e demonstrar um protocolo de perfil comportamental usando cafeína como um modelo neurostimulant. Embora photomotor respostas de peixinhos cabeção ocasionalmente foram afetadas pela cafeína, zebrafish eram marcadamente mais sensível para photomotor e pontos de extremidade locomotoras, que respondeu em níveis ambientalmente relevantes. Futuros estudos são necessários para entender as diferenças de sensibilidade comportamental comparativo entre peixe com idade e tempo de dia e para determinar se semelhantes efeitos comportamentais que ocorrem na natureza e ser indicativo de resultados adversos no indivíduo ou níveis de população da organização biológica.
Introdução
Embora modelos de peixe são cada vez mais utilizados para estudos biomédicos, peixe têm sido empregada rotineiramente para estudos de ecologia e fisiologia, para examinar a contaminação das águas de superfície e entender os limiares toxicológicos dos produtos químicos. Tais esforços são importantes porque a contaminação química pode prejudicar os ecossistemas aquáticos e comprometer a qualidade do abastecimento de água de fonte1,2. A maioria dos produtos químicos no comércio, no entanto, falta até mesmo de informação de toxicologia básica3.
Ensaios de modelo animal tradicionalmente utilizados em testes de toxicidade regulamentar são recurso intensivo e não pode fornecer a alta taxa de transferência, triagem de camada início necessária para toxicidade testes no século XXI4. Posteriormente, há um crescente impulso para adotar e utilizar modelos em vitro que podem mais rapidamente e eficientemente tela compostos por atividades biológicas3,5. Embora modelos de célula com base apresentam muitas oportunidades, eles muitas vezes faltam a complexidade biológica e, portanto, não conta para muitos processos importantes de todo organismo, incluindo metabolismo6.
O peixe-zebra é um modelo comum de animal biomédico que está ganhando popularidade como um modelo alternativo em Toxicologia aquática e Ecotoxicologia7,8. Dado seu tamanho pequeno, rápido desenvolvimento e alta fecundidade, modelos de peixes podem ser usados para produtos químicos para a bioatividade e toxicidade na escala todo organismo9de tela rapidamente e eficientemente. Com o auxílio do software de rastreamento automatizado, larval zebrafish comportamentos fornecem utilitário de diagnóstico avançado em triagem de contaminantes para toxicidade10,11. Estudos nas ciências farmacêuticas têm demonstrado que a locomoção pontos de extremidade são informativos dos mecanismos químicos de ação, podem ser usada para comportamentos de fenótipo e então tentativamente podem identificar subcellular alvos para novas moléculas12, 13. Considerando o zebrafish é um modelo popular peixe larval em ciências biomédicas, vairão cabeção é um modelo comum, ecologicamente importante peixe que é utilizado para estudos de Ecotoxicologia e durante em perspectiva (por exemplo, novas avaliações química) e avaliações ambientais de retrospectiva (por exemplo, ambiente água de superfície ou acompanhamento de descarga de efluentes de águas residuais). Infelizmente, respostas comportamentais de peixinhos cabeção larval receberam marcadamente menos atenção do que o peixe-zebra. Nossa pesquisa em andamento com dois modelos comuns de larvas de peixes, o zebrafish e fathead minnow, sugere que larval peixes nadando padrões aparecem exclusivos para modos antecipados ou mecanismos de ação para diversos produtos químicos. Assim, pontos de extremidade comportamentais fornecem o potencial rapidamente e com sensibilidade examinar produtos químicos para a toxicidade e identificar alvos subcellular para industriais químicos e outros contaminantes, particularmente durante avaliações de nível inicial.
Aqui, nós relatamos um protocolo para análise de perfis de resposta comportamental em peixes larvas. Nós demonstramos esses métodos usando a cafeína, um modelo neurostimulant e um contaminante comum aquático que é introduzido aos sistemas aquáticos através de descarga de tratamentos águas residuais após o consumo de alimentos, bebidas, e produtos farmacêuticos formulados com cafeína14. Nós examinamos as respostas comportamentais à cafeína em ambos larval minnow zebrafish e cabeção, incluindo-se a uma mudança súbita na condição de iluminação, que é muitas vezes referida como uma resposta de photomotor (PMR) durante estudos farmacêuticos com embrionário e larvar zebrafish13,15. Identificamo-nos ainda mais os efeitos da cafeína através de vários pontos de extremidade locomotoras para desenvolver perfis químicos de resposta para cada modelo de peixe. Níveis de tratamento de cafeína utilizados neste estudo representam o centiles superior de distribuições de exposição, com base em valores ambientais medidos de cafeína16. Nós também incluímos tratamentos aferidos para larvas de peixes LC50 valores e o valor terapêutico do perigo (THV), uma concentração farmacêutica na água que é antecipada para resultar em níveis plasmáticos em peixe consistente com uma dose terapêutica de plasma humano.
Protocolo
Estudos neste protocolo geralmente siga delineamento experimental padronizado e recomendado diretrizes de análise estatística de nos Environmental Protection Agency (EPA n º 2000,0) para os peixinhos do cabeção e a organização para a cooperação económica e Desenvolvimento (OCDE n º 236) para zebrafish. Estes desenhos experimentais (por exemplo, aumento da replicação) podem ser modificados dentro do protocolo atual para estudos futuros. Piscicultura condições sigam anteriormente publicados literatura17. Todos os protocolos procedimentos e peixe cultura experimentais seguiram protocolos institucionais Cuidado Animal e Comitê de uso aprovados na Universidade de Baylor.
1. expor o peixe para tratamento químico
- Prepare soluções de exposição de cafeína pela dissolução de cafeína em água dura reconstituída. Realizar diluições em série apropriadas diluindo-se tratamentos de cafeína mais elevados com água dura para produzir níveis mais baixos de tratamento de cafeína.
Nota: A tabela 1 resume a nível de tratamento utilizados neste experimento.
| Zebrafish | Fathead Minnow | ||||
| Tratamento | Concentração de cafeína nominal (mg/L) | Concentração de cafeína medido (mg/L) | Tratamento | Concentração de cafeína nominal (mg/L) | Concentração de cafeína medido (mg/L) |
| Controle | 0 | < LOD | Controle | 0 | < LOD |
| 75º percentil * | 0.001 | 0.001 | 75º percentil * | 0.001 | 0.001 |
| ao percentil 95 * | 0.039 | 0,013 | ao percentil 95 * | 0.039 | 0,009 |
| Percentil 99 * | 0.412 | 0.361 | Percentil 99 * | 0.412 | 0.310 |
| THV | 4.07 | 3.81 | THV | 4.07 | 4.12 |
| 10% LC50 | 48.46 | 46,66 | 10% LC50 | 14.1 | 14,7 |
| 40% LC50 | 193.82 | 186.67 | 40% LC50 | 56.38 | 53.91 |
Tabela 1: tratamentos experimentais de cafeína para experimentos de vairão zebrafish e cabeçudo. Valores nominais e medidos de cafeína para cada tratamento são dadas. * Os tratamentos de cafeína utilizados neste estudo representam o centiles superior de distribuições de exposição, com base em valores ambientais medidos de cafeína16. THV: Valor de risco terapêutico. LOD: Limite de detecção
- Despeje a solução preparada no champanhe de exposição individual. Usar copos de vidro de 100 mL enchidos com 20 mL de solução de exposição para câmaras de exposição zebrafish e provetas de 500 mL com 200 mL de solução de exposição para câmaras de exposição fathead minnow.
- Utilizando uma pipeta de transferência, coloque 10 zebrafish embriões envelhecido h de 4-6 post fertilização (hpf) em cada uma das quatro câmaras de exposição replicar por tratamento.
- Larvas de peixe cabeçudo lugar 10 anos dentro de 24 h de incubação em cada uma das três câmaras de exposição replicar por tratamento. Para acomodar o maior tamanho de larvas de peixe cabeçudo, corte a ponta da pipeta de transferência antes da transferência.
- Manter o zebrafish experimentos em um fotoperíodo de luz: escuro 16:8 h e uma temperatura constante de 28 ± 1 ° C. Use o mesmo regime de fotoperíodo para estudos de peixinho de cabeção, mas a uma temperatura de 25 ± 1 ° C.
-
Após 96 h de exposição a substâncias químicas, peixe individual carga separados poços de 48 (para o zebrafish) e 24 (para peixinho cabeção) placas bem.
- Para garantir que cada um contém também um volume igual de solução, transferir as larvas zebrafish para 48 placas bem usando um autopipette de 5.000 µ l para um volume de 1.000 µ l por bem. Use o autopipette para retirar e transferir o zebrafish larvas e exposição solução simultaneamente.
- Devido ao seu tamanho maior, transferência de larvas de peixe cabeçudo usando uma pipeta de transferência com a ponta cortada. Antes de transferir as larvas de peixe de cabeção para poços individuais, encha cada um bem a 2.000 µ l usando um autopipette. Ao transferir as larvas individuais cabeção para poços, colocar a ponta da pipeta de transferência na solução bem e permitir que os peixes a nadar desde a ponta da pipeta dentro do poço.
2. calibração dos parâmetros de controle de vídeo
-
Antes de medidas comportamentais, definir parâmetros de observação e calibração na faixa de vídeo software (consulte a tabela de materiais).
- Coloca uma placa bem na câmara de gravação pelo menos 1 peixe larval em um bem individual. Use a placa e peixes associada como representações para definir parâmetros de calibração.
- No software da faixa de vídeo, clique em "arquivo | Gerar protocolo", que abrirá uma caixa de diálogo"Assistente de criação de protocolo". No campo "contagem de localização", digite o número de indivíduos poços da placa de bem e, em seguida, clique "Okey".
- Na parte superior da tela, clique "View | Tela cheia", que solicitará o sistema para exibir uma visão da câmera aérea da placa bem.
- Clique no ícone "Desenhar áreas", que aparece como três formas multicoloridas. À direita da placa bem área de visualização, selecione o ícone de círculo no campo rotulado "Áreas".
- Utilize o cursor para delinear o vídeo circular rastreamento área na parte superior esquerda do poço da placa de bem. Selecione "Marca Top-Right" e em seguida contorne a área de visualização da parte superior direita bem. Em seguida, selecione "Marca de fundo" para delinear a parte inferior direita bem.
Nota: Depois de desenhar o contorno circular, sua posição provavelmente precisará ser ajustado. Para ajustar a posição da estrutura de tópicos, clique em "selecionar" e em seguida, use o cursor para mover a área delineada. Também, os contornos podem ser replicados clicando em "copiar" e depois "colar". - Após o canto superior esquerdo, superior direito, e fundo muito bem áreas de rastreamento foram definido, clique em "Build" para solicitar que o software automaticamente delinear as áreas de visualização dos poços restantes.
- Na área rotulada de "Calibração", clique em "Escala de desenhar". Utilize o cursor para desenhar uma linha horizontal através da placa. Uma vez que a linha é desenhada, aparecerá uma caixa de diálogo "Medição de calibração". Insira o comprimento bem placa e clique em "Okey".
- O gerente de desenho de saída clicando no ícone de "Áreas de desenhar".
- Clique no ícone de "Tiles". Usando o cursor, destaca todas as caixas que aparecem na tela de visualização, para que cada caixa é verde.
Nota: O ícone de telhas aparece como um grupo de seis individuais pequenos quadrados - "Clique em Exibir | Tela cheia". À direita da placa de área de visualização, clique em "Bkg" na caixa rotulada "Limite de deteção". Use a barra de ajuste de limite para definir o limite de deteção de pixel. Uma vez, o limite de deteção de pixel apropriada é seleccionado, clique em "Aplicar-se ao grupo".
Nota: Este protocolo define o limite de deteção 13 no modo preto para observações de zebrafish e 110 no modo transparente para observações de peixinho de cabeção. - Na caixa rotulada "Limiar de movimento", digite a velocidade de movimento desejado, parâmetros de controle. Uma vez que são definidos parâmetros de velocidade, clique em "Aplicar-se ao grupo".
Nota: Este protocolo define pequenas/grandes movimentos em 20 mm/s e inativo/pequenos movimentos em 5 mm/s. Estas seleções program o software para controlar o movimento de larvas de peixes em três níveis diferentes de velocidade: inativo (congelamento) = < 5 mm/s, pequeno (cruzeiro) = 5-20 mm/s e grandes (estouro) = > 20 mm/s. - Clique em "parâmetros | O protocolo parâmetros"no menu suspenso. Na caixa de diálogo, selecione a guia "Tempo" Enter o tempo de observação e o tempo de integração. Depois são inseridos parâmetros clique "Okey".
- Para definir os tempos de claro/escuro fotoperíodo e intensidade de luz para cada fotoperíodo abrir que as configurações de luz motorista diálogo caixa, selecionando "Condução de luz" de "Parâmetros" do menu suspenso.
Nota: Veja vídeo de protocolo para a criação de múltiplos fotoperíodos de claro-escuro. - Após o vídeo, parâmetros de controle foram estabelecidos, salvar o protocolo de observação.
Nota: Este protocolo observa o comportamento dos peixes durante um período de 50 minutos que inclui uma fase de aclimatação de 10 min seguida por 4 alterando fases de claro/escuro, constituído por dois períodos de luz de 10 min e dois períodos escuros de 10 min. O tempo de integração é definido para medir o comportamento para cada minuto do julgamento comportamental 50 min.
3. observação de peixes Larval Locomotor e comportamento Photomotor
- Coloque a placa bem contendo peixe experimental na câmara de gravação comportamental.
- O vídeo segue o software, abra o protocolo de rastreamento desenvolvido na etapa 3.
- No Visualizador de vídeo monitoramento, verificar para se certificar de que todas as larvas são visíveis na tela do computador, que apenas uma larva individual está presente em cada poço, e que os poços individuais estão alinhados dentro das áreas de observação que foram definidas nas etapas 2.1.5 e 2.1.6.
- Clique no "experimento | Execute".
Nota: O sistema solicitará que o usuário forneça um nome e um local para salvar os dados de observação. - Uma vez o nome e o local de observação de dados foram especificados, clique no ícone "Várias imagens ao vivo" para destacar todas as áreas de visualização predefinidos
Nota: Este ícone está localizado na parte superior da tela do computador e aparece como uma caixa dividida em quatro quadrados menores. Ao clicar neste ícone irá destacar todas as áreas de visualização predefinidos. - Feche o painel da câmara de gravação e clique em "plano de fundo | Start"no monitor do computador.
4. análise de dados comportamentais
- Para recuperar dados de atividade de larvas de peixes, abra a planilha, que é compilada automaticamente pelo software de rastreamento e é na pasta especificada pelo usuário antes de iniciar ensaios comportamentais (passo 3.4).
- Consulte figura 1A e 1B para medições representativas de ingênuo atividade locomotora de zebrafish não exposto e larvas de peixe cabeçudo, respectivamente. Consulte números 1 e 1 D para cálculos de PMR, que efetivamente analisar a magnitude da diferença de movimento entre transições de luz escura ou escuro para a luz.
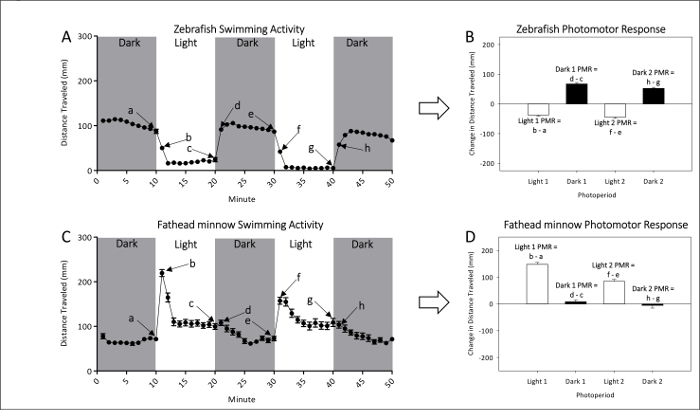
Figura 1: Exemplo de actividade de base de zebrafish não exposto (A e B) e peixinho de cabeção (C e D). A distância média (± SEM) nadou para zebrafish (A) e peixinho cabeção (C) é dada por pontos, cada representando intervalos de um minuto de atividade. Medem-se duas escuro e dois períodos de luz de photomotor respostas. A última (a, c, e e g) e primeiro (b, d, f e h) minutos de cada fotoperíodo são usados para calcular PMRs. Photomotor respostas de zebrafish (B) e peixinho cabeção (D) é medidos como a mudança na média (±SEM) distância percorrida entre o último minuto de um fotoperíodo inicial e o primeiro minuto do período seguinte. Clique aqui para ver uma versão maior desta figura.
Resultados
Níveis de tratamento de cafeína não variou sensivelmente durante os experimentos de 96 h com peixinhos zebrafish e cabeçudo. Por exemplo, a tabela 1 apresenta analiticamente verificadas concentrações de cada nível de tratamento. Este protocolo verificado amostras de água para os níveis de tratamento de cafeína por diluição isotópica cromatografia líquida em tandem espectrometria de massas (LC-MS/MS) geralmente seguindo métodos anteriormente relatados28. A formação de Paraxantina, o metabólito primário de cafeína, também foi quantificada. Uma descrição desses procedimentos analíticos constam as informações analíticas complementares. Por causa das semelhanças entre verificação nominal e analítica dos tratamentos, os níveis de tratamento nominal são apresentados durante o restante deste manuscrito. Cafeína significativamente alterados comportamentos de vairão zebrafish e cabeçudo. No entanto, o zebrafish locomotor respostas foram consistentemente mais sensíveis à cafeína do que os peixinhos de cabeção. Os pontos de extremidade comportamentais mais sensíveis para larvas de peixe zebrafish e cabeção foram afetados pela cafeína com uma concentração de 0,039 mg/L. tabela 2 resume a concentrações de menor efeito observável (LOECs) e concentrações sem efeito observado (NOECs) para cada ponto de extremidade comportamental em ambos os modelos de peixe.
| Zebrafish | Peixinho de cabeção | ||||
| Ponto de extremidade | LOEC (mg/L) | NOEC (mg/L) | Ponto de extremidade | LOEC (mg/L) | NOEC (mg/L) |
| Distância total escuro | 0.412 | 0.039 | Distância total escuro | − | 56.38 |
| Distância total de luz | 48.46 | 4.07 | Distância total de luz | − | 56.38 |
| Contagem total escuro | 0.412 | 0.039 | Contagem total escuro | − | 56.38 |
| Contagem total de luz | 48.46 | 4.07 | Contagem total de luz | − | 56.38 |
| Estourando a distância escuro | − | 193.82 | Estourando a distância escuro | − | 56.38 |
| Estourando a luz de distância | 193.82 | 48.46 | Estourando a luz de distância | − | 56.38 |
| Estourando conta escuro | 193.82 | 48.46 | Estourando conta escuro | − | 56.38 |
| Estourando a conta de luz | 193.82 | 48.46 | Estourando a conta de luz | − | 56.38 |
| Estourando a duração escuro | 193.82 | 48.46 | Estourando a duração escuro | − | 56.38 |
| Estourando a luz de duração | − | 193.82 | Estourando a luz de duração | − | 56.38 |
| Cruzeiro distância escuro | 0.412 | 0.039 | Cruzeiro distância escuro | − | 56.38 |
| Cruzeiro luz de distância | 48.46 | 4.07 | Cruzeiro luz de distância | − | 56.38 |
| Cruzeiro conta escuro | 0.412 | 0.039 | Cruzeiro conta escuro | − | 56.38 |
| Cruzeiro de contagens de luz | 48.46 | 4.07 | Cruzeiro de contagens de luz | − | 56.38 |
| Cruzeiro duração escuro | 0.412 | 0.039 | Cruzeiro duração escuro | − | 56.38 |
| Cruzeiro de duração de luz | 48.46 | 4.07 | Cruzeiro de duração de luz | − | 56.38 |
| Congelando a distância escuro | 0.412 | 0.039 | Congelando a distância escuro | 0.039 | 0.001 |
| Congelamento de distância de luz | 0.039 | 0.001 | Congelamento de distância de luz | − | 56.38 |
| Congelamento conta escuro | 0.412 | 0.039 | Congelamento conta escuro | − | 56.38 |
| Congelamento de contagens de luz | 48.46 | 4.07 | Congelamento de contagens de luz | − | 56.38 |
| Congelamento duração escuro | − | 193.82 | Congelamento duração escuro | 56.38 | 14.10 |
| Congelamento duração luz | 48.46 | 4.07 | Congelamento duração luz | − | 56.38 |
| Escuro 1 PMR | 48.46 | 4.07 | Escuro 1 PMR | 0.039 | 0.001 |
| Luz 1 PMR | 48.46 | 4.07 | Luz 1 PMR | − | 56.38 |
| PMR 2 escuro | 48.46 | 4.07 | PMR 2 escuro | − | 56.38 |
| Leve 2 PMR | 48.46 | 4.07 | Leve 2 PMR | − | 56.38 |
| Estourando o escuro 1 PMR | − | 193.82 | Estourando o escuro 1 PMR | − | 56.38 |
| Estourando a luz 1 PMR | − | 193.82 | Estourando a luz 1 PMR | − | 56.38 |
| Estourando o escuro 2 PMR | 193.82 | 48.46 | Estourando o escuro 2 PMR | − | 56.38 |
| Estourando a luz 2 PMR | − | 193.82 | Estourando a luz 2 PMR | − | 56.38 |
| Cruzeiro escuro 1 PMR | 48.46 | 4.07 | Cruzeiro escuro 1 PMR | − | 56.38 |
| Cruzeiro de luz 1 PMR | 48.46 | 4.07 | Cruzeiro de luz 1 PMR | − | 56.38 |
| Cruzeiro escuro 2 PMR | 48.46 | 4.07 | Cruzeiro escuro 2 PMR | − | 56.38 |
| Cruzeiro de luz 2 PMR | 193.82 | 48.46 | Cruzeiro de luz 2 PMR | 56.38 | 14.10 |
| Congelamento escuro 1 PMR | 48.46 | 4.07 | Congelamento escuro 1 PMR | − | 56.38 |
| Congelamento de luz 1 PMR | 193.82 | 48.46 | Congelamento de luz 1 PMR | − | 56.38 |
| Congelamento escuro 2 PMR | 48.46 | 4.07 | Congelamento escuro 2 PMR | − | 56.38 |
| Congelamento de luz 2 PMR | 193.82 | 48.46 | Congelamento de luz 2 PMR | − | 56.38 |
Tabela 2: vairão Zebrafish e cabeção NOECs comportamentais e LOECs para cafeína. Sem concentração de efeito observado (CSEO) e valores mais baixos observados efeito concentração (LOEC) (mg/L) para cada luz/escuro nadando atividade endpoints e photomotor respostas para os peixinhos zebrafish e cabeção expostos à cafeína. Traços indicam que não há efeitos foram observados em um determinado ponto de extremidade em todos os níveis de tratamento.
A Figura 2 apresenta atividade locomotora total e PMRs de zebrafish e cabeção peixinho após a exposição de 96 h a cafeína. Larvas de peixe cabeçudo que PMRs foram alterados por cafeína a tratamento níveis inferiores (0,038 mg/L) zebrafish, mas um número consideravelmente maior de photomotor pontos de extremidade foram afetadas no zebrafish. O mais alto nível de tratamento de cafeína (193,82 mg/L) alterado PMR no zebrafish, em que estas respostas foram exatamente o oposto de controles. A este nível elevado de tratamento, no entanto, PMRs diminuíram no escuro e aumentaram em condições de luz.

Figura 2: Atividade de natação e photomotor respostas de zebrafish (A e B) e peixinho de cabeção (C e D) após a exposição de 96 h a cafeína. A distância média (± SEM) nadou para zebrafish (A) e peixinho cabeção (C) é dada por pontos, cada representando intervalos de 1 min de atividade. Photomotor respostas de zebrafish (B) e peixinho cabeção (D) são medidas como a mudança na média (± SE) total distância percorrida entre o last minutes de um fotoperíodo inicial e o primeiro minuto do período seguinte. Dois escuro e duas respostas de luz photomotor período foram medidas. Um total de 24 zebrafish (4 repetições cada de 6 larvas) e 12 (3 repetições cada de 4 larvas) peixinhos cabeção foram usados para observação comportamental. p < 0,10; p < 0,05; p < 0,01. Clique aqui para ver uma versão maior desta figura.
Além de medir o larvas PMRs, clara e escura de atividade locomotora foi analisada através de três limites de velocidade para a distância movida, número de movimentos e duração dos movimentos. Este dados são utilizados para desenvolver perfis de resposta comportamental de cafeína (Figura 3, suplementar , Figura 1). Em ambos os modelos de peixes, atividade de cafeína inibida em tudo significativamente afetados pontos de extremidade do aparelho locomotoras. Ambos os peixes modelos demonstraram aumento da atividade com os limites de velocidade ruptura após a exposição a cafeína, embora não significativamente. Semelhante aos resultados das observações PMR, cafeína efetuado um maior número de pontos de extremidade locomotor zebrafish. Na verdade, a cafeína significativamente alterados várias respostas locomotoras em condições escuras em níveis ambientalmente realistas abaixo a THV. No entanto, atividade locomotora de fathead minnow não foi significativamente afetada sob condições de luz por qualquer nível de tratamento.

Figura 3: perfis de resposta de larvas peixinhos zebrafish e cabeção após exposição de 96 h para cafeína. Quer dizer zebrafish escuro (A) e luz (B) natação atividade comparada para significar peixinho cabeção escuro (C) e atividade de luz (D) após a exposição de 96 h a cafeína. Plotados dados representa a atividade mais dois fotoperíodos escuro de 10 min e dois fotoperíodos de luz de 10 min para cada modelo de peixe. Dados são normalizados para o controle, que é representado no eixo 0 em cada figura. Parâmetros comportamentais incluem distância atravessou nadando, número de movimentos (contagem) e a duração de cada movimento 3 níveis de velocidade, estourando (> 20 mm/s), cruzeiro (5-20 mm/s) e congelamento (< 5 mm/s). Para além de padrões de movimento em cada um dos limiares de velocidade, distância total nadou, e o número total de movimentos é representado. ↑ representa um aumento significativo na atividade em comparação com o controle e ↓ indica uma diminuição significativa na atividade em comparação com o controle. Um total de 24 zebrafish (4 repetições cada de 6 larvas) e 12 (3 repetições cada de 4 larvas) peixinho bobo quando utilizados em observações comportamentais para cada grupo. p < 0,10; p < 0,05; p < 0,01. Clique aqui para ver uma versão maior desta figura.
Suplementar Figura 1: Photomotor respostas de zebrafish (A e B) e peixinho de cabeção (C e D) através de três limites de velocidade. Zebrafish (A, B e C) e fathead minnow larvas (D, E e F) photomotor respostas através de três limites de velocidade (congelamento: 20 mm/s) após a exposição de 96hr a cafeína. Photomotor respostas de zebrafish e fathead minnow são medidas como a mudança na média (±SE) total distância percorrida entre o last minutes de um fotoperíodo inicial e o primeiro minuto do período seguinte. Dois escuro e duas respostas de luz photomotor período foram medidas. Um total de 24 zebrafish (4 repetições cada de 6 larvas) e 12 (3 repetições de 4 larvas) peixinhos cabeção foram usados para observação comportamental. * p < 0,01 , por favor clique aqui para baixar este arquivo.
Discussão
Ao selecionar os níveis de tratamento químico para estudos de toxicologia comportamental, vários fatores devem ser considerados. Níveis de tratamento de cafeína no presente estudo foram selecionados com base em valores superiores ao percentil para cenários de exposição ambiental prevista de águas residuais efluentes16. Quando possível, selecionamos rotineiramente níveis de tratamento para estudos de Toxicologia aquática utilizando avaliações probabilísticas exposição de observações ambientais19,20,21. Um THV, que é calculável para medicamentos, também foi incluída como um nível de tratamento no presente estudo. THV valores (EQ. 1)22,23 são definidos como as concentrações de água previsto levando a doses terapêuticas humanas (Cmax) de produtos farmacêuticos em peixes23, são inspirados de plasma inicial esforços24de modelagem e são calculado com base na química do sangue: água particionamento coeficientes (EQ. 2)25.
THV = Cmáx / log PBW (EQ. 1)
log PBW = log [(100,73. log Kow · 0.16) + 0,84] (EQ. 2)
Aqui, selecionamos também níveis subletais de tratamento em relação ao zebrafish e fathead minnow LC50 valores. Consideramos esta abordagem um procedimento de avaliação comparativa útil para respostas comportamentais, particularmente quando comparando os limiares de comportamentos específicos, com um modelo de peixe através de vários produtos químicos. Facilita ainda mais os cálculos de aguda para rácios crônicos, que podem ser útil para o diagnóstico em Toxicologia aquática para avaliações e estudos mecanicistas. Foram obtidos valores de CL50 bioensaios de toxicidade preliminar, seguindo as orientações padronizadas dadas no passo 2.1.
Neste protocolo, empregamos comuns projetos experimentais e técnicas estatísticas recomendado pela US EPA e OECD métodos padronizados para estudos de toxicologia com modelos de peixe. Embora nós relatamos p valores (EG., < 0,01, < 0.05, < 0,10), diferenças significativas (α = 0,10) em atividade, níveis são identificados entre os tratamentos, usando a análise de variância (ANOVA) se normalidade e equivalência de suposições de variância forem atendidas. Testes post hoc de Dunnett ou de Tukey HSD são realizados para identificar as diferenças de nível de tratamento. Nós selecionamos este alfa (α = 0,10) valor para reduzir erros de tipo II, particularmente para os primeiros ensaios de camada e quando uma compreensão do tamanho do efeito biologicamente importante é limitada para os pontos de extremidade comportamentais pouco estudados e de organismos modelo26, em vez de empregando os procedimentos mais comuns em ciências biomédicas para comparações múltiplas (por exemplo., correção de Bonferroni para dados de RNA-Seq)27. Futuros estudos são necessários para compreender a variabilidade dessas respostas comportamentais e potencialmente modificar desenhos experimentais (por exemplo, aumento de replicação) em conformidade.
Uma série de fatores pode influenciar o comportamento dos peixes larvas, além de exposição a substâncias químicas. Por exemplo, hora do dia, idade, tamanho bem, temperatura, condições de iluminação e volume de solução de exposição em cada bem representam importantes considerações11,30. Por estas razões, devem ser tomadas precauções para minimizar os efeitos de fatores externos que podem influenciar o comportamento locomotor do peixe larval durante a experimentação. Observações comportamentais devem ser realizadas em janelas de tempo estreita (3 a 4 h) e em períodos de tempo em tempo dos efeitos de dia deverão ter influência mínima sobre comportamento locomotor larval11. Além disso, peixes larvas devem ser mantidos a uma temperatura consistente (28 ± 1 ° C para zebrafish) e 24 ± 1 ° C para FHM e por um ciclo claro/escuro definido nas incubadoras com temperatura controlada durante todo o período de exposição. Além disso, a temperatura do laboratório onde os comportamentos são registrados deve ser mantida para condições de aproximar as condições experimentais para evitar influências de temperatura em comportamentos. Além disso, poços usados durante observações comportamentais devem ser mantidos em um volume consistente para cada peixe individual.
Embrionário e larvar zebrafish que PMRs foram usados anteriormente em ciências biomédicas para identificar alvos terapêuticos para romance compostos,12,13. Este protocolo expande pesquisa comportamental anterior com zebrafish utilizando 38 pontos de extremidade para investigar a bioatividade química dos contaminantes ambientais. Embora a cafeína é um contaminante comum aquático com um mecanismo compreendido de ação (MoA), muitos compostos no comércio faltam dados importantes mecanicistas. Portanto, este protocolo pode ser empregado para ganhar a introspecção de MoAs para compostos faltando dados de toxicidade, incluindo produtos químicos comerciais39. Além disso, o protocolo fornece métodos para dois dos modelos de peixes mais comumente usados. Conforme observado anteriormente, considerando o zebrafish é um modelo biomédico peixe comum que está se tornando cada vez mais popular em ecotoxicologia, o fathead minnow é comumente usado como um modelo ecológico para aplicações de avaliação ambiental, mas recebeu comparativamente menos atenção em estudos comportamentais com sistemas automatizados, em comparação com o peixe-zebra. Embora não ainda não há nenhum métodos padronizados regulamentares para estudos de toxicologia comportamental de peixes, este protocolo fornece uma abordagem para suportar os esforços futuros.
Cafeína suscitou respostas comportamentais em cada um dos modelos de peixes em níveis que foram detectados no ambiente aquático16. Rodriguez-Gil et al . 2018 desenvolvido distribuições de exposição ambiental global em sistemas aquáticos com base nos valores medidos de cafeína16. Especificamente, 95% das concentrações efluentes de águas residuais previsto cairia abaixo as LOECs para os pontos de extremidade comportamentais mais sensíveis de zebrafish e fathead minnow no presente estudo (tabela 2). Embora vários efeitos comportamentais de cafeína foram observados no zebrafish (particularmente em condições escuras) em níveis ambientalmente relevantes, não está claro se essas modificações comportamentais podem ocorrer nas populações naturais de peixes ou resultar em ecologicamente importantes resultados adversos. Embora útil para fins de seleção sensível, diagnóstico, limiares comportamental de larvas de peixes podem não ser representativa de outras fases da história de vida ou de peixe em populações naturais. Uma pesquisa mais adicional é garantida para determinar se semelhante limiares de resposta comportamental que ocorre na natureza e ser indicativo de resultados adversos nos níveis de organização biológica indivíduo ou população.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Suporte para este estudo foi fornecido pelo US National Science Foundation (projeto #:-1339637) com o apoio adicional da Agência de proteção ambiental dos Estados Unidos. Agradecemos o Dr. Jone Corrales, Dr. Lauren Kristofco, Gavin Saari, Samuel Haddad, Bekah Burket e Bridgett Hill para suporte geral do laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| ViewPoint Zebrabox | ViewPoint | ZebraLab and ZebraLab platform for automated behavioral observations | |
| Caffeine | Sigma-Aldrich | C0750-100G | Study chemical |
| Incubator | VWR | 9110589 | Maintains light/dark cycle and temperature for fathead minnow experiments |
| Incubator | Thermo Fisher Scientific | 35824-636 | Maintains light/dark cycle and temperature for zebrafish experiments |
| 100 mL glass beakers | VWR | 89000-200 | Zebrafish exposure chambers |
| 500 mL glass beakers | Pyrex | EW-34502-03 | Fathead minnow exposure chambers |
| 5,000 µL auto-pipette | Eppendorf | Research 5000 | Used to fill individual wells in well plates |
| Transfer Pippettes | VWR | 414-004-004 | Used to transfer study organisms |
| 48-well plates | Fisher Scientific | 08-772-52 | Larval zebrafish behavioral recording chambers |
| 24-well plates | VWR | 10062-896 | Larval fathead minnow behavioral recording chambers |
| Calcium sulfate dihydrate | Sigma-Aldrich | C3771 | For reconstituted hard water |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | For reconstituted hard water |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | For reconstituted hard water |
| Potassium Chloride | Sigma-Aldrich | P9333 | For reconstituted hard water |
| z-mod recirculating system | Marine Biotech Systems | Recirculating system to maintian zebrafish cultures | |
| Statistical analysis software | Sigma Plot | Version 13.0 | Used to analyze beahvioral data and produce figures |
| Statistical analysis software | Graphpad Prism | Prism 5 | Used to produce figures |
| Autosampler/quaternary pumping system | Agilent Technologies | Infinity 1260 model | Analytical verification of caffeine treatment levels |
| Jet stream thermal gradient electrospray ionization source | Agilent Technologies | Analytical verification of caffeine treatment levels | |
| Triple quadrupole mass analyzer | Agilent Technologies | Model 6420 | Analytical verification of caffeine treatment levels |
| 10 cm × 2.1 mm Poroshell 120 SB-AQ column (120Å, 2.7) | Agilent Technologies | 685775-914T | Caffiene chromatography |
| MassHunter Optimizer Software | Agilent Technologies | Determine the ionization mode, monitored transitions, and instrumental parameters for caffeine/caffeine-d9 and paraxanthine/paraxanthine-d6 |
Referências
- Malaj, E., et al. Organic chemicals jeopardize the health of freshwater ecosystems on the continental scale. Proceedings of the National Academy of Sciences. 111 (26), 9549-9554 (2014).
- Schäfer, R. B., Kühn, B., Malaj, E., König, A., Gergs, R. Contribution of organic toxicants to multiple stress in river ecosystems. Freshwater Biology. 61 (12), 2116-2128 (2016).
- Andersen, M. E., Krewski, D. Toxicity testing in the 21st century: bringing the vision to life. Toxicological Sciences. 107 (2), 324-330 (2008).
- Rovida, C., Hartung, T. Re-evaluation of animal numbers and costs for in vivo tests to accomplish REACH legislation requirements for chemicals-a report by the transatlantic think tank for toxicology (t (4)). Altex. 26 (3), 187-208 (2009).
- Council, N. R. . Toxicity testing in the 21st century: a vision and a strategy. , (2007).
- Mehta, G., Hsiao, A. Y., Ingram, M., Luker, G. D., Takayama, S. Opportunities and challenges for use of tumor spheroids as models to test drug delivery and efficacy. Journal of Controlled Release. 164 (2), 192-204 (2012).
- Scholz, S., Fischer, S., Gündel, U., Küster, E., Luckenbach, T., Voelker, D. The zebrafish embryo model in environmental risk assessment-applications beyond acute toxicity testing. Environmental Science and Pollution Research. 15 (5), 394-404 (2008).
- Fraysse, B., Mons, R., Garric, J. Development of a zebrafish 4-day embryo-larval bioassay to assess toxicity of chemicals. Ecotoxicology and Environmental Safety. 63 (2), 253-267 (2006).
- Noyes, P. D., Haggard, D. E., Gonnerman, G. D., Tanguay, R. L. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants. Toxicological Sciences. 145 (1), 177-195 (2015).
- Colón-Cruz, L., et al. Alterations of larval photo-dependent swimming responses (PDR): New endpoints for rapid and diagnostic screening of aquatic contamination. Ecotoxicology and Environmental Safety. 147, 670-680 (2018).
- Kristofco, L. A., et al. Age matters: developmental stage of Danio rerio larvae influences photomotor response thresholds to diazinion or diphenhydramine. Aquatic Toxicology. 170, 344-354 (2016).
- Rihel, J., et al. Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation. Science. 327 (5963), 348-351 (2010).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nature Chemical Biology. 6 (3), 231-237 (2010).
- Bruton, T., Alboloushi, A., DeL a Garza, B., Kim, B. -. O., Halden, R. U. . Contaminants of Emerging Concern in the Environment: Ecological and Human Health Considerations. , 257-273 (2010).
- Woudenberg, A. B., et al. Zebrafish embryotoxicity test for developmental (neuro) toxicity: Demo case of an integrated screening approach system using anti-epileptic drugs. Reproductive Toxicology. 49, 101-116 (2014).
- Rodríguez-Gil, J., Cáceres, N., Dafouz, R., Valcárcel, Y. Caffeine and paraxanthine in aquatic systems: Global exposure distributions and probabilistic risk assessment. Science of the Total Environment. 612, 1058-1071 (2018).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Kristofco, L. A., Brooks, B. W. Global scanning of antihistamines in the environment: Analysis of occurrence and hazards in aquatic systems. Science of the Total Environment. 592, 477-487 (2017).
- Saari, G. N., Scott, W. C., Brooks, B. W. Global assessment of calcium channel blockers in the environment: Review and analysis of occurrence, ecotoxicology and hazards in aquatic systems. Chemosphere. , (2017).
- Corrales, J., et al. Toward the Design of Less Hazardous Chemicals: Exploring Comparative Oxidative Stress in Two Common Animal Models. Chemical Research in Toxicology. 30 (4), 893-904 (2017).
- Berninger, J. P., et al. Effects of the antihistamine diphenhydramine on selected aquatic organisms. Environmental Toxicology and Chemistry. 30 (9), 2065-2072 (2011).
- Brooks, B. W. Fish on Prozac (and Zoloft): ten years later. Aquatic Toxicology. 151, 61-67 (2014).
- Huggett, D., Cook, J., Ericson, J., Williams, R. A theoretical model for utilizing mammalian pharmacology and safety data to prioritize potential impacts of human pharmaceuticals to fish. Human and Ecological Risk Assessment. 9 (7), 1789-1799 (2003).
- Fitzsimmons, P. N., Fernandez, J. D., Hoffman, A. D., Butterworth, B. C., Nichols, J. W. Branchial elimination of superhydrophobic organic compounds by rainbow trout (Oncorhynchus mykiss). Aquatic Toxicology. 55 (1-2), 23-34 (2001).
- Scheiner, S. M., Gurevitch, J. . Design and Analysis of Ecological Experiments. , (2001).
- Nakagawa, S. A farewell to Bonferroni: the problems of low statistical power and publication bias. Behavioral Ecology. 15 (6), 1044-1045 (2004).
- Bean, T. G., et al. Pharmaceuticals in water, fish and osprey nestlings in Delaware River and Bay. Environmental Pollution. 232, 533-545 (2018).
- Richendrfer, H., Pelkowski, S., Colwill, R., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behavioural Brain Research. 228 (1), 99-106 (2012).
- Padilla, S., Hunter, D., Padnos, B., Frady, S., MacPhail, R. Assessing locomotor activity in larval zebrafish: Influence of extrinsic and intrinsic variables. Neurotoxicology and Teratology. 33 (6), 624-630 (2011).
- Sukardi, H., Chng, H. T., Chan, E. C. Y., Gong, Z., Lam, S. H. Zebrafish for drug toxicity screening: bridging the in vitro cell-based models and in vivo mammalian models. Expert Opinion on Drug Metabolism & Toxicology. 7 (5), 579-589 (2011).
- Ankley, G. T., Villeneuve, D. L. The fathead minnow in aquatic toxicology: past, present and future. Aquatic Toxicology. 78 (1), 91-102 (2006).
- Hutson, L. D., Liang, J. O. Making an impact: zebrafish in education. Zebrafish. 6, 119 (2009).
- Hutson, L. D., Liang, J. O., Pickart, M. A., Pierret, C., Tomasciewicz, H. G. Making a difference: education at the 10th international conference on zebrafish development and genetics. Zebrafish. 9 (4), 151-154 (2012).
- Kane, A., Salierno, J., Brewer, S. Fish models in behavioral toxicology: automated techniques, updates and perspectives. Methods in Aquatic Toxicology. 2, 559-590 (2005).
- Rodriguez, A., et al. ToxTrac: a fast and robust software for tracking organisms. Methods in Ecology and Evolution. 9 (3), 460-464 (2018).
- Hamm, J., Wilson, B., Hinton, D. Increasing uptake and bioactivation with development positively modulate diazinon toxicity in early life stage medaka (Oryzias latipes). Toxicological Sciences. 61 (2), 304-313 (2001).
- Kristofco, L. A., Haddad, S. P., Chambliss, C. K., Brooks, B. W. Differential uptake of and sensitivity to diphenhydramine in embryonic and larval zebrafish. Environmental Toxicology and Chemistry. 37, 1175-1181 (2018).
- Steele, W. B., Kristofco, L. A., Corrales, J., Saari, G. N., Haddad, S. P., Gallagher, E. P., Kavanagh, T. J., Kostal, J., Zimmerman, J. B., Voutchkova-Kostal, A., Anastas, P. T., Brooks, B. W. Comparative behavioral toxicology of two common larval fish models: exploring relationships between modes of action and locomotor responses. Science of the Total Environment. 460-461, 1587-1600 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados