Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Y pruebas biológicas No opción para estudiar la preferencia de pupación y emergencia éxito de Ectropis grisescens
En este artículo
Resumen
Aquí, presentamos un protocolo para investigar la preferencia de pupación de las larvas maduras de Ectropis grisescens en respuesta a factores del suelo (p. ej., contenido de humedad y tipo de sustrato) utilizando bioensayos de elección. También presentamos un protocolo de pruebas biológicas no opción para determinar los factores que afectan los comportamientos de pupación y supervivencia de E. grisescens.
Resumen
Muchos insectos viven sobre el suelo como larvas y adultos y como forman pupas bajo la tierra. En comparación con las etapas sobre el suelo de sus ciclos de vida, menos atención se ha prestado en afectan factores ambientales cómo estos insectos cuando ellos pupan en el suelo. El lazador de té, Ectropis grisescens Warren (Lepidoptera: Geometridae), es una grave plaga de las plantas de té y ha causado grandes pérdidas económicas en el sur de China. Los protocolos descritos aquí tienen por objeto investigar, a través de pruebas biológicas de selección múltiples, si maduro último instar las larvas de E. grisescens pueden discriminar variables de suelo como el contenido de humedad y tipo de sustrato y determinar, a través de la opción de no bioensayos, el impacto de los contenidos de tipo y humedad de sustrato en comportamientos de pupación y el éxito de la aparición de E. grisescens. Los resultados podrían mejorar la comprensión de la ecología de pupas de E. grisescens y pueden traer penetraciones en tácticas de manejo de suelo para suprimir las poblaciones de E. grisescens . Además, estas pruebas biológicas pueden ser modificados para estudiar las influencias de diversos factores en los comportamientos de pupación y supervivencia de plagas suelo pupating.
Introducción
En comparación con las etapas de larvas y adultos de insectos, la etapa pupal es altamente vulnerable debido a la limitada capacidad móvil de pupas, que no puede escapar rápidamente de situaciones peligrosas. Pupating debajo de la tierra es una estrategia común usada por diversos grupos de insectos (por ejemplo, en los órdenes Diptera1,2,3,4,5de coleópteros, himenópteros6, Thysanoptera7y lepidópteros8,9,10,11,12) para protegerlos de los depredadores sobre la tierra y los peligros ambientales. Muchos de ellos están graves agrícola y forestal plagas1,2,3,4,5,6,7,8 ,9,10,11,12. Las larvas maduras de estos insectos de suelo pupating generalmente dejan sus anfitriones, caen al suelo, pasear para encontrar un sitio apropiado, madriguera en el suelo y construir una cámara pupal de pupating8,10.
El lazador de té, Ectropis grisescens Warren (Lepidoptera: Geometridae), es una de las más importantes plagas de defoliador del té Camellia sinensis L.13de la planta. Aunque esta especie primero fue descrita en 1894, ha sido erróneamente identificado como Ectropis obliqua Prout (Lepidoptera: Geometridae) en el pasado décadas14,15. Las diferencias en la morfología, biología y distribución geográfica entre las dos especies de hermano se han descrito en algunos estudios recientes14,15,16. Por ejemplo, Zhang et al. 15 informó que E. oblicuo se produjo principalmente en las fronteras de tres provincias (Anhui, Jiangsu y Zhejiang) de China, mientras que E. grisescens tiene una distribución mucho más amplia en comparación con oblicua e. Por lo tanto, las pérdidas económicas causadas por E. grisescens son pasados por alto en gran parte, y el conocimiento de esta plaga debe revisarse exhaustivamente y renovado16,17,18,19 . Nuestros estudios anteriores demostraron que E. grisescens prefieren pupar en el suelo pero podría también pupate cuando el suelo no está disponible (condiciones de sustrato de pupación no)11,12.
Este artículo proporciona un procedimiento paso a paso (1) determinar la preferencia de pupas de E. grisescens en respuesta a factores como el tipo de sustrato y humedad mediante el uso de pruebas biológicas de selección múltiples de contenido y (2) determinar el impacto de factores abióticos en las conductas de pupación y éxito de la aparición de E. grisescens utilizando bioensayos de elección no. Todas estas pruebas biológicas se llevan a cabo bajo condiciones de laboratorio bien controladas. Además, se adaptan estos bioensayos para evaluar la influencia de otros factores sobre los comportamientos de pupación y supervivencia de diversos insectos de suelo pupating.
Protocolo
1. humedad-opción pruebas biológicas para determinar preferencia de pupas de E. grisescens
-
Obtención de larvas de último estadio Maduritas de E. grisescens
- Cortar brotes frescos (30-40 cm de longitud) de las plantas de té (Camellia sinensis L.). Inserte los brotes de 25-30 en un matraz de 250 mL triangular. Llene el frasco con agua del grifo. Poner 3-4 frascos (con brotes de té) en un recipiente plástico (parte superior: 51 cm de diámetro, parte inferior: 40 cm de diámetro, altura: 16 cm).
- Liberar larvas de 1.000-2.000 (segundo a quinto instar) de la Colonia del laboratorio de E. grisescens sobre las hojas de los brotes de té en cada cuenca. Mantener estas larvas en condiciones controladas de laboratorio [un fotoperíodo de 14 h de luz seguido por 10 h de oscuridad (14:10 l:), 60-90% humedad relativa (HR) y 24-28 ° C]. Cuidadosamente transfiera las larvas en hojas frescas a mano cada 1-2 d. Cada día Retire las heces y residuos de la parte inferior de las cuencas.
- Seleccionadas último instar las larvas maduras que caen de las hojas de los brotes de té y pasear activamente en la parte inferior de la cuenca. Obtener por lo menos 240 larvas maduras para asegurar que suficientes larvas están disponibles para los bioensayos.
Nota: Seleccione sólo larvas activamente errantes para los experimentos. No seleccione las larvas que permanecen en las hojas, porque éstos no están listos para pupar. Además, no seleccione prepupas con actividades móviles limitadas porque ellos no activamente buscará las condiciones adecuadas después de ser lanzado en las arenas de bioensayo.
-
Preparación del sustrato
- Colectar e identificar 4 tipos de sustrato (por ejemplo, arena, marga arena 1, arena 2 de Marga y Marga del légamo) utilizando el método de hidrómetro20. Esterilizar el suelo y la arena en un horno de 80 ° C secador de > 3 d y después secar completamente la tierra y la arena a 50 ° C durante varias semanas hasta que el peso seco de las muestras de sustrato no cambia ya con el tiempo.
- Suelo seco suelo con morteros y morteros de madera. Cernir la arena y el suelo conectada a tierra a través de un tamiz de 3 mm y almacenarlas en bolsas de plástico con cierre hermético.
- Calcular los diferentes contenidos de humedad de cada sustrato (Marga arenosa, arena 1, arena 2 de Marga o marga del légamo) son las siguientes2:
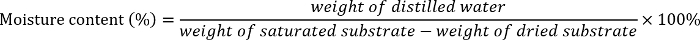
- Añada la cantidad necesaria de agua destilada en las sellables bolsas de plástico que contiene el suelo seco o arena para preparar 5%-20%-35%, 50%, 65% y 80% de humedad sustrato. Mezclar bien el agua y el suelo o la arena.
-
Preparación de arena de bioensayo
- Dividir igualmente los envases de polipropileno (parte superior: 20,0 cm de largo x 13,5 cm de ancho, parte inferior: 17,0 cm de longitud x 10,0 cm de ancho, altura: 6.5cm) en 6 cámaras con hojas resistente al agua cloruro de polivinilo (PVC) (altura: 3,5 cm). Fijar las láminas de PVC y sellar las grietas usando pegamento caliente.
Nota: Selle completamente ningún crack para evitar penetración de agua. - Para cada prueba, llene las 6 cámaras con el mismo tipo de sustrato de diferentes contenidos de humedad (5%-20%-35%-50%, 65% y 80% humedad) (Figura 1a).
Nota: Utilice sólo 1 tipo de sustrato de diferentes contenidos de humedad en cada prueba. Asignar al azar el orden de las cámaras que contienen el sustrato con el contenido de humedad de 6. - Pasta 4-6 piezas de hojas de té frescas usando pequeños trozos de cinta para cubrir la superficie interna de las tapas de los envases de polipropileno (Figura 1b).
- Dividir igualmente los envases de polipropileno (parte superior: 20,0 cm de largo x 13,5 cm de ancho, parte inferior: 17,0 cm de longitud x 10,0 cm de ancho, altura: 6.5cm) en 6 cámaras con hojas resistente al agua cloruro de polivinilo (PVC) (altura: 3,5 cm). Fijar las láminas de PVC y sellar las grietas usando pegamento caliente.

Figura 1: ejemplos de arenas de prueba para las pruebas de elección. (un) resistente al agua hojas de cloruro de polivinilo (PVC) se utilizan para dividir igualmente los contenedores de polipropileno en 6 cámaras. Láminas de PVC se fijan con pegamento caliente, y grietas están selladas cuidadosamente. En este ejemplo, Franco arenoso 2 con diferentes contenidos de humedad (5%, 20%, 35%, 50%, 65% y 80% de humedad) se utilizan para llenar las cámaras de las órdenes asignadas al azar. (b) fresco té de hojas se pegan en la cara interna de los párpados donde la madura Ectropis grisescens larvas se liberarán. (c) PVC hojas se utilizan para dividir igualmente los contenedores de polipropileno en 4 compartimientos, que se llenan con 4 tipos de sustratos (Marga arenosa, arena 1, arena 2 de Marga y Marga del légamo) en el 50% de humedad. Esta figura ha sido modificada de Wang et al. 11. por favor haga clic aquí para ver una versión más grande de esta figura.
-
Ajuste de prueba y registro de datos
- Liberar 30 último instar las larvas maduras (obtenidas en paso 1.1.3) en las hojas de té frescas pegadas en la tapa del envase polipropileno. Volcar con cuidado la tapa y cubrir bien el recipiente de polipropileno.
- Repetir cada prueba 8 x. Mantener las arenas de la prueba biológica en un ambiente de la cámara en un fotoperiodo de 14:10 (l:) y 26 ° C.
- El día 5, contar el número de pupas en la superficie del suelo en cada cámara. Además, desmontar las pruebas biológicas y contar el número de pupas en el sustrato.
Nota: Solo cuentan las pupas Vives sobre o dentro del sustrato. Comprobar la viabilidad de pupas observando movimientos abdominales después de tocar las pupas con unas pinzas.
-
Análisis de datos
- Para cada prueba, calcular el porcentaje de pupas encontradas en cada compartimiento de cada repetición. Transferir los datos de porcentaje a la proporción de registro utilizando el método de Kucera y Malmgren21.
- Comparar el porcentaje de pupas (datos transformados) en cada cámara mediante un análisis de varianza unidireccional (ANOVA). Definir los niveles de significación en el α = 0.05 para cada prueba.
2. elección de sustrato pruebas biológicas para determinar la preferencia de pupas de E. grisescens
- Repita el paso 1.1 para obtener larvas de último estadio maduritas, y de paso 1.2 para preparar el sustrato con diferentes contenidos de humedad. Esta vez, se necesitan sustrato sólo 20%, 50% y 80% de humedad.
-
Preparación de las arenas de bioensayo
- Similar al paso 1.3.1, dividir igualmente los contenedores de polipropileno en 4 cámaras mediante láminas de PVC. Fijar las láminas de PVC y sellar las grietas usando pegamento caliente.
- Para cada prueba, se llenan las cámaras de los 4 tipos de sustratos (Marga arenosa, arena 1, arena 2 de Marga y Marga del légamo) que tienen el mismo contenido de humedad (humedad 20%, 50% o 80%) con aleatoriamente asignan órdenes (figura 1C). Repita el paso 1.3.3 para preparar las tapas.
- Repita el paso 1.4 establecer las pruebas biológicas y grabar los datos y paso 1.5 para analizar los datos.
3. No-opción pruebas biológicas para determinar el comportamiento de madriguera en suelo y éxito de la aparición de E. grisescens
- Repita el paso 1.1 para obtener las larvas de último estadio maduritas, y de paso 1.2 para preparar los 4 substratos (Marga arenosa, arena 1, arena 2 de Marga y Marga del légamo) 3 contenido de humedad (humedad 20%, 50% y 80%).
-
Configuración de prueba
- Añadir el sustrato en un recipiente de plástico (parte superior: parte inferior lado; 11,5 cm de diámetro: 8,5 cm de diámetro, altura: 6,5 cm) a una profundidad de 3 cm. En total, aseguran que habrá 12 tratamientos (combinaciones de 4 tipos de sustrato y 3 contenido de humedad). Repetir cada tratamiento 7 x.
- Liberar larvas de último estadio Maduritas 15 sobre el sustrato de arena de cada bioensayo. Selle los contenedores firmemente cubriendo las tapas. Mantener las pruebas biológicas en un ajuste de la cámara en un fotoperiodo de 14:10 (l:) y 26 ° C.
Nota: No habrá ninguna necesidad de pegar hojas de té frescas en las tapas como se menciona en los bioensayos de elección.
-
Análisis y registro de datos
- El día 3, contar el número de pupas y cualquier larvas muertas en la superficie del sustrato de cada repetición. Calcular el porcentaje de individuos de E. grisescens que enterrada en el sustrato como sigue:
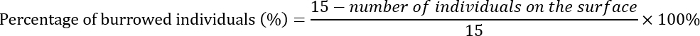
- Registrar el número de adultos emergentes cada día hasta que emergió no más adulto de 15 d. Calcule el éxito de la aparición de la siguiente manera:
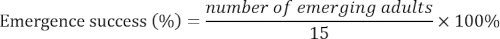
- Comparar el porcentaje de individuos enterrados y el éxito de aparición entre los tratamientos usando ANOVA unidireccional. Definir los niveles de significación en el α = 0.05.
- El día 3, contar el número de pupas y cualquier larvas muertas en la superficie del sustrato de cada repetición. Calcular el porcentaje de individuos de E. grisescens que enterrada en el sustrato como sigue:
Resultados
Los bioensayos de elección de la humedad demostraron que significativamente más individuos de E. grisescens empupado en o dentro de los 5% y 35% humedad arena comparado con la arena de 80% de humedad (Figura 2a). Sin embargo, significativamente más individuos preferían pupar en o en el suelo (Franco arenoso 1 y 2 y Marga de cieno) que tenía un contenido de humedad intermedia (figuras 2b - 2d).
Discusión
Preferencias de pupación responder a variables diferentes se han estudiado en algunas plagas6,9,,,2223. Por ejemplo, para estudiar la preferencia de las larvas maduras de Bactrocera tryoni (Froggatt) (Diptera: Tephritidae) entre diferentes condiciones de humedad, Hulthen y Clarke22 establecer un diseño de cuadro latino 3 x 3 que contiene 9 contenedores llenado...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Yuzhen Wen, Liang Shiping, Shengzhe Jian y Li Yanjun (Colegio de silvicultura y paisajismo, Universidad de agricultura de China del Sur) por su ayuda en la cría de insectos y el montaje experimental. Este trabajo fue financiado por la Fundación Nacional de Ciencias naturales de China (Grant no. 31600516), la Fundación de Ciencias naturales de Guangdong (Grant No. 2016A030310445) y la ciencia y tecnología de planificación de proyecto de la provincia de Guangdong (Grant No. 2015A020208010) .
Materiales
| Name | Company | Catalog Number | Comments |
| Triangular flask | Bomex Chemical (Shanghai) Co., LTD | 99 | 250 mL |
| Plastic basin | Chahua, Fuzhou, China | 100 | upper side: 51 cm in diameter; bottom side: 40 cm in diameter; height: 16 cm |
| Zip lock bags | Glad, Guangzhou, China | 126/133 | |
| Polypropylene containers | Youyou Plastic Factory, Taian, China | 139/155/160/161/190 | upper side: 20.0 cm [L] × 13.5 cm [W], bottom side: 17.0 cm [L] × 10.0 cm [W], height: 6.5 cm |
| Waterproof polyviny chloride sheet | Yidimei, Shanghai, China | 141 | |
| Tape | V-tech, Guangzhou, China | VT-710 | |
| Oven drier | Kexi, Shanghai, China | KXH-202-3A | |
| Environmental chamber | Life Apparatus, Ningbo, China | PSX-280H |
Referencias
- Dimou, I., Koutsikopoulos, C., Economopoulos, A. P., Lykakis, J. Depth of pupation of the wild olive fruit fly, Bactrocera (Dacus) oleae (Gmel.) (Dipt., Tephritidae), as affected by soil abiotic factors. Journal of Applied Entomology. 127 (1), 12-17 (2003).
- Chen, M., Shelton, A. M. Impact of soil type, moisture, and depth on swede midge (Diptera: Cecidomyiidae) pupation and emergence. Environmental Entomology. 36 (6), 1349-1355 (2007).
- Holmes, L. A., Vanlaerhoven, S. L., Tomberlin, J. K. Substrate effects on pupation and adult emergence of Hermetia illucens (Diptera: Stratiomyidae). Environmental Entomology. 42 (2), 370-374 (2013).
- Renkema, J. M., Cutler, G. C., Lynch, D. H., MacKenzie, K., Walde, S. J. Mulch type and moisture level affect pupation depth of Rhagoletis mendax Curran (Diptera: Tephritidae) in the laboratory. Journal of Pest Science. 84 (3), 281 (2011).
- Ellis, J. D., Hepburn, R., Luckman, B., Elzen, P. J. Effects of soil type, moisture, and density on pupation success of Aethina tumida (Coleoptera: Nitidulidae). Environmental Entomology. 33 (4), 794-798 (2004).
- Pietrantuono, A. L., Enriquez, A. S., Fernández-Arhex, V., Bruzzone, O. A. Substrates preference for pupation on sawfly Notofenusa surosa (Hymenoptera: Tenthredinidae). Journal of Insect Behavior. 28 (3), 257-267 (2015).
- Buitenhuis, R., Shipp, J. L. Influence of plant species and plant growth stage on Frankliniella occidentalis pupation behaviour in greenhouse ornamentals. Journal of Applied Entomology. 132 (1), 86-88 (2008).
- Zheng, X. L., Cong, X. P., Wang, X. P., Lei, C. L. Pupation behaviour, depth, and site of Spodoptera exigua. Bulletin of Insectology. 64 (2), 209-214 (2011).
- Wen, Y., et al. Effect of substrate type and moisture on pupation and emergence of Heortia vitessoides (Lepidoptera: Crambidae): choice and no-choice studies. Journal of Insect Behavior. 29 (4), 473-489 (2016).
- Wen, Y., et al. Soil moisture effects on pupation behavior, physiology, and morphology of Heortia vitessoides (Lepidoptera: Crambidae). Journal of Entomological Science. 52 (3), 229-238 (2017).
- Wang, H., et al. Pupation behaviors and emergence successes of Ectropis grisescens (Lepidoptera: Geometridae) in response to different substrate types and moisture contents. Environmental Entomology. 46 (6), 1365-1373 (2017).
- Wang, H., et al. No-substrate and low-moisture conditions during pupating adversely affect Ectropis grisescens (Lepidoptera: Geometridae) adults. Journal of Asia-Pacific Entomology. 21 (2), 657-662 (2018).
- Ge, C. M., Yin, K. S., Tang, M. J., Xiao, Q. Biological characteristics of Ectropis grisescens Warren. Acta Agriculturae Zhejiangensis. 28 (3), 464-468 (2016).
- Xi, Y., Yin, K. S., Tang, M. J., Xiao, Q. Geographic populations of the tea geometrid, Ectropis obliqua (Lepidoptera: Geometridae) in Zhejiang, eastern China have differentiated into different species. Acta Entomologica Sinica. 57, 1117-1122 (2014).
- Zhang, G. H., et al. Detecting deep divergence in seventeen populations of tea geometrid (Ectropis obliqua Prout) in China by COI mtDNA and cross-breeding. PloS One. 9 (6), e99373 (2014).
- Ma, T., et al. Analysis of tea geometrid (Ectropis grisescens) pheromone gland extracts using GC-EAD and GC× GC/TOFMS. Journal of Agricultural and Food Chemistry. 64 (16), 3161-3166 (2016).
- Zhang, G. H., et al. Asymmetrical reproductive interference between two sibling species of tea looper: Ectropis grisescens and Ectropis obliqua. Bulletin of Entomological Research. , (2016).
- Luo, Z. X., Li, Z. Q., Cai, X. M., Bian, L., Chen, Z. M. Evidence of premating isolation between two sibling moths: Ectropis grisescens and Ectropis obliqua (Lepidoptera: Geometridae). Journal of Economic Entomology. 110 (6), 2364-2370 (2017).
- Li, Z. Q., et al. Chemosensory gene families in Ectropis grisescens and candidates for detection of Type-II sex pheromones. Frontiers in Physiology. 8, (2017).
- Chen, L. Q. Research on structure of soil particle by hydrometer method. Environmental Science Survey. 29 (4), 97-99 (2010).
- Kucera, M., Malmgren, B. A. Logratio transformation of compositional data: a resolution of the constant sum constraint. Marine Micropaleontology. 34 (1-2), 117-120 (1998).
- Hulthen, A. D., Clarke, A. R. The influence of soil type and moisture on pupal survival of Bactrocera tryoni (Froggatt) (Diptera: Tephritidae). Australian Journal of Entomology. 45 (1), 16-19 (2006).
- Alyokhin, A. V., Mille, C., Messing, R. H., Duan, J. J. Selection of pupation habitats by oriental fruit fly larvae in the laboratory. Journal of Insect Behavior. 14 (1), 57-67 (2001).
- Torres-Muros, L., Hódar, J. A., Zamora, R. Effect of habitat type and soil moisture on pupal stage of a Mediterranean forest pest (Thaumetopoea pityocampa). Agricultural and Forest Entomology. 19 (2), 130-138 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados