Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Choix et sans choix bioessais pour étudier la préférence de nymphose et succès à l’émergence de Ectropis grisescens
Dans cet article
Résumé
Nous présentons ici un protocole afin d’étudier la préférence de nymphose des larves matures de Ectropis grisescens en réponse aux facteurs de sol (p. ex., contenu de l’humidité et du type de substrat) à l’aide de tests biologiques de choix. Nous présentons également un protocole d’essais biologiques sans choix de déterminer les facteurs qui influent sur les comportements de nymphose et la survie des E. grisescens.
Résumé
Beaucoup d’insectes vivre au-dessus du sol comme les larves et les adultes et comme se nymphose sous la terre. Par rapport aux étapes de leur cycle de vie hors-sol, moins d’attention a été payé sur l’effet de facteurs environnementaux ces insectes quand elles se nymphosent dans le sol. La fausse-arpenteuse du thé, Warren Ectropis grisescens (Lepidoptera : Geometridae), est un ravageur sévère de théiers et a causé des pertes économiques considérables en Chine du Sud. Les protocoles décrits ici visent à étudier, par le biais de tests biologiques à choix multiples, si mature dernier stade E. grisescens larves peuvent discriminer les variables du sol tels que le contenu de type et de l’humidité du substrat et déterminer, par l’intermédiaire de sans choix tests biologiques, l’impact du contenu substrat type et de l’humidité sur les comportements de nymphose et le succès à l’émergence de E. grisescens. Les résultats permettraient d’améliorer la compréhension de l’écologie de la pupaison d’e. grisescens et peuvent apporter des aperçus de tactiques de gestion des sols pour réprimer les populations d’e. grisescens . En outre, ces tests biologiques peuvent être modifiés afin d’étudier l’influence de divers facteurs sur les comportements de la nymphose et de la survie des parasites du sol-se transformer en pupe.
Introduction
Par rapport aux stades larvaires et adultes d’insectes, la chrysalide est très vulnérable en raison de la capacité limitée de mobile des nymphes, qui ne peut pas échapper rapidement à des situations dangereuses. Se transformer en pupe sous la terre est une stratégie commune utilisée par divers groupes d’insectes (par exemple, dans l’ordre des diptères1,2,3,4, Coleoptera,5,6de hyménoptères, Thysanoptera7et Lepidoptera8,9,10,11,12) pour les protéger des prédateurs au-dessus du sol et des dangers pour l’environnement. Beaucoup d'entre eux sont sévères agricole et forestier ravageurs1,2,3,4,5,6,7,8 ,9,10,11,12. Habituellement, les larves matures de ces insectes du sol-se transformer en pupe quittent leurs hôtes, tombent sur le sol, errent pour trouver un site approprié, s’enfouissent dans le sol et aménager une chambre nymphale pour poupée8,10.
La fausse-arpenteuse du thé, Warren Ectropis grisescens (Lepidoptera : Geometridae), est un des plus importants parasites effeuilleuse du thé plante Camellia sinensis L.13. Bien que cette espèce a été décrite en 1894, il a été identifié par erreur comme Ectropis obliqua Prout (Lepidoptera : Geometridae) dans le passé des décennies14,15. Les différences de morphologie, biologie et répartition géographique entre les deux espèces ont été décrites dans quelques récentes études14,15,16. Par exemple, Zhang et al. 15 signalé que E. oblique est produite principalement sur les frontières de trois provinces (Anhui, Jiangsu et Zhejiang), de la Chine, tandis qu’e. grisescens a une distribution beaucoup plus large par rapport à E. oblique. Par conséquent, les pertes économiques causées par E. grisescens sont en grande partie ignorées, et la connaissance de cet organisme nuisible doit être révisé et renouvelé le16,17,18,19 . Nos études précédentes ont montré que E. grisescens préfèrent se nymphosent dans le sol, mais pourrait aussi se transforment en pupes lorsque le sol n’est pas disponible (conditions de non-chrysalide-substrat)11,12.
Cet article fournit une procédure pas à pas (1) déterminer la préférence de la nymphose de grisescens E. en réponse à des facteurs comme le type de substrat et l’humidité de contenu à l’aide de tests biologiques à choix multiples et (2) déterminer l’impact des facteurs abiotiques sur les comportements de nymphose et succès à l’émergence de grisescens E. à l’aide de tests biologiques sans choix. Tous ces tests biologiques sont effectués dans des conditions bien contrôlées en laboratoire. En outre, ces tests biologiques sont adaptées afin d’évaluer l’influence d’autres facteurs sur les comportements de la nymphose et de la survie des divers insectes du sol-se transformer en pupe.
Protocole
1. l’humidité-choix bioessais pour déterminer une préférence nymphose grisescens E.
-
Obtention des larves de dernier stade matures de grisescens E.
- Coupez les pousses fraîches (30 à 40 cm de longueur) de plantes de thé (Camellia sinensis L.). Insérez pousses de 25-30 dans un ballon jaugé de 250 mL triangulaire. Remplir le flacon avec l’eau du robinet. Mettre 3-4 flacons (dont les pousses de thé) dans une bassine en plastique (côté supérieur : 51 cm de diamètre ; bas : 40 cm de diamètre, hauteur : 16 cm).
- Sortie 1 000-2 000 larves (le deuxième à cinquième stade larvaire) de la colonie de laboratoire de grisescens E. sur les feuilles des pousses thé dans chaque bassin. Maintenir ces larves dans des conditions contrôlées en laboratoire [une photopériode de 14 h de lumière suivie de 10 h d’obscurité (14:10 DL), 24-28 ° C et 60 à 90 % d’humidité relative (HR)]. Transvaser avec soin les larves sur les feuilles fraîches à la main tous les jours 1-2. Chaque jour enlever les excréments et les débris du fond des bassins.
- Sélectionnez des larves de dernier stade matures qui tombent des feuilles des pousses thé et activement errent sur le fond du bassin. Obtenir au moins 240 larves matures pour s’assurer que suffisamment de larves sont disponibles pour les essais biologiques.
Remarque : Sélectionnez seulement errants activement larves pour les expériences. Ne sélectionnez pas les larves qui restent sur les feuilles, car ce ne sont pas prêts pour se nymphoser. Aussi, ne sélectionnez pas prénymphes avec les activités mobiles limitées car ils pas activement recherchera les conditions appropriées après avoir été libéré dans les arènes d’essais biologiques.
-
Préparation du substrat
- Recueillir et identifier les 4 types de substrat (par exemple, sable, loam sableux 1, sable fin loam 2 et limon argileux) à l’aide de la méthode de l’hydromètre20. Stériliser le sol et le sable à 80 ° C four sécheur pour > 3 d et puis sécher complètement le sol et le sable à 50 ° C pendant plusieurs semaines jusqu'à ce que le poids sec des échantillons de substrat ne change pas plus au fil du temps.
- La masse du sol sec avec des mortiers et des pilons de bois. Tamiser le sable et le sol de la terre à travers un tamis de 3 mm et rangez-les dans des sacs en plastique refermables.
- Calculer la teneur en humidité différentes de chaque substrat (sable, sable limoneux 1, sable fin loam 2 ou limon argileux) comme suit2:
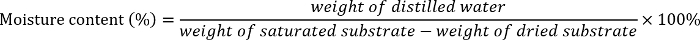
- Ajouter la quantité nécessaire d’eau distillée dans les sacs de plastique scellables contenant le sol sec ou le sable pour préparer 5 %-20 %-, 35 %-, 50 substrat %, 65 % et 80 %-humidité. Bien mélanger l’eau distillée et le sol ou le sable.
-
Préparation de biodosage arena
- Tout aussi diviser les récipients en polypropylène (face supérieure : 20,0 cm de longueur x 13,5 cm de largeur, face inférieure : 17,0 cm de longueur x 10,0 cm de largeur, hauteur : 6,5 cm) en 6 chambres avec des feuilles en polychlorure de vinyle (PVC) imperméable à l’eau (hauteur : 3,5 cm). Fixer les feuilles de PVC et sceller les fissures à l’aide de colle chaude.
NOTE : Isoler totalement une fissure, pour empêcher la pénétration de l’eau. - Pour chaque test, remplissez les 6 compartiments en utilisant le même type de substrat avec différents taux d’humidité (5 %-20 %-, 35 %-, 50 %, 65 % et 80 %-humidité) (Figure 1 a).
Remarque : Utilisez uniquement 1 type de substrats différents taux d’humidité dans chaque test. L’ordre des chambres contenant le substrat avec la teneur en humidité 6 répartissent de manière aléatoire. - Collez les 4-6 morceaux de feuilles de thé frais à l’aide de petits morceaux de ruban adhésif pour couvrir la surface intérieure des couvercles des conteneurs en polypropylène (Figure 1 b).
- Tout aussi diviser les récipients en polypropylène (face supérieure : 20,0 cm de longueur x 13,5 cm de largeur, face inférieure : 17,0 cm de longueur x 10,0 cm de largeur, hauteur : 6,5 cm) en 6 chambres avec des feuilles en polychlorure de vinyle (PVC) imperméable à l’eau (hauteur : 3,5 cm). Fixer les feuilles de PVC et sceller les fissures à l’aide de colle chaude.

Figure 1 : exemples d’arènes bioessai pour les tests à choix. (un) imperméable à l’eau feuilles de polychlorure de vinyle (PVC) sont utilisées également diviser les récipients en polypropylène en 6 chambres. Feuilles de PVC sont fixés avec de la colle chaude, et toutes les fissures sont soigneusement scellés. Dans cet exemple, loam sableux 2 avec teneur en humidité différentes (de 5 %, 20 %, 35 %, 50 %, 65 % et 80 % d’humidité) sont utilisés pour remplir les chambres dans les ordonnances aléatoirement affectées. (b) thé feuilles sont collées sur la face interne des paupières où la mature Ectropis grisescens larves sortira. (c) PVC feuilles servent également diviser les récipients en polypropylène en 4 chambres, qui sont remplis de 4 types de substrats (sable, sable limoneux 1, sable fin loam 2 et limon argileux) à 50 % d’humidité. Ce chiffre a été modifié par Wang et al. 11. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Réglage du dosage biologique et enregistrement des données
- Sortie 30 dernier stade larves matures (obtenus à l’étape 1.1.3) sur les feuilles de thé frais collés sur le couvercle du conteneur en polypropylène. Renverser délicatement le couvercle et couvrir hermétiquement le récipient en polypropylène.
- Répétition chaque test 8 x. Maintenir les arènes d’essais biologiques dans un décor de chambre environnementale à une photopériode de 14:10 (DL) et 26 ° C.
- Le jour 5, compter le nombre de nymphes sur la surface du sol dans chaque chambre. Aussi, démanteler les essais biologiques et compter le nombre de nymphes dans le substrat.
Remarque : Ne compter que les nymphes vivent sur ou dans le substrat. Vérifier la viabilité de nymphes en observant les mouvements abdominaux après avoir touché la pupe à l’aide de pinces.
-
Analyses de données
- Pour chaque test, calculer le pourcentage de nymphes trouvées dans chaque chambre de chaque répétition. Transférer les données de pourcentage pour le log-rapport à l’aide de la méthode fournie par Kucera et Malmgren21.
- Comparez le pourcentage des pupes (données transformées) dans chaque chambre à l’aide d’une analyse de variance (ANOVA). Définir les niveaux de signification à α = 0,05 pour chaque test.
2. substrat-choix des bioessais pour déterminer la préférence de nymphose de grisescens E.
- Répétez l’étape 1.1 pour obtenir les larves de dernier stade et étape 1.2 pour préparer le substrat avec différents taux d’humidité. Cette fois, seulement 20 %, 50 % et 80 % l’humidité du substrat sont nécessaires.
-
Préparation des arènes essai biologique
- Semblable à l’étape 1.3.1, tout aussi diviser les récipients en polypropylène en 4 chambres à l’aide de feuilles de PVC. Fixer les feuilles de PVC et sceller les fissures à l’aide de colle chaude.
- Pour chaque test, remplissez les compartiments les 4 types de substrats (loam sablonneux, sable 1, sable fin loam 2 et limon argileux) qui ont la même teneur en eau (humidité de 20 %, 50 % ou 80 %) avec aléatoirement assignés commandes (Figure 1C). Répétez l’étape 1.3.3 pour préparer les couvercles.
- Répétez l’étape 1.4 pour les essais biologiques et enregistrer les données et l’étape 1.5 pour analyser les données.
3. sans choix bioessais pour déterminer le comportement du sol-terriers et les succès à l’émergence de grisescens E.
- Répétez l’étape 1.1 pour obtenir les larves de dernier stade matures, et étape 1.2 pour préparer les 4 substrats (sable, sable limoneux 1, sable fin loam 2 et limon argileux) à 3 teneurs en humidité (20 %, 50 % et 80 % d’humidité).
-
Réglage du dosage biologique
- Ajoutez le substrat dans un récipient en plastique (côté supérieur : 11,5 cm de diamètre ; dessous : 8,5 cm de diamètre ; hauteur : 6,5 cm) jusqu'à une profondeur de 3 cm. Au total, s’assurer qu’il y aura 12 traitements (les combinaisons de 4 types de substrat et 3 teneurs en eau). Répétez chaque traitement 7 x.
- Sortie 15 larves de dernier stade matures sur le substrat de chaque arène bioassay. Sceller les conteneurs en couvrant bien les couvercles. Maintenir les essais biologiques dans un décor de chambre environnementale à une photopériode de 14:10 (DL) et 26 ° C.
Remarque : Il n’y aura aucun besoin de coller des feuilles de thé fraîches sur les couvercles, tel que mentionné dans les essais biologiques de choix.
-
Analyses et enregistrement des données
- Le jour 3, comptez le nombre de nymphes et des larves mortes sur la surface du substrat de chaque répétition. Calculer le pourcentage d’individus d’e. grisescens qui sont enfouies dans le substrat comme suit :
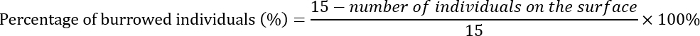
- Noter le nombre d’adultes émergents chaque jour jusqu'à ce que plus aucun adulte a émergé pour 15 d. calculer le succès à l’émergence comme suit :
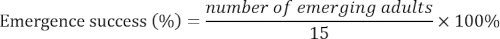
- Comparer le pourcentage de personnes enfouies et le succès à l’émergence parmi les traitements utilisant ANOVA à. Définir les niveaux de signification à α = 0,05.
- Le jour 3, comptez le nombre de nymphes et des larves mortes sur la surface du substrat de chaque répétition. Calculer le pourcentage d’individus d’e. grisescens qui sont enfouies dans le substrat comme suit :
Résultats
Humidité-choix biologiques ont montré que beaucoup plus d’individus grisescens E. pupated sur ou dans les 5 % et 35 %-humidité sable par rapport au sable 80 %-humidité (Figure 2 a). Toutefois, beaucoup plus d’individus préféraient pour se nymphoser sur ou dans le sol (loam sableux 1et 2 et loam limoneux) ayant une teneur en humidité intermédiaire (figure 2 b - 2d).
Discussion
Préférences de nymphose répondant aux variables du sol différentes ont été étudiées dans quelques ravageurs6,9,22,23. Par exemple, pour étudier la préférence des larves matures de Bactrocera tyroni (Froggatt) (Diptera : Tephritidae) parmi les conditions d’humidité des sols différents, Hulthen et Clarke22 scénographie un 3 x 3 carré Latin conten...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Yuzhen Wen, Shiping Liang, Shengzhe Jian et Li Yanjun (College of Forestry et Architecture de paysage, Université agricole de Chine du Sud) pour leur aide dans les insectes d’élevage et le montage expérimental. Ce travail a été financé par la Fondation nationale des sciences naturelles de Chine (Grant no 31600516), la Fondation de sciences naturelles de Guangdong (Grant No. 2016A030310445) et la Science et technologie de planification projet la Province du Guangdong (Grant No. 2015A020208010) .
matériels
| Name | Company | Catalog Number | Comments |
| Triangular flask | Bomex Chemical (Shanghai) Co., LTD | 99 | 250 mL |
| Plastic basin | Chahua, Fuzhou, China | 100 | upper side: 51 cm in diameter; bottom side: 40 cm in diameter; height: 16 cm |
| Zip lock bags | Glad, Guangzhou, China | 126/133 | |
| Polypropylene containers | Youyou Plastic Factory, Taian, China | 139/155/160/161/190 | upper side: 20.0 cm [L] × 13.5 cm [W], bottom side: 17.0 cm [L] × 10.0 cm [W], height: 6.5 cm |
| Waterproof polyviny chloride sheet | Yidimei, Shanghai, China | 141 | |
| Tape | V-tech, Guangzhou, China | VT-710 | |
| Oven drier | Kexi, Shanghai, China | KXH-202-3A | |
| Environmental chamber | Life Apparatus, Ningbo, China | PSX-280H |
Références
- Dimou, I., Koutsikopoulos, C., Economopoulos, A. P., Lykakis, J. Depth of pupation of the wild olive fruit fly, Bactrocera (Dacus) oleae (Gmel.) (Dipt., Tephritidae), as affected by soil abiotic factors. Journal of Applied Entomology. 127 (1), 12-17 (2003).
- Chen, M., Shelton, A. M. Impact of soil type, moisture, and depth on swede midge (Diptera: Cecidomyiidae) pupation and emergence. Environmental Entomology. 36 (6), 1349-1355 (2007).
- Holmes, L. A., Vanlaerhoven, S. L., Tomberlin, J. K. Substrate effects on pupation and adult emergence of Hermetia illucens (Diptera: Stratiomyidae). Environmental Entomology. 42 (2), 370-374 (2013).
- Renkema, J. M., Cutler, G. C., Lynch, D. H., MacKenzie, K., Walde, S. J. Mulch type and moisture level affect pupation depth of Rhagoletis mendax Curran (Diptera: Tephritidae) in the laboratory. Journal of Pest Science. 84 (3), 281 (2011).
- Ellis, J. D., Hepburn, R., Luckman, B., Elzen, P. J. Effects of soil type, moisture, and density on pupation success of Aethina tumida (Coleoptera: Nitidulidae). Environmental Entomology. 33 (4), 794-798 (2004).
- Pietrantuono, A. L., Enriquez, A. S., Fernández-Arhex, V., Bruzzone, O. A. Substrates preference for pupation on sawfly Notofenusa surosa (Hymenoptera: Tenthredinidae). Journal of Insect Behavior. 28 (3), 257-267 (2015).
- Buitenhuis, R., Shipp, J. L. Influence of plant species and plant growth stage on Frankliniella occidentalis pupation behaviour in greenhouse ornamentals. Journal of Applied Entomology. 132 (1), 86-88 (2008).
- Zheng, X. L., Cong, X. P., Wang, X. P., Lei, C. L. Pupation behaviour, depth, and site of Spodoptera exigua. Bulletin of Insectology. 64 (2), 209-214 (2011).
- Wen, Y., et al. Effect of substrate type and moisture on pupation and emergence of Heortia vitessoides (Lepidoptera: Crambidae): choice and no-choice studies. Journal of Insect Behavior. 29 (4), 473-489 (2016).
- Wen, Y., et al. Soil moisture effects on pupation behavior, physiology, and morphology of Heortia vitessoides (Lepidoptera: Crambidae). Journal of Entomological Science. 52 (3), 229-238 (2017).
- Wang, H., et al. Pupation behaviors and emergence successes of Ectropis grisescens (Lepidoptera: Geometridae) in response to different substrate types and moisture contents. Environmental Entomology. 46 (6), 1365-1373 (2017).
- Wang, H., et al. No-substrate and low-moisture conditions during pupating adversely affect Ectropis grisescens (Lepidoptera: Geometridae) adults. Journal of Asia-Pacific Entomology. 21 (2), 657-662 (2018).
- Ge, C. M., Yin, K. S., Tang, M. J., Xiao, Q. Biological characteristics of Ectropis grisescens Warren. Acta Agriculturae Zhejiangensis. 28 (3), 464-468 (2016).
- Xi, Y., Yin, K. S., Tang, M. J., Xiao, Q. Geographic populations of the tea geometrid, Ectropis obliqua (Lepidoptera: Geometridae) in Zhejiang, eastern China have differentiated into different species. Acta Entomologica Sinica. 57, 1117-1122 (2014).
- Zhang, G. H., et al. Detecting deep divergence in seventeen populations of tea geometrid (Ectropis obliqua Prout) in China by COI mtDNA and cross-breeding. PloS One. 9 (6), e99373 (2014).
- Ma, T., et al. Analysis of tea geometrid (Ectropis grisescens) pheromone gland extracts using GC-EAD and GC× GC/TOFMS. Journal of Agricultural and Food Chemistry. 64 (16), 3161-3166 (2016).
- Zhang, G. H., et al. Asymmetrical reproductive interference between two sibling species of tea looper: Ectropis grisescens and Ectropis obliqua. Bulletin of Entomological Research. , (2016).
- Luo, Z. X., Li, Z. Q., Cai, X. M., Bian, L., Chen, Z. M. Evidence of premating isolation between two sibling moths: Ectropis grisescens and Ectropis obliqua (Lepidoptera: Geometridae). Journal of Economic Entomology. 110 (6), 2364-2370 (2017).
- Li, Z. Q., et al. Chemosensory gene families in Ectropis grisescens and candidates for detection of Type-II sex pheromones. Frontiers in Physiology. 8, (2017).
- Chen, L. Q. Research on structure of soil particle by hydrometer method. Environmental Science Survey. 29 (4), 97-99 (2010).
- Kucera, M., Malmgren, B. A. Logratio transformation of compositional data: a resolution of the constant sum constraint. Marine Micropaleontology. 34 (1-2), 117-120 (1998).
- Hulthen, A. D., Clarke, A. R. The influence of soil type and moisture on pupal survival of Bactrocera tryoni (Froggatt) (Diptera: Tephritidae). Australian Journal of Entomology. 45 (1), 16-19 (2006).
- Alyokhin, A. V., Mille, C., Messing, R. H., Duan, J. J. Selection of pupation habitats by oriental fruit fly larvae in the laboratory. Journal of Insect Behavior. 14 (1), 57-67 (2001).
- Torres-Muros, L., Hódar, J. A., Zamora, R. Effect of habitat type and soil moisture on pupal stage of a Mediterranean forest pest (Thaumetopoea pityocampa). Agricultural and Forest Entomology. 19 (2), 130-138 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon