Method Article
Micropunción del espacio de Bowman en ratones por 2 fotones microscopía
En este artículo
Resumen
Presentamos uso de microscopia de 2 fotones a una micropipeta dentro del espacio urinario de Bowman en los ratones, la combinación de 2 técnicas fundamentales de la fisiología renal. Uso de la microscopia de 2 fotones supera críticas limitaciones de la microscopia convencional para estudios de micropunción fisiología renal.
Resumen
Micropunción renal y renal 2-photon imaging son técnicas seminales en la fisiología renal. Sin embargo, micropunción está limitada por la dependencia en microscopia convencional a las nefronas superficiales características y estudios de 2 fotones se limitan en que las intervenciones sólo pueden ser evaluadas en el órgano, más bien que el nivel de la nefrona. En particular, estudios de micropunción de los glomérulos de los ratones han sido desmentidos por la escasez de superficie glomérulos en ratones. Para solucionar esta limitación para llevar a cabo estudios de aspirado del espacio de Bowman en modelos fisiológicos de ratón, que desarrollamos micropunción glomerular 2 fotones. Presentamos una novedosa preparación quirúrgica que permite el acceso lateral al riñón preservando la columna imagen vertical requiere de 2 fotones microscopía. Administración de alto peso molecular isotiocianato de fluoresceína (FITC)-dextran se utiliza para representar la vasculatura renal y glomérulos visible para la proyección de imagen de 2 fotones. Luego se introduce una pipeta de punto cubrió quantum bajo guía estereotáctica a un glomérulo de varios a muchos de los cuales pueden visualizarse en la ventana de imagen. En este protocolo, nos proporcionan detalles de la preparación, materiales y métodos necesarios para llevar a cabo el procedimiento. Esta técnica facilita previamente imposible estudio fisiológica del riñón, incluyendo todos los segmentos de la nefrona en la proyección de imagen límite de profundidad, cerca de 100 μm por debajo de la cápsula renal y recuperación del filtrado desde el espacio de Bowman. Presión, carga y flujo se pueden todos medir con la pipeta de introducidas. Aquí, nos proporcionan datos representativos de cromatografía de líquidos/masas espectrometría en aspirado del espacio de Bowman. Esperamos que esta técnica tiene amplia aplicabilidad en la investigación fisiológica renal.
Introducción
El objetivo de este procedimiento es rutinario micropunción acceso al espacio de Bowman y otras estructuras glomerulares en ratones. Estudios de micropunción de fisiología renal se han limitado a 1 fotones microscopía, que solo pueden tomar imágenes dentro de unas pocas micras de la superficie del riñón, y que ofrece una precisión limitada en la dimensión z. Porque los ratones tienen pocos glomérulos superficiales, no siempre es posible encontrar una superficie glomérulo por microscopia 1 fotón, por lo tanto se han realizado más estudios de micropunción en ratas Wistar de Munich, que tienen más numerosos glomérulos superficiales. Por lo tanto, los beneficios de trabajar en modelos de ratón han sido limitados en estudios de micropunción1,2,3. Los avances recientes en tecnologías, incluyendo micro-CT4,5, nanopartículas6la proyección de imagen y espectrometría de masa7 la proyección de imagen han mejorado considerablemente la gama de modalidades aplicables a la fisiología glomerular, pero queda nada que sustituya a la única capacidad de intervenir y eso micropunción de la muestra. Por lo tanto extendiendo el uso de micropunción usando las técnicas presentadas aquí se espera facilitar estudios de fisiología renal novela, en particular, evaluación de los contenidos del filtrado renal (es decir, metabolómica) y fisiología básica de la ratones transgénicos, tales como medidas de presión de filtrado y carga, sólo en ratas.
En esta técnica, uso de 2 fotones microscopía permite la visualización y acceso de la micropipeta a estructuras renales hasta cerca de 100 μm por debajo de la cápsula renal. Varios glomérulos (5 – 10) por lo tanto son accesibles para micropunción en cada riñón de ratón reflejado hasta el momento. Aunque esta técnica comparte algunas características con micropunción renal convencional, fue diseñado de novo y modificaciones extensas de la técnica convencional se requieren. En este protocolo demuestran la aspiración de líquido desde el espacio de Bowman y mostrar resultados de ejemplo de posteriores análisis con espectrometría de masas (nanoproteomics)8,9,10,11. Uso aguas abajo de espectrometría de masas requiere una muestra especializada preparación flujo de trabajo, que también se demuestra aquí.
Protocolo
Todos los procedimientos aquí descritos fueron aprobados por la institucional Animal Care y Comité de uso de la Oregon Health & Science University.
1. configuración utilizada para la demostración
- Usar un microscopio vertical de 2 fotones, un regulador de la etapa de 3 ejes, un soporte headstage/pipeta y un controlador de 3 ejes para el porta headstage/pipeta; los cuatro de estos elementos son necesarios.
Nota: Muchos configuraciones similares están disponibles y serán suficiente como independiente control cuantitativo de 3 ejes de la pipeta y microscopio de fase están disponibles, y el microscopio se configura en vivo la imagen vertical.
2. los materiales necesarios antes de comenzar el protocolo Experimental
- Uso de FITC-los dextranos, Da 2.000.000, solución al 5% en solución salina normal o solución salina con tampón fosfato para inyección retroorbital marcar la vasculatura renal. Este peso molecular (MW) se selecciona porque permanece en la vasculatura y no filtra.
- Micropipetas de vidrio de borosilicato máquina tirada: Tire Micropipetas a 6 – 10 μm punta con punta cónica larga, cerrada configuración (p. ej., calor = 610, velocidad = 150, tiempo = 250 ms, enrollados) en un extractor de la micropipeta. Biselado a 45° y llama-Pula ligeramente.
- Capa de punto cuántico de Micropipetas: puntas de micropipeta con puntos cuánticos según el protocolo de referenciado de la capa. 12
- Polysiloxane riñón apoyo/espaciador. Utilice masilla de polisiloxano para elaborar a un riñón apoyo/espaciador. Manera un 1 x 1 cm2 de 5 mm espesor ángulo recto romboide (es decir, un cubo truncado) de masilla de polisiloxano. Retire el medio 70% de polisiloxano de un extremo y un círculo que comprende aproximadamente el 70% del centro del romboide. Permiten el polysiloxane secar 24 h. Vea la figura 1.
- Preparación microinyectora: rellenar previamente una longitud de tubería de polietileno (PE)-50 y el soporte de carga micropipeta Micropipetas con aceite. Si se planea la espectrometría de masas, perfluorodecalina se requiere, de lo contrario puede usarse aceite mineral. Configurar la microinyectora con una jeringa Hamilton tipo estanca a los gases y perfluorodecalina se llenan. Este se conectará a la tubería de PE-50 y titular de la pipeta.
- Coloque la pipeta en el soporte de pipeta adelante llenar la tubería de PE-50 y la pipeta, y fije el extremo proximal de la PE-50 tubo la jeringa Hamilton llena de aceite, la creación de un sistema hidráulico de pipeta a jeringa.
3. lateral pipeta acceso al riñón debajo de un líquido de columna a través de un novedoso procedimiento quirúrgico
Nota: La Asamblea de la proyección de imagen de sistema de apoyo y preparación quirúrgica se muestra en la figura 1. El procedimiento descrito se realiza en ratones C57BL/6 con 20-25 g de peso.
- Peso del ratón.
- Inducir la anestesia con isoflurano 4% y mantener con isoflurane 1.5 – 2.5% en la mezcla de aire/oxígeno. Confirmar que el ratón es anestesiado por la ausencia de respuesta al estímulo doloroso y reducción de la frecuencia respiratoria.
- Lubricar los ojos y coloque el lateral animal en una placa de base. Inmovilizar las 4 extremidades con cinta.
- Inyectar solución salina normal, 200 μL, por vía subcutánea y colocar una sonda de temperatura rectal. Control de temperatura utilizando una lámpara de calefacción durante cirugía y una almohadilla de calefacción durante proyección de imagen.
- Quitar todo el pelo en el lado izquierdo del ratón utilizando una crema depilatoria.
- Localizar el bazo, que es visible bajo la piel, y localizar el riñón izquierdo en el lado dorsal y caudal del bazo.
- Hacer una incisión de 0,5 cm en la piel y la incisión más pequeña en el peritoneo, lo suficiente como para el riñón empujar a través fácilmente.
- Sacar el riñón con una ligera presión. Colocar el forma de estabilizador de riñón con polisiloxano alrededor del riñón y fijar con pegamento de cianoacrilato. Alinee el riñón con el espaciador tal que la superficie más lateral del riñón se extiende más allá del estabilizador por cerca de 1 milímetro.
- Fijar una placa principal a la forma de estabilizador con pegamento y montar la placa principal a barras de montaje en la placa base.
- Llenar el pozo en el apoyo de polisiloxano que rodea el riñón con solución de agarosa al 1% y colocar el cubreobjetos de 10 mm en la parte superior y mantenga presionado hasta que la agarosa es firme. Cubreobjetos a la placa principal con el pegamento del sello y crear un anillo alrededor de lo cubreobjetos con cemento dental.
- Inyecte retro-orbitally FITC-los dextranos (2.000.000 Da, solución al 5%, 100-150 μL) y mover el ratón y la fijación la placa a la platina del microscopio 2 fotones rápidamente, mantenimiento de la anestesia y garantizar adecuada residuos gas barrido sobre la platina del microscopio.
4. selección de pipeta acceso al espacio de Bowman y glomérulo adecuado
-
Definiciones:
- Definir X como en la pantalla de izquierda a derecha y de izquierda derecha mirando el microscopio
- Leer SX (etapa X) desde el controlador de la etapa
- Definir PX como pipeta X, en la pipeta de la dial regulador
- Definir Y como arriba-abajo en la pantalla y hacia adelante hacia el microscopio y hacia la configuración de 2 fotones
- Definir Z como para arriba hacia el techo, abajo hacia el suelo y medido en la etapa con la posición del objetivo Z.
- S (O) Z se define como la altura de la etapa (realmente el objetivo).
-
Encontrar la superficie del riñón, identificación de parámetros de filtro proteína fluorescente verde (GFP) en el ocular. Debido a la inyección de FITC-los dextranos, la vasculatura será verde brillante.
- Identificar un glomérulo adecuado. Tras la identificación de la superficie del riñón usando el ocular, cambiar a 2-fotón (modo de exploración no) y explorar la ventana de imagen. Características favorables para micropunción son las siguientes: distancia vertical debajo del cubreobjetos > 30 μm (para evitar la colisión entre la pipeta y el cubreobjetos en acceso) y distancia de la cápsula renal lateral a los glomérulos lateral < 400 μm (más allá de esta distancia la desviación de la pipeta puede aumentar la probabilidad de una falta).
- Registro lateral y la distancia vertical a la punción del punto, un punto en la cápsula renal directamente a la pipeta-parte de los glomérulos.
- Plantear el objetivo punto focal en la columna de agua, manteniendo la x y y coordenadas del escenario sin cambios, una distancia de casi un centímetro.
- Introduzca la pipeta en la columna de agua y encender 4', 6-diamidino-2-phenylindol excitación de (DAPI). Mueva la pipeta en x e y dimensiones hasta el punto de máxima de la fluorescencia de la punta, esto será el centro del objetivo. La pipeta en el ocular es difícil encontrar sin esta posicionando precisa. Porque puntos cuánticos es fluorescente en la misma (en este caso, rojo) longitud de onda independientemente de la longitud de onda de excitación, la excitación de DAPI produce fluorescencia roja que se centra firmemente en la punta, ilustrada en la figura 2.
- Cambiar la configuración de excitación a la proteína fluorescente roja (RFP) y visualizar la pipeta en el ocular, y precisamente lo centro en el punto de vista ocular.
- Cambiar a 2-photon y encontrar la pipeta bajo 2-fotón, precisamente en el centro de la imagen. Esta es la posición de registro.
- Guardar una imagen de la pipeta.
- Registro de la etapa y las coordenadas de controlador de la micropipeta.
Nota: Utilizar el archivo .html suplementario, que ejecutará los cálculos usando código JavaScript, (ventajoso en sistemas que no tienen software de hoja de cálculo instalada) o una hoja de cálculo para calcular el desplazamiento entre la etapa y pipeta de coordenadas y calcular las coordenadas de destino para el aspirador. - Retire la pipeta de la columna de agua en el eje x, z e y manteniendo el mismo.
- La pipeta Z hacia el glomérulo destino Z (es decir, mover la pipeta hacia abajo en la dirección Z por debajo del cubreobjetos)
- Hacia la pipeta Y la coordenada del glomérulo Y de destino.
- Mover la vista en vivo 2-fotón del glomérulo destino Z y luego el borde del riñón y observe el SX.
- Calcular el borde del riñón PX con el desplazamiento desde el registro del SX.
- Mover el escenario hacia la pipeta (aumento del SX) tal que el borde del riñón es tan a la izquierda de la pantalla, pero todavía visible.
- Avanzar rápidamente la pipeta a cerca de 100 μm menos que el borde del riñón PX calculado anteriormente.
- Coloque la punta de la pipeta, avanzando lentamente la pipeta. Aumentar la ganancia del rojo y ver el histograma de píxeles rojos (el pixel distribución cambios antes de que la pipeta está reflejada en la ventana, debido a la extrema luminosidad de puntos cuánticos y la fluorescencia fuera de objetivo).
- Avanzar hasta el borde del riñón en vivo 2-photon imaging.
Nota: Antes de entrar en la cápsula renal, es posible redirigir la pipeta en las dimensiones Y y Z. Sin embargo, esto puede romper la punta de la pipeta. Una medida más conservadora, si la pipeta es de blanco, es retirar en la dimensión X hasta 2 cm, redirigir y luego vuelta en la dimensión X en el borde del riñón. Una vez la pipeta dentro del tejido, el movimiento en cualquier eje que no sea X conduce a flexión pipeta que requiere gran experiencia para hacer uso de y con frecuencia conduce a la rotura. - Conduzca la pipeta en el eje X lentamente a la meta de glom PX, manteniendo un ojo en el SX. (Es útil que de vez en cuando volver a los glomérulos para ver si ha cambiado en absoluto sobre la inserción de la micropipeta).
- Cuando estás en el lugar correcto, posición del documento con un z-stack.
Nota: Con la micropipeta en el lugar, medicamentos, proteínas o marcadores fluorescentes se pueden inyectar, puede se aspira líquido para su posterior análisis o presión o carga en relación con el otro electrodo se puede medir.
5. aspiración de líquido desde el espacio de Bowman
- Establecer el microbomb a inyectar 100 nL de perfluorodecalina más 2 minutos para asegurar la permeabilidad de la pipeta y reducir la confusión de pipeta conectar durante la entrada. Crear una nueva imagen para asegurar la posición de la pipeta.
- Esperar 4 – 6 minutos para la filtración adicional.
- Establecer el microbomb para aspirar hasta 300 nL a una velocidad de hasta 50 nL/min.
Nota: Cambios en la morfología glomerular no se observan con este ritmo, lo que sugiere que no altera la tasa de suministro de líquido al espacio durante la aspiración. Como no hay ningún bloque de aceite como en convencional micropunción, recuperación de este volumen, para espectrometría de masas, podría incluir algunos de los perflourodecalin inyectado y el fluido tubular posiblemente. Para los ensayos como la espectroscopia de fluorescencia de medidas sensibles al ion electrodo, reacción en cadena de polimerasa y otros extremos sensibles, pueden utilizarse volúmenes inferiores. Si espectrometría de masas no es el punto final, aceite mineral y las técnicas de micropunción estándar pueden utilizarse para medir el volumen aspirado antes de almacenar. - Una vez más la imagen.
- Retirar la pipeta y preservar la muestra, añadir tampón TRIS y almacenamiento a-80 ° antes del análisis.
- Eutanasia el ratón utilizando una sobredosis de isoflurano u otro método aprobado.
Nota: Filtrado entra en el espacio por la filtración de los capilares glomerulares. La tasa de filtración glomerular de Nefrona única (SNGFR) en ratones se divulga entre 8-14 nL/min3 fuerzas de Starling regulan SNGFR, sin embargo, y la presión hidrostática negativa en el espacio de Bowman por lo tanto puede aumentar SNGFR. Métodos estándar de micropunción utilizan bloqueo tubular con aceite y presión neutra para el muestreo de fluido tubular, sin embargo estos compuestos interfieren con espectrometría de masas (véase abajo); por lo tanto, en esta técnica el túbulo proximal temprano sigue siendo patente. Además, en el momento de la aspiración, espacio de Bowman contiene a un desconocido, pero positivo volumen de filtrado. Por lo tanto, la tasa de aspiración de líquidos puede exceder SNGFR.
Nota: En los experimentos descritos aquí, el objetivo era obtener un más grande que generalmente muestra del filtrado glomerular para el análisis de espectrometría de masas por técnicas nanoproteomic. Puesto que el uso de espectrometría de masas impide uso de bloques de aceite con aceite mineral o cera (mezclas complejas de moléculas orgánicas que reducir la relación señal: ruido en espectrometría de masas) perfluorodecalina se utiliza para llenar la jeringa y micropipeta. Perflourodecalin no es conocida para bloquear el flujo tubular, pero es biológicamente inerte y no interfiera con la espectrometría de masas.
Resultados
Este procedimiento requiere una única preparación quirúrgica del riñón para la proyección de imagen de 2 fotones y acceso, que se ilustra en la figura 1. Esta preparación que se muestra a continuación permite una columna vertical de la imagen con el objetivo por encima de los riñones con pocos cambios de densidad óptica de la mejor posible para microscopía 2 fotones simultáneamente con acceso lateral para la pipeta, exclusivamente en la horizontal (x ) dimensión. Extrusión parcial del riñón impide que una tensión excesiva sobre el pedículo renal y preserva el flujo vascular, y construcción de un soporte personalizado renal permite los dos objetivos de la proyección de imagen y acceso. El segundo desafío en este procedimiento es un posicionamiento preciso de la pipeta dentro del riñón en 3 dimensiones, que requiere el registro de los sistemas de coordenadas pipeta y etapa. El paso crítico de este proceso se ilustra en la figura 2, que muestra la pipeta ser vista en la columna de agua del microscopio 2 fotones bajo excitación DAPI. Entrar en la columna de agua y registrar las coordenadas de la pipeta a los de la etapa antes de entrar en el riñón son fundamental para facilitar la colocación estereotáctica precisa de la pipeta dentro del espacio de Bowman de destino. La pipeta entra en la columna de agua imagen de la derecha. Con excitación de DAPI encendida, la pipeta de punto cubrió quantum rojo fluoresce brillantemente en el rojo-naranja y puede ser colocado cuidadosamente en el centro del objetivo. Como el haz de excitación pasa a través del centro del objetivo, la pipeta puede moverse libremente hasta el punto de máxima fluorescencia, asegurando que será visible en el ocular.
Pipeta adecuada tirando y glomérulo selección son críticos para el éxito de este protocolo, como se ilustra en la figura 3, figura 4, figura 5. En la Figura 3A, se aprecia una micropipeta de vidrio recubierto de punto cuántico bien tirado, rojo fluorescente reflejada en la columna de líquido durante la parte de registro de la pipeta del procedimiento. La punta es de 6 micras de ancho. En la figura 3B, se muestra una pipeta mal tirado con 12 punta de μm. Esta pipeta no penetra la cápsula renal sin causar trauma vascular debido a la superficie de la punta irregular (nota la fresa en la parte superior del bisel) y 12 μm de diámetro. En figura 3 y en 3D, se muestra la importancia de la óptima colocación en lugar de la proyección de imagen de los glomérulos de destino. El glomérulo hermoso, cerca de la superficie muestra en la figura 3 se muestra la proyección de imagen favorable (debido a su posición superficial 20 μm por debajo de la cápsula renal) pero no sería conveniente para el acceso por este procedimiento ya que es muy cerca de la superficie, y la pipeta golpearía el cubreobjetos. En la figura 3D, se muestran glomérulos óptimamente posicionados. Tenga en cuenta la diferente escala para ilustrar ambos glomérulos (barras de escala son todos de 50 μm). Estos glomérulos aparecen menos fuerte debido a la refracción causada por la profundidad; Esta imagen fue tomada en 70 μm por debajo de la cápsula renal. El borde lateral del riñón es 250 μm a la derecha, ambos de estos glomérulos hacer accesible. Durante un procedimiento de acceso, la proyección de imagen se centra firmemente en el glomérulo de destino como en la figura 4, y se utiliza la adquisición de imágenes cada segundo, permitiendo al investigador a observar precisamente la colocación de la pipeta en el espacio de Bowman.
Figura 4 ilustra una típica entrada renal y el resultado, una punta de la pipeta dentro del espacio de Bowman. En la Figura 4A, una proyección de intensidad media de una z-pila con vistas ortogonales muestra la punta de la pipeta en el espacio de Bowman. Tenga en cuenta que no hay artefacto espectral de punta de pipeta roja (bola redonda de la fluorescencia) debido a la extremadamente brillante de la fluorescencia de los puntos de quantum dispuesto en la sección cónica de la punta. En la Figura 4B, una proyección del volumen de datos z-stack muestra la otra pipeta en el espacio de Bowman. Tenga en cuenta que la pipeta arrastrado de cápsula de Bowman en el sentido de la marcha en la entrada, creando aparente acampar detrás de la punta como se describe en el protocolo.
En la figura 5, se muestran los resultados de un procedimiento fallido en el que una pipeta con una abertura demasiado grande se rompió en la cápsula renal, causando sangrado. La pipeta fue demasiado contundente; al intentar pasar la cápsula renal, la cápsula fue empujada por delante de la punta de la pipeta hasta que la fractura ocurrió. En esta imagen, la cápsula renal es visible, mejorado por subcaspular sangrado, de FITC-fluorescente. Señal FITC es visible dentro de la pipeta, lo que indica que la sangre bajo presión entró el lumen de la pipeta. La flecha señala a muchos glóbulos rojos visibles dentro del lumen de la pipeta como relleno de defectos en el FITC-los dextranos.
Figura 6 muestra un espectro de masas representativo obtenido del aspirado del espacio de Bowman, urinaria 17 (MUP17) de la proteína de ratón. Por último, tabla 1 muestra resultados de ejemplo de los procedimientos de aspiración exitosa, listado de proteínas identificadas usando espectrometría de nanoescala en aspirados recogidos durante 6 minutos de cada uno de los 3 ratones. En cada caso, la pipeta era reflejada como se retiró del espacio de Bowman, y ninguna fluorescencia FITC se observó en el espacio de Bowman o el lumen de la pipeta, indicando falta de aspirar la contaminación con plasma. se identificaron 17 proteínas, sobre todo de bajo peso molecular, de un mínimo de 2 péptidos únicos por proteína. Cuentas espectrales son bajas, consistentes con las estimaciones previas de proteínas en el filtrado glomerular, y conocido las proteínas filtradas, como proteína de unión a vitamina D (VTDB), albúmina (ALBU) y proteína urinaria importante 17 (MUP17) están presentes.

Figura 1: extrusión parcial del riñón con apoyo personalizado e inmovilización de acceso lateral. A la izquierda, se muestran las partes de la imagen ayuda columna y los riñones, con el montaje completo en el centro. A la derecha, se muestra la preparación de riñón antes (arriba) y después (abajo) de aplicación de la ayuda. Haga clic aquí para ver una versión más grande de esta figura.
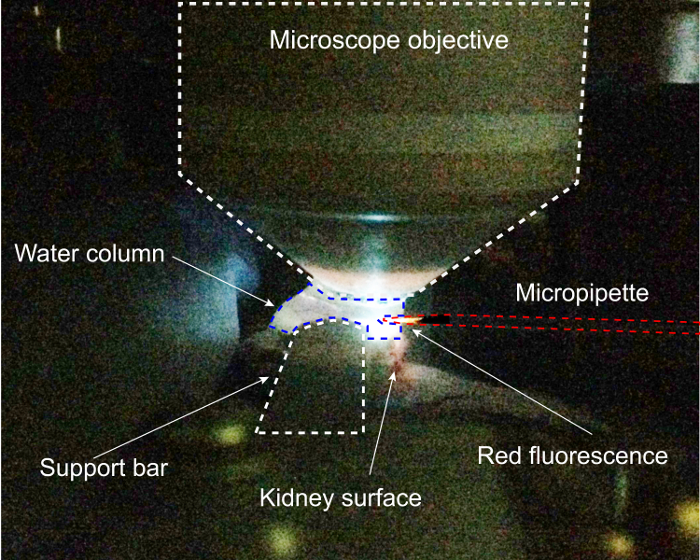
Figura 2: completado preparación de riñón en etapa de registro de pipeta del Protocolo de. Aquí, la excitación DAPI se está utilizando para colocar la micropipeta dentro de la columna de agua del microscopio 2 fotones. Haga clic aquí para ver una versión más grande de esta figura.
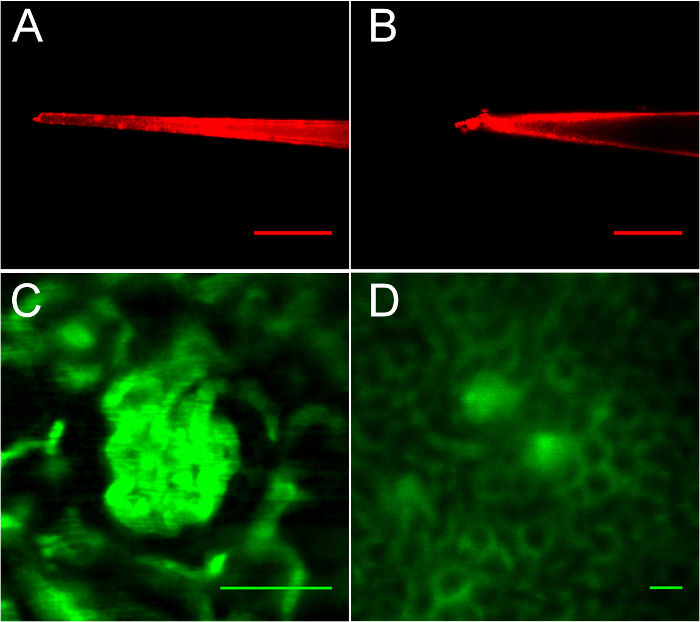
Figura 3: proyección de imagen de pipetas y el riñón después de la inyección de FITC-los dextranos, demostrando glomérulos adecuados e inadecuados de micropunción. A. una pipeta bien tirada con 6 punta de μm. B. una punta con bordes ásperos, embotada. C. este glomérulo está bien definido, pero muy cerca del cubreobjetos para micropunción. D. Convenientemente colocado glomérulos. Barras de escala son todos 50 μm. haga clic aquí para ver una versión más grande de esta figura.
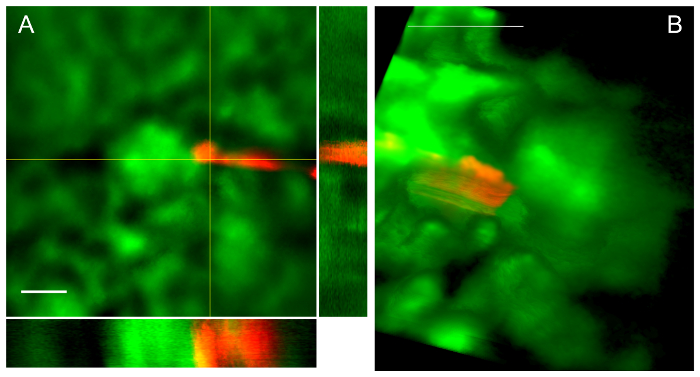
Figura 4: pasaje de pipeta éxito conduce a la colocación en el espacio-vistas de Bowman de 2 procedimientos diferentes. A. Z-stack con proyecciones ortogonales muestra la punta de la pipeta en el espacio de Bowman contigua al del penacho glomerular. Es la barra de escala 50 μm. B. Volumétrica de z-pila del mismo modo demuestra una pipeta en el espacio de Bowman contigua al del penacho glomerular. Barra de escala es 100 μm. haga clic aquí para ver una versión más grande de esta figura.
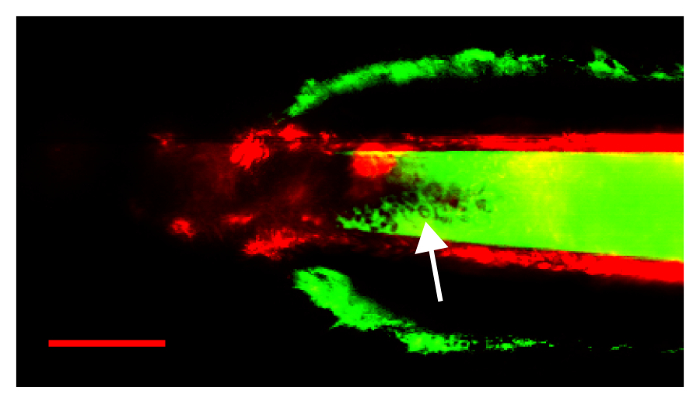
Figura 5: un procedimiento fallido debido a una pipeta embotado, rasgando la cápsula renal y conduce a sangrado en el lumen de la pipeta. La fluorescencia FITC de plasma extravasado y células de sangre rojas (flecha) son visibles dentro de la pipeta. Flecha señala glóbulos rojos visibles dentro del lumen de la pipeta. Es la barra de escala 50 μm. haga clic aquí para ver una versión más grande de esta figura.
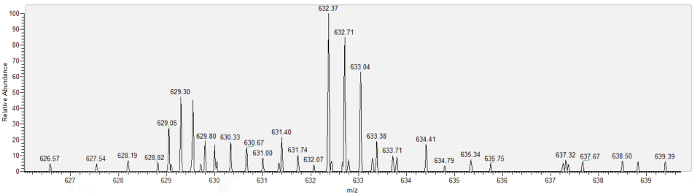
Figura 6: el espectro de masas de proteína urinaria mayor 17 (MUP17), obtenido del análisis de espectrometría de masa cromatografía líquida a nanoescala de aspirado del espacio de Bowman. Haga clic aquí para ver una versión más grande de esta figura.
| Proteína | MW (kD) | Significa Conde espectral |
| ACTA_MOUSE | 42 | 2 |
| ACTB_MOUSE | 42 | 1 |
| CLPX_MOUSE | 69 | 2.5 |
| DHSA_MOUSE | 73 | 1 |
| FOLR2_MOUSE | 29 | 1 |
| GBLP_MOUSE | 35 | 1 |
| ALBU_MOUSE | 66 | 6.7 |
| HBA_MOUSE | 15 | 2 |
| HBB1_MOUSE | 16 | 1 |
| MIB1_MOUSE | 110 | 1 |
| MUP17_MOUSE | 21 | 1 |
| PERI_MOUSE | 54 | 1 |
| RNAS4_MOUSE | 17 | 2 |
| SPTB1_MOUSE | 2 | 1 |
| VIME_MOUSE | 54 | 1 |
| VTDB_MOUSE | 53 | 1 |
Tabla 1: Lista de proteínas identificadas en aspirado del espacio de Bowman de los 3 ratones.
1 Video suplementario: una representación de volumen de una z-pila adquirida después de una pipeta de posicionamiento en el espacio de Bowman muestra la punta de la pipeta dentro del espacio, contigua al del penacho capilar. Haga clic aquí para descargar este archivo.
Discusión
Se presenta un método para acceder a espacio de Bowman de glomérulos no-superficie en ratones, facilitados por microscopia 2 fotones. Hemos desarrollado este procedimiento para solucionar una limitación clave de micropunción glomerular, la rareza de glomérulos superficiales direccionables por microscopia 1 fotón en ratones, con el fin de facilitar un objetivo experimental, aspiración de líquido desde el espacio de Bowman para análisis subsecuente. Desarrollo y la práctica de esta técnica se basa en seis pasos críticos. En primer lugar, la novela preparación quirúrgica debe cuidadosamente llevará a cabo para que la proyección de imagen de columna de agua no funcionan con el cubreobjetos y el cubreobjetos se extiende sobre el área del riñón que es el objetivo de la pipeta. En segundo lugar, la pipeta de vidrio utilizada para micropunción debe hacerse visible por microscopía 2-photon, que se logra usando puntos cuánticos. Tercera técnica estereotáctica es necesaria precisamente colocar una pipeta en el espacio de Bowman en tres dimensiones, hasta 100 μm por debajo de la superficie del riñón. Por lo tanto, registrar los sistemas de coordenadas de la pipeta y el escenario con precisión es pasos críticos. Cuarto, cuidadosa selección de los glomérulos de destino es necesario garantizar es accesible a la pipeta sin choque por la estructura de soporte renal y columna de imagen. Por último, debe prestar cuidadosa atención a los pasos analíticos a seguir el procedimiento de adquisición, y volumen y el momento de la adquisición de las muestras de líquido deben corresponder al análisis y a la fisiología glomerular.
Hemos diseñado un procedimiento de adquisición que puede extenderse a muchos análisis, incluyendo las terminales de micropunción tradicionales, como la fotometría de llama, electrodo sensible al ion mediciones o mediciones de presión, volumen o carga. Además, creemos que esta técnica sea susceptible de nuevos extremos analíticos incluyendo reacción en cadena de polimerasa (quizás después de reversa de la transcripción para miRNA) y metabolómica aguas abajo de la espectrometría de masas. Las modificaciones especiales para facilitar la espectrometría de masas merecen discusión adicional, y que imponen algunas limitaciones. En primer lugar, aunque la espectrometría de masas es muy sensible, el contenido bajo en proteínas y volumen de las muestras de micropunción hace análisis de proteínas por debajo del rango dinámico de exploración convencional de la proteómica, y por lo tanto nanoproteomics simplificados necesario. 8 , 13 en segundo lugar, para optimizar el rendimiento de proteína para los primeros ensayos, se determinó que nL 200-300 de aspirado era necesario, pero de nuevo filtrado adquisición de este volumen requeriría quizás mientras 20 minutos de aspiración si el ratón GFR es solamente 8-14 nL / min3. Como Tojo y Endou demostraron que la aspiración prolongada altera el contenido de albúmina de líquido tempranos del túbulo proximal14, elegimos para aspirar más de 6 minutos; sin embargo esto significa que nuestra tasa de aspiración superior a la tasa de entrada de filtrado. Los usuarios de este procedimiento se anima a tener en cuenta la fisiología de la filtración glomerular en su sistema experimental en el diseño de su flujo de trabajo. Espectrometría de masas, una técnica sensible, abrumado por la señal de un destilado de petróleo introducidas tales como aceite mineral, que se utiliza comúnmente en micropunción comprenden el sistema hidráulico de aspiración y aislar segmentos de la nefrona. Por lo tanto, no podríamos usar aceite mineral para este propósito, o su otros común uso, cuantificación del volumen de las muestras de gama nanoliter. En su lugar llena el sistema con perfluorodecalina que es biológicamente inerte, no perturba la espectrometría de masas y tiene características ópticas favorables. Creemos que las limitaciones impuestas por perfluorodecalina son superables y están trabajando en más innovaciones técnicas que esperamos que permitirá la medición de volumen de la muestra y el bloqueo de los segmentos tubulares.
Se han realizado más estudios de micropunción en ratas Wistar de Munich, que demostró el aumento en el número de glomérulos superficiales, pero este estudio fisiológico muy limitada de transporte tubular y otros fisiología renal debido a la pérdida de la fundamental herramienta de la biología molecular, ratones transgénicos2,3. Porque facilita el acceso de la micropipeta al espacio de Bowman en ratones, la nueva técnica por lo tanto mitiga estas limitaciones críticas. Hemos adoptado esta técnica para poder acceder a filtrado renal estudios de proteómica utilizando espectrometría de masas de alta sensibilidad, conocido como nanoproteomics9. Sin embargo, hay probabilidades de aplicaciones adicionales. Por ejemplo, estudio renal fisiológica de la proteína filtrada ha sido grandemente ayudado por uso de trazadores fluorescentes con 2 fotones microscopía15,16,17. Además de micropunción 2 fotones microscopía ofrece la posibilidad de realizar estudio fisiológico solo nephron con moléculas fluorescentes, permitiendo nefronas vecinas, no servir como controles. Se espera que esta explicación clara de los pasos necesarios permitirá amplia adopción en los laboratorios ya equipados para 2 fotones microscopía o micropunción. Aunque es complejo, ahora hemos realizado este procedimiento muchas veces y los refinamientos presentados representan una plataforma estable para el descubrimiento fisiológico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
NIDDK K08 DK090754 a MPH. NIGMS P41 GM103493 a RDS. Este material es el resultado de la obra (MPH) que fue apoyado con recursos y el uso de instalaciones en el centro de médico de asuntos de veteranos de Portland. Los contenidos no representan las opiniones del Departamento de Asuntos Veteranos de Estados Unidos o el gobierno de Estados Unidos.
Materiales
| Name | Company | Catalog Number | Comments |
| Upright 2 photon microscope | Zeiss | LSM 7MP | |
| 3 axis microscope stage controller | Sutter | MP-285 | |
| 3 axis headstage controller | Sutter | MP-225 | |
| Pipette holder | Molecular Devices | 1-HL-U | |
| Headstage | Molecular Devices | CV203BU | |
| FITC-dextran 2000 kDa MW | Sigma-Aldrich | 52471-1G | |
| borosilicate glass capillary tubes | Sutter | B150-110-7.5 | |
| Micropipette puller | Sutter | P-97 | |
| Quantum dots, 605 nm | Thermofisher | Q21701MP | |
| Polysiloxane | Sugru | No cat number | www.sugru.com, "original formula". Any color. |
| PE-50 tubing | Instech Labs | BTPE-50 | |
| Microinjector | WPI | UMP-3 | |
| Microinjector controller | WPI | Micro4 | |
| Perfluorodecalin | Sigma-Aldrich | 306-94-5 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| Coverslip, 10 mm | Harvard Apparatus | 64-0718 | |
| Headplate | Custom | No part number | Common in neuroscience labs, many suppliers |
| Head fixation device | Custom | No part number | Common in neuroscience labs, many suppliers |
| 30 G needle | Becton-Dickinson | 125393 | For retroorbital injection |
| Tuberculin syringe | Becton-Dickinson | 309626 | For retroorbital injection |
Referencias
- Schnermann, J. Micropuncture analysis of tubuloglomerular feedback regulation in transgenic mice. Journal of the American Society of Nephrology. 10 (12), 2614-2619 (1999).
- Lorenz, J. N. Micropuncture of the kidney: a primer on techniques. Comprehensive Physiology. 2 (1), 621-637 (2012).
- Vallon, V. Micropuncturing the nephron. Pflugers Archive. European Journal of Physiology. 458 (1), 189-201 (2009).
- Perrien, D. S., et al. Novel methods for microCT-based analyses of vasculature in the renal cortex reveal a loss of perfusable arterioles and glomeruli in eNOS-/- mice. BMC Nephrology. 17, 24(2016).
- Ehling, J., et al. Quantitative Micro-Computed Tomography Imaging of Vascular Dysfunction in Progressive Kidney Diseases. Journal of the American Society of Nephrology. 27 (2), 520-532 (2016).
- Gimenez, Y., et al. 3D Imaging of Nanoparticle Distribution in Biological Tissue by Laser-Induced Breakdown Spectroscopy. Scientific Reports. 6, 29936(2016).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
- Piehowski, P. D., Zhao, R., Moore, R. J., Clair, G., Ansong, C. Quantitative proteomic analysis of mass limited tissue samples for spatially resolved tissue profiling. Methods in Molecular Biology. , (2017).
- Yi, L., Piehowski, P. D., Shi, T., Smith, R. D., Qian, W. J. Advances in microscale separations towards nanoproteomics applications. Journal of Chromatography A. 1523, 40-48 (2017).
- Clair, G., et al. Spatially-resolved proteomics: Rapid quantitative analysis of laser capture microdissected alveolar tissue samples. Scientific Reports. 6, 39223(2016).
- Huang, E. L., et al. SNaPP: Simplified nanoproteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), 1307-1314 (2016).
- Andrasfalvy, B. K., et al. Quantum dot-based multiphoton fluorescent pipettes for targeted neuronal electrophysiology. Nature Methods. 11 (12), 1237-1241 (2014).
- Huang, E. L., et al. SNaPP: Simplified nano-proteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), (2016).
- Tojo, A., Endou, H. Intrarenal handling of proteins in rats using fractional micropuncture technique. American Journal of Physiology. 263 (4 Pt 2), F601-F606 (1992).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments. (74), (2013).
- Sandoval, R. M., Kennedy, M. D., Low, P. S., Molitoris, B. A. Uptake and trafficking of fluorescent conjugates of folic acid in intact kidney determined using intravital two-photon microscopy. American Journal of Physiology: Cell Physiology. 287 (2), C517-C526 (2004).
- Salmon, A. H., et al. Loss of the endothelial glycocalyx links albuminuria and vascular dysfunction. Journal of the American Society of Nephrology. 23 (8), 1339-1350 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados