Method Article
보 먼의 공간 2 광자 현미경에 의해 촉진 생쥐에서의 Micropuncture
요약
선물이 2 광자 현미경은 micropipette 쥐, 보 먼의 요도 공간 배치의 사용의 신장 생리학의 2 기초 기술을 결합. 2 광자 현미경의 사용 micropuncture 신장 생리학 연구에 대 한 기존의 현미경의 중요 한 한계를 극복 한다.
초록
신장 micropuncture 및 신장 2 광자 이미징 신장 생리학 정액 기술이 있습니다. 그러나, micropuncture은 기존의 현미경 표면 nephron 기능에 대 한 의존에 의해 제한 및 2 광자 연구는 제한 개입만 nephron 수준 보다는 기관에서 평가 될 수 있다. 특히, 쥐의 glomeruli의 micropuncture 연구 생쥐에서 표면 glomeruli의 소수에 의해 도전을 받고 있다. 해결 하기 위해이 제한 마우스 생리 모델에서 보 먼의 공간에서 aspirate의 연구를 추구 하기 위하여, 우리는 2 광자 사 micropuncture 개발. 선물이 2 광자 현미경 검사 법에 대 한 필요한 수직 이미지 열을 유지 하면서 신장에 측면 액세스할 수 있는 새로운 수술 준비. 높은 분자량 fluorescein isothiocyanate (FITC) 관리-dextran 신장 맥 관 구조 및 그러므로 glomeruli 2 광자 영상에 대 한 표시를 렌더링 하는 데 사용 됩니다. 양자 점 코팅 피 펫 다음 정위 적 지도 하에 있는 많은 여러 이미징 창 내에서 시각화 수 있습니다에서 선택한 glomerulus 소개 했다. 이 프로토콜의 준비, 재료 및 방법 절차를 수행 하는 데 필요한 세부 사항을 제공 합니다. 이 기술은 보 먼의 공간에서 여과 액의 복구 및 이미징 깊이 제한, 신장 캡슐 아래 약 100 µ m 내 nephron의 모든 세그먼트를 포함 하 여 신장, 이전 불가능 한 생리 연구를 촉진 한다. 압력, 충전 및 흐름 수 있습니다 모든 측정 도입된 피 펫을 사용 하 여. 여기, 우리는 보 우먼의 공간에서 aspirate에 수행 하는 액체 크로마토그래피/질량 분석에서 대표 데이터를 제공 합니다. 우리는이 기술을 신장 생리 조사에 있는 넓은 적용을 기대 합니다.
서문
이 절차의 목적은 일상적인 micropuncture 액세스 보 먼의 공간 및 쥐에 다른 사 구조를 제공 하는 것 이다. 신장 생리학에 대 한 Micropuncture 연구 1-광자 현미경 검사 법,이 수만 내에 신장 표면의 몇 미크론 이미지와 z 차원에서 제한 된 정밀도 제공 하 게 제한 되었다. 쥐 몇 표면 glomeruli 있기 때문에, 그것은 항상 1-광자 현미경으로 표면 glomerulus 찾을 수, 따라서 대부분의 micropuncture 연구는에서 실시 되었습니다 더 많은 표면 glomeruli 있는 뮌헨 Wistar 쥐. 따라서, 마우스 모델에서 작업의 장점 micropuncture 연구1,2,3에 제한 되었습니다. 이미징 기술, 마이크로-CT4,5를 포함 하 여 최근 발전 나노 이미징6및7 질량 분석 이미징 형식 사 생리학에 적용의 범위 향상 크게 하지만 대신할 독특한 남아 능력을 개입 하 고 그 micropuncture 샘플을 제공 합니다. 따라서 여기에 제시 된 기술을 사용 하 여 micropuncture 사용 하 여 확장 소설 신장 생리학 연구, 특히, 신장 여과 액 (즉, metabolomics)의 내용과의 기본적인 생리학의 평가 촉진 예정 이다 이전 filtrate 압력 및 충전, 측정 등의 유전자 변형 쥐 쥐에만 수행합니다.
이 기술에서는, 2 광자 현미경 사용 신장 캡슐 아래 시각화 및 약 100 µ m까지 신장 구조 micropipette 액세스 수 있습니다. 여러 (5-10) glomeruli 따라서 지금까지 몇 군데 모든 마우스 신장에서 micropuncture에 액세스할 수 있습니다. 기존의 신장 micropuncture와 일부 기능을 공유 하는이 기술을, 비록 그것은 디자인된 드 노 보 고 기존의 기술에서 광범위 한 수정 필요 합니다. 이 프로토콜에서 우리 보 먼의 공간에서 액체의 포부를 설명 하 고 질량 분석 (nanoproteomics)8,9,,1011이후 분석의 결과 예를 보여. 질량 분석의 다운스트림 사용 여기 시연 또한 특수 샘플 준비 워크플로를 필요 합니다.
프로토콜
여기에서 설명한 모든 절차는 기관 동물 관리 및 사용 위원회의 오 레 곤 건강 & 과학 대학에 의해 승인 되었다.
1입니다. 설치 데모 사용
- 직 립 2 광자 현미경, 3 축 스테이지 컨트롤러, headstage/피 펫 홀더 및 3 축 컨트롤러를 사용 하 여 headstage/피 펫 보유자; 이러한 항목의 모든 4가 필요 합니다.
참고: 많은 비슷한 설정을 사용할 수 있으며 피 펫 및 현미경 무대의 독립적인 양적 3 축 제어를 사용할 수 있습니다 그리고 현미경 vivo에서 똑바로 영상에 대 한 설정으로 충분 합니다.
2. 필요한 실험 프로토콜을 시작 하기 전에
- FITC-dextran, 2000000 다 정상적인 염 분 또는 인산 염 버퍼 신장 맥 관 구조를 표시 하려면 retroorbital 주입에 대 한 식 염 수에 5% 솔루션을 사용 합니다. 이 분자량 (MW)는 맥 관 구조에 남아 있기 때문에 필터링 하지 않습니다 선택 됩니다.
- 기계를 뽑아 붕 규 산 유리 micropipettes: 6-10 µ m 팁 긴 테이퍼, 닫힌 팁 설정을 사용 하 여 micropipettes를 끌어 (예를 들어, 열 610, 속도 = = 150, 시간 = 250 ms, 반복) micropipette 끌어당기는 사람에. 45 ° 베벨과 불꽃-폴란드어 가볍게.
- Micropipettes의 양자 점 코팅: 참조 된 프로토콜에 따라 양자 점으로 micropipette 팁 코트. 12
- 스페이서/Polysiloxane 신장 지원입니다. Polysiloxane 퍼 티를 사용 하 여 신장 지원/스페이서 공예. 패션 1 x 1 cm2 5 m m 두꺼운 직각 rhomboid (즉, 잘린된 큐브)에 의해 polysiloxane 퍼 티에서. 한 가장자리에서 polysiloxane는 rhomboid의 센터의 약 70%를 구성 하는 원 가운데 70%를 제거 합니다. 24 h 동안 건조를 polysiloxane를 수 있습니다. 그림 1을 참조 하십시오.
- Microinjector 준비: 폴 리 에틸렌 (PE)-50 튜브 길이 micropipette micropipette 로드 홀더 오일 프리 필. 질량 분석을 계획 하는 경우 perfluorodecalin은 필요한, 그렇지 않으면 광 유를 사용할 수 있습니다. 가스 꽉 해밀턴 형 주사기와 perfluorodecalin로 채우기는 microinjector를 설정 합니다. 이 PE-50 튜브와 피 펫 소유자에 연결 될 것입니다.
- 피 펫 홀더에 피펫으로 장소 앞으로 PE-50 튜브와 피 펫, 채우기 다음 PE-50 석유 채워진 해밀턴 주사기 튜빙, 피 펫에서 유압 시스템을 만드는 주사 통을 근 위 끝.
3. 측면 피펫은 액세스 새로운 수술 절차를 통해 열 이미징 액체 아래 신장에
참고: 이미징 지원 시스템 및 수술 준비의 조립은 그림 1에 표시 됩니다. 설명 하는 절차는 C57BL/6 쥐 20-25 g를 무게에서 수행 됩니다.
- 마우스 무게.
- 4 %isoflurane 사용 하 여 마 취를 유발 하 고 공기/산소 혼합물에서 1.5-2.5 %isoflurane 유지. 마우스는 고통 스러운 자극 및 감소 된 호흡 속도의 부재에 의해 마 취를 확인 합니다.
- 눈에 기름칠을 하 고는 baseplate에 동물 옆 위치. 테이프를 사용 하 여 4 사지 무력화
- 정상적인 염 분, 200 µ L를 피하 주사 하 고 직장 온도 프로브를 배치 합니다. 제어 온도 이미징 동안 수술 및 생리대 시 난방 램프를 사용 하 여.
- Depilatory 크림을 사용 하 여 마우스의 왼쪽에 모든 머리카락을 제거 합니다.
- 피부에서 볼 수 있는 비장을 찾아서 왼쪽된 신장 비장의 지 느 러 미와 꼬리에 찾습니다.
- 피부에 0.5 c m 절 개를 만들고, 복 막에 작은 절 개를 쉽게 밀어 신장에 대 한 충분.
- 부드러운 압력으로 신장 압출 성형. 신장 안정제 양식 신장 및 cyanoacrylate 접착제로 수정 polysiloxane로 만든 장소. 일렬로 신장은 스페이서와 함께 신장의 측면-대부분 표면 안정기 약 1 m m로 확장 되도록.
- 접착제로 안정제 폼 헤드 플레이트를 해결 하 고 머리 접시 바 베이스 플레이트에 마운트를 탑재.
- Polysiloxane 지원 1 %agarose 솔루션 신장 주변에 잘 작성 하 고 10 mm coverslip 위에 놓고 agarose는 회사 때까지. 접착제로 헤드 플레이트에 coverslip 봉인 하 고 치과 시멘트와는 coverslip 주위에 반지를 만듭니다.
- 복고풍 orbitally FITC-dextran (2000000 다 5% 용액, 100-150 µ L)를 주입 하 고 마우스와 고정 플레이트 2 광자 현미경 단계를 신속 하 게 이동, 마 취 및 적절 한 보장 폐기물 가스 현미경 스테이지에 청소 유지.
4. 보 먼의 공간에는 적당 한 Glomerulus와 피 펫의 선택
-
정의:
- 화면에 왼쪽 오른쪽 및 왼쪽-오른쪽 현미경을 직면 하 고 X를 정의
- 무대 컨트롤러에서 읽기 SX (단계 X)
- 피펫은 X 픽셀 정의 피펫으로에 다이얼 컨트롤러
- 화면에 아래로와 현미경 그리고 다시 2 광자 설치 쪽으로 앞으로 Y를 정의
- 아래 바닥 쪽으로 Z로 천장으로 정의 하 고 목표 Z 위치와 함께 무대에 측정.
- 무대 (정말 목표) 높이 Z S (O)를 정의 합니다.
-
신장는 눈에서 녹색 형광 단백질 (GFP) 필터 설정을 사용 하 여 식별의 표면을 찾아. FITC Dextran의 주입 때문에 맥 관 구조 밝은 녹색 될 것입니다.
- 적합 한 glomerulus를 식별 합니다. 확인 후 사용 하는 안구 신장의 표면, 2-광자 (아닌 스캔 모드)로 전환 하 고 이미징 창 찾아보기. Micropuncture에 대 한 유리한 특성은 다음: 수직 거리는 coverslip 아래 > 30 µ m (액세스 하는 동안 피 펫 coverslip 사이 충돌 방지)에 glomerulus 측면 신장 캡슐에서 거리 측면 및 < 400 µ m (이 거리를 넘어 피펫으로의 편차 증가 시킬 수 있습니다 미스의 가능성).
- 기록 옆과 수직 거리는 빵 꾸에 포인트는 glomerulus의 피 펫 측에 직접 신장 캡슐에 포인트.
- Y 단계 좌표 변경, 막 센티미터의 거리와 x 유지 물 열에 객관적인 초점 포인트를 올립니다.
- 물 란으로 피 펫 팁을 드라이브와 4', 6-diamidino-2-phenylindol (DAPI) 여기에 설정. X 및 y에 피 펫 팁의 최대한 형광의 지점에 치수, 올 목표의 센터를 이동 합니다. 이 정확한 prepositioning 없이 어렵다는 눈에는 피 펫을 찾는. 양자 점 형광 여기 파장에 (이 경우, 빨간색)에 동일한 파장에, 때문에 DAPI 여기 단단히 끝, 그림2에 초점을 맞추고 있는 빨간색 형광을 생성 합니다.
- 빨간 형광 성 단백질 (RFP)를 구동 설정을 변경, 안구에 피 펫을 시각화 다음 정확 하 게 눈 보기에 센터.
- 2 광자로 전환 하 고 2-광자, 이미지의 중심에 정확 하 게 배치에서 피 펫을 찾을 합니다. 이것은 등록 위치 이다.
- 피 펫의 이미지를 저장 합니다.
- 무대와 micropipette 컨트롤러 좌표를 등록 합니다.
참고: 사용 보조.html 파일을 단계 및 피 펫 좌표 사이 오프셋을 계산 하기 위해 자바 스크립트 코드, (시스템에 설치 된 스프레드시트 소프트웨어 없는 유리) 또는 스프레드시트를 사용 하 여 계산 실행 피 펫 컨트롤러에 대 한 대상 좌표를 계산 합니다. - 피펫으로 유지 z와 y 같은 x 축에 물 열에서 제거 합니다.
- 대상 glomerulus Z (즉, 이동은 coverslip 아래 Z 방향에서 아래로 피 펫)을 피펫으로 Z 이동
- 대상 glomerulus Y 좌표를 피펫으로 Y를 이동 합니다.
- 대상 glomerulus Z 그리고 신장 가장자리 2 광자 라이브 뷰를 이동 하 고 SX 합니다.
- 신장 가장자리 픽셀 등록 SX에서에서 오프셋을 사용 하 여 계산 합니다.
- 신장의 가장자리까지 계속 표시 하지만 화면의 왼쪽에는 피 펫 (증가 SX)으로 무대를 이동 합니다.
- 약 100 µ m 신장 가장자리 픽셀 위의 계산 보다는 더 적은을 피펫으로 신속 하 게 사전.
- 피펫으로 천천히 전진 피 펫 팁을 찾습니다. 빨간 이득 증가 하 고 빨간 픽셀 히스토그램 (픽셀 분포 교대 전에 피펫으로 창 양자 점과 오프 대상 형광의 극단적인 밝기 때문에 몇 군데)을 보고.
- 라이브 2 광자 영상에서 신장 가장자리에 진출.
참고: 입력 신장 캡슐, 전에 그것은 Y와 Z 치수에 피펫으로 리디렉션할 수입니다. 그러나,이 피 펫 팁을 깰 수 있습니다. 더 보수적인 측정 피펫으로 목표, 경우 최대 2 cm, 리디렉션, 및 신장 가장자리에 x에서 다음 반환 X 차원에서 철회 하는 것입니다. X 이외의 모든 축에서 움직임을 좋은 경험을 필요로 하는 피 펫 굴곡 이끌어 피펫으로 되 면 조직 내의의 사용 하 고 자주 파손에 이르게. - X 축에 피펫으로 드라이브 천천히 보고 대상 픽셀, SX에 눈을 유지. (가끔 다시 보고는 micropipette의 삽입 시에 이동 했다 경우 glomerulus가 야 도움이 됩니다).
- 때 올바른 위치, z-스택 문서 위치에에서 있습니다.
참고: 자리에 micropipette와 함께 약물, 단백질, 또는 형광 추적기 수 주입, 액체는 나중에 분석, 발음 수 있습니다 또는 압력 또는 다른 전극 기준으로 요금을 측정할 수 있습니다.
5. 보 먼의 공간에서 액체의 포부
- 100 주사를 micropump 설정 보장 하는 피 펫의 patency 고 피 펫 항목 중 연결에서 혼동을 줄이기 위해 perfluorodecalin 2 분 이상의 nL. 피 펫 위치 되도록 이미지 복원.
- 추가적인 여과 위한 4-6 분을 기다립니다.
- 최대 300 발음을 micropump 설정 최대 50 nL/min의 속도로 nL.
참고: 사 형태학에 있는 변화는 하지 관찰이 속도 제안 하는 포부 동안 공간에 액체의 배달의 속도 변경 하지 않습니다. 기존의 micropuncture에서 없는 오일 블록으로이 볼륨, 질량 분석에 필요한의 복구 주입된 perflourodecalin와 가능 하 게 관 액체의 일부를 포함할 수 있습니다. 민감한 이온 전극 측정 형광 분광학, 연쇄 반응, 및 기타 민감한 끝점 등 분석 실험에 대 한 낮은 볼륨을 사용할 수 있습니다. 질량 분석 하지 않으면 끝점, 미네랄 오일과 표준 micropuncture 기술을 저장 전에 aspirated 볼륨 측정 하 사용할 수 있습니다. - 이미지를 한 번 더입니다.
- 피펫으로 철회 하 고 샘플, TRIS 버퍼를 추가 하 고-80 ° 분석 전에 저장을 보존 한다.
- Isoflurane 또는 다른 승인 된 방법의 과다를 사용 하 여 마우스를 안락사
참고: Filtrate 사 모세 혈관에서 여과 하 여 공간을 입력합니다. 그러나 쥐에서 단일 nephron 사 여과 비율 (SNGFR) 8-14 nL/분3 사이 보고 Starling 세력 지배 SNGFR,,은 보 먼의 공간에 부정적인 압 따라서 SNGFR을 증가 시킬 수 있습니다. 그러나 표준 micropuncture 메서드 사용 하 여 관 봉쇄 석유와 중립 압력 관 유체 샘플링,이 화합물 방해 질량 분석 (아래 참조); 따라서,이 기술은 초기 근 관 특허 남아 있습니다. 또한, 당시 포부, 보 먼의 공간 filtrate의 긍정적인 볼륨 하지만 알 수 없는 포함합니다. 따라서, 유체 포부 속도 SNGFR을 초과할 수 있습니다.
참고: 여기서 설명 하는 실험에서 목표 더 큰 얻을 했다 nanoproteomic 기술에 의해 질량 분석 분석 사 filtrate의 평소 샘플 보다. 질량 분석의 사용 미네랄 오일이 나 왁 스 (신호: 소음 질량 분석에 있는 유기 분자의 복잡 한 혼합물) 오일 블록의 사용을 방해 하는 이후 perfluorodecalin micropipette과 주사기를 채우는 데 사용 됩니다. Perflourodecalin 관의 흐름을 차단 하 알려져 있지 하지만 생물학적으로 불활성 이며 질량 분석을 방해 하지 않습니다.
결과
이 절차에는 2 광자 이미징 및 액세스는 그림 1에 나와 있는 신장의 독특한 수술 준비가 필요 합니다. 여기에 표시 된이 준비 측면에 수평 (x에 독점적으로 구동 하는 피 펫에 대 한 액세스와 동시에 2 광자 현미경 검사 법에 대 한 최고의 가능한 광학에 대 한 몇 가지 밀도 변화 신장 위의 목적으로 수직 이미징 열 수 ) 차원. 신장 부분 압출 신장 작은 꽃 자루에 과잉 긴장을 방지 하 고 혈관의 흐름을 유지 고 건설 사용자 지정 신장 지원의 이미징 및 액세스의 두 가지 목표를 수 있습니다. 이 절차에서는 두 번째 도전은 피 펫 및 단계 좌표계의 등록을 요구 하는 3 차원, 신장 내 피 펫의 정확한 위치 이다. 이 프로세스에 대 한 중요 한 단계는 그림 2, DAPI 여기에서 2 광자 현미경의 물 열에 발견 되 고 피 펫을 보여 주는 그림입니다. 물 란을 입력 하 고 입력 신장 이전 무대의 피 펫의 좌표 등록 대상 보 먼의 공간 내에서 피 펫의 정확한 정위 적 위치 수 있도록 중요 하다. 피펫으로는 오른쪽에서 이미징 물 열을 입력합니다. DAPI 여기에, 빨간 양자 점 코팅 피펫으로 fluoresces 밝은 빨간색-주황색, 그리고 목표의 중간 아래 신중 하 게 배치 될 수 있습니다. 여기 빔 목표의 센터를 통해 전달, 피펫으로 최대 형광, 접 안 렌즈에 표시 될 것입니다 확보 지점으로 자유롭게 이동할 수 있습니다.
그림 3, , 그림 4 그림 5에서 볼 수 있듯이 적절 한 피 펫 고 glomerulus 선택이이 프로토콜의 성공에 중요 하다. 그림 3A, 제대로 뽑아, 레드-형광 양자 점 코팅 유리 micropipette 유체 열에 절차의 피 펫 등록 부분 몇 군데를 볼 수 있습니다. 팁 6 미크론 폭에서 이다입니다. 그림 3B, 제대로 뽑아 피 펫 12 µ m 팁이 표시 됩니다. 이 피 펫 12 µ m 직경 및 불규칙 한 팁 표면 (빗면의 상단에 버 노트) 혈관 외상을 일으키는 원인이 되기 없이 신장 캡슐을 침투 수 없습니다. 그림 3C 와 3D, 최적의 위치 보다는 대상 glomerulus의 이미징의 중요성은 표시 됩니다. 그림 3C 에 아름 다운, 표면 근처 glomerulus (신장 캡슐 아래 20 µ m에 그것의 표면 위치) 때문에 유리한 영상 보여줍니다 하지만 표면에 너무 가까이 있기 때문에이 절차에의 한 액세스에 적합 되지 않을 것 이라고 하 고 피펫으로 coverslip 거란. 그림 3D, 최적의 위치 glomeruli 표시 됩니다. 두 glomeruli (스케일 바는 모두 50 µ m)를 설명 하는 데 사용 하는 다른 규모 note 이러한 glomeruli 깊이;으로 인 한 굴절 때문에 덜 날카로운 표시 이 이미지는 신장 캡슐 아래 70 µ m에서 촬영 했다. 측면 신장 가장자리 오른쪽, 편리 모두 이러한 glomeruli 250 µ m 이다. 액세스 절차 중 이미징 밀접 하 게 그림 4처럼 대상 glomerulus에 초점을 맞춘 고 보 먼의 공간에서 피 펫의 위치를 정확 하 게 관찰 하는 탐정을 수 있도록 모든 초 이미지 수집 사용 됩니다.
그림 4 는 일반적인 신장 항목 및 결과, 보 먼의 공간 내에서 피 펫 팁을 보여 줍니다. 그림 4A에서 직교 뷰와 z 스택의 평균 강도 프로젝션 보 먼의 공간에서 피 펫 팁을 보여 줍니다. 참고 빨간색 피 펫 팁 스펙트럼 유물 (라운드 볼 형광의) 끝의 원뿔 부분에 양자 점의 매우 밝은 형광 때문 이다. 그림 4B에서 z-스택 데이터의 볼륨 투영 보 먼의 공간에서 또 다른 피 펫을 보여 줍니다. 피펫으로 프로토콜에 설명 된 대로 끝에 뒤에 tenting 명백한 만드는 항목에 여행의 방향에 활의 사 수의 캡슐 끌고 note.
그림 5, 실패 한 절차의 결과 출혈을 일으키는 신장 캡슐에서 너무 큰 개통을 가진 피 펫 파산 표시 됩니다. 피펫으로가 했다 너무 무딘; 신장 캡슐을 통과 하려고에 캡슐이 밀었습니다 앞으로 피 펫 팁 파손 발생 될 때까지. 이 이미지에서 신장 캡슐은 표시, FITC 형광 녹색에서 subcaspular 출혈에 의해 향상. FITC 신호 압력 혈액 피펫은 루멘을 입력 한다는 자체 피펫으로 내에서 표시 됩니다. 화살표는 많은 적혈구 결함 FITC dextran에 작성으로 피 펫 루멘 내 표시를 가리킵니다.
그림 6 보 먼의 공간 aspirate, 마우스 오 줌 단백질 17 (MUP17)에서 얻은 대표 질량 스펙트럼을 보여준다. 마지막으로, 표 1 단백질 aspirate 3 쥐의 각각에서 6 분 이상 수집에 nanoscale 질량 분석을 사용 하 여 식별 목록 성공적인 열망 절차의 예제 결과 보여 줍니다. 각각의 경우 피펫으로 했다 몇 군데 보 먼의 공간에서 철회 되었다 고 아무 FITC 형광 보 먼의 공간이 나 플라즈마와 함께 aspirate 오염의 부족을 나타내는 피 펫 루멘 내에서 관찰 되었다. 주로 저 분자 무게의 17 단백질 단백질 당 2 독특한 펩 티 드의 최소에서 확인 되었다. 스펙트럼 카운트는 낮은, 사 여과 액에는 단백질의 사전 예상치와 일치 하 고 필터링 된 단백질, 비타민 D 의무적인 단백질 (VTDB) 같은 알 부 민 (ALBU), 그리고 주요 오 줌 단백질 17 (MUP17)는 존재.

그림 1: 사용자 지정 지원 및 동원 정지 측면 액세스를 위해 신장의 부분 입체. 왼쪽, 이미징 및 신장 지원의 부분은 센터에서 완전 한 어셈블리와 함께 표시 됩니다. 오른쪽에 (위에) 신장 준비 하기 전에 표시 된 후 (아래) 응용 프로그램 지원. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
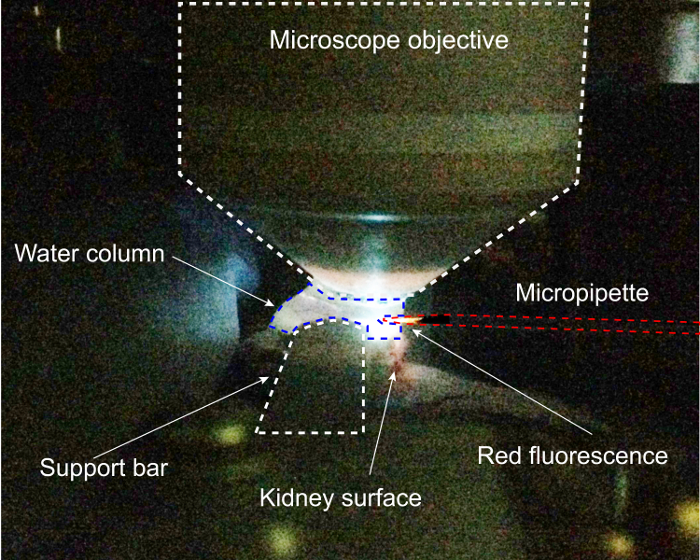
그림 2: 프로토콜의 피 펫 등록 단계에서 신장 준비 완료. 여기, DAPI 여기 2 광자 현미경의 물 열 내의 micropipette 위치에 사용 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
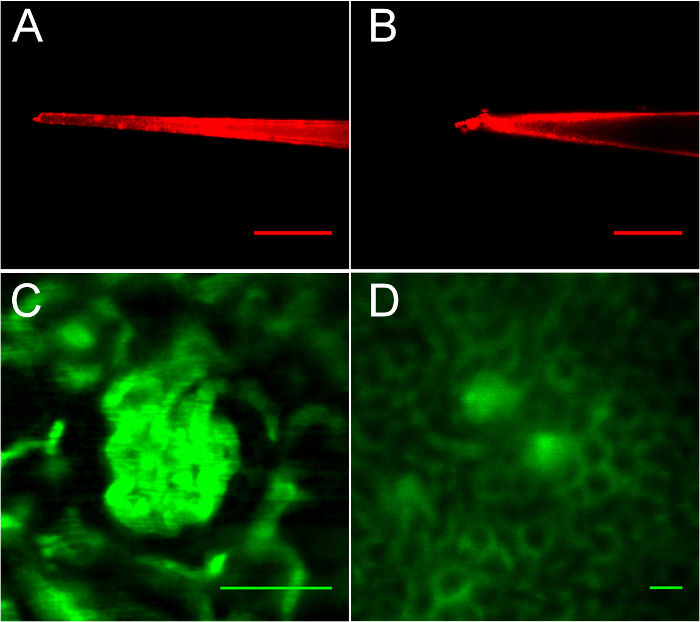
그림 3: micropuncture에 대 한 적합 및 부적합 glomeruli 시연 FITC-dextran의 주입 후 펫과 신장 이미징. A. 6 µ m 팁 잘 뽑아 피 펫. B. 거친 가장자리가, 무딘 팁. C. 이 glomerulus 분명, 하지만 micropuncture에 coverslip에 너무 가까이. 디 는 적당히 glomeruli 위치. 스케일 바는 모두 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
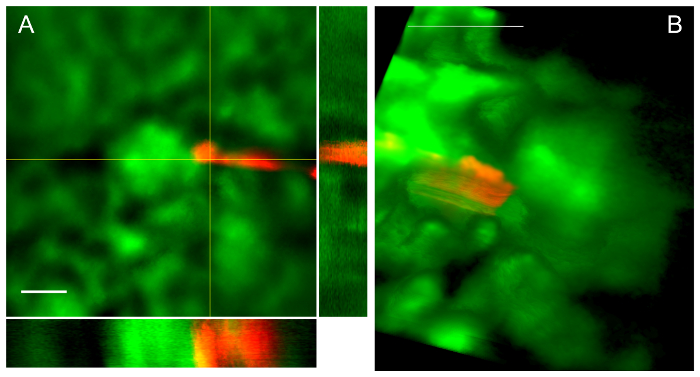
그림 4: 성공적인 피펫은 통로 2 다른 프로시저에서 보 먼의 공간 뷰에 배치를 이끌어. A. 직교 투영으로 Z-스택 사 술 인접 보 먼의 공간에서 피 펫 팁을 보여 줍니다. 눈금 막대는 50 µ m. b. Z 스택의 볼륨 렌더링은 마찬가지로 사 술 인접 보 먼의 공간에서 피 펫을 보여 줍니다. 눈금 막대는 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
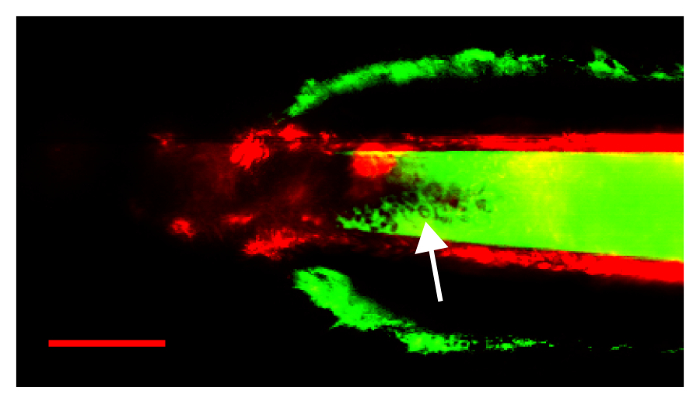
그림 5: 무딘 피 펫, 신장 캡슐을 찢 어 하 고 피펫으로 루멘에 출혈로 이어지는 인해 실패 절차. Extravasated 플라스마와 적혈구 (화살표) FITC 형광 피펫으로 내에서 볼 수 있습니다. 화살표는 적혈구 피펫은 루멘 내 표시를 가리킵니다. 눈금 막대는 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
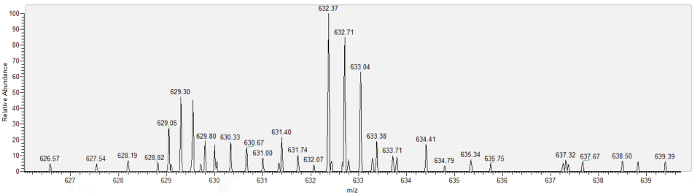
그림 6: 보 먼의 공간 aspirate의 나노 액체 크로마토그래피/질량 분석 분석에서 얻은 주요 오 줌 단백질 17 (MUP17)에 대 한 질량 스펙트럼. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 단백질 | MW (kD) | 스펙트럼의 수를 의미 |
| ACTA_MOUSE | 42 | 2 |
| ACTB_MOUSE | 42 | 1 |
| CLPX_MOUSE | 69 | 2.5 |
| DHSA_MOUSE | 73 | 1 |
| FOLR2_MOUSE | 29 | 1 |
| GBLP_MOUSE | 35 | 1 |
| ALBU_MOUSE | 66 | 6.7 |
| HBA_MOUSE | 15 | 2 |
| HBB1_MOUSE | 16 | 1 |
| MIB1_MOUSE | 110 | 1 |
| MUP17_MOUSE | 21 | 1 |
| PERI_MOUSE | 54 | 1 |
| RNAS4_MOUSE | 17 | 2 |
| SPTB1_MOUSE | 2 | 1 |
| VIME_MOUSE | 54 | 1 |
| VTDB_MOUSE | 53 | 1 |
표 1: 3 쥐에서 보 먼의 공간 aspirate에서 확인 된 단백질의 목록입니다.
보충 비디오 1: z 스택의 인수 후 모 세관 술 인접 공간 내에서 피 펫 팁을 보여 보 먼의 공간에는 피 펫 위치 볼륨 렌더링. 이 파일을 다운로드 하려면 여기를 클릭 하십시오.
토론
우리는 비 표면 glomeruli 쥐, 2 광자 현미경 검사 법에 의해 촉진 된의 보 먼의 공간에 액세스 하는 방법을 제시. 우리는 실험 목적, 보 먼의 공간에서 액체의 포부를 촉진 하기 위하여 사 micropuncture, 표면 glomeruli 생쥐, 1-광자 현미경으로 주소 지정이 가능한 희귀의 키 제한을 해결 하기 위해이 절차를 개발 이후 분석입니다. 개발 및이 기술의 연습 6 개 중요 한 단계에 달려있다. 첫째, 새로운 수술 준비 해야 신중 하 게 실시 이미징 물 열은 coverslip에서 실행 되지 않습니다 하 고는 coverslip 피펫으로의 대상인 신장의 영역 확장. 둘째, micropuncture에 사용 되는 유리 피 펫 2 광자 현미경, 양자 점을 사용 하 여 수행 됩니다에 대 한 표시 렌더링 되어야 합니다. 셋째, 정위 적 기술은 신장 표면 아래 100 µ m까지 3 차원에서 보 먼의 공간에는 피 펫을 정확 하 게 위치 해야 합니다. 따라서 중요 한 단계는 정밀 피펫으로 무대의 좌표 시스템에 등록. 대상 glomerulus의 4, 주의 선택은 신장 지원 구조 및 이미징 열에 의해 충돌 없이 피 펫에 액세스할 수 있도록 해야 합니다. 마지막으로, 인수 절차에 따라 심사 분석 단계를 부여 해야 합니다 하 고 분석 하 고 사 생리학 볼륨 및 액체 샘플의 취득 시기를 일치 해야 합니다.
우리는 많은 분석, 불꽃 광도, 민감한 이온 전극 측정, 압력, 볼륨 또는 충전의 측정 등 전통적인 micropuncture 끝점을 포함 하 여 연장 될 수 있습니다 인수 절차를 설계. 또한, 우리는이 기술을 소설 분석 끝점 연쇄 반응 (아마도 다음 miRNA에 대 한 반전 녹음 방송) 등 하류 질량 분석의 대사체학 의무가 있을 것입니다 믿습니다. 질량 분석을 촉진 하기 위하여 고용 하는 특별 한 수정 추가 논의 받을 자격이 그리고 그들은 몇 가지 한계를 부과. 첫째, 질량 분석은 매우 중요 한, 낮은 단백질 콘텐츠 및 micropuncture 샘플의 볼륨 렌더링 기존의 proteomic 탐사의 동적 범위는 단백질의 분석 했으며 따라서 단순화 된 nanoproteomics 필요한. 8 , 13 둘째, 최적화 하려면 초기 분석에 대 한 단백질 수확량, 우리 결정 aspirate의 200-300 nL 필요 하다 하지만 마우스 GFR은 8-14 nL만 하는 경우이 볼륨의 de novo filtrate 수집 포부의 20 분 아마도 오래 필요한 것 /min3. 우리 6 분 이상; 발음 선출 같이 도조 및 Endou 장기간된 포부 초기 근 관 유체14의 알 부 민 콘텐츠 변경, 그러나 우리의 포부 속도 filtrate 유입 속도 초과 하는 것이 즉. 이 절차의 사용자는 그들의 워크플로 설계에 그들의 실험 시스템에 사 여과의 생리를 고려 하도록 권장 된다. 질량 분석, 중요 한 기술, 광 유, 열망에 대 한 유압 시스템을 구성 하는 nephron의 세그먼트를 격리 micropuncture에서 일반적으로 사용 되는 등 도입된 석유 유출 물에서 신호에 의해 압도 것 이다. 따라서, 우리는이 목적을 위해 미네랄 오일 사용 하지 수 또는 그것의 다른 일반적인 사용, nanoliter 범위 샘플의 볼륨의 정량화. 대신 우리가 채울 시스템 생물학적으로 불활성, 질량 분석을 방해 하지 않습니다 이며 유리한 광학 특성이 있다 perfluorodecalin. 우리는 perfluorodecalin에 의해 부과 된 한계 극복할 수 있으며, 우리가 기대 하는 샘플 볼륨의 측정 및 봉쇄 관 세그먼트의 추가 기술 혁신에 노력 하 고 믿습니다.
대부분의 micropuncture 연구 뮌헨 Wistar 쥐, 근본적인의 손실이 증가 수가 표면 glomeruli, 하지만 관 전송 및 다른 신장 생리학이 크게 제한 된 생리 연구를 설명 하는에서 수행 되었습니다. 분자 생물학, 유전자 변형 마우스2,3의 도구입니다. 쥐에서 보 먼의 공간 micropipette 액세스 용이 그것 때문에 소설 기법을 따라서 이러한 중요 한 제한 완화 합니다. 우리 신장 filtrate proteomic 연구 nanoproteomics9로 알려진 높은 감도 질량 분석을 사용 하 여 액세스 하기 위해이 기술을 채택. 그러나, 아마 추가 응용 프로그램 있다. 예를 들어 필터링 된 단백질의 신장 생리 연구는 되었습니다 크게 주 었 형광 추적기를 사용 하 여 2 광자 현미경15,,1617. Micropuncture 2-광자 현미경 하의 추가 형광 분자로, 이웃, 비 주사 nephrons 컨트롤 역할을 수 있도록 단일 nephron 생리 연구 수행의 가능성을 제공 합니다. 그것은 필요한 조치의 명확한 설명이 이미 2 광자 현미경 및 micropuncture 장착 하는 실험실에서 광범위 한 채택 수 기대. 그것은 복잡 한, 비록 우리 지금 여러 번이이 절차를 수행 했습니다 하 고 여기에 소개 하는 상세 생리 발견을 위한 안정적인 플랫폼을 나타냅니다.
공개
저자는 공개 없다.
감사의 말
NIDDK K08 RDS에 MPH NIGMS P41 GM103493 DK090754. 이 자료는 자원으로 지원 되었다 (MPH)에 의해 작업의 결과 이며 포틀랜드 노 병 사변 의료 센터에 시설 사용. 내용을 미국 재향 군인 담당 부서 또는 미국 정부의 의견을 대표 하지 않는다.
자료
| Name | Company | Catalog Number | Comments |
| Upright 2 photon microscope | Zeiss | LSM 7MP | |
| 3 axis microscope stage controller | Sutter | MP-285 | |
| 3 axis headstage controller | Sutter | MP-225 | |
| Pipette holder | Molecular Devices | 1-HL-U | |
| Headstage | Molecular Devices | CV203BU | |
| FITC-dextran 2000 kDa MW | Sigma-Aldrich | 52471-1G | |
| borosilicate glass capillary tubes | Sutter | B150-110-7.5 | |
| Micropipette puller | Sutter | P-97 | |
| Quantum dots, 605 nm | Thermofisher | Q21701MP | |
| Polysiloxane | Sugru | No cat number | www.sugru.com, "original formula". Any color. |
| PE-50 tubing | Instech Labs | BTPE-50 | |
| Microinjector | WPI | UMP-3 | |
| Microinjector controller | WPI | Micro4 | |
| Perfluorodecalin | Sigma-Aldrich | 306-94-5 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| Coverslip, 10 mm | Harvard Apparatus | 64-0718 | |
| Headplate | Custom | No part number | Common in neuroscience labs, many suppliers |
| Head fixation device | Custom | No part number | Common in neuroscience labs, many suppliers |
| 30 G needle | Becton-Dickinson | 125393 | For retroorbital injection |
| Tuberculin syringe | Becton-Dickinson | 309626 | For retroorbital injection |
참고문헌
- Schnermann, J. Micropuncture analysis of tubuloglomerular feedback regulation in transgenic mice. Journal of the American Society of Nephrology. 10 (12), 2614-2619 (1999).
- Lorenz, J. N. Micropuncture of the kidney: a primer on techniques. Comprehensive Physiology. 2 (1), 621-637 (2012).
- Vallon, V. Micropuncturing the nephron. Pflugers Archive. European Journal of Physiology. 458 (1), 189-201 (2009).
- Perrien, D. S., et al. Novel methods for microCT-based analyses of vasculature in the renal cortex reveal a loss of perfusable arterioles and glomeruli in eNOS-/- mice. BMC Nephrology. 17, 24(2016).
- Ehling, J., et al. Quantitative Micro-Computed Tomography Imaging of Vascular Dysfunction in Progressive Kidney Diseases. Journal of the American Society of Nephrology. 27 (2), 520-532 (2016).
- Gimenez, Y., et al. 3D Imaging of Nanoparticle Distribution in Biological Tissue by Laser-Induced Breakdown Spectroscopy. Scientific Reports. 6, 29936(2016).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
- Piehowski, P. D., Zhao, R., Moore, R. J., Clair, G., Ansong, C. Quantitative proteomic analysis of mass limited tissue samples for spatially resolved tissue profiling. Methods in Molecular Biology. , (2017).
- Yi, L., Piehowski, P. D., Shi, T., Smith, R. D., Qian, W. J. Advances in microscale separations towards nanoproteomics applications. Journal of Chromatography A. 1523, 40-48 (2017).
- Clair, G., et al. Spatially-resolved proteomics: Rapid quantitative analysis of laser capture microdissected alveolar tissue samples. Scientific Reports. 6, 39223(2016).
- Huang, E. L., et al. SNaPP: Simplified nanoproteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), 1307-1314 (2016).
- Andrasfalvy, B. K., et al. Quantum dot-based multiphoton fluorescent pipettes for targeted neuronal electrophysiology. Nature Methods. 11 (12), 1237-1241 (2014).
- Huang, E. L., et al. SNaPP: Simplified nano-proteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), (2016).
- Tojo, A., Endou, H. Intrarenal handling of proteins in rats using fractional micropuncture technique. American Journal of Physiology. 263 (4 Pt 2), F601-F606 (1992).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments. (74), (2013).
- Sandoval, R. M., Kennedy, M. D., Low, P. S., Molitoris, B. A. Uptake and trafficking of fluorescent conjugates of folic acid in intact kidney determined using intravital two-photon microscopy. American Journal of Physiology: Cell Physiology. 287 (2), C517-C526 (2004).
- Salmon, A. H., et al. Loss of the endothelial glycocalyx links albuminuria and vascular dysfunction. Journal of the American Society of Nephrology. 23 (8), 1339-1350 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유