Method Article
Mikropunktion Bowmans Platz bei Mäusen durch die 2-Photonen-Mikroskopie
In diesem Artikel
Zusammenfassung
Kombination von 2 grundlegenden Techniken der renalen Physiologie präsentieren wir Verwendung von 2-Photonen-Mikroskopie, einer Mikropipette Bowmans Harn Raum bei Mäusen zu platzieren. Verwendung von 2-Photonen-Mikroskopie überwindet kritische Grenzen der konventionellen Mikroskopie für mikropunktion renal Physiology Studien.
Zusammenfassung
Renale mikropunktion und renalen 2-Photon Imaging sind wegweisende Techniken in renal Physiologie. Allerdings mikropunktion durch Abhängigkeit von konventionellen Mikroskopie auf Oberfläche Nephron Funktionen begrenzt ist, und 2-Photonen-Studien sind begrenzt, dass Interventionen nur auf der Orgel, statt der Nephron Ebene beurteilt werden können. Mikropunktion Studien über die Glomeruli Mäuse sind vor allem durch den Mangel an Oberfläche Glomeruli bei Mäusen angefochten worden. Um diese Einschränkung zu beheben um aspirat aus dem Weltraum Bowmans in physiologischen Mausmodellen studieren, haben wir 2-Photonen glomerulären mikropunktion entwickelt. Wir präsentieren Ihnen eine neuartige chirurgische Vorbereitung, die seitlichen Zugang zu den Nieren unter Wahrung der erforderlichen bildgebenden Vertikalsäule für 2-Photonen-Mikroskopie kann. Verwaltung von hochmolekularen Fluorescein erfolgt (FITC)-Dextran wird verwendet, um den renalen Gefäßsystem und damit Glomeruli für 2-Photon Imaging sichtbar zu machen. Eine Quantum Dot-beschichtete Pipette wird dann unter stereotaktischen Führung eines Glomerulus ausgewählt aus eingeführt mehrere, viele, die innerhalb des imaging-Fensters visualisiert werden können. In diesem Protokoll geben wir die Vorbereitung, Materialien und Methoden zur Durchführung des Verfahrens erforderlich. Diese Technik ermöglicht bisher nicht physiologische Studie der Niere, einschließlich Wiederherstellung von Filtrat von Bowmans Raum und alle Segmente der Nephron innerhalb der bildgebenden Tiefe, etwa 100 µm unterhalb der renalen Kapsel. Druck, Ladung und Strom können mit der eingeführten Pipette gemessen werden. Hier bieten wir Ihnen repräsentative Daten von flüssige Chromatographie/Massenspektrometrie auf aspirat von Bowmans Raum durchgeführt. Wir erwarten, dass diese Technik, breite Anwendbarkeit in renal physiologische Untersuchung zu haben.
Einleitung
Der Zweck dieses Verfahrens ist Routine mikropunktion Zugang zu Bowmans Raum und andere glomerulären Strukturen in den Mäusen. Mikropunktion wurden für renale Physiologie Studien beschränkt sich auf 1-Photonen-Mikroskopie, die können nur innerhalb von wenigen µm der Niere Oberfläche Bild und bietet begrenzte Präzision in der Z-Dimension. Da Mäuse paar Oberfläche Glomeruli haben, es ist nicht immer möglich, eine Oberfläche Glomerulus durch 1-Photonen-Mikroskopie zu finden, daher die meisten mikropunktion Studien wurden durchgeführt in München-Wistar-Ratten, die immer zahlreicher Oberfläche Glomeruli haben. Daher haben die Vorteile der Arbeit in Mausmodellen in mikropunktion Studien1,2,3begrenzt worden. Jüngste Fortschritte in der imaging-Technologien, einschließlich Mikro-CT-4,5, Nanopartikel6imaging und bildgebende Massenspektrometrie7 haben das Spektrum der Modalitäten zur glomerulären Physiologie, erheblich verbessert, aber Es bleibt kein Ersatz für die einzigartige Möglichkeit bietet, zu intervenieren und probieren Sie die mikropunktion. Daher Ausweitung der Anwendung des mikropunktion mit den hier vorgestellten Techniken soll Roman renal Physiology Studien, insbesondere Bewertung des Inhalts der renalen Filtrat (d.h., Metabolomik) und grundlegende Physiologie der erleichtern Transgene Mäuse, wie Messungen von Filtrat Druck und Ladung, die zuvor nur in Ratten durchgeführt.
Bei dieser Technik ermöglicht die Verwendung von 2-Photonen-Mikroskopie Visualisierung und Mikropipette Zugang zu renaler Strukturen bis zu etwa 100 µm unterhalb der renalen Kapsel. Mehrere (5-10) Glomeruli sind damit zugänglich zu mikropunktion in jedem Mausniere bisher abgebildet. Obwohl diese Technik einige Features mit konventionellen renal mikropunktion teilt, es war gestaltete de Novo und umfangreiche Modifikationen von konventioneller Technik erforderlich sind. In diesem Protokoll wir demonstrieren Aspiration von Flüssigkeit aus dem Weltraum Bowmans und Beispielergebnisse der nachfolgenden Analyse mit Massenspektrometrie (Nanoproteomics)8,9,10,11zeigen. Nachgeschaltete Verwendung von Massenspektrometrie erfordert einen spezielle Probe Vorbereitung Workflow, der auch hier deutlich wird.
Protokoll
Alle hier beschriebene Verfahren wurden von der institutionellen Animal Care und Nutzung Ausschuss der Oregon Health & Science University angenommen.
1. Setup zur Demonstration
- Verwenden Sie eine aufrechte 2-Photonen-Mikroskop, 3-Achsen-Bühne Controller, Inhaber eines Headstage/Pipette und einem 3-Achs-Controller für den Headstage/Pipette Halter; alle vier dieser Elemente sind erforderlich.
Hinweis: Viele ähnliche Einstellungen stehen zur Verfügung und genügt als unabhängige quantitative 3-Achsen-Steuerung der Pipette und Mikroskop Bühne stehen und das Mikroskop für in Vivo aufrechte Bildgebung eingerichtet ist.
2. Materialien notwendig vor Beginn der experimentelle Protokolle
- FITC-Dextran, 2.000.000 Da 5 % ige Lösung in normalen Kochsalzlösung oder Phosphat-gepufferte Kochsalzlösung Injektionslösung Retroorbital anlässlich der renalen Gefäßsystem zu verwenden. Das Molekulargewicht (MW) wird ausgewählt, da es in das Gefäßsystem bleibt und wird nicht gefiltert.
- Maschine zog Borosilikatglas Mikropipetten: ziehen Sie Mikropipetten bis 6 – 10 µm Spitze mit langen Kegel, geschlossene Spitze Einstellungen (z. B. Wärme = 610, Geschwindigkeit = 150, Zeit = 250 ms, geloopt) auf einer Mikropipette Puller. Auf 45° abgeschrägt und Flamme-polnische leicht.
- Quantenpunkt Beschichtung von Mikropipetten: Mikropipette Tipps mit Quantenpunkte nach dem referenzierten Protokoll zu beschichten. 12
- Polysiloxan Niere Unterstützung/Abstandshalter. Verwenden Sie Polysiloxan Kitt, einen Niere Unterstützung/Abstandhalter Handwerk. Ein 1 x 1 cm2 Mode von 5 mm Dicke rechtwinkliger Rhomboid (d.h. einen abgeschnittenen Würfel) aus Polysiloxan Kitt. Entfernen Sie die mittlere 70 % Polysiloxan von einem Rand und einem Kreis, bestehend aus etwa 70 % des Zentrums der Rhomboid. Lassen Sie die Polysiloxan 24 h trocknen. Siehe Abbildung 1.
- Microinjector Vorbereitung: Vorausfüllen von einer Länge von Polyethylen (PE)-50 Schlauch und dem Inhaber der Mikropipette geladen Mikropipette mit Öl. Wenn Massenspektrometrie geplant ist, Perfluorodecalin ist erforderlich, sonst Mineralöl verwendet werden. Richten Sie die Microinjector mit einem gasdichten Hamilton-Typ Spritze und füllen sich mit Perfluorodecalin. Dies wird mit der PE-50 Schlauch und Pipette Halter verbunden sein.
- Setzen Sie die Pipette in die Pipette Halter und nach vorne füllen Sie PE-50 Schläuche und Pipette, dann befestigen Sie das proximale Ende des PE-50 Schläuche an der Ölgefüllte Hamilton-Spritze, Schaffung eines hydraulischen Systems aus Pipette zu spritzen.
(3) seitliche Pipette Zugriff auf die Niere unter einer Flüssigkeit Imaging Spalte über eine neuartige Operationsverfahren
Hinweis: Die Montage der imaging Support-System und chirurgische Vorbereitung ist in Abbildung 1dargestellt. Das beschriebene Verfahren erfolgt auf C57BL/6 Mäusen mit einem Gewicht von 20 – 25 g.
- Wiegen Sie die Maus.
- Anästhesie mit 4 % Isofluran zu induzieren und pflegen mit 1,5 – 2,5 % Isofluran in Luft/Sauerstoff-Gemisch. Bestätigen Sie, dass die Maus durch mangelnde Reaktion auf schmerzhafte Reize und reduzierte Atemfrequenz betäubt ist.
- Schmieren Sie die Augen und positionieren Sie das Tier seitlich auf einer Grundplatte zu. 4 Extremitäten mit Klebeband zu immobilisieren.
- Normale Kochsalzlösung, 200 µL subkutan zu injizieren und eine rektale Temperatursonde legen. Regeltemperatur mit einer Wärmelampe während der Operation und ein Heizkissen während der Bildgebung.
- Entfernen Sie alle Haare auf der linken Seite der Maus mit einer Enthaarungscreme.
- Suchen Sie die Milz, die unter der Haut sichtbar ist, und suchen Sie die linke Niere auf der dorsalen und kaudalen Seite der Milz.
- Machen einen 0,5 cm Schnitt auf der Haut und kleineren Schnitt auf das Peritoneum, gerade genug für die Niere leicht durchzusetzen.
- Extrudieren Sie die Niere mit sanftem Druck. Platzieren Sie Niere Stabilisator Form mit Polysiloxan rund um die Niere und Fix mit Cyanacrylat-Klebstoff hergestellt. Die Niere mit dem Spacer Line-up, derart, dass die Lateral-die meisten Oberfläche der Niere über den Stabilisator ca. 1 mm hinausgeht.
- Eine Kopfplatte, Stabilisator Form mit Kleber fixieren und die Kopfplatte, Montagebrücken auf der Grundplatte zu montieren.
- Füllen Sie den Brunnen in der Polysiloxan-Support rund um die Niere mit 1 % Agarose-Lösung und oben legen Sie 10 mm deckgläschen auf und halten Sie bis Agarose fest ist. Verschließen Sie Deckglas auf der Kopfplatte mit Klebstoff und erstellen Sie einen Ring um das Deckglas mit dental Zement.
- Injizieren Sie FITC-Dextran (2.000.000 Da, 5 % ige Lösung, 100 – 150 µL) Retro-Orbital zu und bewegen Sie die Maus und Fixierung Platte zur Stufe 2-Photonen-Mikroskop schnell, Aufrechterhaltung der Narkose und die Gewährleistung angemessener Gas Aufräumvorgang auf den Mikroskoptisch verschwenden.
4. Auswahl einer geeigneten Glomerulus und Pipette Zugang zum Bowmans Weltraum
-
Definitionen:
- Definieren von X als Links-Rechts auf dem Bildschirm und Links-Rechts mit Blick auf das Mikroskop
- Lesen Sie SX (Stufe X) von der Bühne-controller
- Definieren Sie PX als Pipette X, wählen Sie auf die Pipette controller
- Y wie oben-unten auf dem Bildschirm und nach vorne in Richtung des Mikroskops und zurück in Richtung der 2-Photonen-Setup zu definieren
- Definieren Z so bis gegen die Decke nach unten in Richtung Boden, und auf der Bühne mit dem Ziel Z-Position gemessen.
- S (O) Z als Bühnenhöhe (wirklich das Ziel) zu definieren.
-
Die Oberfläche der Niere, identifizierbare mit grün fluoreszierenden Proteins (GFP) Filter-Einstellungen in das Okular zu finden. Durch die Injektion von FITC-Dextran wird das Gefäßsystem leuchtend grün sein.
- Eine geeignete Glomerulus zu identifizieren. Nach der Identifizierung der Oberfläche der Niere mit Hilfe des Okulars, wechseln Sie zu 2-Photonen (nicht-Scan-Modus) und erkunden Sie die Image-Fenster. Günstige Eigenschaften für mikropunktion sind die folgenden: vertikaler Abstand unter dem Deckglas > 30 µm (um Kollision zwischen der Pipette und Deckglas beim Zugriff zu verhindern) und seitliche Entfernung der lateralen Niere Kapsel des Glomerulus < 400 µm (jenseits dieser Entfernung kann die Abweichung der Pipette Wahrscheinlichkeit eine Miss erhöhen).
- Rekord lateralen und vertikalen Abstand von der Punktion darauf, einen Punkt auf die renale Kapsel direkt auf die Pipette-Seite des Glomerulus.
- Heben der objektiven Dreh-und Angelpunkt in der Wassersäule, halten die x und y-Koordinaten Bühne unverändert, einer Entfernung von nur etwa einen Zentimeter.
- Fahren Sie die PIPETTENSPITZE in der Wassersäule und schalten Sie 4', 6-Diamidino-2-Phenylindol (DAPI) Erregung. Bewegen Sie die Pipette in die x- und y-Dimensionen bis hin zur maximalen Fluoreszenz der Spitze, das wird die Mitte des Ziels. Die Pipette in das Okular zu finden ist schwierig, ohne diese genaue Stationierung. Weil Quantenpunkte an (in diesem Fall rot) Wellenlänge unabhängig von Erregung Wellenlänge fluoreszieren, produziert die DAPI Erregung rote Fluoreszenz, die dicht an der Spitze, in Figur 2dargestellten ausgerichtet ist.
- Die Erregung Einstellung rot fluoreszierende Protein (RFP) und visualisieren Sie die Pipette in das Okular und zentrieren Sie ihn genau in der Okular-Ansicht.
- Wechseln Sie zur 2-Photonen und finden Sie die Pipette unter 2-Photonen, indem es genau in der Mitte des Bildes zu. Dies ist die Registrierung-Position.
- Speichern Sie ein Bild der Pipette.
- Registrieren Sie die Bühne und die Mikropipette Controller Koordinaten.
Hinweis: Verwenden Sie die zusätzliche HTML-Datei, die ausgeführt werden Berechnungen mit JavaScript-Code (vorteilhaft auf Systemen, die nicht installierten Tabellenkalkulations-Software verfügen) oder eine Tabelle zu den Versatz zwischen Bühne und Pipette Koordinaten zu berechnen Berechnen Sie die Zielkoordinaten für den Controller der Pipette. - Entfernen Sie die Pipette aus der Wassersäule in der x-Achse, Z und y gleich zu halten.
- Die Pipette Z ans Ziel Glomerulus Z (d. h. bewegen Sie die Pipette nach unten in der Z-Richtung unter dem Deckglas)
- Bewegen Sie die Pipette Y auf die Ziel-Glomerulus Y-Koordinate.
- Bewegen Sie die 2-Photonen-live-Ansicht zu, um das Ziel Glomerulus Z und dann an den Rand der Niere und beachten Sie die SX.
- Berechnen Sie die Niere Kante mit den Offset von der Registrierung SX PX.
- Verschieben Sie die Phase in Richtung der Pipette (Erhöhung der SX), so dass der Rand der Niere weit auf der linken Seite des Bildschirms, aber noch sichtbar ist.
- Fördern Sie die Pipette schnell auf weniger als die Niere-Kante, die PX oben berechnet etwa 100 µm.
- Suchen Sie die PIPETTENSPITZE, die Pipette langsam voran. Erhöhen Sie den Rote Gewinn zu und beobachten Sie das rote Pixel-Histogramm (die Pixel Verteilung Verschiebungen vor die Pipette in das Fenster, durch die extreme Helligkeit der Quantenpunkte und Ziel-Fluoreszenz abgebildet wird).
- Wechseln Sie zur Niere Rand unter live 2-Photonen-Bildgebung.
Hinweis: Vor dem Eintritt in die renale Kapsel, ist es möglich, die Pipette in der Y- und Z-Dimensionen umzuleiten. Jedoch kann dies die PIPETTENSPITZE brechen. Eine eher konservative Maßnahme, ist die Pipette vom Zielwert, berechtigt, in der X-Dimension bis zu 2 cm, umleiten und dann zurück in die X-Dimension an den Rand der Niere. Die Pipette ist innerhalb des Gewebes, Bewegung in jeder Achse als X führt zu Pipette Flexion erfordert große Erfahrung machen Verwendung von, und häufig führt zu Bruch. - Fahren Sie die Pipette in der x-Achse langsam Glom auf PX, ein Auge auf die SX. (Es ist hilfreich, um gelegentlich zurück, um den Glomerulus zu sehen, ob es überhaupt beim Einsetzen der Mikropipette verschoben hat).
- Wenn Sie an der richtigen Position, Position des Dokuments mit einem Z-Stapel sind.
Hinweis: Mit der Mikropipette in Ort, Drogen, Proteine oder Fluoreszenz Tracer können injiziert werden, Flüssigkeit kann für eine spätere Analyse aspiriert oder Druck oder kostenlos im Vergleich zu anderen Elektrode gemessen werden kann.
(5) Absaugen von Flüssigkeit aus dem Bowmans Weltraum
- Legen Sie die Mikropumpe 100 zu injizieren nL von Perfluorodecalin über 2 min Durchgängigkeit der Pipette zu gewährleisten und Störfaktoren aus Pipette einstecken, während der Eingabe zu reduzieren. Voraussichtlich um Pipette Position zu gewährleisten.
- Warten Sie 4 – 6 min. für zusätzliche Filterung.
- Legen Sie die Mikropumpe für bis zu 300 Aspirieren nL mit einer Geschwindigkeit von bis zu 50 nL/min.
Hinweis: Änderungen in der glomerulären Morphologie nicht eingehalten mit diesem Tempo weitergeht, was darauf hindeutet, dass es nicht die Rate der Lieferung von Flüssigkeit in den Raum während Anspruch ändert. Da gibt es kein Öl-Block wie in konventionellen mikropunktion, könnte Wiederherstellung dieses Bandes, notwendig für die Massenspektrometrie, die eingespritzte Perflourodecalin und möglicherweise röhrenförmige Flüssigkeit gehören. Für Assays wie Ionen-sensitiven Elektrode Messungen Fluoreszenzspektroskopie, Polymerase-Kettenreaktion und andere empfindliche Endpunkte können geringere Mengen verwendet werden. Wenn die Massenspektrometrie nicht der Endpunkt ist, Mineralöl und standard mikropunktion Techniken lässt sich das abgesaugte Volumen vor der Einlagerung zu messen. - Bild noch einmal.
- Zurückziehen Sie die Pipette und bewahren Sie die Stichprobe, Hinzufügen von TRIS-Puffer und Speicherung bei-80 ° vor der Analyse.
- Einschläfern Sie die Maus mit einer Überdosis Isoflurane oder andere anerkannte Methode.
Hinweis: Filtrat betritt den Raum durch Filtration aus den glomerulären Kapillaren. Die Single-Nephron glomeruläre Filtrationsrate (SNGFR) bei Mäusen wird zwischen 8 – 14 nL/min.3 berichtet, Starling Kräfte regieren SNGFR, aber, und negativen hydrostatischer Druck in Bowmans Raum kann daher SNGFR erhöhen. Standard mikropunktion Methoden verwenden röhrenförmigen Blockade mit Öl und neutraler Druck für röhrenförmige Flüssigkeit Sampling, aber diese Verbindungen stören Massenspektrometrie (siehe unten); Deshalb bleibt bei dieser Technik der frühen proximalen Röhrchen patent. Weiter zum Zeitpunkt der Aspiration enthält Bowmans Leerzeichen eine unbekannte, aber positive Volumen von Filtrat. Daher kann Flüssigkeit Absaugen Rate SNGFR überschreiten.
Hinweis: In den hier beschriebenen Experimenten Ziel war es, ein größeres zu erhalten als übliche Probe der glomerulären Filtrat für die Massenspektrometrie Analyse durch Nanoproteomic Techniken. Seit Einsatz der Massenspektrometrie schließt die Verwendung von Öl-Blöcke mit Mineralöl oder Wachs (komplexe Gemische organischer Moleküle die Signal: in der Massenspektrometrie Lärmminderung) wird Perfluorodecalin verwendet, um die Mikropipette und Spritze füllen. Perflourodecalin ist nicht bekannt, röhrenförmigen Fluss blockieren aber ist biologisch inert und Massenspektrometrie nicht stört.
Ergebnisse
Dieses Verfahren erfordert eine einzigartige chirurgische Vorbereitung der Niere für 2-Photon Imaging und Zugang, die in Abbildung 1dargestellt ist. Dieses Präparat hier gezeigten ermöglicht eine vertikale bildgebende Spalte mit dem Ziel, über die Niere mit paar Dichteänderungen für bestmögliche Optik für 2-Photonen-Mikroskopie gleichzeitig mit seitlichen Zugang für die Pipette angetrieben ausschließlich in horizontaler (x ) Dimension. Partielle Extrusion der Niere verhindert übermäßige Spannung auf die renale Knochenschrauben und bewahrt Kreislauf fließen, und Aufbau einer benutzerdefinierten Niere-Unterstützung ermöglicht die beiden Ziele der Bildgebung und Zugang. Die zweite Herausforderung in diesem Verfahren ist die präzise Positionierung der Pipette innerhalb der Niere in 3 Dimensionen, die Registrierung der Pipette und Bühne Koordinatensysteme erfordert. Der entscheidende Schritt für diesen Prozess ist in Abbildung 2dargestellt, zeigt die Pipette entdeckt in der Wassersäule von der 2-Photonen-Mikroskop unter DAPI-Anregung. Eintritt in die Wassersäule und registrieren die Koordinaten der Pipette, die von der Bühne vor dem Eintritt in die Niere ist entscheidend für Stereotaktische präzise Positionierung der Pipette in das Ziel Bowman Raum zu ermöglichen. Die Pipette betritt die bildgebenden Wassersäule von rechts. Mit DAPI Erregung eingeschaltet die roten Quantum Dot-beschichtete Pipette fluoresziert hell in rot-Orange und sorgfältig unter die Mitte des Ziels positioniert werden kann. Während der Mitte des Ziels der Erregung Strahl durchläuft, kann die Pipette frei verschoben werden, bis zu dem Punkt der maximalen Fluoreszenz, um sicherzustellen, dass es in das Okular sichtbar werden.
Auswahl der richtigen Pipette ziehen und Glomerulus sind entscheidend für den Erfolg dieses Protokolls, wie in Abbildung 3, Abbildung 4, Abbildung 5dargestellt. In Abbildung 3Asehen Sie ein richtig gezogen, rot-fluoreszierend Quantum Dot-beschichtete Glas Mikropipette abgebildet in der Flüssigkeitssäule während der Pipette Registrierung Teil des Verfahrens. Die Spitze ist 6 µm Breite. Abbildung 3 bist eine schlecht zog Pipette mit 12 µm Spitze dargestellt. Diese Pipette durchdringen nicht renale Kapsel, ohne dass vaskuläre Trauma aufgrund der 12 µm Durchmesser und unregelmäßige Tipp Oberfläche (man beachte den Bohrer an der Spitze der Abschrägung). In Abbildung 3 und 3Dzeigt die Bedeutung der optimalen Positionierung anstatt Bildgebung des Ziel-Glomerulus. Die schöne, oberflächennahe Glomerulus in Abbildung 3 dargestellten zeigt günstige Bildgebung (wegen seiner Oberfläche Lage am 20 µm unterhalb der renalen Kapsel) aber wäre nicht für den Zugriff durch dieses Verfahren geeignet, denn es ist zu nahe an der Oberfläche und die Pipette schlug das Deckglas. In Abbildung 3Dsind optimal positioniert Glomeruli gezeigt. Beachten Sie die unterschiedlichen Skala verwendet, um beide Glomeruli veranschaulichen (Maßstabsleisten sind alle 50 µm). Diese Glomeruli erscheinen weniger scharf wegen Brechung verursacht durch Tiefe; Dieses Bild wurde bei 70 µm unterhalb der renalen Kapsel aufgenommen. Die seitlichen Niere Kante ist 250 µm auf der rechten Seite, beide diese Glomeruli zugänglich zu machen. Während ein Zugriffsverfahren Bildgebung ist eng fokussiert auf das Ziel Glomerulus wie in Abbildung 4, und jeder zweite Bildaufnahme verwendet wird, so dass die Ermittler, genau zu beobachten, Positionierung der Pipette in Bowmans Raum.
Abbildung 4 zeigt einen typischen renalen Eintrag und das Ergebnis einer PIPETTENSPITZE Bowmans Raum. Abbildung 4Azeigt eine mittlere Intensität Projektion von einem Z-Stapel mit orthogonalen Ansichten die PIPETTENSPITZE in Bowmans Raum. Beachten Sie, dass es rote Pipette Tipp spektrale Artefakt (Runde Kugel der Fluoreszenz) wegen extrem helle Fluoreszenz von Quantenpunkten, die auf den konischen Abschnitt der Spitze angeordnet. In Abbildung 4 bzeigt eine Volumen-Projektion von Z-Stapel-Daten einer anderen Pipette in Bowmans Raum. Beachten Sie, dass die Pipette auf Eintrag erstellen scheinbare Zelten hinter der Spitze, wie im Protokoll beschrieben Bowman die Kapsel in Fahrtrichtung gezogen.
In Abbildung 5werden die Ergebnisse einer gescheiterten Prozedur angezeigt, in dem eine Pipette mit eine zu große Öffnung in der renalen Kapsel, verursachen Blutungen brach. Die Pipette war zu stumpf; am Versuch, die renale Kapsel zu übergeben, wurde die Kapsel vor der Pipettenspitze geschoben, bis Bruch aufgetreten ist. In diesem Bild ist die renale Kapsel sichtbar, ergänzt durch Subcaspular Blutungen, FITC-fluoreszierend grün. FITC Signal ist sichtbar in der Pipette selbst darauf hinweist, dass Blut unter dem Druck der Pipette Lumen eingegeben. Der Pfeil zeigt zu viele rote Blutkörperchen innerhalb der Pipette Lumen als Füllung Mängel in der FITC-Dextran sichtbar.
Abbildung 6 zeigt eine repräsentative Massenspektrum von Bowmans Raum Auwäldchen, Maus Urin Protein 17 (MUP17) erhalten. Zu guter Letzt zeigt Tabelle 1 Beispielergebnisse der erfolgreichen Aspiration Verfahren Inserat Proteine identifiziert mit nanoskaligen Massenspektrometrie auf aspirat gesammelt über 6 Minuten von jedem der 3 Mäuse. In jedem Fall war die Pipette abgebildet, wie es Bowmans Raum entzogen war und keine FITC-Fluoreszenz in Bowmans Raum oder die Pipette Lumen, zeigt Mangel an aspirat Kontamination mit Plasma beobachtet wurde. 17 Proteine, in erster Linie von niedermolekularen, wurden von einem Minimum von 2 einzigartige Peptide pro Protein identifiziert. Spektrale zählt, sind niedrig, im Einklang mit früheren Schätzungen von Eiweiß in glomerulären Filtrat und bekannt gefilterte Proteine, wie z.B. Vitamin-D-bindendes Protein (VTDB), Albumin (ALBU) und großen Harn Eiweiß 17 (MUP17) vorhanden sind.

Abbildung 1: partielle Extrusion der Niere mit individuellem Support und Immobilisierung für seitlichen Zugang. Auf der linken Seite sind die Teile der bildgebenden Spalte und Niere Unterstützung gezeigt, die Komplettmontage in Mitte. Auf der rechten Seite zeigt die Niere Vorbereitung vor (oben) und nach (Anwendung des Supports siehe unten). Bitte klicken Sie hier für eine größere Version dieser Figur.
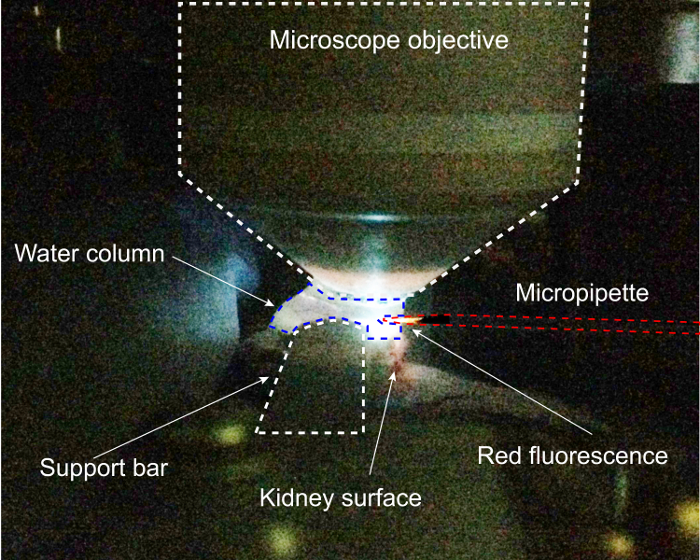
Abbildung 2: Niere Prep auf Pipette Registrierungsschritt des Protokolls abgeschlossen. Hier wird DAPI Erregung verwendet, die Mikropipette innerhalb der Wassersäule von der 2-Photonen-Mikroskop zu positionieren. Bitte klicken Sie hier für eine größere Version dieser Figur.
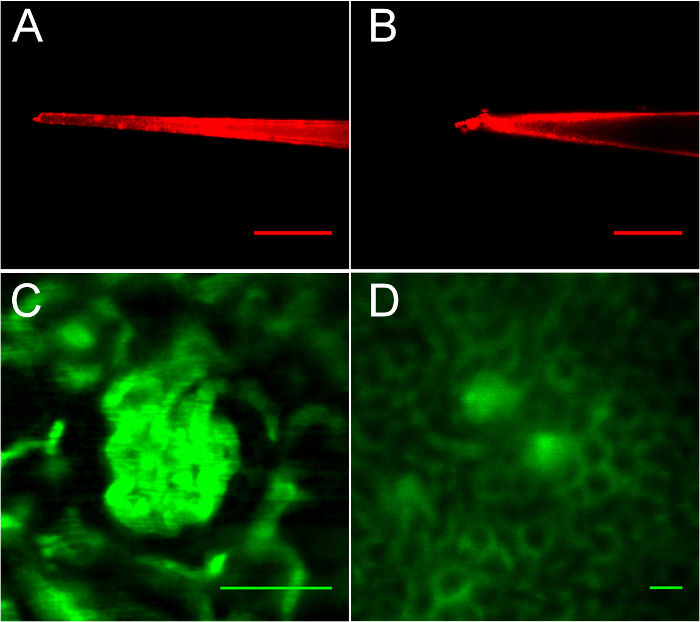
Abbildung 3: Imaging von Pipetten und der Niere nach Injektion von FITC-Dextran, zeigen geeignete und ungeeignete Glomeruli für mikropunktion. A. ein gut gezapftes Pipette mit 6 µm Spitze. B. eine raue Kanten, stumpfe Spitze. C. dieses Glomerulus ist wohldefiniert, aber zu nah an das Deckglas für mikropunktion. D. Entsprechend positioniert Glomeruli. Maßstabsleisten sind alle 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
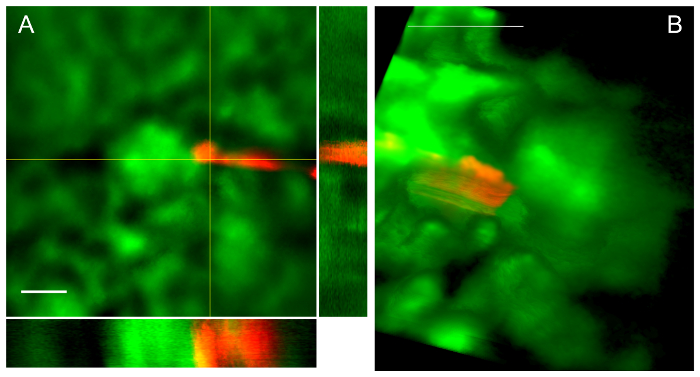
Abbildung 4: erfolgreiche Pipette Passage führt zur Platzierung in Bowmans Raumansichten aus 2 verschiedenen Verfahren. A. Z-Stapel mit orthogonale Projektionen zeigt PIPETTENSPITZE in Bowmans Raum anschlagenden die glomeruläre Büschel. Maßstabsleiste wird 50 µm. B. Volumen-Rendering aus Z-Stapel zeigt ähnlich eine Pipette in Bowmans Raum anschlagenden die glomeruläre Büschel. Maßstabsleiste ist 100 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
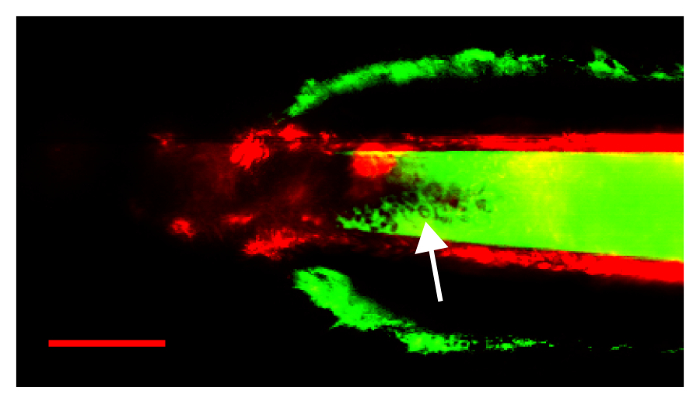
Abbildung 5: eine erfolglose Verfahren aufgrund einer stumpfen Pipette, reißen die renale Kapsel und führt zu Blutungen in das Lumen der Pipette. FITC Fluoreszenz von extravasierten Plasma und rote Blutkörperchen (Pfeil) sind innerhalb der Pipette sichtbar. Pfeil zeigt auf die roten Blutkörperchen innerhalb der Pipette Lumen sichtbar. Maßstabsleiste wird 50 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
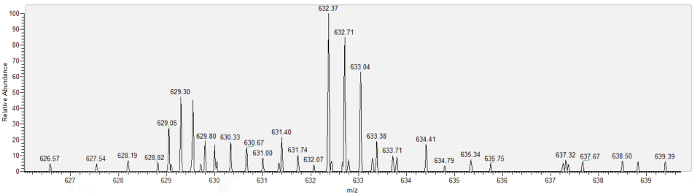
Abbildung 6: das Massenspektrum für große Urin Protein 17 (MUP17), aus der nanoskaligen flüssige Chromatographie/Masse Spektrometrie Analyse von Bowmans Raum Auwäldchen. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Protein | MW (kD) | Meine spektrale Graf |
| ACTA_MOUSE | 42 | 2 |
| ACTB_MOUSE | 42 | 1 |
| CLPX_MOUSE | 69 | 2.5 |
| DHSA_MOUSE | 73 | 1 |
| FOLR2_MOUSE | 29 | 1 |
| GBLP_MOUSE | 35 | 1 |
| ALBU_MOUSE | 66 | 6.7 |
| HBA_MOUSE | 15 | 2 |
| HBB1_MOUSE | 16 | 1 |
| MIB1_MOUSE | 110 | 1 |
| MUP17_MOUSE | 21 | 1 |
| PERI_MOUSE | 54 | 1 |
| RNAS4_MOUSE | 17 | 2 |
| SPTB1_MOUSE | 2 | 1 |
| VIME_MOUSE | 54 | 1 |
| VTDB_MOUSE | 53 | 1 |
Tabelle 1: Liste der Proteine in Bowmans Raum aspirat aus 3 Mäuse identifiziert.
Ergänzende Video 1: ein Volumen-Rendering aus einem Z-Stapel erwarb nach Positionierung einer Pipette im Bowmans Raum zeigt die PIPETTENSPITZE innerhalb der Kapillare Büschel anschlagenden. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Wir präsentieren Ihnen eine Methode, um Bowmans Raum des nicht-Oberfläche Glomeruli bei Mäusen, durch 2-Photonen-Mikroskopie erleichtert. Wir entwickelten folgendermaßen vor, um eine wesentliche Einschränkung der glomerulären mikropunktion, die Seltenheit der Oberfläche Glomeruli adressierbare durch 1-Photonen-Mikroskopie bei Mäusen, Adresse zur Erleichterung eine experimentellen objektiven, Absaugen von Flüssigkeit aus Bowmans Platz für nachträgliche Analyse. Entwicklung und Praxis dieser Technik beruht auf sechs wichtige Schritte. Erstens muss die neuartige chirurgische Vorbereitung sorgfältig durchgeführt werden damit die bildgebenden Wassersäule nicht aus dem Deckglas läuft und dem Deckglas erstreckt sich über die Fläche der Niere ist das Ziel der Pipette. Zweitens muss die Glaspipette für mikropunktion verwendet für 2-Photonen-Mikroskopie, sichtbar gemacht werden, was erfolgt mit Quantenpunkte. Drittens: Stereotaktische Technik ist erforderlich, um eine Pipette in Bowmans Raum in drei Dimensionen bis zu 100 µm unterhalb der Niere Oberfläche genau zu positionieren. Registrieren den Koordinatensystemen der Pipette und die Bühne mit Präzision sind daher wichtige Schritte. Vierte, sorgfältige Auswahl von Ziel Glomerulus ist notwendig um sicherzustellen, dass sie die Pipette ohne Impingement durch die Niere Tragstruktur und bildgebenden Spalte zugänglich ist. Schließlich vorsichtig muss erwogen werden, die analytische Schritte folgen der Übernahme Verfahren und Umfang und Zeitpunkt der Übernahme von Flüssigkeitsproben müssen abgestimmt sein, um die Analyse und glomerulären Physiologie.
Wir entwarfen eine Übernahme-Prozedur, die viele Analysen, einschließlich traditionelle mikropunktion Endpunkte wie Flamme Photometrie, Ionen-sensitiven Elektrode Messungen oder Messungen von Druck, Volumen oder kostenlos verlängert werden kann. Darüber hinaus glauben wir, dass diese Technik für neuartige analytische Endpunkte, einschließlich der Polymerase-Kettenreaktion (vielleicht nach reversen Transkription für MiRNA) und Metabolomik flussabwärts der Massenspektrometrie zugänglich sein wird. Die speziellen Modifikationen eingesetzt, um Erleichterung der Massenspektrometrie verdienen zusätzliche Diskussion, und sie einige Einschränkungen auferlegen. Zunächst zwar Massenspektrometrie hochsensiblen, die niedrigen Eiweißgehalt und das Volumen der mikropunktion Proben macht Analyse des Proteins unter den dynamischen Bereich des konventionellen Proteomic Exploration, und daher waren vereinfachte nanoproteomics notwendig. 8 , 13 Zweitens zur Optimierung der Proteinausbeute für frühe Tests haben wir festgestellt, dass 200-300 nL von aspirat notwendig war, aber de Novo Filtrat Erwerb dieses Bandes müsste vielleicht so lang wie 20 Minuten der Aspiration, wenn die Maus GFR nur 8-14 nL ist / Min3. Wie Tojo und Endou gezeigt, dass längere streben den Albumin-Inhalt der frühen proximalen Röhrchen Fluid14verändert, wir gewählt, um über 6 Minuten Aspirieren; Allerdings bedeutet dies, dass unser Bestreben das Filtrat zuflussrate übersteigt. Benutzer dieses Verfahrens werden ermutigt, die Physiologie der glomerulären Filtration in ihrer experimentellen System bei der Gestaltung ihres Workflows zu berücksichtigen. Massenspektrometrie, eine sensible Technik würde das Signal von einem eingeführten Petroleum Destillat wie Mineralöl, überwältigt das allgemein in mikropunktion verwendet ist, umfassen das hydraulische System zum Absaugen und Segmente der Nephron zu isolieren. Daher konnten wir nicht Mineralöl für diesen Zweck nutzen, oder die anderen gemeinsamen verwenden, Quantifizierung des Volumens von Nanoliter Reihe Proben. Statt dessen füllen wir des Systems mit Perfluorodecalin die biologisch inert ist, stört nicht die Massenspektrometrie und hat günstige optische Eigenschaften. Wir glauben, dass die Beschränkungen durch Perfluorodecalin sind überwindbar und arbeiten auf zusätzliche technische Innovationen, die wir erwarten, Messung von Probenvolumen und Blockade des Segments röhrenförmigen ermöglichen wird.
Die meisten mikropunktion Studien wurden in München-Wistar Ratten durchgeführt, die erhöhten Anzahlen von Oberfläche Glomeruli, aber diese stark eingeschränkt physiologische Studie des röhrenförmigen Transport- und andere renale Physiologie wegen des Verlustes des Grundtons zeigen Werkzeug der Molekularbiologie, Transgene Mäuse2,3. Weil es Mikropipette Zugang zu Bowmans Raum bei Mäusen erleichtert, mildert die neuartige Technik daher diese kritischen Einschränkungen. Wir haben diese Technik um renal Filtrat für die Proteomik-Studien mit hoher Empfindlichkeit Massenspektrometrie, bekannt als Nanoproteomics9zuzugreifen angenommen. Es gibt jedoch wahrscheinliche zusätzliche Anwendungen. Beispielsweise hat renal physiologische Studie des gefilterten Protein stark durch Verwendung von fluoreszierenden Tracer mit 2-Photonen-Mikroskopie15,16,17unterstützt worden. Zusatz von mikropunktion, 2-Photonen-Mikroskopie bietet die Möglichkeit der Durchführung von Einzel-Nephron physiologische Studie mit fluoreszierenden Molekülen, so dass benachbarte, nicht injiziert Nephrone als Kontrollen dienen. Es ist zu hoffen, dass diese klare Erklärung der notwendigen Schritte breite Annahme in Labors bereits ausgestattet für 2-Photonen-Mikroskopie und/oder mikropunktion ermöglicht. Obwohl es Komplex ist, haben wir nun dieses Verfahren viele Male durchgeführt und die Raffinessen enthaltenen eine stabile Plattform für physiologische Entdeckung.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
NIDDK K08-DK090754, MPH. NIGMS P41 GM103493 RDS. Dieses Material ist das Ergebnis der Arbeit (von MPH), die mit Mitteln gefördert wurde und die Nutzung der Einrichtungen im Portland Veterans Affairs Medical Center. Den Inhalt repräsentieren nicht die Ansichten des US-Department of Veterans Affairs oder Regierung der Vereinigten Staaten.
Materialien
| Name | Company | Catalog Number | Comments |
| Upright 2 photon microscope | Zeiss | LSM 7MP | |
| 3 axis microscope stage controller | Sutter | MP-285 | |
| 3 axis headstage controller | Sutter | MP-225 | |
| Pipette holder | Molecular Devices | 1-HL-U | |
| Headstage | Molecular Devices | CV203BU | |
| FITC-dextran 2000 kDa MW | Sigma-Aldrich | 52471-1G | |
| borosilicate glass capillary tubes | Sutter | B150-110-7.5 | |
| Micropipette puller | Sutter | P-97 | |
| Quantum dots, 605 nm | Thermofisher | Q21701MP | |
| Polysiloxane | Sugru | No cat number | www.sugru.com, "original formula". Any color. |
| PE-50 tubing | Instech Labs | BTPE-50 | |
| Microinjector | WPI | UMP-3 | |
| Microinjector controller | WPI | Micro4 | |
| Perfluorodecalin | Sigma-Aldrich | 306-94-5 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| Coverslip, 10 mm | Harvard Apparatus | 64-0718 | |
| Headplate | Custom | No part number | Common in neuroscience labs, many suppliers |
| Head fixation device | Custom | No part number | Common in neuroscience labs, many suppliers |
| 30 G needle | Becton-Dickinson | 125393 | For retroorbital injection |
| Tuberculin syringe | Becton-Dickinson | 309626 | For retroorbital injection |
Referenzen
- Schnermann, J. Micropuncture analysis of tubuloglomerular feedback regulation in transgenic mice. Journal of the American Society of Nephrology. 10 (12), 2614-2619 (1999).
- Lorenz, J. N. Micropuncture of the kidney: a primer on techniques. Comprehensive Physiology. 2 (1), 621-637 (2012).
- Vallon, V. Micropuncturing the nephron. Pflugers Archive. European Journal of Physiology. 458 (1), 189-201 (2009).
- Perrien, D. S., et al. Novel methods for microCT-based analyses of vasculature in the renal cortex reveal a loss of perfusable arterioles and glomeruli in eNOS-/- mice. BMC Nephrology. 17, 24(2016).
- Ehling, J., et al. Quantitative Micro-Computed Tomography Imaging of Vascular Dysfunction in Progressive Kidney Diseases. Journal of the American Society of Nephrology. 27 (2), 520-532 (2016).
- Gimenez, Y., et al. 3D Imaging of Nanoparticle Distribution in Biological Tissue by Laser-Induced Breakdown Spectroscopy. Scientific Reports. 6, 29936(2016).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
- Piehowski, P. D., Zhao, R., Moore, R. J., Clair, G., Ansong, C. Quantitative proteomic analysis of mass limited tissue samples for spatially resolved tissue profiling. Methods in Molecular Biology. , (2017).
- Yi, L., Piehowski, P. D., Shi, T., Smith, R. D., Qian, W. J. Advances in microscale separations towards nanoproteomics applications. Journal of Chromatography A. 1523, 40-48 (2017).
- Clair, G., et al. Spatially-resolved proteomics: Rapid quantitative analysis of laser capture microdissected alveolar tissue samples. Scientific Reports. 6, 39223(2016).
- Huang, E. L., et al. SNaPP: Simplified nanoproteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), 1307-1314 (2016).
- Andrasfalvy, B. K., et al. Quantum dot-based multiphoton fluorescent pipettes for targeted neuronal electrophysiology. Nature Methods. 11 (12), 1237-1241 (2014).
- Huang, E. L., et al. SNaPP: Simplified nano-proteomics platform for reproducible global proteomic analysis of nanogram protein quantities. Endocrinology. 157 (3), (2016).
- Tojo, A., Endou, H. Intrarenal handling of proteins in rats using fractional micropuncture technique. American Journal of Physiology. 263 (4 Pt 2), F601-F606 (1992).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments. (74), (2013).
- Sandoval, R. M., Kennedy, M. D., Low, P. S., Molitoris, B. A. Uptake and trafficking of fluorescent conjugates of folic acid in intact kidney determined using intravital two-photon microscopy. American Journal of Physiology: Cell Physiology. 287 (2), C517-C526 (2004).
- Salmon, A. H., et al. Loss of the endothelial glycocalyx links albuminuria and vascular dysfunction. Journal of the American Society of Nephrology. 23 (8), 1339-1350 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten