Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Estudio simultáneo de la contratación de las subpoblaciones de monocitos bajo flujo In Vitro
En este artículo
Resumen
Aquí, presentamos un protocolo integrado que mide la subpoblación de monocito tráfico bajo flujo in vitro por el uso de marcadores de superficie específicos y microscopía de fluorescencia confocal. Este protocolo puede utilizarse para explorar medidas de reclutamiento secuencial así como a otros subtipos de leucocitos usando otros marcadores de superficie específicos del perfil.
Resumen
El reclutamiento de monocitos de la sangre a los tejidos periféricos específicos es fundamental para el proceso inflamatorio durante la lesión tisular, desarrollo de tumores y enfermedades autoinmunes. Esto se facilita a través de un proceso de captura de flujo libre en la superficie luminal de las células endoteliales activadas, seguido por su migración de adherencia y transendothelial (transmigración) a los tejidos subyacentes afectados. Sin embargo, no se entienden los mecanismos que soportan la contratación preferencial y contextual de las subpoblaciones de monocitos. Por lo tanto, hemos desarrollado un método que permite la contratación de las subpoblaciones de monocitos diferentes para visualizar y medir bajo flujo simultáneamente. Este método, basado en la proyección de imagen confocal Time-lapse, permite la distinción inequívoca entre adherentes y transmigrated monocitos. Aquí, describimos cómo se puede utilizar este método para estudiar simultáneamente la cascada de reclutamiento de monocitos pro-angiogénica y no angiogénico in vitro. Además, este método se puede ampliar para estudiar las distintas etapas de la contratación de un máximo de tres poblaciones de monocitos.
Introducción
Monocitos constituyen un componente fagocitario de la inmunidad innata que es esencial para la lucha contra patógenos, limpieza de los tejidos dañados, angiogénesis y la fisiopatología de muchas enfermedades incluyendo cáncer1,2,3 . Los monocitos son células derivadas de médula ósea, compuestas de subpoblaciones heterogéneas que circulan en la sangre pueden ser reclutadas en el sitio de la inflamación en tejido periférico a través de mecanismos moleculares específicos. Las cascadas de reclutamiento de monocitos, en cuanto a los leucocitos en general, implica diversos pasos incluyendo captura, rodar, gatear, detención, migración transendothelial (transmigración) y migración a través de la pared del vaso (la membrana del sótano y mural células)4. Estos pasos consisten principalmente en inflamación inducida por moléculas en la superficie luminal endotelial selectinas ligandos de glicoproteína, quimiocinas, moléculas de adhesión intercelular y junctional, y sus receptores en los leucocitos como ligandos de selectina y las integrinas. Vías de tráfico a través de las uniones celulares endoteliales (paracelular) o a través del cuerpo de la célula endotelial (transcelular) pueden utilizarse por los leucocitos para atravesar la barrera endotelial5. Mientras que los monocitos se han documentado históricamente a transmigrada a través de la ruta transcelular, se han propuesto posibles divergencias en su camino migratorio como monocitos ya no se consideran una población celular homogénea. Ahora resulta claro que la diversidad de monocitos puede ser definido por cada una de sus diferencias y similitudes, con respecto a su extravasación distintivo cascadas3,6. Por lo tanto, para discriminar claramente entre subpoblaciones de monocitos, es fundamental visualizar y fenotipo el comportamiento de cada una de estas subpoblaciones diferentes durante la contratación del proceso.
Monocitos de humano, cerdo, rata y ratón se subdivide en subpoblaciones fenotípicas con ciertas funciones adscrito y comportamientos migratorios específicos7,8,9. Por ejemplo, en los seres humanos, los monocitos pueden dividirse en tres subconjuntos basados en su superficial expresión de CD14, un correceptor para lipopolisacárido bacteriano y CD16, receptor Fc gamma III. Subpoblaciones de monocitos humanos incluyen CD14 clásico+CD16-, intermedio CD14+CD16+ y no clásica CD14dimCD16 células de+ 6,9. El CD14 clásico+CD16– monocitos fueron demostrados para ser principalmente inflamatorias mientras que la piscina de CD16+ monocitos encontraron colectivamente presentar TIE2 expresión proangiogénico función10. Constantemente, la estimulación de células endoteliales con las citoquinas inflamatorias tales como necrosis del tumor humano factor α (TNF) o la interleucina (IL-1) beta (inflamación convencional) sea suficiente para la completa captación de CD14 clásico+CD16 – monocitos. Sin embargo, son necesarias para provocar la transmigración de la CD16 acciones simultáneas de A factor de crecimiento endotelial vascular (VEGF) y TNFα (inflamación impulsado por factores angiogénicos)+ piscina proangiogénico de monocitos3. Históricamente, el sistema tradicional de Transwell bajo condiciones estáticas, la cámara de flujo paralelo de la placa y las cámaras de flujo μ diapositiva se han utilizado para analizar cuantitativamente el reclutamiento de la población de un leucocito en un tiempo en vitro11 ,12,13. Mientras que estos protocolos se han validado, un método más robusto que permite el análisis simultáneo de varias subpoblaciones de monocitos se consideraría más perspicaz. Esas metodologías deben cuenta para múltiples interacciones y las diferentes frecuencias de cada población respectiva y también proporcionar una comprensión mecanicista de las similitudes y especificidades para las cascadas de reclutamiento que definen cada monocito subconjunto.
Aquí, presentamos un método basado en la proyección de imagen de Time-lapse de reclutamiento de monocitos bajo flujo que permite las cascadas migratorias de subpoblaciones de monocitos diferentes a estudiar simultáneamente mediante el uso de microscopia confocal. Este método integra ciertas características que imitan la inflamación endotelial de la célula, así como la hemodinámica de la circulación de monocitos en vénulas post-capilares, la principal situación de reclutamiento leucocitario en vivo. El método propuesto utiliza células endoteliales de vena umbilical humana (HUVEC), que se generan a través de un protocolo bien establecido de aislamiento de cordón umbilical humano. Este recurso clínico tiene la ventaja de ser fácilmente disponibles como subproductos biológicos, mientras que también proporciona un rendimiento razonable de las células endoteliales que pueden ser aisladas de la vena umbilical. También utilizamos tintes fluorescentes y la inmunofluorescencia para distinguir entre los diferentes componentes celulares y la microscopia confocal para definir inequívocamente monocito posicionamiento (luminal y abluminal) con el tiempo. El protocolo que presentamos ha sido desarrollado para medir simultáneamente los niveles de la transmigración de las subpoblaciones de monocitos. Por otra parte, cabe señalar que esta metodología puede ampliarse para estudiar otras subpoblaciones de leucocitos y procesos de selección por medio de diferentes biomarcadores y etiquetado.
Protocolo
Materiales humanos fueron utilizados con el consentimiento informado de los donantes voluntarios y de acuerdo con el suizo comités de ética en investigación clínica.
1. aislamiento y congelación de Umbilical humano vena las células endoteliales (HUVEC)
- Añadir 5 mL de solución de recubrimiento a un matraz T75 (0,1 mg/mL G de colágeno y gelatina de 0.2% en tampón fosfato salino PBS a pH 7.4) durante 30 min a 37 ° C antes de iniciar el aislamiento de HUVEC.
- Limpiar el cordón con PBS, limpie con compresas estériles y colocarlo en un estéril 20 cm plato de Petri. Cortar los extremos del cordón con una tijera estéril.
- Identificar una sola vena grande y las dos pequeñas arterias. Suavemente, inserte una cánula con una llave de paso de tres vías que se le atribuye en las extremidades de la vena en los extremos del cable.
- Apriete el cable y la conexión de la cánula con una longitud de cable.
- Inundar el cable dos veces con 20 mL de Medio RPMI con 100 U/mL de penicilina, estreptomicina U/mL 100 y 250 ng/mL de anfotericina B para lavar las venas del cordón. Este proceso hace que la aparición de la cuerda más blanca y más clara. Vaciar la vena antes además de colagenasa recogiendo el RPMI con una jeringa en un extremo.
- Perfusión en la vena con 12 mL de 1 mg/mL colagenasa tipo I (0.22 μm filtrado).
- Cierre la llave de paso del cable termina e incubar el cable a 37 ° C durante 12 minutos.
- Masajee suavemente el cable para separar las células endoteliales de la luz de la vena.
- Tomar 30 mL de RPMI con 10% de suero fetal de becerro con una jeringa de 50 mL y conecte un extremo del cordón umbilical.
- Conecte una jeringa de 50 mL vacía al otro extremo del cordón umbilical
- Abra la llave de paso y perfusión la vena de un extremo mientras que recogiendo recíprocamente desde el otro extremo.
Nota: La suspensión recogida contiene las células endoteliales. - Centrifugar esta suspensión de células a 200 x g durante 5 minutos.
- Deseche el sobrenadante y resuspender el sedimento celular con 10 mL de medio completo de M199 (M199 suplementos que contengan 20% FCS, crecimiento de células endoteliales de 15 μg/mL 100 μg/mL heparina sódica, hidrocortisona μm 0.5, ácido L-ascórbico de 10 μg/mL, 100 U/mL de penicilina, 100 U/mL estreptomicina y 250 ng/mL anfotericina B).
- Retirar la solución de recubrimiento del frasco T75 y enjuague una vez con PBS.
- Semilla de las células recogidas de paso 1.13 en el matraz T75 y colóquelo en la incubadora a 37 ° C con 5% CO2.
- Al día siguiente, enjuagar el matraz 3 veces con el medio M199 completo para eliminar eritrocitos residuales y luego cambiar el medio cada 2 días hasta confluencia.
- En 80-90% de confluencia, lavar la monocapa HUVEC una vez con 5 mL de PBS y separar las células con 5 mL de tripsina 0,05% en 1 mM EDTA a 37 ° C por 5 minutos agregar 4 mL de M199 y 1 mL de FCS para detener la acción de la tripsina. Lave el matraz para separar HUVEC todos.
- Recoge una alícuota de 50 μl se utiliza para la tinción de VE-cadherina, PECAM-1 y gp38 y analizar mediante citometría de flujo para verificar pureza HUVEC.
- Recoger el resto de HUVEC de paso 1.18 en un tubo de 15 mL y centrifugar a 200 x g durante 5 min a temperatura ambiente.
- Desechar el sobrenadante del paso 1.19, Resuspender el precipitado de células en solución (FCS que contiene 10% DMSO) para congelar a una densidad de 5 x 105 células/mL en criotubos y congelar a-80 ° C o en nitrógeno líquido hasta su utilización.
-
Para comprobar la pureza HUVEC:
- Añadir 1 μl de anticuerpo anti-humana VE-cadherina-FITC, 1 μl de anticuerpo anti-humana PECAM1 PE y 1 μl de anticuerpo anti-humana Podoplanin-APC a la alícuota de 50 μl de HUVEC en paso 1.18.
- Incubar a temperatura ambiente durante 10 minutos.
- Añada 100 μl de PBS y centrifugar a 400 x g durante 30 s.
- Deseche el sobrenadante y resuspender en 100 μl de PBS. Datos pueden ser adquiridos ahora por técnicas de citometría de flujo.
Nota: HUVEC son positivos para VE-cadherina y PECAM-1 y negativos para Podoplanin.
2. HUVEC descongelación
Nota: Uso HUVEC en paso bajo para los experimentos (máximo 5 pasos).
- Capa un T75 frasco con 1 mL de la solución de recubrimiento a 37 ° C durante 30 minutos.
- Rápidamente descongelar HUVEC a 37 ° C por 2 min y resuspender las células en 10 mL de M199 completa.
- Centrifugar las células a 200 x g durante 5 min y descarte el sobrenadante.
- Resuspender el precipitado de células en 10 mL de M199 completa.
- Transferir la suspensión de células en el frasco previamente revestido. Coloque el frasco en el incubador a 37 ° C con 5% CO2. Cambiar el medio de cultivo celular cada 2 días.
3. HUVEC cultura en 0,4 μ diapositiva cámara
- Cinco días antes de comenzar el experimento de flujo, la capa de las cámaras de una diapositiva de 0,4 μ con 30 μl de PBS con un 0.1 mg/mL de colágeno G, gelatina 0,2% a 37 ° C por 30 min.
- Lavar las cámaras con 100 μl de PBS.
- Separar las células de un 80-90% HUVEC confluentes de un frasco de T75.
- Enjuague HUVEC con 5 mL de PBS y separar con 5 mL de tripsina 0,05% a 37 ° C durante 5 minutos.
- Lavar y recoger la suspensión celular en M199 completa y contar las celdas por el método más conveniente. Centrifugue a 200 x g durante 5 min a temperatura ambiente.
- Resuspender el precipitado de células 106 células/ml y distribuir 30 μl (30.000 células) por cámara.
- Incubar las células en una incubadora a 37 ° C con 5% CO2 para 1 h.
- Añadir 150 μL de M199 completa a cada cámara y de la cultura las células 5 días en la incubadora a 37 ° C y 5% CO2. Cambiar el medio cada 2 días.
4. HUVEC tinción para análisis de reclutamiento de monocitos bajo flujo
- Prepare el soporte de etiquetado de M199 y 1 μm de CMFDA (Diacetato de 5-chloromethylfluorescein) y caliente a 37 ° C durante 5 minutos antes de la célula etiquetado.
- HUVEC lavar dos veces con medio M199 calentado a 37 ° C.
- Reemplazar el medio con 30 μl de medio etiquetado calentado con 1 μm de CMFDA y colocar en la incubadora a 37 ° C y 5% CO2 durante 10 minutos.
- Lavar una vez con M199 completa e incubar las células con M199 completa en la incubadora a 37 ° C y 5% CO2 durante 30 minutos.
Nota: Es importante eliminar todos los rastros de suero antes de la adición de la solución de etiquetado, de lo contrario puede alterar HUVEC tinción. - Reemplazar el medio con M199 completa que contiene o TNFα humano (500 U/mL) o una mezcla de TNFα humano (500 U/mL) con humano VEGFA (1 μg/mL) durante 6 h en una incubadora a 37 ° C y 5% CO2.
5. aislamiento de monocitos humanos Pan y tinción de las subpoblaciones
- Use una capa buffy de la sangre humana concentrada, o 20 mL de sangre humana recién aislado, recogido en el día del experimento en tubos vacutainer con EDTA.
- Diluir la sangre en PBS-1 mM EDTA (1:1) y pipetar suavemente 20 mL de la sangre diluida en 20 mL de medio de gradiente de densidad. Centrifugar a 400 x g durante 30 min a temperatura ambiente con una aceleración lenta y sin freno.
- Recoger las células mononucleares de sangre periférica (PBMC)-capa de plaquetas (entre medio de gradiente de densidad y capas de plasma) en un nuevo tubo de 50 mL que contiene 40 mL de PBS - 1 mM EDTA. Superior a 50 mL con PBS - 1 mM EDTA.
- Centrifugue a 200 x g a temperatura ambiente durante 5 minutos eliminar el sobrenadante.
- Resuspender el pellet celular con 10 mL de tampón de tinción (PBS - 1 mM EDTA con 0.5% albúmina de suero bovino BSA).
- Centrifugue a 200 x g a temperatura ambiente durante 5 minutos eliminar el sobrenadante.
- Repita los pasos 5.5 y 5.6.
- Resuspender el pellet celular con 10 mL de tampón de tinción. Tomar una alícuota de 10 μl de una cuenta de célula.
- Controlar las poblaciones de PBMC y contar las células rápidamente con un citómetro de flujo.
Nota: Las poblaciones de linfocitos y monocitos característica pueden observarse (figura 1A). De 50 mL de sangre humana fresca esperar sobre 50-100 x 106 PBMC. -
Para la contratación de CD14 + versus CD14-PBMC bajo flujo:
- Lavar el precipitado tres veces con tampón de flujo (M199 con 0,5% BSA) y resuspender las células mononucleares en el búfer de flujo en 6 x 106 células / mL.
- Hacer alícuotas de 200 μL para cada ensayo. Incubar a 37 ° C hasta 20 min antes del ensayo.
- Añadir 5 μl de anti-CD14-PE y Hoechst 33342 a una concentración final de 2 μm a cada alícuota. Mezcla e incubar a 37 ° C durante 10 minutos.
- Centrifugue la alícuota a 400 x g durante 30 s.
- Deseche el sobrenadante y resuspender el precipitado con 200 μL de tampón de flujo.
-
Para la contratación de las subpoblaciones de monocitos bajo flujo:
- Aislamiento de monocitos con un kit de aislamiento de monocitos de pan según las instrucciones del fabricante.
Nota: El siguiente protocolo de aislamiento es de 50 x 106 células. Se pueden escalar hacia arriba o abajo siempre y cuando sea dentro de las recomendaciones del fabricante. - Centrifugue la suspensión PBMC a 200 x g a temperatura ambiente durante 5 minutos.
- Deseche el sobrenadante y resuspender el precipitado con 400 μL de tampón de tinción.
- Añadir 50 μl de reactivo de bloqueo de los receptores Fc y 50 μl de anticuerpo monocito Pan cóctel.
- Incubar a temperatura ambiente durante 10 minutos.
- Añadir 400 μL de coloración buffer y 100 μl de anticuerpo anti-biotina conjugado de bolas magnéticas. Incubar a temperatura ambiente durante 15 minutos.
- Añadir 2 mL de tampón de tinción y utilizar una columna de LS MACS juntada con un imán.
- Coloque la columna de LS en el imán y añade 1 mL de tampón de tinción. Deseche el flujo a través.
- Pasar la suspensión PBMC en la columna y recoger el flujo claro aunque conteniendo pan monocitos en un nuevo tubo de 15 mL.
- Añadir el tampón de tinción para completar hasta 5 mL.
- Tomar una alícuota y comprobar la calidad del aislamiento de monocitos con un citómetro de flujo.
- Determinar el recuento de monocitos de pan.
Nota: Población de monocitos sólo puede observarse (Figura 1B). - Centrifugue el resto de los monocitos del paso 5.11.11 a 200 x g durante 5 minutos.
- Deseche el sobrenadante.
- Resuspender el precipitado de células en 5 mL de tampón de flujo (M199 con 0,5% BSA).
- Repita 5.11.13 al 5.11.14 dos veces para eliminar cualquier rastro de EDTA.
- Aislamiento de monocitos con un kit de aislamiento de monocitos de pan según las instrucciones del fabricante.
- Que suspensión de monocitos en flujo tampón (M199 con 0,5% BSA) 6 x 106 células/ml.
- Hacer alícuotas de 200 μL de monocitos para cada ensayo de reclutamiento.
- Mantener la alícuota a 37 ° C en la incubadora hasta 20 minutos antes de la inyección.
- Añadir 5 μl de anticuerpo anti-CD16-PE y Hoechst 33342 (final de 2 μm) a cada alícuota.
- Mezcla e incubar a 37 ° C durante 10 minutos.
- Centrifugue la alícuota a 400 x g durante 30 s.
- Deseche el sobrenadante y resuspender el precipitado con 250 μl de tampón de flujo.
- Añadir 30 μl de la suspensión de monocitos en un compartimiento de la diapositiva para fijar los parámetros de adquisición en el microscopio confocal.
- Mantener las alícuotas de la suspensión del monocito de paso 5.18 a 37 ° C.
Nota: Esta suspensión está lista para ser inyectado en el sistema de flujo.
6. preparación del sistema fluídico
- Asegúrese de que la incubadora de la célula para la proyección de imagen a 37 ° C.
Nota: En la figura 2muestra un diagrama del sistema de flujo. - Montar la parte de tubería I: Introduzca un macho del conector Luer a un extremo de un pedazo de tubo de silicona (8 cm largo y 3 mm de espesor) y conecte el otro extremo a un sistema de inyección en línea Luer. Conecte el segundo conector Luer a un pedazo de tubo de silicona (40 cm y 3 mm de espesor) en un extremo.
Nota: Opcionalmente, un grifo de 3 vías conectado a una jeringa de 5 mL puede ser insertado entre el sistema de inyección Luer en línea y la silicona en tubo para la eliminación de burbujas de aire eventual. - Montar la segunda parte de la tubería: Conecte una jeringa de 20 mL a un extremo de una longitud de tubo de silicona (1 m de largo y 3 mm de espesor). Inserte un macho del conector Luer en el otro extremo de la tubería.
- Conectar la parte I y parte tubo II mediante la inserción de los varones de conector Luer para un acople hembra de la cerradura de Luer (figura 2A).
- Coloque el extremo libre del tubo de silicona en el depósito que contiene el tampón de flujo (M199 + 0,5% BSA) calentado a 37 ° C.
- Tire el émbolo de la jeringa de 20 mL para llenar el tubo con tampón de flujo.
- Coloque la jeringa en la bomba y fijarlo.
- Coloque la bomba en retirar el modo (como opuesto a infundir) y especificar la velocidad de flujo.
- Determinar la velocidad de flujo según la diapositiva IBIDI utilizada mediante la siguiente fórmula:
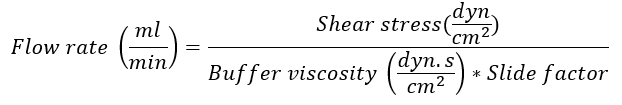
Nota: El factor de deslizamiento es dependiente en la diapositiva IBIDI utilizada para el experimento. De la diapositiva de μ I0.4 Luer lock usado en este ejemplo, el factor de deslizamiento es 131.6. Para factores específicos diapositiva, vea el sitio web de empresa14. La viscosidad del tampón de flujo es dyn.s/cm 0.00722. Tensión de esquileo en las vénulas post capilares es 0,5 dyn/cm2. -
Conexión de la diapositiva (figura 2B):
- Sujete el tubo de silicona alrededor de la hembra Luer Lock acoplador y los dos machos de conector Luer Desconecte el acoplador.
- Conecte a los embalses de la diapositiva que contiene estimula HUVEC y llenar con medio. Evitar las burbujas de aire durante este paso.
- Quite las abrazaderas y asegurar que la conexión no tiene pérdidas.
- Coloque el portaobjetos en el microscopio de proyección de imagen de Time-lapse y arranque la bomba.
7. Time-lapse proyección de imagen de reclutamiento de monocitos bajo flujo por Microscopía Confocal
- Utilice un objetivo de 40 x (véase Tabla de materiales) para la proyección de imagen.
- Activar el 405 nm (azul monocitos núcleos), 488 nm (verdes células endoteliales) y 561 nm (rojo CD16 + subconjunto) láseres.
- Utilice la cámara que contiene a los monocitos para establecer los parámetros de adquisición.
Nota: Para detectar los monocitos no transmigrated y transmigrated, el agujero de alfiler y la intensidad del láser 405 nm se encuentran alta. Por lo tanto, los monocitos no transmigrated son ligeramente visibles en el plan básico. Sin embargo solamente transmigrated monocitos presentan una superficie sin manchas alrededor del núcleo correspondiente al espacio ocupado por debajo de las células endoteliales. - Coloque la cámara a ser adquiridos bajo el microscopio.
- Elija 3 campos de opiniones dentro de radio 1 cm para la proyección de imagen confocal de múltiples posiciones.
- Definir la basal y las partes apicales de las células endoteliales
- Establecer una pila de z al rango 10 – 12 μm (paso de 0.5 μm). Ejecute un time-lapse adquisición cada 1 minuto.
- Después de 3 minutos de la proyección de imagen, inyectar 200 μL de suspensión de monocitos (6 x 106 células/mL) a través del puerto de inyección en línea Luer.
Nota: Rápidamente monocitos aparecen en el plano focal apical, se adhieren y empezar la transmigración (tránsito de la apical al basal plan). - Imagen de al menos 30 minutos. Una vez terminado, deje la proyección de imagen y detener el flujo. Abrazadera de la tubería para desconectar de la diapositiva.
- Fijar la corredera con paraformaldehído al 4% a 4 ° C durante 10 minutos.
- Lavar el portaobjetos con PBS y guardar la diapositiva a 4 ° C para su análisis posterior si es necesario.
8. analizar los datos con ImageJ
- Contar el número de monocitos adherentes total en cada campo. Determinar el número de células por mm2.
- Cuenta transmigrated monocitos que están presentes en el plan básico por debajo de las células endoteliales e identificado por la presencia de un agujero negro (en el canal verde) alrededor del núcleo.
- Dividir la cuenta de leucocitos transmigrated por el número total de leucocitos adherentes. La tasa de transmigración se presenta como un porcentaje de monocitos adherentes.
- Para la ilustración, el apical y basales laterales pueden mostrar simultáneamente para ilustrar los acontecimientos que ocurren en cada uno de estos compartimentos endoteliales.
Resultados
Determinar el estado de activación de HUVEC inducida por el TNFα
La bio-actividad de las citoquinas inflamatorias TNFα puede variar según el lote y la reposición del ciclo de congelación-descongelación. Es importante comprobar el estado de activación de HUVEC con tratamiento de TNFα. Esto podría realizarse mediante tinción en paralelo algunas muestras de HUVEC confluente para la inducción inflamatoria de selectinas, ICA...
Discusión
Aquí, Divulgamos un método que detalla un estudio de cómo transmigrada subpoblaciones de monocitos a través de la monocapa de endotelio inflamada. Utiliza el método discutido microscopia confocal en vez de microscopia de contraste de fase, que también se utiliza para el estudio de reclutamiento de monocitos bajo flujo3,11,19. Una ventaja importante del uso de la microscopia confocal para Time-lapse de imágenes es la capac...
Divulgaciones
Los autores tienen intereses financieros que compiten.
Agradecimientos
Agradecemos Dr. Paul Bradfield manuscrito lectura y retroalimentación. A. S. recibió apoyo financiero de la Sir Jules espina beneficencia ultramar Trust reg.,
Materiales
| Name | Company | Catalog Number | Comments |
| Tissue Culture Flasks 75 cm2 | TPP | 90076 | Routine culture of isolated HUVEC |
| µ-Slide VI 0.4 | IBIDI | 80606 | |
| Centrifuge Tubes 15 mL | TPP | 191015 | |
| Centrifuge Tubes 50 mL | TPP | 191050 | |
| Collagen G | Biochrom | L 7213 | For coating of cell culture flasks |
| Gelatin | Sigma-Aldrich | 1393 | For coating of cell culture flasks |
| Dulbecco’s Phosphate Buffered Saline (without MgCl2 and CaCl2) | Sigma-Aldrich | D8537 | |
| Dulbecco’s Phosphate Buffered Saline (with MgCl2 and CaCl2) | Sigma-Aldrich | D8662 | |
| RPMI-1640 Medium | Sigma-Aldrich | R8758 | |
| 3-Way Stopcocks | BIO-RAD | 7328103 | |
| penicillin 10,000 μ/mL streptomycine 10,000 μg/mL fungizone 25 μ/mL | AMIMED | 4-02F00-H | |
| Collagenase type 1 | Worthington | LS004216 | |
| Medium 199 1x avec Earle's salts, L-Glutamine, 25 mM Hepes | GIBCO | 22340020 | |
| Bovine Albumin Fraction V | ThermoFisher | 15260037 | |
| Endothelial Cell Growth Supplement, 150 mg | Millipore | 02-102 | |
| Heparin Sodium | Sigma-Aldrich | H3149RT | |
| Hydrocortisone | Sigma-Aldrich | H6909 | |
| L-Ascorbic acid | Sigma-Aldrich | A 4544 | |
| EDTA disodium salt dihydrate C10H14N2Na2O8 · 2H2O | APPLICHEM | A2937.0500 | |
| CD144 (VE-Cadherin), human recombinant clone: REA199, FITC | Miltenyi Biotech | 130-100-713 | AB_2655150 |
| CD31-PE antibody, human recombinant clone: REA730, PE | Miltenyi Biotech | 130-110-807 | AB_2657280 |
| Anti-Podoplanin-APC, human recombinantclone: REA446, APC | Miltenyi Biotech | 130-107-016 | AB_2653263 |
| BD Accuri C6 Plus | BD Bioscience | ||
| µ-Slide I Luer | IBIDI | 80176 | |
| CMFDA (5-chloromethylfluorescein diacetate) | ThermoFisher | C2925 | |
| Recombinant human TNFα | Peprotech | 300-01A | |
| Recombinant human VEGFA | Peprotech | 100-20 | |
| NE-1000 Programmable Syringe Pump | KF Technology | NE-1000 | |
| Ficoll Paque Plus | GE Healthcare | 17-1440-02 | |
| Anti-human CD14-PE, human recombinant clone: REA599, PE | Miltenyi Biotech | 130-110-519 | AB_2655051 |
| Pan Monocyte Isolation Kit, human | Miltenyi Biotech | 130-096-537 | |
| Anti-human CD16-PE, human recombinant clone: REA423, PE | Miltenyi Biotech | 130-106-762 | AB_2655403 |
| LS columns | Miltenyi Biotech | 130-042-401 | |
| QuadroMACS Separator | Miltenyi Biotech | 130-090-976 | |
| Hoechst 33342, Trihydrochloride, Trihydrate | ThermoFisher | H1399 | |
| Silicone tubing | IBIDI | 10841 | |
| Elbow Luer Connector | IBIDI | 10802 | |
| Female Luer Lock Coupler | IBIDI | 10823 | |
| Luer Lock Connector Female | IBIDI | 10825 | |
| In-line Luer Injection Port | IBIDI | 10820 | |
| Ar1 confocal microscope | Nikon | ||
| 40x objective | Nikon | 40x 0.6 CFI ELWD S Plane Fluor WD:3.6-2.8mm correction 0-2mm | |
| ImageJ Software | NIH |
Referencias
- Auffray, C., Sieweke, M. H., Geissmann, F. Blood Monocytes: Development, Heterogeneity, and Relationship with Dendritic Cells. Annual Review of Immunology. 27 (1), 669-692 (2009).
- De Palma, M., Venneri, M. A., Roca, C., Naldini, L. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nature Medicine. 9 (6), 789-795 (2003).
- Sidibe, A., et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours. Nature Communications. 9 (1), 355 (2018).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Review Immunology. 7 (9), 678-689 (2007).
- Nourshargh, S., Alon, R. Leukocyte Migration into Inflamed Tissues. Immunity. 41 (5), 694-707 (2014).
- Cros, J., et al. Human CD14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 33 (3), 375-386 (2010).
- Geissmann, F., Jung, S., Littman, D. R. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19 (1), 71-82 (2003).
- Chamorro, S., et al. In vitro differentiation of porcine blood CD163− and CD163+ monocytes into functional dendritic cells. Immunobiology. 209 (1-2), 57-65 (2004).
- Passlick, B., Flieger, D., Ziegler-Heitbrock, H. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 74 (7), (1989).
- Venneri, M. A., et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood. 109 (12), 5276-5285 (2007).
- Bradfield, P. F., et al. JAM-C regulates unidirectional monocyte transendothelial migration in inflammation. Blood. 110 (7), 2545-2555 (2007).
- Schenkel, A. R., Mamdouh, Z., Muller, W. A. Locomotion of monocytes on endothelium is a critical step during extravasation. Nature Immunology. 5 (4), 393-400 (2004).
- Luu, N. T., Rainger, G. E., Nash, G. B. Kinetics of the different steps during neutrophil migration through cultured endothelial monolayers treated with tumour necrosis factor-alpha. Journal Vascular Research. 36 (6), 477-485 (1999).
- ibidi GmbH. . Shear Stress and Shear Rates for ibidi µ-Slides - Based on Numerical Calculations. , (2014).
- Yang, L., Froio, R. M., Sciuto, T. E., Dvorak, A. M., Alon, R., Luscinskas, F. W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood. 106 (2), 584-592 (2005).
- Yang, C. -. R., Hsieh, S. -. L., Ho, F. -. M., Lin, W. -. W. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. Journal of Immunology. 174 (3), 1647-1656 (2005).
- Wong, D., Dorovini-Zis, K. Expression of vascular cell adhesion molecule-1 (VCAM-1) by human brain microvessel endothelial cells in primary culture. Microvascular Research. 49 (3), 325-339 (1995).
- Bradfield, P. F., Nourshargh, S., Aurrand-Lions, M., Imhof, B. A. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis Thrombosis and Vascular Biology. 27 (10), 2104-2112 (2007).
- Bradfield, P. F., et al. Divergent JAM-C Expression Accelerates Monocyte-Derived Cell Exit from Atherosclerotic Plaques. PLoS One. 11 (7), e0159679 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados