A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מחקר בו זמנית של הגיוס של מונוציט Subpopulations תחת זרימה במבחנה
In This Article
Summary
כאן, אנו מציגים פרוטוקול משולב המודד מונוציט subpopulation סחר תחת זרימה במבחנה באמצעות סמני פני שטח מסוים, מיקרוסקופ קונפוקלי זריחה. פרוטוקול זה יכול לשמש כדי לחקור את השלבים רציפים גיוס גם לגבי פרופיל אחרים יחוברו ליקוציט באמצעות סמנים אחרים משטח מסוים.
Abstract
הגיוס של monocytes מהדם לרקמות היקפיים יישוב הינה קריטית תהליך דלקתי במהלך פגיעה ברקמות, התפתחות גידולים ומחלות אוטואימוניות. זה נהיה בתהליך של לכידת זרימה חופשית על גבי המשטח luminal של תאי אנדותל מופעל, ואחריו להגירתם אדהזיה ו- transendothelial (גלגול) לתוך הרקמה הבסיסית המושפעת. עם זאת, המנגנון תומכים בגיוס מועדף, תלויי-ההקשר מונוציט subpopulations עדיין לא לגמרי מובנים. לכן, פיתחנו שיטה המאפשרת הגיוס של subpopulations מונוציט שונים בו זמנית מדמיין, שנמדד תחת זרימה. שיטה זו, המבוססת על הדמיה קונאפוקלית זמן לשגות, מאפשר ההבחנה ברורה וחד משמעית בין חסיד, שמדמו ומונוציטים. כאן, אנו נתאר כיצד ניתן להשתמש בשיטה זו ללמוד בו זמנית את המפל גיוס של pro-אנגיוגנזה, הלא-אנגיוגנזה ומונוציטים במבחנה. יתר על כן, שיטה זו ניתן להרחיב ללמוד את שלבי הגיוס של עד שלוש אוכלוסיות מונוציט שונים.
Introduction
ומונוציטים מהווים מרכיב phagocytic של מולדת חסינות זה חיוני בלחימה פתוגנים, מנקה את רקמות שנפגעו אנגיוגנזה, הפתופיזיולוגיה של מחלות רבות, כולל סרטן1,2,3 . ומונוציטים הם תאים הנגזרות מח העצם מורכב subpopulations הטרוגנית במחזור הדם, אבל יכול להיות גויסו לאתר של דלקת ברקמות היקפיים באמצעות מנגנונים מולקולריים ספציפיים. למפל גיוס של monocytes, באשר לויקוציטים מרמז באופן כללי, שלבים שונים כולל לכידת, גלגול, זחילה, מעצר, transendothelial ההעברה (גלגול) העברה דרך הקיר כלי (קרום המרתף, ציור קיר תאים)4. שלבים אלה כוללות בעיקר דלקת-induced מולקולות על פני אנדותל luminal כגון selectins, ליגנדים גליקופרוטאין, נוגדנים, מולקולות אדהזיה המערכת, מהחיבור שלהם רצפטורים על לויקוציטים כגון בחירת שמלות ליגנדים אינטגרינים. סחר מסלולים דרך גם את תאי אנדותל צמתים (paracellular) או דרך הגוף תא אנדותל (transcellular) ניתן על ידי לויקוציטים לחצות את המכשול אנדותל5. בעוד ומונוציטים היסטורית תועדו כדי transmigrate דרך המסלול transcellular, פערים פוטנציאליים במסלול הנדידה שלהם הוצעו כפי ומונוציטים כבר לא נחשבים אוכלוסיה הומוגנית התא. עכשיו כעת ברור כי גיוון מונוציט יכולה להיות מוגדרת על ידי כל אחד של ההבדלים שלהם מכנה משותף, ביחס extravasation הייחודי שלהם מפלי3,6. לכן, על מנת חד משמעית מתלבטים מונוציט subpopulations, זה חיוני כדי להמחיש ולעבד פנוטיפ ההתנהגות של כל אלה subpopulations שונים במהלך הגיוס.
ומונוציטים מן האדם, חזיר, החולדה, העכבר היו המתפרשות לתוך subpopulations פנוטיפי עם פונקציות ייחסה של התנהגויות ספציפיות נודדות-7,-8,-9מסוימים. לדוגמה, בבני אדם, ומונוציטים ניתן לחלק שלוש קבוצות משנה המבוסס על שלהם ביטוי פני השטח של CD14, coreceptor עבור ליפופוליסכריד חיידקי, CD16, הקולטן Fc-גמא השלישי. מונוציט האנושי subpopulations כוללים CD14 קלאסית+CD16-, ביניים CD14+CD16+ וקלאסי CD14עמוםCD16+ תאים6,9. CD14 הקלאסית+CD16– ומונוציטים הוכחו להיות בעיקר דלקתיות ואילו הבריכה של CD16+ ומונוציטים נמצאו באופן קולקטיבי להציג TIE2 proangiogenic וביטוי פונקציה10. באופן עקבי, תאי אנדותל גירוי עם ציטוקינים דלקתיים כגון גידול אנושי נמק פקטור (TNF) α או אינטרלוקין (IL-1) בטא (דלקת קונבנציונלי) מספיקה לעורר גיוס מלא של קלאסית CD14+CD16 – ומונוציטים. לעומת זאת, נדרשות פעולות בו-זמניות של כלי הדם צמיחה אנדותל (VEGF) A ו TNFα (דלקת מונחה גורמי אנגיוגנזה) לעורר גלגול של CD16+ proangiogenic בריכה של monocytes3. מבחינה היסטורית, שימשו את המערכת Transwell המסורתית תחת תנאים סטטיים תא זרימה לוחית מקבילים, התאים זרימה ממוצע שקופית לנתח באופן כמותי את גיוס ליקוציט אחד האוכלוסייה בגיל זמן במבחנה11 12, ,13. בעוד יש פרוטוקולים אלה מאומתים, שיטה עמידים יותר כי מותר ניתוח בו זמנית של מספר מונוציט subpopulations ייחשב נבונה יותר. מתודולוגיות כזה חייב חשבון עבור אינטראקציות מרובות, התדרים שונות של כל האוכלוסייה בהתאמה ולספק גם הבנה מכניסטית של דמיון ושל specificities למפל גיוס המגדירים כל מונוציט משנה.
כאן, אנו מציגים שיטה המבוססת על ההדמיה בצילום מואץ של הגיוס מונוציט תחת זרימה אשר מאפשר את מפלי נודדות מונוציט שונים subpopulations שילמדו בו זמנית על-ידי שימוש מיקרוסקופיה קונפוקלית. שיטה זו משלבת תכונות מסוימות קריטיות לחקות דלקת תא אנדותל, כמו גם את ספיקת הדם של מחזורי ומונוציטים ב venules נימי פוסט, המיקום המרכזי של גיוס ליקוציט ויוו. השיטה המוצעת משתמשת יפתור אנדותל תאים (HUVEC), אשר נוצרות באמצעות פרוטוקול ומבוססת של בידוד מן האדם חוטי חבל הטבור. משאב קליני זה יש את היתרון של להיות זמין בקלות היא מוצר לוואי ביולוגיות, בעוד גם מתן תשואה סבירה של תאי אנדותל שניתן שבודד וריד הטבור. השתמשנו גם צבעי פלורסנט, immunofluorescence להבחין בין מרכיבי התא השונים, מיקרוסקופיה קונפוקלית חד משמעית להגדיר מונוציט מיצוב (luminal לעומת abluminal) לאורך זמן. פרוטוקול המובאת כאן פותחה כדי למדוד בו זמנית את רמות גלגול מונוציט subpopulations. יתר על כן, יש לציין כי מתודולוגיה זו ניתן להרחיב את לימוד אחרים לויקוציטים subpopulations, תהליכי גיוס על ידי שימוש סמנים ביולוגיים שונים וסימון.
Protocol
חומרים אנושיים שימשו עם הסכמה מדעת של התורמים המתנדבים ועל פי ועדות האתיקה השוויצרי על מחקר קליני.
1. בידוד וקופא של חבל הטבור האנושי הווריד תאי אנדותל (HUVEC)
- הוסף 5 מ של ציפוי פתרון בקבוקון T75 (0.1 מ"ג/מ"ל קולגן G ו- 0.2% ג'לטין ב- PBS מלוחים פוספט באגירה מלאה ב- pH 7.4) במשך 30 דקות ב 37 מעלות צלזיוס לפני ביצוע בידוד HUVEC.
- לנקות את החבל עם PBS, לנגב את זה עם קומפרסים סטרילי, מניחים אותה ס מ 20 עקר פטרי. חותכים את הקצוות של החוט עם מספריים סטרילי.
- לזהות את הווריד גדולה אחת, שני העורקים קטן. הכנס בעדינות את הצינורית עם צימוד-כיוונית מצורף אל הגפיים וריד בקצוות הכבל.
- להדק את הכבל וחיבור בצינורית בחוזקה עם אורך של חוט.
- Perfuse כבל פעמיים עם 20 מ של RPMI בינוני המכיל 100 פניצילין U/mL, סטרפטומיצין U/mL 100, 250 ננוגרם למ"ל המפוטריצין לרחוץ את ורידים חבל הטבור. תהליך זה הופך את המראה של החוט לבן וברורה. רוקן את הווריד לפני חיבור collagenase על ידי איסוף של RPMI עם מזרק בקצה אחד.
- Perfuse את הווריד 12 מ של 1 מ"ג/מ"ל collagenase סוג אני (0.22 מיקרומטר-מסוננים).
- סגור צימוד-החוט מסתיים, דגירה החוט ב 37 מעלות צלזיוס למשך 12 דקות.
- לעסות בעדינות את הכבל כדי לנתק תאי אנדותל של לומן לווריד.
- לקחת 30 מ של RPMI המכיל 10% עגל עוברית סרום עם מזרק 50 מ ל וחבר אותו בקצה אחד של הטבור.
- להתחבר עם מזרק ריק 50 מל הקצה השני של הטבור
- פתח את צימוד, perfuse את הווריד מקצה אחד תוך איסוף קישור הדדי בצד השני.
הערה: המתלה שנאספו מכיל תאי אנדותל. - Centrifuge ההשעייה תא ב x 200 גרם במשך 5 דקות.
- למחוק את תגובת שיקוע, resuspend בגדר תא עם 10 מ"ל של מדיום M199 מלאה (M199 תוספי מזון המכיל 20% FCS, µg/mL 15 תא אנדותל הצמיחה, 100 µg/mL הפארין נתרן, 0.5 מיקרומטר הידרוקורטיזון, µg 10/מ"ל חומצה אסקורבית L, פניצילין U/mL 100, 100 U/mL סטרפטומיצין, שהוא גוסס ng/mL 250 ב').
- הסר את הפתרון ציפוי הבקבוקון T75 ולשטוף פעם עם PBS.
- הזרע התאים שנאספו משלב 1.13 לתוך הבקבוק T75 ולמקם אותו בחממה ב 37 ° C עם 5% CO2.
- למחרת, לשטוף את הבקבוק 3 פעמים עם המדיום M199 מלאה כדי להסיר את שאריות תאי דם אדומים, ומשנים את המדיום כל יומיים עד למפגש.
- ב- 80-90% הנהרות, לשטוף את טפט HUVEC פעם אחת עם 5 מ של PBS ולנתק את התאים עם 5 מ של טריפסין 0.05% ב- 1 מ מ EDTA ב 37 ° C עבור 5 דק להוסיף 4 מ של M199 ו- 1 מ"ל של FCS להפסיק את הפעולה טריפסין. לרוקן את הבקבוק כדי לנתק כל HUVEC.
- אוספים של aliquot של µL 50 לשמש עבור צביעת VE-קדהרין, PECAM-1, gp38, ולנתח על ידי cytometry זרימה כדי לבדוק את טוהר HUVEC.
- לאסוף את שארית HUVEC שלב 1.18 צינור 15 מ"ל, צנטריפוגה-200 g x עבור 5 דקות בטמפרטורת החדר.
- למחוק את תגובת שיקוע מהשלב 1.19 resuspend בגדר תא קפואים פתרון (FCS המכיל 10% דימתיל סולפוקסיד)-צפיפות של 5 x 105 תאים/מ ל cryotubes, להקפיא ב-80 מעלות צלזיוס או חנקן נוזלי עד השימוש.
-
כדי לבדוק את טוהר HUVEC:
- להוסיף aliquot של 50 µL של HUVEC שנאספו בשלב 1.18 µL 1 של נוגדנים נגד VE-קדהרין-FITC, 1 µL של נוגדנים נגד PECAM1-PE ו- µL 1 של נוגדנים נגד Podoplanin-APC.
- דגירה בטמפרטורת החדר במשך 10 דקות.
- להוסיף 100 µL של PBS, צנטריפוגה ב x 400 גרם ל 30 s.
- למחוק את תגובת שיקוע, resuspend ב µL 100 ל- PBS. ניתן כעת לרכוש נתונים באמצעות טכניקות cytometry זרימה.
הערה: HUVEC הן חיוביות VE-קדהרין ו- PECAM-1, וגם שליליות עבור Podoplanin.
2. HUVEC מפשירה
הערה: להשתמש HUVEC נמוכה מעבר לניסויים (מקסימום 5 קטעים).
- מעיל בקבוקון T75 עם 1 מ"ל של הפתרון ציפוי ב 37 מעלות צלזיוס למשך 30 דקות.
- במהירות defreeze HUVEC ב 37 מעלות צלזיוס למשך 2 דקות, resuspend התאים 10 מ"ל של M199 מלאה.
- Centrifuge התאים ב x 200 גרם בטמפרטורת החדר במשך 5 דקות וזורקים את תגובת שיקוע.
- Resuspend בגדר תא ב- 10 מ"ל של M199 מלאה.
- העברת התליה תא בתוך הבקבוק מצופים מראש. מקם את הבקבוקון בחממה ב 37 ° C עם 5% CO2. לשנות את המדיום תרבות תא כל יומיים.
3. HUVEC תרבות בתא ממוצע שקופית 0.4
- חמישה ימים לפני תחילת הניסוי זרימה, מעיל מראש לאהלי ממוצע 0.4-שקופית עם 30 µL של PBS המכיל קולגן 0.1 מ"ג/מ"ל G, 0.2% ג'לטין ב 37 מעלות צלזיוס למשך 30 דקות.
- לשטוף את החדרים עם µL 100 ל- PBS.
- ניתוק תאים מן HUVEC confluent 80-90% של בקבוקון T75.
- לשטוף HUVEC עם 5 מ של PBS ולנתק אותם עם 5 מ של 0.05% טריפסין ב 37 מעלות צלזיוס במשך 5 דקות.
- ריקון לאסוף התליה תא ב M199 מלאה, לספור את התאים בשיטה הנוחה ביותר. צנטריפוגה ב x 200 גרם במשך 5 דקות בטמפרטורת החדר.
- Resuspend בגדר תא-106 תאים למ"ל ולהפיץ 30 µL (תאים 30,000) לכל תא.
- דגירה התאים בתוך אינקובטור ב 37 ° C עם 5% CO2 לשעה.
- להוסיף 150 µL של M199 שלם אחד, התרבות התאים במשך 5 ימים בחממה ב CO 37 ° C ו- 5%2. לשנות את המדיום כל יומיים.
4. HUVEC מכתים עבור מונוציט Assay גיוס תחת זרימה
- להכין המדיום תיוג M199 ו 1 מיקרומטר של CMFDA (5-chloromethylfluorescein diacetate), לחמם את זה ב 37 מעלות צלזיוס במשך 5 דקות לפני תא תיוג.
- HUVEC לשטוף פעמיים עם M199 בינוני חימם ב 37 º C.
- החלף את המדיום µL 30 ומחוממת בינוני תיוג המכיל 1 מיקרומטר של CMFDA ומניחים לתוך החממה-CO של 37 ° C ו- 5%-2 למשך 10 דקות.
- לשטוף פעם עם M199 מלאה, דגירה התאים עם M199 מלאה בחממה ב CO של 37 ° C ו- 5%-2 למשך 30 דקות.
הערה: זה חשוב להסיר כל עקבות של סרום לפני חיבור של הפתרון תיוג, אחרת זה עשוי לשנות HUVEC מכתים. - להחליף את המדיום עם M199 מלאה המכילה גם TNFα אנושי (500 U/mL) או שילוב של TNFα אנושי (500 U/mL) עם VEGFA האנושית (1 µg/mL) עבור 6-אייץ ' באינקובטור 37 ° C ו- 5% CO2.
5. בידוד של פן אנושי ומונוציטים ו צביעה של Subpopulations
- השתמש מעיל באפי של דם אנושי מרוכז או 20 מ"ל של דם אנושי טרי מבודד, שנאספו ביום של הניסוי EDTA האגירה צינורות.
- לדלל את הדם ב- PBS-1 מ מ EDTA (1:1), פיפטה בעדינות 20 מיליליטר דם מדולל mL 20 של מדיה הדרגתיות צפיפות. צנטריפוגה ב x 400 g למשך 30 דקות בטמפרטורת החדר עם האצה איטית וללא בלמים.
- לאסוף תא תאי דם היקפיים (PBMC)-שכבה טסית דם (בין מדיה הדרגתיות צפיפות פלזמה שכבות) לתוך צינור 50 מ ל חדש המכיל 40 מ"ל של PBS - 1 מ מ EDTA. למעלה עד 50 מ עם PBS - 1 מ מ EDTA.
- צנטריפוגה ב x 200 גרם בטמפרטורת החדר במשך 5 דק. למחוק את תגובת שיקוע.
- Resuspend בגדר תא עם 10 מ"ל של מאגר מכתימים (PBS - 1 מ מ EDTA המכילה 0.5% אלבומין שור BSA).
- צנטריפוגה ב x 200 גרם בטמפרטורת החדר במשך 5 דק. למחוק את תגובת שיקוע.
- חזור על שלבים 5.5 ו- 5.6.
- Resuspend בגדר תא עם 10 מ"ל של צביעת מאגר. קח של aliquot של µL 10 עבור ספירת תאים.
- בדוק PBMC אוכלוסיות, לספור תאים במהירות עם cytometer זרימה.
הערה: האוכלוסיות לימפוציט, מונוציט האופיינית יכול להיות שנצפו (איור 1 א'). מ- 50 מ של דם טרי מצפה על 50-100 x 106 PBMC. -
עבור הגיוס של CD14 + נגד CD14-PBMC תחת זרימה:
- לשטוף בגדר שלוש פעמים עם מאגר זרימה (M199 המכילה 0.5% BSA), resuspend תאי תאי זרימה מאגר-תאי6 6 x 10 מ"ל.
- להפוך aliquots של µL 200 עבור כל וזמינותו. דגירה ב 37 ° C עד 20 דקות לפני וזמינותו.
- להוסיף 5 µL של אנטי-CD14-PE Hoechst 33342-ריכוז סופי של 2 מיקרומטר כל aliquot. לערבב, דגירה ב 37 מעלות צלזיוס למשך 10 דקות.
- Centrifuge את aliquot ב x 400 גרם ל 30 s.
- למחוק את תגובת שיקוע, resuspend בגדר עם 200 µL זרימה המאגר.
-
עבור הגיוס של מונוציט subpopulations תחת זרימה:
- לבודד ומונוציטים עם ערכת בידוד מונוציט פאן בהתאם להוראות היצרן.
הערה: פרוטוקול בידוד הבאים הוא עבור 50 x 106 תאים. זה וניתן לשנותם למעלה או למטה כל עוד הוא נמצא המלצות היצרן. - Centrifuge את המתלים PBMC ב x 200 גרם בטמפרטורת החדר במשך 5 דקות.
- למחוק את תגובת שיקוע, resuspend בגדר עם µL 400 של צביעת מאגר.
- הוסף µL 50 של ריאגנט חסימת קולטן Fc ו- 50 µL של פאן מונוציט נוגדן קוקטייל.
- דגירה בטמפרטורת החדר במשך 10 דקות.
- הוסף µL 400 של צביעת מאגר של 100 µL של נוגדן אנטי ביוטין מצומדת beads מגנטי. דגירה בטמפרטורת החדר למשך 15 דקות.
- להוסיף 2 מ של מאגר מוכתמים, להשתמש בעמודה MACS LS בשילוב עם מגנט.
- במקום העמודה LS על המגנט ולהוסיף 1 מ"ל של צביעת מאגר. למחוק את הזרימה דרך.
- להעביר את המתלים PBMC בעמודה ולאסוף את זרימת ברור למרות המכיל פאן ומונוציטים בשפופרת 15 mL החדש.
- להוסיף למאגר מכתימים להתעלות עד 5 מ.
- קח aliquot, לבדוק את טיב הבידוד מונוציט עם cytometer זרימה.
- לקבוע את הרוזן מונוציט פאן.
הערה: רק מונוציט אוכלוסייה יכול להיות שנצפו (איור 1B). - Centrifuge את שארית ומונוציטים מהשלב 5.11.11 ב x 200 גרם במשך 5 דקות.
- למחוק את תגובת שיקוע.
- Resuspend בגדר תא ב 5 מ של מאגר זרימה (M199 המכילה 0.5% BSA).
- חזור על 5.11.13 כדי 5.11.14 פעמיים כדי לחסל את עקבות של EDTA.
- לבודד ומונוציטים עם ערכת בידוד מונוציט פאן בהתאם להוראות היצרן.
- להפוך את מונוציט ההשעיה בזרם המאגר (M199 עם 0.5% BSA) ב 6 x 106 תאים/מ ל....
- להפוך aliquots של µL 200 של monocytes עבור כל שיטת גיוס.
- לשמור את aliquot ב 37 מעלות צלזיוס בחממה עד 20 דקות לפני ההזרקה.
- להוסיף 5 µL של נוגדן anti-CD16-PE ו Hoechst 33342 (סופי 2 מיקרומטר) כל aliquot.
- לערבב, דגירה ב 37 מעלות צלזיוס למשך 10 דקות.
- Centrifuge את aliquot ב x 400 גרם ל 30 s.
- למחוק את תגובת שיקוע, resuspend בגדר עם 250 µL זרימה המאגר.
- להוסיף 30 µL של ההשעיה מונוציט בתא אחד של השקופית לשרת עבור הגדרת הפרמטרים רכישה מיקרוסקופ קונפוקלי.
- למנוע את aliquots של השעיה מונוציט שלב 5.18 ב 37 º C.
הערה: ההשעייה הוא מוכן להיות מוזרק ב מערכת הזרימה.
6. הכנה של מערכת Fluidic
- להבטיח כי החממה תא עבור ההדמיה להגדיר ב- 37 מעלות צלזיוס.
הערה: דיאגרמה של מערכת הזרימה מוצג באיור2. - להרכיב את החלק אבובים i: להוסיף זכר מחבר סכינים סטריליים בקצה אחד של פיסת סיליקון אבובים (8 ס מ ארוך ו- 3 מ מ עבה) וחבר את הקצה השני ערכה זריקת סכינים סטריליים בשורה. חבר את מחבר סכינים סטריליים האחרון פיסת סיליקון אבובים (40 ס מ, בעובי 3 מ מ) בקצה אחד.
הערה: באופן אופציונלי, ברז 3-way מחובר מזרק 5 מ ל יכול להיות מוכנס בין ערכת זריקת סכינים סטריליים בשורה של סיליקון אבובים להסרת בועות אוויר בסופו של דבר. - להרכיב את החלק אבובים II: להתחבר מזרק 20 מ"ל קצה אחד של אורך של סיליקון אבובים (1 מ', בעובי 3 מ מ). הכנס את מחבר סכינים סטריליים זכר הקצה השני של הצנרת.
- לחבר חלק ואני חלק II אבובים על-ידי הוספת הזכרים מחבר סכינים סטריליים כדי במפצל נעל זכוכית הנשי (איור 2 א).
- לשים סוף לאורך צינור סיליקון חינם במאגר המכיל מאגר זרימה (M199 + 0.5% BSA) להתחמם ב 37 º C.
- משוך על הבוכנה של המזרק 20 מ למלא את הצנרור עם מאגר זרימה.
- מניחים את המזרק על המשאבה ואבטח אותו.
- הגדר את המשאבה ב לסגת מצב (בניגוד כדי להשרות) וציין את קצב הזרימה.
- לקבוע את קצב הזרימה על פי השקופית IBIDI בשימוש על-ידי שימוש בנוסחה הבאה:
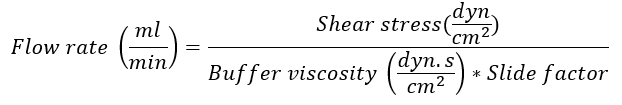
הערה: הגורם שקופיות הוא תלוי השקופית IBIDI המשמש את הניסוי. עבור השקופית ממוצע אני0.4 נעל זכוכית המשמש בדוגמה זו, הגורם שקופיות הוא 131.6. עבור שקופיות ספציפיות גורמים, ראה את אתר האינטרנט של החברה14. צמיגות מאגר הזרימה היא 0.0072 dyn.s/cm2. מאמץ גזירה-venules פוסט-נימי הוא על רמות דינ/cm 0.52. -
לחבר את השקופית (איור 2B):
- מלחציים לאורך צינור סיליקון מסביב מחבר נקבה נעל זכוכית, נתק הזכרים מחבר שני סכינים סטריליים של מחבר.
- לחבר אותם המאגרים של השקופית המכילה מגורה HUVEC ומילוי בינונית. להימנע בועות אוויר במהלך שלב זה.
- . תוריד את התפסים ולהבטיח כי הקשר לא דולף.
- מקם את השקופית מתחת למיקרוסקופ עבור הדמיה בצילום מואץ ולהתחיל את המשאבה.
7. זמן לשגות הדמיה של גיוס מונוציט תחת זרימה על ידי מיקרוסקופיה קונפוקלית
- השתמש מטרה 40 x (ראה טבלה של חומרים) עבור הדמיה.
- להפעיל את 405 ננומטר (גרעינים מונוציט כחול), 488 ננומטר (תאי אנדותל ירוק), לייזרים nm (אדום CD16 + ערכה) 561.
- השתמש את התא המכיל את ומונוציטים כדי להגדיר את הפרמטרים רכישה.
הערה: כדי לזהות ומונוציטים שאינם שמדמו והן שמדמו, חריר ואת עוצמת ננומטר לייזר 405 מוגדרים גבוהה. לפיכך, שאינם שמדמו ומונוציטים גלויים מעט בתכנית הבזליים. עם זאת רק שמדמו ומונוציטים להציג שטח מוכתם מסביב לגרעין המתאים שטח חדש הכבוש מתחת תאי אנדותל. - מקם את התא כדי לרכוש תחת המיקרוסקופ.
- בחר 3 השדות של תצוגות ברדיוס 1 ס מ עבור הדמיה קונאפוקלית במקומות מרובים.
- להגדיר את הבסיס ואת הצדדים הפסגה של תאי אנדותל
- הגדר z-מחסנית הטווח 10 – 12 מיקרומטר (0.5 מיקרומטר שלב). הפעל רכישת זמן לשגות כל 1 דקות.
- לאחר 3 דקות הדמיה, להזריק µL 200 מונוציט השעיה (6 x 106 תאים/mL) דרך היציאה זריקת סכינים סטריליים בשורה.
הערה: במהירות ומונוציטים מופיעים בתוך המטוס מוקד הפסגה, לדבוק ולהתחיל גלגול (תחבורה מן הפסגה לתוכנית הבסיס). - תמונת לפחות 30 דקות. לאחר סיום, תפסיק הדמיה, לעצור את הזרימה. תהדק את הצנרת כדי לנתק אותם מתוך השקופית.
- לתקן את השקופית עם 4% paraformaldehyde ב 4 מעלות צלזיוס למשך 10 דקות.
- לשטוף את השקופית הכוללת PBS ולאחסן את השקופית ב 4 ° C לצורך ניתוח נוסף במידת הצורך.
8. לנתח את הנתונים עם ImageJ
- לספור את מספר הכולל ומונוציטים חסיד בכל שדה. לקבוע את ספירת התאים לכל מ מ2.
- נחשב שמדמו ומונוציטים נוכח התוכנית הבסיס מתחת תאי אנדותל ובלתי מזוהה על ידי הנוכחות של חור שחור (בערוץ ירוק) מסביב לגרעין.
- לחלק את הספירה של לויקוציטים שמדמו על ידי המספר הכולל של לויקוציטים חסיד. שיעור גלגול מוצג כאחוז ומונוציטים חסיד.
- להמחשה, הפסגה, הצדדים הבזליים ניתן להציג בו-זמנית כדי להמחיש את האירועים המתרחשים בכל אלה תאי אנדותל.
תוצאות
קביעת מצב הפעלה HUVEC שנגזרות TNFα
הביו-פעילות ציטוקינים דלקתיים TNFα יכול להשתנות לפי את אצוות גודש של מחזור מפשיר לקפוא. חשוב לבדוק את מצב ההפעלה של HUVEC עם טיפול TNFα. זה יכול להתבצע על ידי צביעת במקביל דוגמאות HUVEC confluent עבור אינדוקציה דלקתיות של s...
Discussion
כאן, אנו מדווחים על שיטה המפרט מחקר של מה מונוציט subpopulations transmigrate דרך טפט אנדותל מודלק. השיטה דנו להשתמש מיקרוסקופיה קונפוקלית במקום שלב-ניגודיות מיקרוסקופ, אשר משמש גם ללמוד מונוציט גיוס תחת זרימה3,11,19. אחד היתרונות של שימוש מיקרוסקופיה ק?...
Disclosures
המחברים יש אין אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים ד ר פול Bradfield על כתב היד הקריאה ואת המשוב. א ס קיבלו תמיכה כספית מארגון אדוני ג'ולס ת'ורן צדקה בחו ל לבטוח רג,
Materials
| Name | Company | Catalog Number | Comments |
| Tissue Culture Flasks 75 cm2 | TPP | 90076 | Routine culture of isolated HUVEC |
| µ-Slide VI 0.4 | IBIDI | 80606 | |
| Centrifuge Tubes 15 mL | TPP | 191015 | |
| Centrifuge Tubes 50 mL | TPP | 191050 | |
| Collagen G | Biochrom | L 7213 | For coating of cell culture flasks |
| Gelatin | Sigma-Aldrich | 1393 | For coating of cell culture flasks |
| Dulbecco’s Phosphate Buffered Saline (without MgCl2 and CaCl2) | Sigma-Aldrich | D8537 | |
| Dulbecco’s Phosphate Buffered Saline (with MgCl2 and CaCl2) | Sigma-Aldrich | D8662 | |
| RPMI-1640 Medium | Sigma-Aldrich | R8758 | |
| 3-Way Stopcocks | BIO-RAD | 7328103 | |
| penicillin 10,000 μ/mL streptomycine 10,000 μg/mL fungizone 25 μ/mL | AMIMED | 4-02F00-H | |
| Collagenase type 1 | Worthington | LS004216 | |
| Medium 199 1x avec Earle's salts, L-Glutamine, 25 mM Hepes | GIBCO | 22340020 | |
| Bovine Albumin Fraction V | ThermoFisher | 15260037 | |
| Endothelial Cell Growth Supplement, 150 mg | Millipore | 02-102 | |
| Heparin Sodium | Sigma-Aldrich | H3149RT | |
| Hydrocortisone | Sigma-Aldrich | H6909 | |
| L-Ascorbic acid | Sigma-Aldrich | A 4544 | |
| EDTA disodium salt dihydrate C10H14N2Na2O8 · 2H2O | APPLICHEM | A2937.0500 | |
| CD144 (VE-Cadherin), human recombinant clone: REA199, FITC | Miltenyi Biotech | 130-100-713 | AB_2655150 |
| CD31-PE antibody, human recombinant clone: REA730, PE | Miltenyi Biotech | 130-110-807 | AB_2657280 |
| Anti-Podoplanin-APC, human recombinantclone: REA446, APC | Miltenyi Biotech | 130-107-016 | AB_2653263 |
| BD Accuri C6 Plus | BD Bioscience | ||
| µ-Slide I Luer | IBIDI | 80176 | |
| CMFDA (5-chloromethylfluorescein diacetate) | ThermoFisher | C2925 | |
| Recombinant human TNFα | Peprotech | 300-01A | |
| Recombinant human VEGFA | Peprotech | 100-20 | |
| NE-1000 Programmable Syringe Pump | KF Technology | NE-1000 | |
| Ficoll Paque Plus | GE Healthcare | 17-1440-02 | |
| Anti-human CD14-PE, human recombinant clone: REA599, PE | Miltenyi Biotech | 130-110-519 | AB_2655051 |
| Pan Monocyte Isolation Kit, human | Miltenyi Biotech | 130-096-537 | |
| Anti-human CD16-PE, human recombinant clone: REA423, PE | Miltenyi Biotech | 130-106-762 | AB_2655403 |
| LS columns | Miltenyi Biotech | 130-042-401 | |
| QuadroMACS Separator | Miltenyi Biotech | 130-090-976 | |
| Hoechst 33342, Trihydrochloride, Trihydrate | ThermoFisher | H1399 | |
| Silicone tubing | IBIDI | 10841 | |
| Elbow Luer Connector | IBIDI | 10802 | |
| Female Luer Lock Coupler | IBIDI | 10823 | |
| Luer Lock Connector Female | IBIDI | 10825 | |
| In-line Luer Injection Port | IBIDI | 10820 | |
| Ar1 confocal microscope | Nikon | ||
| 40x objective | Nikon | 40x 0.6 CFI ELWD S Plane Fluor WD:3.6-2.8mm correction 0-2mm | |
| ImageJ Software | NIH |
References
- Auffray, C., Sieweke, M. H., Geissmann, F. Blood Monocytes: Development, Heterogeneity, and Relationship with Dendritic Cells. Annual Review of Immunology. 27 (1), 669-692 (2009).
- De Palma, M., Venneri, M. A., Roca, C., Naldini, L. Targeting exogenous genes to tumor angiogenesis by transplantation of genetically modified hematopoietic stem cells. Nature Medicine. 9 (6), 789-795 (2003).
- Sidibe, A., et al. Angiogenic factor-driven inflammation promotes extravasation of human proangiogenic monocytes to tumours. Nature Communications. 9 (1), 355 (2018).
- Ley, K., Laudanna, C., Cybulsky, M. I., Nourshargh, S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nature Review Immunology. 7 (9), 678-689 (2007).
- Nourshargh, S., Alon, R. Leukocyte Migration into Inflamed Tissues. Immunity. 41 (5), 694-707 (2014).
- Cros, J., et al. Human CD14dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 33 (3), 375-386 (2010).
- Geissmann, F., Jung, S., Littman, D. R. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity. 19 (1), 71-82 (2003).
- Chamorro, S., et al. In vitro differentiation of porcine blood CD163− and CD163+ monocytes into functional dendritic cells. Immunobiology. 209 (1-2), 57-65 (2004).
- Passlick, B., Flieger, D., Ziegler-Heitbrock, H. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 74 (7), (1989).
- Venneri, M. A., et al. Identification of proangiogenic TIE2-expressing monocytes (TEMs) in human peripheral blood and cancer. Blood. 109 (12), 5276-5285 (2007).
- Bradfield, P. F., et al. JAM-C regulates unidirectional monocyte transendothelial migration in inflammation. Blood. 110 (7), 2545-2555 (2007).
- Schenkel, A. R., Mamdouh, Z., Muller, W. A. Locomotion of monocytes on endothelium is a critical step during extravasation. Nature Immunology. 5 (4), 393-400 (2004).
- Luu, N. T., Rainger, G. E., Nash, G. B. Kinetics of the different steps during neutrophil migration through cultured endothelial monolayers treated with tumour necrosis factor-alpha. Journal Vascular Research. 36 (6), 477-485 (1999).
- ibidi GmbH. . Shear Stress and Shear Rates for ibidi µ-Slides - Based on Numerical Calculations. , (2014).
- Yang, L., Froio, R. M., Sciuto, T. E., Dvorak, A. M., Alon, R., Luscinskas, F. W. ICAM-1 regulates neutrophil adhesion and transcellular migration of TNF-alpha-activated vascular endothelium under flow. Blood. 106 (2), 584-592 (2005).
- Yang, C. -. R., Hsieh, S. -. L., Ho, F. -. M., Lin, W. -. W. Decoy receptor 3 increases monocyte adhesion to endothelial cells via NF-kappa B-dependent up-regulation of intercellular adhesion molecule-1, VCAM-1, and IL-8 expression. Journal of Immunology. 174 (3), 1647-1656 (2005).
- Wong, D., Dorovini-Zis, K. Expression of vascular cell adhesion molecule-1 (VCAM-1) by human brain microvessel endothelial cells in primary culture. Microvascular Research. 49 (3), 325-339 (1995).
- Bradfield, P. F., Nourshargh, S., Aurrand-Lions, M., Imhof, B. A. JAM family and related proteins in leukocyte migration (Vestweber series). Arteriosclerosis Thrombosis and Vascular Biology. 27 (10), 2104-2112 (2007).
- Bradfield, P. F., et al. Divergent JAM-C Expression Accelerates Monocyte-Derived Cell Exit from Atherosclerotic Plaques. PLoS One. 11 (7), e0159679 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved