Method Article
Análisis de la célula de tensión de esquileo en vivo en Pseudomonas aeruginosa mediante un sistema de microfluidos superior rendimiento automatizado
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, describimos el uso de un biorreactor de microfluidos un mayor rendimiento juntado con un microscopio de fluorescencia para el análisis de los efectos de la tensión de esquileo de aeruginosa de los Pseudomonas biofilms expresando proteínas fluorescentes verdes, como instrumento establecido, la determinación de la cobertura de biofilm, tasa de crecimiento y características morfológicas.
Resumen
Un mayor rendimiento microfluídicos en vitro biorreactor juntado con microscopía de fluorescencia se ha utilizado para el estudio de crecimiento del biofilm bacteriano y la morfología, incluyendo aeruginosa de los Pseudomonas (p. aeruginosa). Aquí, vamos a describir cómo el sistema se puede utilizar para estudiar la cinética de crecimiento y las características morfológicas tales como la rugosidad de la superficie y textura entropía de p. aeruginosa cepa PA01 que expresa una proteína verde fluorescente mejorada (PA01-EGFP ). Un protocolo detallado describe cómo crecer y sembrar cultivos PA01-EGFP, cómo ajustar el microscopio y el autorun y realizar el análisis de imagen para determinar la tasa de crecimiento y propiedades morfológicas usando una variedad de fuerzas de cizalla que son controlados por el dispositivo de microfluidos. Este artículo proporcionará una descripción detallada de una técnica para mejorar el estudio de biofilms PA01-EGFP que eventualmente puede aplicarse a otras cepas de biofilms de bacterias, hongos o algas utilizando la plataforma de microfluidos.
Introducción
Aquí le mostraremos un método para medir el efecto de la tensión de esquileo en la formación de fluorescente Pseudomonas aeruginosa (p. aeruginosa) PA01 biopelículas usando un sistema automatizado de un mayor rendimiento de microfluidos.
Los biofilms son comunidades de microorganismos, como bacterias, organizadas por una sustancia polimérica extracelular que se unen a un soporte y normalmente se encuentran en la interfase entre un líquido y un sólido superficie1. Estas comunidades biofilm pueden ser beneficiosas para el medio ambiente, tales como mejorar la calidad del agua en las líneas de suministro de agua y biorremediación de recalcitrantes compuestos2,3. Sin embargo, los biofilms también puede ser altamente perjudiciales para la salud humana con consecuencias indeseables. Por ejemplo, dispositivos médicos, tales como implantes de cadera y rodilla, son un tipo de superficie donde la acumulación de biofilm ha sido un desafío y causa severas complicaciones médicas4,5. Biofilms puede también entrar en los sistemas naturales de agua, como ríos y lagos e infiltrarse en tuberías de abastecimiento de agua conduciendo a contaminación por bacterias en agua potable, dando por resultado infecciones6,7,8. Biofilms formados en ambientes marinos se adhieren a los barcos y otros sustratos artificiales y presentan un grave problema económico y ambiental como aumento de la fricción conduce a aumentar el consumo de combustible9,10. Recubrimientos antimicrobianos, como el tributilestaño, se han desarrollado para prevenir estos problemas pero son tóxicos para la vida marina11.
P. aeruginosa es una bacteria gram negativa con alta capacidad próspera en una variedad de condiciones ambientales y nutrimental12. P. aeruginosa es una causa común de infecciones comunitarias y nosocomiales y a estar estrechamente asociadas a lesiones, como quemaduras graves y los anfitriones immunocompromised, tales como en la fibrosis quística (CF)5,12, 13, SIDA y cáncer pacientes5,13. La formación de biofilms de p. aeruginosa se ha conectado más seriamente a CF, donde infecciones pulmonares crónicas son la principal causa de muerte por esta enfermedad5.
Una cepa de referencia de p. aeruginosa, PA01, es utilizada en este informe y es genéticamente modificada para expresar una proteína verde fluorescente mejorada (PA-EGFP). EGFP representa una forma mutante de GFP con mayores propiedades de fluorescencia que permite en situ biofilm análisis mediante microscopía de fluorescencia14,15,16. Este tipo de análisis de la fluorescencia es ventajoso para el estudio de biofilms porque GFP no interfiere significativamente con el crecimiento de la célula y función17. Por ejemplo, las células de Escherichia coli que fueron marcadas con GFP crecieron bien y continuamente sin haber sufrido ningún efecto tóxico en comparación con la de las bacterias de control17. Otros informes corroborar esta afirmación18,19,20. Además, el uso de un reportero fluorescente como EGFP es rápida y sencilla, sin embargo, células vivas sólo se medirán porque las células muertas rápidamente dejan de emitir fluorescencia21.
Biofilms puede crecer bajo diferentes condiciones ambientales los caudales diferentes incluidos. Por ejemplo, las películas pueden crecer en alta tensión de esquileo, como en los ríos, donde las condiciones de flujo de agua conducen a una mayor diversidad microbiana22. Por el contrario, agua en estanques o biofilms orales experimentan una mucho más baja del esquileo fuerza23. Además de flujo, existen otros factores que influyen en la adherencia de biofilm, rugosidad de la superficie como hidrofobicidad, composición de los medios de comunicación, y aún el bacteriano de la célula superficie1,4,7, 24. condiciones también pueden causar variación en la estructura espacial o la morfología de un biofilm. Esto incluye condiciones ambientales como la tensión de esquileo ejercida por un líquido móvil o gradientes en la disponibilidad de nutrientes y factores biológicos como las especies presentan en el sistema, la motilidad de las células y las proteínas específicas presentes en el medio extracelular sustancia polimérica25,26,27. Bajo ciertas condiciones, el biofilm será como césped (lisa y plana), mientras que bajo otras condiciones el biofilm será áspero, esponjoso, o incluso hongos como28. Mientras que la diferencia cualitativa entre biofilm céspedes y seta se aprecia claramente en imágenes microscópicas, entender la relación entre la estructura de la película y los procesos biológicos dentro de la película requiere sistemática y cuantitativa métodos de descripción de la morfología. Propiedades morfológicas sugeridos para el estudio por los investigadores incluyen porosidad, longitud difusional, dimensión fractal, área microcolony en el sustrato, microcolony volumen, coeficiente de rugosidad y textura entropía29,30 .
Biorreactores se utilizan en el estudio de biofilms para imitar la vida real las condiciones31. Reactores de flujo de goteo (DFR) representan un ambiente de baja cizalladura donde nutrientes en medios de comunicación fluyen lentamente a través de las células que están sujetando a una superficie con el tiempo para formar un biofilm con un celular alta densidad32. Reactores de CDC son Biorreactores que crean un ambiente de alta tensión de esquileo líquido por el control de una varilla que gira continuamente dentro de los medios de comunicación llenado tanque33. Estos tipos de biorreactores son fáciles de configurar, pero están limitados en alcance debido al tamaño de muestra relativamente baja, el alto consumo de medios de comunicación, grandes cantidades de desechos con riesgo biológico producido a partir de los medios de comunicación corrientes de goteo desde 125 μl/minuto para reactores de flujo de goteo a más de 1 mL/min para reactores de CDC y la necesidad de grandes cantidades de autoclave de material de vidrio y residuos de los medios de comunicación34. Biofilms no crecen uniformemente por toda la superficie en un reactor de flujo de goteo porque el bajo cizallamiento de los medios de comunicación provoca que se arrastra a lo largo de los más grandes conglomerados de bacterias p. aeruginosa por lo tanto, el crecimiento del biofilm no es muy suave y las muestras desiguales no pueden ser fácilmente analizados con microscopía de fluorescencia35,36 .
Algunas limitaciones comunes del biorreactor se superan mediante el uso de un biorreactor de rendimiento medio de microfluidos, donde sólo mililitros de los medios de comunicación son necesarios, y las placas de reacción son pequeñas y fácilmente desechable después de autoclavar37. Además, dependiendo del número de pozos, se pueden realizar muchas repeticiones en un reactor de ejecutar, que proporciona la cantidad suficiente de datos para llevar a cabo análisis estadístico significativo. En la figura 1, se muestran los diferentes componentes del sistema de microfluidos-microscopía que permiten condiciones controladas, incluyendo temperatura y fluyen tasa38,39,40. El biorreactor es junto con microscopía de fluorescencia para visualizar la fluorescencia de la etiqueta EGFP en PA01 bajo aplicado bajo condiciones de alta cizalladura que imitará a escenarios más realistas que se encuentran en el ambiente o en el campo biomédico.
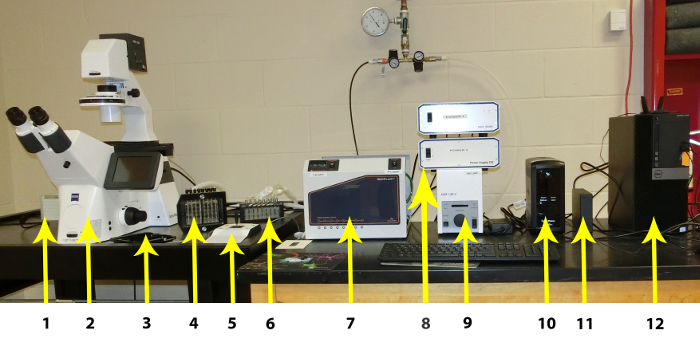
Figura 1 : Los componentes individuales del sistema de microfluidos. Los componentes individuales se enumeran de izquierda a derecha: 1. cámara CCD, 2. alta resolución invertido microscopio automatizado etapa, módulo de fluorescencia automatizada y módulo de enfoque automático, 3. fase de placa, 4: imágenes de sistema de interfaz, 5: Manual de platina del microscopio Control, 6: Trampa de Vapor, 7: sistema controlador (controlador de temperatura incluyendo), 8 de imagen: Controladores de Hardware, 9: regulador de fluorescencia, 10: fuente de alimentación ininterrumpida, 11: disco duro externo para almacenamiento de imágenes, 12: estaciones de trabajo PC. Haga clic aquí para ver una versión más grande de esta figura.
Un fragmento de la placa de microfluidos se muestra en la figura 2. Las placas más utilizadas consisten en 48 pozos. Un experimento requiere una entrada y una salida pozos, un total de 2 pozos. Esto permite 24 experimentos simultáneos que se pueden realizar con diversas condiciones experimentales, tales como cepas de bacterias, tratamientos antimicrobianos y los medios de comunicación variaron de canal a canal y controlado flujo de corte para cada columna de seis canales. También se controla la temperatura experimental con un ajuste de temperatura a lo largo de la placa. Los canales de microfluidos muestran que cada canal tiene una región serpentina para proporcionar suficiente presión y cizallamiento controlado.
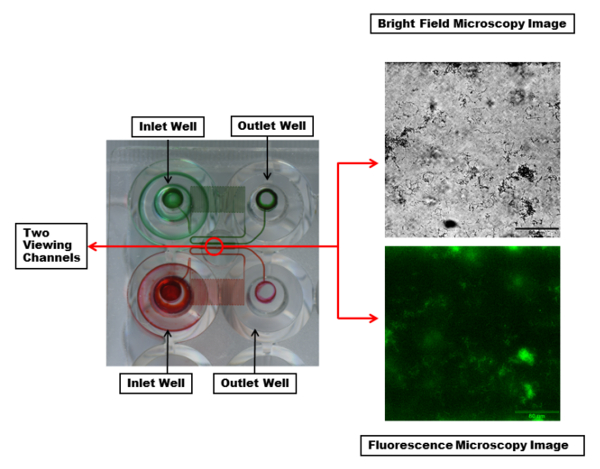
Figura 2: visualización de los canales de microfluidos y ventana. Se destacan dos pozos de entrada y salida con los canales de microfluidos conectarlos con colorantes rojos y verdes. El tinte hace visible una región serpentina en cada canal que crea suficiente presión y cizallamiento controlado durante el flujo de fluidos. Cada canal de visualización (dentro del círculo rojo) puede ser reflejada con longitudes de onda deseadas. Campo claro (arriba) y fluorescentes (abajo) se muestran imágenes de microscopía de un solo canal con una biopelícula de PA01-EGFP mediante objetivo 20 X. Barra de escala = 80 μm. haga clic aquí para ver una versión más grande de esta figura.
Una guía paso a paso se proporciona para permitir a los usuarios de biorreactores de microfluidos que se juntan con microscopía de fluorescencia para llevar a cabo experimentos biofilm novela corte diferentes ambientes. Este método permitirá la expansión de los experimentos que implican otros microorganismos además de bacterias como hongos y algas, que tienen aplicaciones médicas y ambientales41,42,43. El enfoque detallado describe cómo cultura PA01-EGFP, inocular una placa de 48 pozos y configurar el dispositivo de microfluidos y el software, configurar el microscopio fluorescente y demostrar el análisis de software para obtener la cobertura de biofilm, la tasa de crecimiento, y características morfológicas como la rugosidad de la superficie.
Protocolo
1. preparación de medios de comunicación
- Preparar media mínima (MM) con 0.25% de glucosa. Para hacer 1 L de MM con 0.25% de glucosa, añadir 200 mL de solución salina de M9 estéril, 2 mL de estéril 1 M MgSO4, 100 μl de estéril 1 M CaCl2, 12,5 mL de glucosa estéril de 20% (p/v) al agua (dH2O) en un volumen final de 1 L.
- Transferencia de medios necesarios para una botella estéril usando técnicas estériles. Preparar la cantidad necesaria según el número de canales que se utilizan. Por lo general, cada canal requiere 200 μL para el cebado, 300 μL para siembra y 1300 μL para el experimento de 24 h.
- Coloque la botella en una incubadora o baño de la temperatura experimental. Los medios de comunicación deben estar en la temperatura del experimento antes de su uso para evitar burbujas en los microcanales.
2. preparación de una cultura Experimental y durante la noche de PA01-EGFP.
- Colocar 15 mL de medio experimental en un frasco estéril de la mano e inocular con una o dos colonias de una placa de agar con mechas con PA01-EGFP. Expandir la cultura de 12 a 16 h en una tabla de coctelera de la incubadora a 37 ° C y 180-220 rpm.
- Mida OD600 de la cultura durante la noche. Cuando el OD600 es superior a 0.80, diluir la cultura durante la noche para el OD final de 0,8 con lugar mm fresco cultivo experimental en una incubadora o baño de agua a 37 ° C hasta que se necesite para la siembra de los canales de microfluidos. Compruebe el OD600 otra vez inmediatamente antes de sembrar para asegurar que no ha cambiado significativamente desde la meta OD600, 0.8 en este caso.
3. equipo Inicio
- Configurar la estación de sistema según la guía del usuario, similar a la configuración en la figura 1. Para evitar un error en la conexión del instrumento en el software, activar el instrumento en el siguiente orden:
Estaciones de trabajo PC
Módulo de fluorescencia. Asegúrese de que el obturador de la fluorescencia está en (la luz azul botón de obturador)
Controladores de hardware
Sistema control de imagen (véase Tabla de materiales)
Cámara CCD
Estación de la proyección de imagen (microscopio)
Nota: Debe ajustarse la temperatura de la placa calentada a la temperatura deseada de la experimental. - Iniciar la aplicación de control y escriba el número de placa ubicado en la etiqueta en el lado de la placa.
Nota: Después se inicia la aplicación de control habrá dos ventanas separadas, una para el software que controla el software de la proyección de imagen de microscopio y otra para el módulo de control que controla la bomba y la interfaz de la placa de la pozo. Esto se muestra en la Figura S1, donde el menú de "Multi Dimensional adquisición" está abierto en la parte superior y el módulo de Control se establece para un archivo autorun en la parte inferior.
4. cebado y siembra la placa microfluídica
Nota: El cebado, sembrando, fijación bacteriana y crecimiento se ilustran en la figura 3.
- Retire la placa de 48 pozos microfluídicos del embalaje asegurándose de no tocar la superficie del vidrio en la parte inferior de la placa. Limpiar el portaobjetos de cristal en la parte inferior de la placa con un papel para lentes, un paño libre de pelusa o una toallita de pelusas.
- Para preparar los canales de microfluidos, pipetear 200 μL de 37 ° C MM en la salida, siendo cuidadoso para evitar burbujas. Coloque la placa en la etapa de la placa y limpiar la interfaz con etanol, lo que permite que se seque, antes de sellar en el escenario de la placa.
- En el Modo Manual en el módulo de Control, conjunto de líquido como LB a 37 ° C y Max corte en 5,00 Dina/cm2. Haga clic en los pozos de salida para activar el flujo de la salida a la entrada, los canales de cebado. Después de lo 5 min de cebado, hacer una pausa en el flujo para preparar para la siembra. Cuidadosamente retire la placa de la etapa y pipetear restos de medios de la salida pero no quitar cualquiera de los medios de comunicación del círculo interior que conduce a los canales de microfluidos.
- Para los canales experimentales de semillas, primero pipetear 300 μL de MM en la entrada bien seguida por pipeteo 300 μL de cultivo bacteriano en la salida en la salida del bien. Coloque la placa en la etapa de placa asegurándose de limpiar la interfaz antes de colocarlo en la placa.
- En el módulo de Control, se centran en un solo canal usando la cámara en vivo de la alimentación después de colocar el escenario de la placa sobre la platina del microscopio. Mientras visualmente por el vivo, reanudar el flujo de 1.00-2.00 Dina/cm2 para aproximadamente 2-4 s permitir que las células a entrar en el canal experimental pero no en los canales serpenteantes. Dejar la placa en la etapa de regulación de temperatura durante 1 h permitir el accesorio de la célula. Durante la incubación de 1 h, el módulo de Control y montaje de software puede configurarse para el autorun (paso 5).
Nota: La cantidad de tiempo necesario para la siembra dependerá del medio y el organismo, por lo que deben ser vigilado de cerca por el vivo hasta optimizado y utilizado como un marco de tiempo general. Siembra a lo largo de la placa puede variar que requeriría más tiempo de flujo aplicada a ciertas columnas de canales para la siembra completa. - Tras el periodo de fijación, retire la placa de la etapa y pipetar las bacterias de la salida del primero, evitando perturbar el canal. Con una punta de pipeta nueva, retire los medios de comunicación de los pozos de entrada.
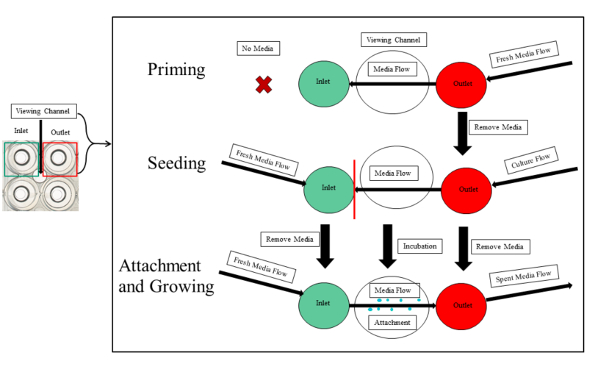
Figura 3 : Resumen experimental de cebado siembra y accesorio de PA01-EGFP en los canales de microfluidos. Se contornea el cebado siembra y accesorio. El primer paso de cebado requiere medios frescos que te presenten a la salida. La siembra implica iguales volúmenes de cultivo bacteriano y los medios de comunicación en la entrada y salida de pozos, respectivamente. La cultura no debe pasar el segmento de la visualización del canal experimental (línea roja) para evitar la obstrucción de los canales serpenteantes. Después de que el período de incubación es largo, media fresca fluye continuamente desde la entrada, a la cámara de visión y en la toma. Esto inicia el accesorio y el crecimiento de la biopelícula bacteriana. Haga clic aquí para ver una versión más grande de esta figura.
5. configuración del Software
- En el software, abra "Adquisición Dimensional múltiple" para controlar la adquisición de imágenes de microscopio. En el menú "principal", seleccione "Timelapse", "Múltiples posiciones de etapa" y "Varias longitudes de onda" (S1A figura).
- Configurar las opciones de ahorro , crear un simple Nombre Base, asegurándose de comprobar nombre base incremento si el archivo existe . Haga clic en Seleccionar directorio para seleccionar la carpeta donde se guardarán todos los archivos. Incluyen detalles esenciales del experimento en la Descripción.
- En la ficha de Timelapse , ajustar la duración del tiempo experimental a las 24 h. Para controlar la frecuencia se adquieren imágenes, establecer el Intervalo de tiempo para que las imágenes son adquiridas cada 5 min durante todo el experimento. El Número de puntos de tiempo ajusta automáticamente con los parámetros establecidos.
- Establecer posiciones de etapa usando la cámara en vivo de la alimentación en el microscopio de campo brillante, permitiendo para el enfoque y la correcta colocación. Comenzando con el objetivo de X 10, se centran en el centro del canal, situado por encima o por debajo de los números del canal grabados en la placa. Interruptor para el objetivo 20 X, encontrar la zona de visión óptima y plano focal dentro del canal. Añadir la posición en la lista o cambiar la posición de canal preajustado con la nueva configuración.
- En el menú de longitudes de onda , establecer el número de longitudes de onda 3. La longitud de onda 1 (W1), seleccione el FITC 100% CAM con un tiempo de exposición de 10 ms. Para longitud de onda 2 (W2), seleccione el campo luminoso 50% CAM 50% VIS con un tiempo de exposición mínimo de 3 ms. 3 (W3), la longitud de onda como el filtro Cerrado todos así no hay luz sigue en el último canal entre tiempos de adquisición.
- Cuando se configura el módulo de Control, verifique que el manual de funcionamiento se ha detenido.
- En el menú de Autoejecución de editar en la ficha Configuración del protocolo , establece un nuevo protocolo para 24 h de duración, que fluye en la dirección de avance a la velocidad de corte deseada. Tarifa del esquileo es variada para estudiar el efecto del crecimiento de biopelícula con tarifa del esquileo. Haga clic en Agregar y Guardar como protocolo.
- En la pestaña de Configuración de la secuencia , crear una nueva secuencia seleccionando LB@37degrees como el líquido por defecto para todos los canales. En Iteración del paso 1, para los canales 1-12, seleccione el protocolo con la tarifa del esquileo deseado y Habilitar todos los canales. Para los canales 13-24, seleccionar el protocolo con la segunda tarifa del esquileo deseado y Habilitar todos los canales. Seleccione aplicar y Guardar como la secuencia.
- En el menú de ejecución automática , seleccione la secuencia guardada para el autorun.
6. tiempo de instalación de experimento de crecimiento de Biofilm
- Pipetear un máximo de 1.300 μL de MM estéril en la entrada de la placa de microfluidos. Coloque la placa en la etapa de la placa y limpiar la interfaz con etanol, permitiendo que el etanol se seque completamente, antes de sellar la placa.
- Colocar la placa de la etapa en la platina del microscopio y asegúrese de que los protocolos y secuencias se establecen correctamente. Seleccione iniciar para iniciar el autorun seguido rápidamente haciendo clic en adquirir para iniciar la colección de imágenes de microscopio.
- Ajustar el enfoque y la colocación de todas las posiciones de etapa entre adquisiciones de imagen. Seleccione pausa y, usando el modo de imagen en directo en la longitud de onda de campo brillante, seleccione Ir a para ver las posiciones de cada etapa. Configuración de nuevo mediante la selección de corriente. Haga clic en reanudar antes de la próxima adquisición programada.
7. revisar y analizar secuencias de imágenes después del experimento de crecimiento de Biofilm tiempo
- Para revisar cada canal después de las 24 h autorun, en el software, Abra Revisar datos multidimensionales, situado bajo Herramientas de análisis. Haga clic en Seleccione Archivo Base | Seleccione el directorio para navegar a la carpeta de secuencias de imágenes para el experimento de interés. En la lista de conjuntos de datos en la carpeta que aparece, seleccione el nombre de base de datos de interés.
- Una vez seleccionados los datos de interés, haga clic en Ver para revisar estos datos. Seleccione una longitud de onda para revisar que los datos en la ventana de longitud de onda (Figura S2).
- Revisión de la secuencia de imágenes para cada canal, seleccione el número de canal en Posición y utilizando los controles de vídeo para analizar los datos para el tiempo de 289 puntos (suponiendo que se obtienen imágenes cada 5 min durante un plazo de 24 h). Tome nota de los datos de crecimiento utilizable.
Nota: En cada canal, reloj para el desarrollo de las burbujas de aire y los zuecos que perturbarán el crecimiento de la biopelícula en el canal, que afectan a los datos. Sin embargo, si éstos ocurren más adelante en los datos de ejecución, antes de estas circunstancias puede encontrar útil. - Después de revisar y seleccionar los datos deseados para el análisis, crear pilas de imágenes para cada canal. En el menú archivo , seleccione abierto especial | Construir la pila | Número de nombres. En la ventana de Construcción de pila , seleccione el botón de Seleccionar primera imagen luego selecciona la primera imagen de la pila en la carpeta de archivo. Seleccione el botón de Seleccionar última imagen y seleccione el archivo correspondiente a la última imagen de la pila. Haga clic en Aceptar para abrir la pila con todas las imágenes del canal en orden cronológico. Las pilas se pueden guardar en el menú archivo , Guardar como archivos tiff.
Nota: No crear pilas con las imágenes pulgar. Estos archivos no son muy útiles y pueden ser suprimidos para ahorrar espacio en el disco duro. También, se guardan archivos de imagen como la siguiente:
BASE NAME_WAVELENGTH_sCHANNEL #_tIMAGE #.
Por ejemplo, 07062018_W1FITC 100_s12_t112 es para el canal 12, momento 112, imagen en la primera longitud de onda-FITC 100% cámara de datos con el nombre "07062018". - Por último, seleccione Guardar como desde el menú desplegable de archivo para guardar la secuencia como una pila de tiff. Pilas pueden ser overlaid y guardan como una película. Esto se aborda en el paso 9.
- Antes de cuantificar el % de cobertura superficial, calibrar las distancias imagen. En Herramientas de análisis, haga clic en Calibrar distancias. Seleccione la medida de calibración apropiado y haga clic en aplicar a todas las imágenes abiertas.
- Mientras que la pila está en la primera imagen de la secuencia, haga clic en el botón de umbral . Utilice Auto Threshold para objetos de luz al umbral para señal fluorescente (longitud de onda FITC) y Umbral de Auto para objetos oscuros al umbral en campo brillante. Ajuste el umbral a la cobertura que representa la cobertura de la imagen.
- Los umbrales fluorescentes, de utilizar un canal con células no fluorescente para establecer cualquier señal de fondo y el valor umbral mínimo para excluir la señal detectada en canales que contengan estos no fluorescente hace las células para la medición de la señal de sistema no sobreestimar el área de la fluorescencia. Esto puede ser diferente de ejecución por lo que es una buena idea de utilizar al menos uno, si no más, canales para los controles no fluorescente.
- Para umbrales de campo brillante, si todas las células no están cubiertas por la firma umbral naranja, ajustar el valor de umbral máximo ya sea mediante la barra deslizante o usando el Umbral de la imagen (se encuentra en las Herramientas de análisis) para que todas las células son cubierto pero se excluye cualquier fondo.
Nota: Aunque estos valores umbral idealmente se utilizará para todas las imágenes en una pila y para todos los canales, valores umbral seleccionados para una imagen/canal pueden no ser apropiados para otras imágenes o canales, por lo tanto, que el usuario puede necesitar ajustar el rango de umbral periódicamente. Por esta razón, es una buena idea realizar siempre el máximo y valores de umbral mínimo utilizados deben la necesidad de datos que deben ser revisadas más adelante.
- Para cuantificar la cobertura, en Herramientas de análisis, haga clic en Mostrar estadísticas de región. Umbral de uso está marcada, se selecciona Toda la imagen y debajo de los Datos obtenidos, asegúrese de que las mediciones/valores deseados son seleccionados (área del umbral, promedio, desviación estándar, min, max y umbral % área). Haga clic en Abrir Registro y asegúrese de que selecciona archivo DDE antes de hacer clic en Aceptar. Seleccione Microsoft Excel y haga clic en Aceptar. En la hoja de cálculo abrir, haga clic en Registro de datos para registrar automáticamente las mediciones de la imagen que se está analizando.
- Dejando esta hoja de cálculo, utilice la misma hoja para recoger los datos de análisis de imagen para una sola pila. En la pila, ir a la cuarta imagen y umbral para la configuración óptima. Haga clic en Registro de datos en la pantalla de Mostrar estadísticas de región y los valores se registran en la hoja de cálculo. Repetir este proceso para análisis de imágenes cada 15 minutos.
8. otros análisis incluyendo morfología y superficie de cobertura medida usando Python scripts de la Suite de morfología de Biofilm
- Instalar una distribución de Python 3.6 que incluye módulos científicos estándar mediante el uso de una distribución estándar de Python científica como Anaconda, disponible en https://www.anaconda.com/download.
- Obtener el conjunto de la morfología de Biofilm de GitHub en un navegador, navegando por https://github.com/cdwentworth/Biofilm-Morphology-Suite.git, luego seleccione copia o descarga (botón verde) y seleccione Descargar Zip. Descomprimir el archivo y mover las carpetas de código en un directorio de trabajo.
- Medida por ciento cobertura thresholded copiando la pila de la imagen en la carpeta de "cobertura". Utilizar una ventana de terminal para vaya a esa carpeta y luego ejecutar el script con el comando
Python bfCoverage.py tiffStackName.tif
desde la interfaz de línea de comando, donde tiffStackName.tif es el nombre del archivo que contiene la pila de tiff de imágenes. Se creará un archivo de texto que contiene las mediciones de cobertura en cada momento con el nombre tiffStackName.txt y un archivo gráfico con una parcela de cobertura como una función del tiempo se creará con el nombre tiffStackName.png. - Utilice el mismo procedimiento especificado en el paso 8.3 para medir las otras características morfológicas: biofilm acumulación, coeficiente de rugosidad y textura entropía. Use el script bfAcc.py para la medición de la acumulación, el script de roughCoef.py para la medición del coeficiente de rugosidad y el script de TEvsTime.py para la medición de la entropía textural.
9. otras aplicaciones de Software - fabricación de recubrimientos y películas
- Si se utilizan varias longitudes de onda, crear montones de superposición entre estas longitudes de onda. Abra todas las pilas de interés y calibrar la distancia como hecho en el paso 7.6.
- En Herramientas de análisis, seleccione Superposición de imágenes. Establecer las fuentes como las pilas de interés. En la pila FITC, haga clic en el círculo del arco iris y seleccione filtro de color verde a ser añadido para resaltar esta longitud de onda.
- Uso de bal para ajustar la plantilla para que la pila FITC es evidente en las imágenes. Después de han realizado todos los ajustes, seleccione Todos los planos para las pilas de ambos y haga clic en aplicar. Guarde las plantillas de la misma manera como pilas que se describe en el paso 7.5 o como una película que se describe en el paso 9.2.
- Para ahorrar pilas o superposiciones como una película de lapso de tiempo, bajo Estándar m m y apilado, haga clic en Hacer películas. Seleccionar la fuente de la pila o recubrimiento que se desea. Haga clic en Guardar y guardar como Microsoft Video 1 , con una calidad entre 70-80.
Resultados
Figura 4 una muestra la zona thresholded por ciento con el tiempo de una 24 h en corrientes de corte de 0,2, 0,5 y 1,0 Dina/cm2. El biofilm cobertura o por ciento superficie área del umbral (C [%]) fue diferente para todos los valores de tres del esquileo. La cobertura de biopelícula fue el más rápida en el esquileo de 1,0 Dina/cm2 , donde el área del umbral mayor de 2-5% a 100% después de 200 min de crecimiento y llegado a una fase estacionaria después de 400 minutos. En 0,5 Dina/cm2, la cobertura de biofilm se retrasó y comenzó a aumentar a 400 min llegar a 100% de cobertura de después de 800 min. La corte más baja en 0,2 Dina/cm2 demostró claramente el aumento más lento de biofilm cobertura, donde cobertura porcentaje comenzó a aumentar a 500 minutos pero nunca llegó más allá del umbral de 65%. Estos resultados indicaron que la corte tuvo una influencia directa en la cobertura superficial de biofilm. La cizalla mayor parece ser una condición más óptima para el crecimiento de la biopelícula, posiblemente debido a que los medios de comunicación proporcionan las bacterias con más nutrientes para que el biofilm puede proliferar más rápido.
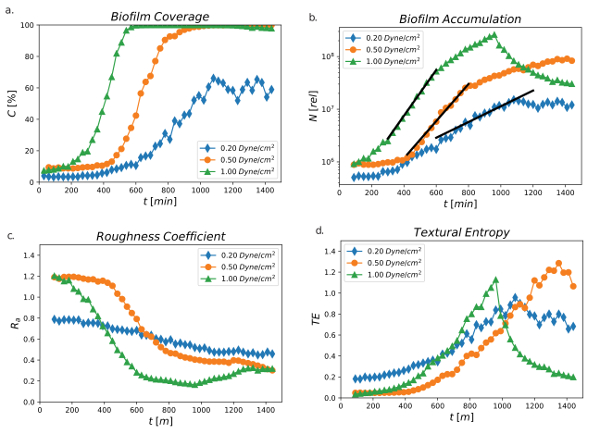
Figura 4: porcentaje umbral zona acumulación de biofilm total, coeficiente de rugosidad y textura entropía. área del umbral un) por ciento (C [%]) con el tiempo usando 0,2, 0,5 y 1,0 Dina/cm2 durante 24 h período de tiempo. Se obtuvieron datos de un canal para cada condición de corte. b) total de acumulación de biofilm (medida relativa) como una función del tiempo utilizando 0,2, 0,5 y 1,0 Dina/cm2 durante 24 h período de tiempo. Las líneas negras son mínimos cuadrados se ajusta a un modelo exponencial. Se obtuvieron datos de un canal para cada condición de corte. c) coeficiente de rugosidad de la PA01-EGFP usando valores de tensión de esquileo de 0,2, 0,5 y 1,0 Dina/cm2 sobre 24 h. datos de seguimiento se obtuvo de un canal para cada condición de corte. d) textura entropía de PA01-EGFP usando valores de tensión de esquileo de 0,2, 0,5 y 1,0 Dina/cm2. Se obtuvieron datos de un canal para cada condición de esquileo (Valquier-Flynn, H., Sutlief, A.L., Wentworth, C.D., 2018). Haga clic aquí para ver una versión más grande de esta figura.
Figura 4 b es consistente con los resultados que se muestra en la figura 4un. La acumulación de biofilm (N[rel]) se midió en base a la suposición de que la señal de la GFP en un punto en una imagen es proporcional a la densidad de células vivas en esa posición. Demuestra que la acumulación de biofilm de medición relativa total aumentó en función del tiempo utilizando 0,2, 0,5 y 1,0 Dina/cm2 durante 24 h período de tiempo, y la tasa de crecimiento disminuyó de más alta tensión de esquileo a menor tensión de esquileo. Hay un período de tiempo claro que un crecimiento exponencial de la que puede calcularse una tasa de crecimiento cuantitativo.
Figura 4 c se muestra el coeficiente de rugosidad (Ra) en los flujos del esquileo de 0,2, 0,5 y 1,0 Dina/cm2. Rugosidad de la superficie, cuantificada por el coeficiente de rugosidad, mide la variación en el perfil del grueso de la película. La definición formal es
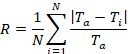
donde T es la -ésima medición de espesores, Tun es el espesor medio, y N es el número de espesor medida30. El procedimiento descrito en esta investigación mide el espesor asociado con células vivas. Un arreglo plano de células produce un coeficiente de rugosidad de cero mientras que variaciones de espesor de la media dará como resultado un coeficiente de rugosidad mayor que uno. Similar a la influencia de la corte en la tasa de crecimiento y la cobertura de umbral por ciento de la película, los biofilms exhiben diferentes topografías en el tiempo. En general, Runa disminución en el tiempo para todas las condiciones de corte que indica que todas las superficies se hizo más suaves. Sin embargo, en comparación con el corte más bajo de 0,2 Dina/cm, la configuración de corte mayor de 0,5 y 1,0 Dina/cm2 dio lugar a una superficie más suave con el tiempo que indica que un rápido flujo de cizalla contribuyó a la superficie más suave y más uniforme y la más alta corte de 1,0 Dina/cm2 alcanzando por debajo de 0,2 Runa.
La finura, regularidad o aspereza de una superficie puede expresarse también en entropía textural (TE). TE es una propiedad utilizada en análisis de imágenes para medir el grado de aleatoriedad en una imagen bidimensional. Su cálculo se basa en la matriz de co-ocurrencia nivel gris, definido por Haralick et al., que analiza si los valores de píxeles en un lugar se correlacionan con los valores de píxeles a otra ubicación44. Un alto grado de correlación llevará a entropía baja. Figura 4 d representa el TE en los flujos del esquileo de 0,2, 0,5 y 1,0 Dina/cm2. El TE aumentó con el tiempo para todas las condiciones de corte, pero la tensión de esquileo máxima 1,0 dyne/cm alcanzada la máxima TE (1.0) antes que las tensiones de esquileo baja en 900 min. La corte menor de 0,2 Dina/cm2 tuvo la TE menor (0,8) llegando a su máximo después de 1.000 minutos. Sin embargo, la tensión de esquileo intermediaria de 0,5 Dina/cm2 alcanzó su máximo TE (1.2) mucho más tarde que las condiciones de alta o baja tensión de esquileo.
El coeficiente de rugosidad y TE miden distintas características. Mientras que una película plana tendría un coeficiente de rugosidad bajo y baja entropía, una película con una variación significativa en el espesor tendría un coeficiente de rugosidad alta pero todavía podría ser baja entropía si la variación es sinusoidal en lugar de al azar. En este caso, Run disminuyó con el aumento de esfuerzo cortante y momento mientras que las tendencias TE no pueden estar directamente relacionado con esquileo tensión aplicada a la formación de biofilm en el tiempo.
Figura S1 : Captura de las ventanas de software de control de la imagen. Ventana con menú Multi Dimensional adquisición del software abierto (parte superior). Módulo de control para un archivo de AutoRun (abajo). Haga clic aquí para ver una versión más grande de esta figura.
Figura S2 Captura del software de revisión de datos de la imagen. Ventana de la aplicación después de seleccionar el conjunto de datos de interés utilizando la herramienta De datos de múltiples dimensiones en el menú de Herramientas de análisis . Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El procedimiento de análisis de imagen y sistema de microfluidos discutidos aquí se centra en la ejecución de experimentos de biofilm microfluídicos para determinar propiedades morfológicas que no requieren la información completo tridimensional típicamente de confocal estudios de microscopio. Estos incluyen cobertura de sustrato microcolony (porcentaje cobertura), rugosidad de la superficie medida por el coeficiente de rugosidad y textura entropía. Un método para estimar la acumulación de biofilm relativa total de la célula se presenta también de que las tasas de crecimiento de registro de fase puede ser calculada.
Hay varios pasos pequeños pero significativos que destacar en este método. Limpiar la interfaz con el alcohol ayuda a evitar la contaminación de otras bacterias en ir de un experimento a experimento pero también de bien a bien en un experimento. Cebado y siembra son también muy importantes ya cebado permite al usuario determinar los canales que permiten que los medios de comunicación que fluya a través de los canales sin interferencias u obstrucción. Canales también no deben ser perturbado (es decir, que deben ser constantemente llenos de medios de comunicación) después de cebado para aumentar las posibilidades de un experimento exitoso con sin burbujas de aire o de obstrucción. El paso de siembra puede variar según el tipo de bacterias y así debe optimizarse para el accesorio de la célula. Por ejemplo, si las células no parecen conectar, pueden tener modificaciones superficiales que ocurren en la placa microfluídica antes de la siembra o tiempos de incubaciones más largos pueden ser necesario. También es importante asegurarse de que el microscopio está configurado correctamente para obtener una imagen enfocada y debe controlarse periódicamente durante todo el experimento para asegurar que se obtienen imágenes de calidad. Si el foco está apagado, el microscopio puede y debe ser ajustado como el experimento continúa. Durante el tiempo de adquisición de imagen, la última longitud de onda debe establecerse en Todo cerrado para evitar la exposición de filtros e iluminación a un único canal durante el tiempo de espera que se produce entre la adquisición de la imagen. Además, el análisis de imágenes que determina el % de cobertura superficial fue diseñado en la casa porque el manual de software de montaje describen explícitamente el procedimiento. Además, con el fin de ampliar en el análisis de la imagen y determinar otras características tales como rugosidad, etcetera., abierta fuente código basado en Python45 fue desarrollado en la casa y compartida en el repositorio de gitHub. También hay limitaciones en la cantidad de datos puede almacenarse y gestionado en el disco duro, así que es necesario un disco duro externo o el uso compartido de datos en línea como CyVerse46.
Biorreactores convencionales, tales como el reactor de CDC y el reactor de flujo de goteo de34, requieren mucho de los medios de comunicación, proporcionan menos los tamaños de muestra y demandan una gran cantidad de esterilización de equipos. En cambio, las ventajas de esta plataforma de rendimiento más alto incluyen la capacidad de corte de control, las tasas de flujo, y la asunción que la vitro en experimentos de cerca se asemejan a condiciones en vivo . Desventajas del sistema incluyen los múltiples accesorios y software que requieren una meticulosa instalación debe realizarse en el orden correcto de los acontecimientos. Además, el manual que se proporciona para los equipos no explica completamente cada paso de los experimentos y los comandos del software, y por lo tanto, muchos errores se producen durante los experimentos, incluyendo la obstrucción de canales, falta de crecimiento o accesorio, o las imágenes de microscopía de alta calidad falta o películas. El propio instrumento y consumibles, como las placas de microfluidos, también son relativamente caros con un precio de más de $200 por placa y no son reutilizables. Así, mientras que la técnica da resultados de gran alcance, los conocimientos técnicos necesarios para su uso es relativamente alto y requiere entrenamiento repetido por expertos en la materia. Este informe intenta resolver este problema al proporcionar una guía para nuevos usuarios de estos biorreactores para estudiar las características de los biofilms.
El sistema de microfluidos, que es capaz de realizar análisis celular, ha ganado considerable atención para diversas modalidades científicas, tales como en microbiología, Inmunología, hematología, oncología y célula de vástago investigación. Más específicamente, la tecnología ha dado lugar a numerosas publicaciones que describen temas que son altamente relevantes para aplicaciones médicas37,47, incluyendo adherencia oral microbiana48, determinar los efectos de la biosurfactantes en Pseudomonas aeruginosa y Staphylococcus aureus49,50, sede de las interacciones patógeno de e. coli51, Streptococcus adherencia52y el tratamiento de fibrosis quística53. Dado que este sistema de microfluidos es muy versátil, se prevé que los sistemas cada vez más se distribuirán en todo el mundo.
Algunos pasos de protocolo específico se deben considerar cuidadosamente. Los medios de comunicación se pueden diluir al 50% con dH2O para ayudar a prevenir las burbujas y la obstrucción pero no era necesario en este caso. El valor específico de OD600 utilizado para la siembra debe ser determinado usando pistas de prueba de un experimento de crecimiento para ver qué funciona mejor para el conjunto particular de condiciones. Burbujas en los pocillos antes de sellado pueden conducir a burbujas en los canales de microfluidos y deben ser retiradas por estallar o aspirado hacia fuera con una punta de pipeta. Es importante mantener las bacterias fuera de los canales pequeños del serpentín. Al tener volúmenes iguales de los medios en la entrada y salida durante el proceso de transferencia, flujo debido a la presión del volumen líquido será controlado por flujo es solamente debido a la presión aplicada al sistema. Las distancias de calibración deben establecerse durante la instalación por el representante de la empresa. Estos ajustes son específicos para cada cámara.
Hay varios desafíos que se presentan al encontrar el umbral más representativo para una imagen. Establecer valores de umbral máximo puede ser difícil si no es coherente la intensidad promedio de píxeles en todas las regiones del fondo causado seleccionando una posición que no está en el centro del canal o de suciedad en la placa. Bajo MM estándar, haga clic en procesoy seleccione herramienta de fondo y corrección de sombreado a la corrección de estas inconsistencias. Sin embargo, esta herramienta generalmente sólo es útil si el usuario ha tomado imágenes de los canales antes de sembrar que pueden utilizar como imágenes de referencia. O, si el fondo/sombreado referencia imágenes no están disponibles, el usuario deberá usar su juicio para establecer un valor umbral que cubre más área de celular sin incluir el fondo de la imagen. Como alternativa, seleccione áreas representativas a medida que excluyen a las regiones de inconsistencia por haga clic en Región Rectangular, Elipse regióno Región de rastro que seleccione una región y Región activa en lugar de entero Imagen en la ventana Mostrar región estadística (en Herramientas de análisis). Si se utiliza una región representativa de umbral la imagen de campo claro, la misma región pueden usarse para la medición de la imagen correspondiente de FITC. Es útil grabar la específica estadística espacial (izquierda, arriba, ancho, altura, área, perímetro) asociada con la región representativa para la misma región se encuentra y medida sobre la imagen correspondiente de FITC.
Para evitar la acumulación de datos en el disco duro que hará que el equipo reducir la velocidad, se puede comprar un disco duro externo para almacenamiento de datos. Otra opción para el almacenamiento de datos y facilitar intercambio de información es la plataforma de Bioinformática de CyVerse. Crear una cuenta en el sistema de CyVerse por ir a http://www.cyverse.org/. Una vez conectado, inicie el entorno de descubrimiento luego seleccione "Registro en CyVerse". Seleccionamos "datos" y vaya que tienes la carpeta. Si la pila de la imagen está en el equipo local luego seleccionar "subir" y luego "Upload Simple desde el escritorio". Encontrar el archivo de imagen de la pila y seleccione subir. El archivo o carpeta puede compartirse con colaboradores si tienen una cuenta de CyVerse y se otorga el permiso. Uso compartido de la carpeta de datos al público en general requiere agregar que los metadatos para cada archivo con CyVerse aprobado normas. Este procedimiento no se discutirán aquí porque esto no está dentro del alcance de este trabajo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue posible por becas del Instituto Nacional para el General médico Ciencia (NIGMS) (5P20GM103427), un componente de los institutos nacionales de salud (NIH)
Materiales
| Name | Company | Catalog Number | Comments |
| Ammonium Chloride, ACS | VWR | BDH9208-500G | Part of the minimal media composition |
| BioFlux 1000 48 Well Low Shear Plate | Fluxion Biosciences | 910-0047 | |
| BioFlux 1000Z Microfluidic Imaging System | Fluxion Biosciences | BF 1000Z | |
| Calcium Chloride Dihydride, ACD Grade | VWR | 97061-904 | Part of the minimal media composition |
| Dextrose, Anhydrous, ACS | VWR | BDH9230-500G | Part of the minimal media composition |
| Magnesium Sulfate ACS Grade | VWR | EM-MX0070-1 | Part of the minimal media composition |
| Potassium Phosphate Monobasic, ACS Grade | VWR | BDH9268-500G | Part of the minimal media composition |
| Pseudomonas Aeurginosa GFP | ATCC | 15692GFP | Pseudomonas aeurinosa bacterial strain PA01 with GFP modification used for this study. |
| Sodium Chloride, ACS | VWR | BDH9286-500G | Part of the minimal media composition |
| Sodium Phosphate, Monobasic, Anhydrous, Reagent Grade | VWR | 97061-942 | Part of the minimal media composition |
Referencias
- Donlan, R. M., et al. Model System for Growing and Quantifying Streptococcus pneumoniae Biofilms In Situ and in Real Time. Applied and Environmental Microbiology. 70 (8), 4980-4988 (2004).
- Lührig, K., et al. Bacterial Community Analysis of Drinking Water Biofilms in Southern Sweden. Microbes and Environments. 30 (1), 99-107 (2015).
- Singh, R., Paul, D., Jain, R. Biofilms: implications in bioremediation. Trends in Microbiology. 14 (9), 389-397 (2006).
- Veerachamy, S., et al. Bacterial adherence and biofilm formation on medical implants: A review. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 228 (10), 1083-1099 (2014).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Establishment of Pseudomonas aeruginosa infection: lessons from a versatile opportunist. Microbes and Infection. 2 (9), 1051-1060 (2000).
- Percival, S. L., Knapp, J. S., Edyvean, R., Wales, D. S. Biofilm Development On Stainless Steel In Mains Water. Water Research. 32 (1), 243-253 (1998).
- Percival, S. L., Knapp, J. S., Wales, D. S., Edyvean, R. G. J. The effect of turbulent flow and surface roughness on biofilm formation in drinking water. Journal of Industrial Microbiology and Biotechnology. 22 (3), 152-159 (1999).
- Ling, F., Whitaker, R., LeChevallier, M. W., Liu, W. -T. Drinking water microbiome assembly induced by water stagnation. The ISME Journal. , 1(2018).
- Moss, B. Water pollution by agriculture. Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1491), 659-666 (2008).
- Schultz, M. P., Bendick, J. A., Holm, E. R., Hertel, W. M. Economic impact of biofouling on a naval surface ship. Biofouling. 27 (1), 87-98 (2011).
- Tornero, V., Hanke, G. Chemical contaminants entering the marine environment from sea-based sources: A review with a focus on European seas. Marine Pollution Bulletin. 112 (1-2), 17-38 (2016).
- LaBauve, A. E., Wargo, M. J. Growth and Laboratory Maintenance of Pseudomonas aeruginosa. Current Protocols in Microbiology. 25 (1), 1-8 (2012).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 101 (8), 2530-2535 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Zhang, G., Gurtu, V., Kain, S. R. An Enhanced Green Fluorescent Protein Allows Sensitive Detection of Gene Transfer in Mammalian Cells. Biochemical and Biophysical Research Communications. 227 (3), 707-711 (1996).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophysical Journal. 73 (5), 2782-2790 (1997).
- Chalfie, M., Tu, Y., Euskirche, G., Ward, W. W., Prashert, D. C. Green fluorescent protein as a marker for gene expression. Science. 263 (5148), 802-805 (1994).
- Heim, R., Prasher, D., Tsien, R. Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 91, 12501-12504 (1994).
- Bakke, R., Kommedal, R., Kalvenes, S. Quantification of biofilm accumulation by an optical approach. Journal of Microbiological Methods. 44 (1), 13-26 (2001).
- Heydorn, A., et al. Statistical analysis of Pseudomonas aeruginosa biofilm development: impact of mutations in genes involved in twitching motility, cell-to-cell signaling, and stationary-phase sigma factor expression. Applied and Environmental Microbiology. 68 (4), 2008-2017 (2002).
- Wilson, E., et al. Using Fluorescence Intensity of Enhanced Green Fluorescent Protein to Quantify Pseudomonas aeruginosa. Chemosensors. 6 (21), (2018).
- Fang, H., Chen, Y., Huang, L., He, G. Analysis of biofilm bacterial communities under different shear stresses using size-fractionated sediment. Scientific Reports. 7 (1), 1299(2017).
- Saunders, K. A., Greenman, J. The formation of mixed culture biofilms of oral species along a gradient of shear stress. Journal of Applied Microbiology. 89 (4), 564-572 (2001).
- Valquier-Flynn, H., Wilson, C. L., Holmes, A. E., Wentworth, C. D. Growth Rate of Pseudomonas aeruginosa Biofilms on Slippery Butyl Methacrylate-Co-Ethylene Dimethacrylate (BMA-EDMA), Glass and Polycarbonate Surfaces. Journal of Biotechnology & Biomaterials. 7 (4), (2017).
- Trulear, M. G., Characklis, W. G. Dynamics of biofilm processes. Journal (Water Pollution Control Federation). 54 (9), 1288-1301 (1982).
- Machineni, L., Rajapantul, A., Nandamuri, V., Pawar, P. D. Influence of Nutrient Availability and Quorum Sensing on the Formation of Metabolically Inactive Microcolonies Within Structurally Heterogeneous Bacterial Biofilms: An Individual-Based 3D Cellular Automata Model. Bulletin of Mathematical Biology. 79 (3), 594-618 (2017).
- Jiao, Y., et al. Identification of Biofilm Matrix-Associated Proteins from an Acid Mine Drainage Microbial Community. Applied and Environmental Microbiology. 77 (15), 5230-5237 (2011).
- Flemming, H. C., Wingender, J. The Biofilm Matrix. Nature Reviews Microbiology. 8 (9), 632-633 (2010).
- Yang, X., Beyenal, H., Harkin, G., Lewandowski, Z. Quantifying biofilm structure using image analysis. Journal of Microbiological Methods. 39 (2), 109-119 (2000).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (3), 783-788 (2009).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology. 151, 757-762 (2005).
- Swartz, K., Stephenson, R., Hernandez, M., Jambang, N., Boles, B. R. The use of Drip Flow and Rotating Disk Reactors for Staphylococcus aureus biofilm analysis. Journal of Visual Experiments. (46), e2470(2010).
- Werner, E., et al. Stratified Growth in Pseudomonas aeruginosa Biofilms. Applied and Environmental Microbiology. 70 (10), 6188-6196 (2004).
- Wilson, C., et al. The Quantitative Assessment of Pseudomonas aeruginosa (PA)14 Biofilm Surface Coverage on Slippery Liquid Infused Polymer Surfaces (SLIPS). International Journal of Nanotechnology in Medicine & Engineering. 3 (3), 35-42 (2018).
- Samarian, D. S., Jakubovics, N. S., Luo, T. L., Rickard, A. H. Use of a High-throughput In Vitro Microfluidic System to Develop Oral Multi-species Biofilms. Journal of Visualized Experiments. (94), 52467(2014).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43, 65-91 (2014).
- Kim, J., Park, H. -D., Chung, S. Microfluidic Approaches to Bacterial Biofilm Formation. Molecules. 17 (8), 9818-9834 (2012).
- Mosier, A. P., Cady, N. C. Analysis of bacterial surface interactions using microfluidic systems. Science Progress. 94 (4), 431-450 (2011).
- Nobile, C. J., Johnson, A. D. Candida albicans Biofilms and Human Disease. Annual Review of Microbiology. 69, 71-92 (2015).
- Chandra, J., Kuhn, D. M., Mukherjee, P. K., Hoyer, L. L., McCormick, T., Ghannoum, M. A. Biofilm Formation by the Fungal Pathogen Candida albicans: Development, Architecture, and Drug Resistance. Journal of Bacteriology. 183 (18), 5385-5394 (2001).
- Vasconcelos, M. A., et al. Effect of Algae and Plant Lectins on Planktonic Growth and Biofilm Formation in Clinically Relevant Bacteria and Yeasts. BioMed Research International. 2014, 9(2014).
- Haralick, R. M., Shanmugam, K., Dinstein, I. Textural Features for Image Classification. IEEE Transactions on Systems, Man, and Cybernetics. 3 (6), 610-621 (1973).
- Wentworth, C. D. Biofilm Morphology Suite. , Available from: https://github.com/cdwentworth/Biofilm-Morphology-Suite.git (2018).
- Cyverse. , Available from: https://user.cyverse.org/services/mine (2018).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New Device for High-Throughput Viability Screening of Flow Biofilms. Applied and Environmental Microbiology. 76 (13), 4136-4142 (2010).
- Ding, A. M., Palmer, R. J., Cisar, J. O., Kolenbrander, P. E. Shear-Enhanced Oral Microbial Adhesion. Applied and Environmental Microbiology. 76 (4), 1294-1297 (2010).
- Diaz De Rienzo, M. A., Stevenson, P. S., Marchant, R., Banat, I. M. Effect of biosurfactants on Pseudomonas aeruginosa and Staphylococcus aureus biofilms in a BioFlux channel. Applied Microbiology and Biotechnology. 100 (13), 5773-5779 (2016).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus Biofilm: A Complex Developmental Organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Tremblay, Y. D. N., Vogeleer, P., Jacques, M., Harel, J. High-Throughput Microfluidic Method To Study Biofilm Formation and Host-Pathogen Interactions in Pathogenic Escherichia coli. Applied and Environmental Microbiology. 81 (8), 2827-2840 (2015).
- Nobbs, A. H., Lamont, R. J., Jenkinson, H. F. Streptococcus Adherence and Colonization. Microbiology and Molecular Biology Reviews. 73 (3), 407-450 (2009).
- Díez-Aguilar, M., Morosini, M. I., Köksal, E., Oliver, A., Ekkelenkamp, M., Cantón, R. Use of Calgary and Microfluidic BioFlux Systems To Test the Activity of Fosfomycin and Tobramycin Alone and in Combination against Cystic Fibrosis Pseudomonas aeruginosa Biofilms. Antimicrobial Agents and Chemotherapy. 62 (1), 01650-01717 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados