Method Article
Prediciendo en Vivo cargas entrega usando una Barrera Blood-brain Tumor en un plato
En este artículo
Resumen
Medicamentos dirigidos a tumores del sistema nervioso central es un gran desafío. Aquí se describe un protocolo para producir a un imitador in vitro de la tumor-barrera blood-brain con células murinas y humanas y discutir su pertinencia para la previsibilidad del sistema nervioso central tumor targeting in vivo.
Resumen
Altamente selectivo por naturaleza, la barrera blood - brain (BBB) es esencial para la homeostasis cerebral en condiciones fisiológicas. Sin embargo, en el contexto de los tumores cerebrales, la selectividad molecular de BBB también protege a las células neoplásticas bloqueando el suministro de quimioterapia administrada periféricamente. El desarrollo de nuevos fármacos (incluya nanopartículas) dirigidos a tumores cerebrales malignos idealmente requiere el uso de modelos animales preclínicos para estudiar la droga transcitosis y eficacia antitumoral. Para cumplir con el principio de las 3R (refinar, reducir y sustituir) para reducir el número de animales de laboratorio en la configuración experimental y realizar la proyección de alto rendimiento de una gran biblioteca de agentes antitumorales, desarrollamos un humano in vitro reproducible y murino imitador del tumor-barrera blood-brain (BBTB) utilizando cultivos de tres capas de células endoteliales, astrocitos y glioblastoma derivados del paciente. Para una mayor escalabilidad y reproducibilidad, inmortalizadas células o líneas celulares comerciales se han utilizado en condiciones a la medida para permitir la formación de una barrera que se asemeja a la BBB real. Aquí se describe un protocolo para obtener a un imitador BBTB por cultivo de células endoteliales en contacto con astrocitos en densidades celulares específicas en partes movibles. Este imitador BBTB puede utilizarse, por ejemplo, para la cuantificación y proyección de imagen confocal del paso de nanopartículas a través de las barreras endoteliales y astrocíticos, además de la evaluación de la focalización de célula de tumor dentro del mismo ensayo. Por otra parte, se muestra que los datos obtenidos pueden utilizarse para predecir el comportamiento de las nanopartículas en modelos animales preclínicos. En una perspectiva más amplia, este modelo in vitro podría ser adaptado a otras enfermedades neurodegenerativas para la determinación de la aprobación de nuevas moléculas terapéuticas a través de la BBB o complementarse con organoides del cerebro para evaluar directamente la eficacia de la medicamentos.
Introducción
La unidad neurovascular se compone de neuronas, astrocitos y el BBB, formado por las intrincadas conexiones entre pericitos, astrocitos, células endoteliales y la membrana basal asociada formando la microvasculatura cerebral del1. Este apretada pared celular formada por vasos continuados, nonfenestrated finalmente regula el movimiento de iones y moléculas (incluyendo hormonas, nutrientes o medicamentos) sino también de circular las células1. La transcitosis en particular baja a través de la BBB de moléculas de alto peso molecular, tales como anticuerpos terapéuticos, fármacos conjugados o nanocompuestos, restringen considerablemente los avances en el descubrimiento de fármacos para enfermedades neurológicas, incluyendo mala los gliomas2. De hecho, quimioterapias entregadas por vía oral o intravenosa alcanzan el parénquima cerebral a menudo a protegidos bajas concentraciones para inducir un efecto antitumoral o simplemente no pueden cruzar lo BBTB para llegar a las células neoplásticas3. Varios estudios preclínicos y clínicos no han tratado el tema de la penetración BBTB pero han intentado interrumpir la BBTB transitoriamente, por ejemplo mediante el uso de ultrasonidos enfocado4,5, o para evadir por el directo en situ entrega de drogas6. Sin embargo, ninguna de estas técnicas fueron capaces de contrarrestar la expansión inevitable del tumor o de la recaída. Por lo tanto, en el desarrollo de nuevas terapias antiglioma, la difusión a través de lo BBTB puede considerarse uno de los aspectos críticos para la entrega exitosa de los agentes terapéuticos7.
Debido a la naturaleza compleja de las interacciones celulares dentro de lo BBTB, estudios in vivo en animales de laboratorio parecen ser la opción obvia al estudiar el paso de moléculas de la sangre al cerebro. Sin embargo, métodos in vivo de gran escala son relativamente complejos para establecer y, por lo tanto, no permite el cribado de alto rendimiento de moléculas en un tiempo razonable a un costo razonable. Más importante aún, la experimentación con animales debe seguir la pauta ética de 3R definida como i) refinar ii) reducir y, de relevancia para el contexto actual, iii) sustituir por protocolos alternativos (por ejemplo, en los métodos de vitro/in silico). Por lo tanto, recreando lo BBTB in vitro aparece como una posibilidad interesante y atractiva, pero también constituye una tarea compleja, desafiada por varias limitaciones. Muchos intentos de recrear este compartimiento complejo con cultivos de células primarios o líneas celulares de canino, porcino, origen murino y humano incluso se han publicado (ya revisado por Rahman et al.8 y9de la ley Helms et al.). Estos modelos incluyen microfluídicos tridimensional sistemas10, BBB-en-un-chip11,12, y rellenos de multitud de variantes, basadas en el clásicos co-cultivos en sistemas. Sin embargo, sistemas microfluídicos y chip actuales son o no adecuados para estudios de validación de medicamentos rápida, alto rendimiento13,14 o son actualmente incompatible con estudios de administración de fármacos para tumores cerebrales. Además, la revisión de 155 modelos publicados utilizando células primarias, células pluripotentes inducible (iPSC) o líneas celulares comerciales insertos Co cultivadas en todos mostraron una tendencia de discrepancia interstudy en sus mediciones y conclusiones8. Esta falta de reproducibilidad interlaboratorios podría ser correlacionada con las condiciones de cultivo i) nonnormalized, por ejemplo con el recubrimiento opcional con proteínas de la matriz de la membrana del sótano en el recipiente de cultivo celular, ii) un número creciente de subcultivo y uso del suero que contienen los medios de comunicación, los conductores principales de modificaciones genéticas y fenotípicas de la célula líneas15, o iii) la dificultad para recrear reproducible el equilibrio adecuado entre los componentes endoteliales en un plato y astroglial. Aunque el uso de las células inmortalizadas o celular comercial líneas para establecer un modelo in vitro de BBB carece de algunas de las propiedades en comparación con modelos similares que utilizan sólo células primarias, en el método descrito se muestra que la combinación de células exhibe una muy rendimiento comparable a estudios publicados en otros modelos de referencia16,17. Finalmente, la falta de un modelo robusto y reproducible para estudiar el paso de compuestos terapéuticos dirigidos a tumores cerebrales a través de lo BBTB nos motivó a desarrollar los métodos descritos aquí.
Puesto que el objetivo era usar el modelo para predecir la entrega en vivo de nanopartículas en modelos animales preclínicos, primero validamos el modelo BBTB mediante la utilización de insertos que contiene murinas células endoteliales en contacto con astrocitos murinos. Además de esto, nosotros también optimizado el modelo para utilizar ciertas líneas de células humanas. Una vez estabilizado, las barreras de la célula se transfieren a las culturas con esferas de glioblastoma derivados del paciente o líneas celulares de glioma comercial. Después de eso, la transcitosis de nanopartículas y tumor de la célula objetivo pueden ser visualizado por microscopía confocal y cuantificado por la recogida de muestras en el tiempo. Lo importante, resultados obtenidos utilizando la mímica BBTB confiablemente podrían predecir el comportamiento de las nanopartículas en vivo, apoyando el uso de la previa mímica BBTB la validación preclínica.
Protocolo
Los experimentos con animales fueron aprobados por el Comité para los experimentos de animales del distrito de Finlandia meridional (ESAVI/6285/04.10.07/2014).
1. establecimiento de los imitadores BBTB
Nota: Suplementos y medio de cultivo celular se detallan en la tabla de materiales.
- Preparación de astrocitos
Nota: Los volúmenes siguientes son adecuados para un plato de Petri de 10 cm o un frasco de cultivo celular T75.- Bajo una campana de cultivo de células estériles, lavar cuidadosamente los astrocitos cultivados con 5 mL de solución salina estéril tamponada con fosfato (PBS). Descartar el PBS utilizando una bomba de vacío y añadir 2 mL del reactivo de disociación celular durante 5 minutos (a 37 °C, véase Tabla de materiales) para separar las células. Compruebe la separación de células bajo el microscopio. No exceda los 5 minutos de incubación para limitar el estrés en las células.
- Añadir 10 mL de medio de cultivo celular estéril astrositos completa (ABM +) al recipiente para inhibir la actividad del reactivo de disociación celular. Utilice una pipeta serológica estéril para transferir las células separadas de la nave a un tubo de 15 mL estéril. Centrifugar la suspensión celular por 3 min a 250 rcf (aceleración: 9 rcf/s, desaceleración: 5 rcf/s) a temperatura ambiente (RT).
- Mientras tanto, preparar los rellenos (véase la Tabla de materiales): utilizando pinzas estériles, colocar los insertos con la parte de cerebro hacia arriba (figura 1A) en la tapa de una placa de 6 pozos estéril (figura 1B). Verificar previamente que la placa puede colocarse boca abajo sobre los insertos sin tocar o mover los insertos durante el proceso.
Nota: La adecuada colocación de los insertos permite el atrapamiento de la suspensión de astrositos entre la membrana y la parte inferior del pozo. - Una vez centrifugado, descartar cuidadosamente el sobrenadante de la suspensión celular; Resuspender el precipitado de astrositos en 1 mL de ABM + por suavemente Resuspender el sedimento en el tubo de's pared hasta 5 x. Evite el uso excesivo de las células para limitar la tensión en las células. Contar las células y ajustar la densidad de la suspensión de células a 1.5 x 105 células en 400 μL de ABM + insertar.
- Lugar a la suspensión de células en el cerebro lado del parte movible'membrana de s (figura 1B) y, muy cuidadosamente, utilizando la fuerza capilar con una punta de la pipeta estéril. Evitar el contacto directo ya que la membrana es especialmente frágil.
- Con la parte del cerebro de los insertos todavía hacia arriba, coloque la placa de 6 pozos en los insertos. Esto asegura que la suspensión de células está atrapada entre la membrana y el fondo real del pozo (figura 1). Evitar burbujas de aire en la suspensión de células, ya que impedirá la propagación homogénea de los astrocitos en la membrana.
- Coloque la placa y partes movibles, con el lado del cerebro, en la incubadora (a 37 °C con 5% CO2) para permitir la adherencia de la célula durante un mínimo de 2 h (astrocitos inmortalizados murinos) y hasta 6 h (astrocitos primarios humanos).
Nota: Los insertos se mantengan boca abajo, visualización de la adhesión celular no es posible bajo un microscopio. Por lo tanto, se recomienda a la semilla de un buque de cultura separada de la célula regular y controlar la adherencia de la célula en el recipiente con el tiempo. Manipulación cuidadosa de la membrana es imprescindible que los resultados serán confiables cuando las membranas están dañadas. - Al final del tiempo de incubación, verificar la ausencia de fugas de suspensión celular fuera del área de siembra y deseche los insertos si son fugas. Revertir la placa de 6 pozos a su posición normal, con los partes movibles que ahora la parte de la sangre hacia arriba (figura 1A). Añadir 2,6 mL de ABM + a cada pocillo. Vierta 2,5 mL de medio de astrositos completa en cada insert y colocar la placa en la incubadora (a 37 °C con 5% CO2).
- Preparación de las células endoteliales
Nota: Para el cerebro murino microvascular células endoteliales (bEND3), las células deben llegar a 100% de confluencia para asegurar contactos célula máxima activación de la expresión de proteína óptima ensambladura apretada en el día del experimento. Esto no se aplica para las células endoteliales de vena umbilical humana (HuAR2T) como la presencia de astrocitos es necesaria para una expresión de la proteína de Unión estrecha para estas células.- Proceder como se describió anteriormente para los astrocitos (pasos de 1.1.1 y 1.1.2.). Una vez centrifugado, eliminar cuidadosamente el sobrenadante; Resuspender el precipitado de células endoteliales en 1 mL de medio de cultivo de células endoteliales completo (EBM +) transfiriendo lentamente la suspensión de células en el tubo de's pared hasta 5 x. Evite el uso excesivo de las células para limitar la tensión en las células. Contar las células y ajustar la densidad de la suspensión de células a 2 x 105 células en 2,5 mL/insertar células endoteliales del medio de cultivo sin suero (EBM) y factor de crecimiento endotelial vascular-A (VEGF-A).
- Sacar la placa que contenga los insertos, deseche el medio desde el lado de sangre cuidadosamente y reemplazar con 2,5 mL de la suspensión de células endoteliales. Vuelva la placa a la incubadora (a 37 °C con 5% CO2) y dejarlo toda la noche para las células endoteliales a adherirse a la membrana.
- Al día siguiente, prepare una placa de 6 pozos estéril mediante la transferencia de 3 mL de medio de astrositos libre de suero precalentado (ABM-) a cada pocillo. Controlando los insertos con pinzas estériles, cuidadosamente deseche el medio completo endotelial desde el lado de la sangre, coloque la inserción en la nueva placa contiene ABM- y añadir 2,5 mL de EBM-.
Nota: El uso de la EBM es crítico para el establecimiento de la barrera endotelial (por favor consulte la sección de discusión). - Dejan los insertos en la incubadora (a 37 °C con 5% CO2) con un mínimo disturbio físico y las variaciones de temperatura durante 5 días, lo que permite la producción de la membrana basal endotelial, astrositos entra en contacto con las células endoteliales y finalmente, la formación mímica BBTB. Reemplazar el medio en el día de la transferencia en cultivos de células de glioma (consulte la sección 1.4).
- Medición de la permeabilidad mímica BBTB (opcional)
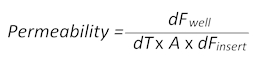
- Difusión pasiva de la tintura fluorescente de pequeño peso molecular sodio-fluoresceína (Na-Fl) en el tiempo de la sangre hacia el cerebro de los insertos permite el cálculo de los valores de permeabilidad según la siguiente fórmula:
Aquí, dFbienes el valor de fluorescencia medido en el pozo en un cierto punto del tiempo menos el valor de Autofluorescencia de medio de cultivo celular, dT es el tiempo en segundos, A es la superficie de la barrera en centímetros cuadrados y dFInsertar se mide el valor de fluorescencia en el inserto en el mismo punto de tiempo menos el valor medio de Autofluorescencia). - Recoger 100 μl del medio de la sangre y los lados del cerebro de lo mimic BBTB y transferir cada uno de ellos a una separado placa de 96 pocillos de fondo plano, negra para las mediciones posteriores de la fluorescencia. Utilizar los medios llano como el espacio en blanco para corregir la autofluorescencia.
- Preparar 2,5 mL por pocillo de la Na-Fl (50 μm) en EBM-. Precaliente la solución Na-Fl a 37 ° C. Sustituir los medios de comunicación desde el lado de la sangre de los insertos con los medios de comunicación que contiene Na-FL. iniciar un temporizador como el medio se sustituye.
- Cuidadosamente recoger 100 μl de medio de la sangre y el lado del cerebro de los insertos en 5, 30, 60 y 120 min transferir cada muestra para separar los pocillos de la placa de 96 pozos negro.
- En consecuencia, sustituir los medios recogidos de los insertos para mantener el balance del volumen entre ambos lados. Vuelva a colocar los insertos en la incubadora entre cada toma de muestras para reducir al mínimo las variaciones de temperatura.
- Cuantificar la fluorescencia de las muestras recolectadas, utilizando un lector de placas con el filtro en 480/560 nm (excitación y emisión, respectivamente).
Nota: Fluorescencia de la parte del cerebro es casi indetectable en el momento de 5 min. Valores altos en comparación con el espacio en blanco indicar una fuga de / daño el prospecto del's membrana o barrera; por lo tanto, excluir éstos de mayores análisis. Valores de permeabilidad de Na-Fl esperados para lo BBTB deben estar en el 10-5 a 10-6 cm/s rango (tabla 1).
- Difusión pasiva de la tintura fluorescente de pequeño peso molecular sodio-fluoresceína (Na-Fl) en el tiempo de la sangre hacia el cerebro de los insertos permite el cálculo de los valores de permeabilidad según la siguiente fórmula:
- Preparación de las células de glioma
Nota: Aunque aquí se usan esferas de glioblastoma derivados del paciente, el siguiente protocolo se puede adaptar fácilmente para células de glioblastoma adherente, comercialmente disponible como U - 87 MG.- Opcionalmente, para la proyección de imagen de inmunofluorescencia, colocar hasta cuatro cubreobjetos redondo de borosilicato estéril (ø 0,9 cm) por pozo en una placa de 6 pozos que contienen 2 mL de poly-D-lisina (0.01%). Incubar a temperatura ambiente durante 30 minutos.
- Mientras tanto, transferir cuidadosamente las esferas tumor del recipiente de cultivo celular a un tubo de 15 mL estéril utilizando una pipeta serológica estéril. Centrifugue las esferas tumor durante 3 min a rcf 250.
- Eliminar el sobrenadante, suavemente suspender las esferas en 1 mL de bFGF EGF-libre (GBM) glioma células medianas y contar las células. Ajustar la densidad celular y aproximadamente 104 esferas/mL (105 células/mL) en GBM-.
- Deseche el poly-D-lisina de los pozos y enjuagar 3 veces con PBS estéril. La placa con 3 mL o bien de la suspensión del esferoide de tumor de la semilla y la transferencia los insertos con el imitador BBB sobre la suspensión de células de tumor.
- Incubar durante una noche (a 37 °C con 5% CO2) para permitir el equilibrio entre la sangre y el cerebro partes del tumor del ensayo. Al día siguiente, vuelva a colocar los medios en el lado de la sangre con EBM-complementado con las moléculas/drogas/nanopartículas de interés. Las muestras se recogen en el tiempo para la cuantificación directa como se describe en la sección anterior. Las células se fijan en un punto del tiempo preciso para imágenes de fluorescencia (consulte las secciones 2.1 y 2.2).
2. alta resolución imagen Confocal de la BBTB
Nota: 4% paraformaldehido (PFA, pH 7,4, 6 mL por repetición BBTB) siempre está preparado en PBS. Mantener en hielo.
PRECAUCIÓN: PFA es carcinogénico. Utilice guantes de nitrilo PFA para preparar la solución bajo una campana de vapores químicos.
-
Expresión endotelial BBTB de proteínas de Unión estrecha
- Enjuague ambos lados de la membrana con PBS helado (3 x 5 min, 2,5 mL/insertar, 3 mL/pozo). Descartar el PBS y añadir 3 mL y 2,5 mL de helado 4% PFA en el pozo y en la inserción, respectivamente. Incubar en hielo durante 10 minutos, descarte la PFA (según institución'desecho químico peligroso s) y enjuagar 3 veces con PBS a temperatura ambiente (2.5 mL/insertar, 3 mL/pocillo).
Nota: Una vez montado, las muestras pueden almacenarse en PBS (2.5 mL/insertar, 3 mL/pocillo) a 4 °C durante una semana. - Utilice un hisopo de algodón para limpiar el lado del cerebro de la inserción y quitar los astrocitos. Utilizando un bisturí afilado, con cuidado corte la membrana en cuatro partes iguales, haciendo dos cortes perpendiculares, formando una cruz. A continuación, insertar el bisturí en el punto donde la membrana se une a la pared del parte movible y gire el inserto con la otra mano para liberar a las cuatro muestras. Cuidadosamente con unas pinzas finas, transferir cada muestra a una placa de 24 pocillos que contienen 200 μL de PBS/bien, con la parte de la sangre hacia arriba en cada pozo.
- Bloquear las membranas con suero bovino fetal 10% en PBS (para 30 min a temperatura ambiente, 200 μL/pocillo). Preparar la solución de anticuerpo 1° para la inmunotinción de la ensambladura apretada proteínas (figura 1) (zonula occludens-1, claudin-5; consulte la Tabla de materiales) en 200 μL de solución/pozo de bloqueo. Opcionalmente, identidad de la célula endotelial se verifica mediante la adición de un anticuerpo levantado contra la molécula de adhesión de células endoteliales plaquetas (PECAM1 o CD31; Consulte la Tabla de materiales) para cada solución de anticuerpo de ensambladura apretada. Deseche la solución de bloqueo e incubar con anticuerpos primarios' O/N a 4 °C.
- Al día siguiente, descartar los anticuerpos primarios y enjuague con 200 μL de PBS (3 x 5 min a temperatura ambiente). Incubar con anticuerpos secundarios conjugados fluoróforo específicos apropiados (dilución 1: 500, 200 μL/pocillo, diluido en solución de bloqueo, consulte la Tabla de materiales) por 2 h a TA.
- Descartar los anticuerpos secundarios, enjuague con 200 μL de PBS (3 x 5 min a temperatura ambiente). Retirar el PBS y contratinción los núcleos celulares usando un 4', solución 6-diamidino-2-phenylindole (DAPI) para una concentración final de 1 μg/mL en pura destilada H2O (dH2O; 200 μL/pocillo; por favor, consulte el tabla de materiales ). Incubar por 7 min en RT. quitar el DAPI y lavar las membranas 3 x con el dH2O (200 μL/pocillo).
- Coloque una gota del medio de montaje (véase la Tabla de materiales) en un portaobjetos de vidrio. Con unas pinzas finas, cuidadosamente saque la membrana del pozo y manteniendo la orientación, retire el exceso de dH2O y colóquela sobre la gota de medio de montaje. Añadir otra gota de medio de montaje sobre la membrana y con cuidado la tapa con un vidrio de borosilicato cubierta. Asegúrese de que no hay ningunas burbujas de aire atrapado. Almacenar las muestras a 4 °C y lejos de la luz hasta observaciones de microscopía confocal.
Nota: Astrositos tinción puede realizarse mediante la colocación de las piezas de las membranas en la placa de 24 pocillos con el lado del cerebro para arriba y con el uso de anticuerpos específicos de astrositos seleccionados (por ejemplo, dirigido contra la proteína ácida fibrilosa glial [GFAP]) (Figura 1E ).
- Enjuague ambos lados de la membrana con PBS helado (3 x 5 min, 2,5 mL/insertar, 3 mL/pozo). Descartar el PBS y añadir 3 mL y 2,5 mL de helado 4% PFA en el pozo y en la inserción, respectivamente. Incubar en hielo durante 10 minutos, descarte la PFA (según institución'desecho químico peligroso s) y enjuagar 3 veces con PBS a temperatura ambiente (2.5 mL/insertar, 3 mL/pocillo).
-
Fluorescencia de BBTB tinción para detectar nanopartículas transcitosis
- Realizar etiquetado de lisosomas de células vivas (por ejemplo, utilizando fluorescentes sondas [véase Tabla de materiales]). Diluir el colorante fluorescente del lisosoma en una concentración de trabajo de 50 nM en precalentado EBM - (2.5 mL/insertar) o de 75 mM en ABM - precalentado (3 mL/pocillo) de lisosoma etiquetado de células endoteliales y astrocitos, respectivamente. Incube las células durante 45 minutos (a 37 °C con 5% CO2); Enjuagar 3 veces con PBS helado (2.5 mL/insertar, 3 mL/pocillo).
- Descartar el PBS y añadir 3 mL y 2,5 mL de helado 4% PFA al pozo y a la inserción, respectivamente. Ellos incubar en hielo durante 10 minutos, descarte la PFA y lavar las células 3 x con PBS (a RT, 2,5 mL/insertar, 3 mL/pocillo).
Nota: Una vez fijadas, las muestras pueden almacenarse en PBS (2.5 mL/insertar, 3 mL/pocillo) a 4 ° C durante una semana. - Retirar el PBS y contratinción los núcleos de la célula mediante una solución DAPI a una concentración final de 1 μg/mL en dH2O (1 mL/insertar, 1 mL/pocillo). Incúbelos durante 7 min a RT. quitar el DAPI y lavar las membranas 3 x con el dH2O (2.5 mL/insertar, 3 mL/pocillo).
- Cortar la membrana cuidadosamente, retirar el exceso de dH2O y colocarla en una gota de medio de montaje (véase la Tabla de materiales) en un portaobjetos de vidrio. Añadir otra gota de medio de montaje en el otro lado de la membrana y con cuidado la tapa con un vidrio de borosilicato cubierta. Evitar las burbujas de aire atrapado. Almacenar las muestras a 4 °C y mantenerlos protegidos de la luz hasta la proyección de imagen de microscopía confocal.
-
Tinción de fluorescencia de las células tumorales
- Con unas pinzas finas, transferir cuidadosamente el cubreobjetos redondo que contiene las esferas del tumor a una placa de 24 pocillos con PBS helado. Proceder con células vivas lisosoma etiquetado usando puntas de prueba fluorescentes lisosoma 75 nM en GBM precalentado (200 μL/pocillo). Incubar las muestras por 45 min; Luego, enjuagar 3 veces con PBS helado (200 μL/pocillo).
- Descartar el PBS y añadir 200 μL de PFA helada por pozo. Incubar en hielo durante 10 minutos, descarte la PFA y enjuagar las muestras 3 x con PBS (a RT).
Nota: Una vez fijadas, las muestras pueden almacenarse en PBS (200 μL) a 4 ° C durante una semana. - Retirar el PBS y contratinción los núcleos de la célula mediante una solución DAPI a una concentración final de 1 μg/mL en dH2O (200 μL/pocillo). Incúbelos durante 7 min a RT. quitar el DAPI y lavar los cubreobjetos 3 x con el dH2O (200 μL/pocillo).
- Con unas pinzas finas, quitar el cubreobjetos, retirar el exceso de dH2O y colocarla en una gota de medio de montaje (véase la Tabla de materiales) en un portaobjetos de vidrio. Evite atrapar burbujas de aire. Almacenar las muestras a 4 °C y mantenerlos protegidos de la luz hasta observaciones de microscopía confocal.
3. in Vivo estudio comparativo
- Grabación in situ de la difusión de la fluoresceína de sodio a través de la BBB
- Preparar 150 μL de una solución a Na-Fl 50 nM en solución fisiológica. Mantener la solución a 37 °C en la entrega intravenosa.
- Anestesiar un ratón con una inyección intraperitoneal de un ketamina/xilacina cóctel (300 μL de 100 mg/kg ketamina y 10 mg/kg xilacina en PBS). Una vez establecida la anestesia profunda, coloque el animal en un cojín de calefacción para mantener su temperatura corporal.
Nota: Diez semanas de edad hembra Instituto de investigación médica Naval (NMRI) immunocompromised ratones desnudos se han utilizado para obtener los datos presentados en la figura 2. Sin embargo, este protocolo se adapta a los ratones inmunocompetentes e immunocompromised. El método de anestesia/analgesia es en el científico'discreción de s. Sin embargo, anestesia inhalatoria como isoflurano no se recomienda ya que aumenta significativamente la permeabilidad BBB del18. - Coloque el ratón sobre un estereotáctica (véase la Tabla de materiales) y realizar una incisión longitudinal del cuero cabelludo con unas tijeras finas, seguidas por dislaceraciones suave del tejido conectivo, con unas pinzas finas, para revelar el cráneo. Utilizando movimientos circulares con una microperforadora fina, quitar una pieza circular de ø 0,3 mm del cráneo del hueso parietal izquierdo o derecho. Proceda con extrema precaución durante la perforación y al quitar la pieza del cráneo para evitar lesionar el tejido meníngeo subyacente y vasos sanguíneos.
- Coloque una gota de solución fisiológica en los tejidos expuestos. Usando dos pares de Pinzas finas, retire con cuidado el tejido meníngeo para acceder a la corteza del cerebro. El tejido cerebral nunca debe estar en contacto directo con el aire.
Nota: Las hemorragias menores de lesión meníngea también pueden pararse mediante esponjas hematológicas (consulte la Tabla de materiales). - Una vez que se extirpa el tejido meníngeo y la corteza está completamente expuesta, atrapar una gota de solución fisiológica entre la corteza y un cubreobjetos de borosilicato de 0,5 mm de ø. Asegurar el área de observación con una gota de pegamento del cianocrilato (consulte la Tabla de materiales) repartidos por el cubreobjetos con una aguja. Deje que el pegamento seco durante 1 minuto.
- Preparar el catéter implantable para la inyección de la vena de la cola (figura 2A). Romper la punta de una aguja de 25 G con unas pinzas de Rochester-Ochsner e insertar la punta en 10 cm de largo PE20 poliuretano tubo (consulte la Tabla de materiales) (figura 2A).
- Inserte el catéter en la vena lateral de la cola del ratón, con bulldog pinzas para la manipulación del catéter y la inserción (consulte la Tabla de materiales) (figura 2B). Asegure la aguja insertada con una gota de pegamento de cianocrilato. Deje que el pegamento seco por 20 s antes de quitar la pinza de bulldog. Conecte con cuidado el otro extremo del catéter a una aguja de 25 G conectada a una jeringa que contiene la solución de Na-Fl (figura 2B).
- Nota: No sujetar la cola con la pinza de bulldog; sólo se utiliza para manipulación de catéter precisa. Inserción de catéter adecuado puede confirmarse por reflujo de sangre en el tubo transparente.
- Colocar al animal bajo el estereomicroscopio (véase la Tabla de materiales). Usando la autofluorescencia bajo nivel en el canal verde (480 nm), centrarse en una región que contiene vasos sanguíneos relativamente grandes (aparecen más oscuros debido a la absorción de la hemoglobina de la luz a esta longitud de onda) y los capilares más pequeños (figura 2). Iniciar la adquisición de Time-lapse brevemente antes de inyectar el colorante fluorescente para obtener una medición de la fluorescencia de fondo.
Nota: Alternativamente, la grabación Time-lapse puede sustituirse por fotografías instantáneas de T0 y de cualquier otro predeterminado puntos del tiempo. - Inyectar la solución a un ritmo lento y continuo, o como alternativa, utilizar un sistema de infusión automatizados. La fluorescencia de la Na-Fl detectada en la sangre debe permanecer estable (vida media en sangre: min 286), que permite una grabación de la difusión de BBB a través de la ventana craneal durante varios minutos. Una vez completada la adquisición, con cuidado retire el catéter y eutanasia a los animales por dislocación cervical.
- Determinación in vivo de la permeabilidad BBB
Nota: Valores se obtienen de cualquier software de procesamiento de imágenes, como el ImageJ, que permite la medición de la intensidad de la señal de fluorescencia dentro de una región personalizada de interés (ROI).- Con la herramienta de anotación, dibujar un ROI en forma de rectángulo fuera de un vaso sanguíneo, en el tejido cerebral, en alrededor 5 μm distancia cualquier visibles los vasos sanguíneos con nota Na-FL. las dimensiones del retorno de la inversión y la intensidad de fluorescencia medidos en T0 en que ROI, que se utiliza como blanco para el tejido's autofluorescencia. Sin desplazar el ROI, adelantar un tiempo ClLi punto (por ejemplo, en el último marco grabado cuando toda la solución se ha inyectado a los animales) y tenga en cuenta los valores precisos de tiempo y fluorescencia medidos en el ROI (figura 2).
- Mueva el ROI en un vaso sanguíneo visible (figura 2) y anote el valor de Autofluorescencia T0 de la sangre. Sin desplazar el ROI, avanzar en el mismo punto de tiempo definido en el paso 3.2.1. y nota el valor de fluorescencia se mide en el ROI (figura 2).
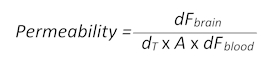
- Utilice la fórmula siguiente (adaptada de la sección 1.3) para determinar la permeabilidad BBB:
- Aquí, dFcerebro es el valor de la intensidad de fluorescencia menos el valor en blanco de T0 en el cerebro, dT es el momento de la adquisición en segundos, A es la superficie aproximada del buque, tomada como el área ROI en centímetros cuadrados y dF sangre es el valor de la intensidad de fluorescencia menos el valor en blanco de T0 en sangre.
Nota: Valores permeabilidad previsto por la BBB deben estar en el 10-6 cm/s rango (tabla 1).
- Proceso para la detección de nanopartículas fluorescentes en el cerebro murino del tejido
- Implante de esferas de glioblastoma paciente derivada (5 x 104 células en 5 μl de PBS estéril) en anestesia 6 semanas de edad hembra NMRI ratones desnudos en el cuerpo calloso. Localizar esta región del cerebro en las siguientes coordenadas estereotáxicas, a partir de la Bregma: anteroposterior + 0,5 mm, izquierda a derecha 2,5 mm, dorsoventral + 3 mm. permitir que el tumor de cerebro a crecer durante 2 semanas.
- Inyectar por vía intravenosa las nanopartículas (100 μg en 100 μl de solución fisiológica estéril) y permitirles circular para 8 h. inyectar por vía intravenosa los ratones control con 100 μl de solución fisiológica estéril.
- Eutanasia a los ratones por dislocación cervical y recoger el cerebro rápidamente para snap-congelación en isopentano mantenido en hielo seco (1 min a-50 °C). Almacenar los cerebros a-80 °C hasta el procesamiento del tejido.
- Corte secciones coronales de cerebro con un cryomicrotome. Localizar la implantación intracraneal por la cicatriz había formada en la corteza y cortar 9 secciones μm de espesor de la zona sobre el microscopio apropiado (véase la Tabla de materiales).
- Sumerja las secciones del cerebro que están inmovilizadas en las diapositivas en PBS helado (2 x 5 min) y, a continuación, fijar en helada 4% PFA (durante 5 min). Lavar los portaobjetos en PBS (3 x 5 min a temperatura ambiente). Coloque las correderas horizontalmente y Pipetee el bloqueo solución con 10% suero fetal bovino en PBS sobre el tejido las secciones cubriendo toda la superficie (por 1 h a temperatura ambiente, 500 μl/diapositiva). Preparar el anticuerpo CD31 (consulte la Tabla de materiales) en 250 μl de solución o diapositiva de bloqueo. Reemplace la solución de bloqueo con el anticuerpo e incubar durante una noche a 4 °C en una cámara humidificada.
- Al día siguiente, sumerja los portaobjetos en PBS (3 x 5 min a temperatura ambiente) y se incuba con el anticuerpo secundario conjugado con fluoróforo correspondiente (1: 500 en 250 μl de PBS durante 2 h a temperatura ambiente). Enjuague 3 veces en PBS (a RT) y contratinción los núcleos de la célula una concentración final de 1 μg/mL en dH2O, utilizando una solución DAPI (250 μl/diapositiva). Incubar las muestras por 7 min en RT. Retire la solución DAPI y lave los portaobjetos 3 x con el dH2O.
- En cada sección de tejido, agregue una gota de medio de montaje (consulte la Tabla de materiales) y las muestras con un cubreobjetos. Evite atrapar burbujas de aire. Almacenar las muestras a 4 °C y mantenerlos protegidos de la luz hasta observaciones de microscopía confocal.
Resultados
Proyección de imagen confocal del mimic BBTB murine demuestra la expresión y localización celular de las proteínas de Unión estrecha zonula occludens-1 (ZO-1) y claudin-5 en bEND3. Contactos entre las células endoteliales y astrocitos claramente inducida por la reubicación de la ZO-1 y claudin-5 a los contactos de la célula endotelial en comparación con el monocultivo de bEND3 (figura 1). Mediante la inmunofluorescencia que manchaba para visualizar los astrocitos expresan GFAP en el cerebro del lado de la membrana, es posible observar y estudiar los procesos astrocytic y final-pies en contacto con las células endoteliales a través de la membrana (Figura 1E ). Los contactos de la célula endotelial astrositos se conocen para promover y estabilizar el estrechamiento de la barrera celular y se asocian con valores más bajos de la permeabilidad de la BBB19. De acuerdo con eso, se observó una sustancial disminución en la permeabilidad de la imitador BBTB de ratón para la Na-Fl de 27.63 (± 3,45) x 10-6 cm/s en el caso de los monocultivos a 6.74 (± 3.01) x 10-6 cm/s cuando cultivadas conjuntamente con la hipoxia inducible factor knock out (HIFko) astrocitos (tabla 1). HuAR2T inmortalizado forman barreras celulares altamente permeables (104.92 ± 27,1 x 10-6 cm/s, tabla 1). Similar al modelo murino, se evaluó la permeabilidad significativamente más baja de lo BBTB Na-FL, es decir, 47.4 (± 14.32) x 10-6 cm/s, cuando las células HuAR2T cultivadas conjuntamente con los astrocitos primarios humanos (tabla 1).
En imitadores BBTB murinos y humanos, la presencia de las esferas del paciente derivado del glioblastoma indujo un ligero aumento en los valores de permeabilidad en comparación con las célula endotelial-astrositos co-cultivos solo (tabla 1). Este fenómeno se observa con varios pero no todos lo paciente glioma esfera modelos. Esto puede ser debido al VEGF-A que es secretada por algunas de estas células derivadas del paciente.
Para comparar los valores de permeabilidad de los in vitro BBTB imitadores con lo BBB en vivo, hemos reflejado la difusión en tiempo real de la Na-Fl a través de una ventana craneal implantada en ratones desnudos. Mediante un estereomicroscopio de fluorescencia, difusión de Na-Fl de los capilares de los vasos sanguíneos derivados de los principales vasos piales grabó antes, durante y después de la inyección sistémica de la sonda (figura 2). Las mediciones de los valores de fluorescencia diferencial del parénquima cortical circulación de sangre y el cerebro con el tiempo nos ha permitido calcular los valores aproximados de la permeabilidad del ratón desnudo's BBB para Na-Fl (5,57 ± 2.19 x 10-6 cm/s, Tabla 1).
Para ilustrar cómo este imitador BBTB puede utilizarse para la visualización del paso de compuestos al lado de sangre hacia el cerebro, comparamos la transcitosis de ø 110 nm (NP110) y ø 350 nm (NP350) nanopartículas dirigida a glioblastoma derivados del paciente. Resultados obtienen in vitro fueron luego comparados con la transcitosis en vivo. En el ejemplo presentado, las nanopartículas fueron superficie cubierta con el péptido tumor targeting CooP20 y cargado con el colorante fluorescente (FITC) para facilitar la visualización. Hemos marcado las células usando el tinte lisosomal y contratinción DAPI 24 h después de la incorporación de las nanopartículas FITC en el lado arterial de la BBTB mímico y adquirido micrografías confocales a diferentes niveles (por ejemplo, el lado de la sangre, la membrana, del lado del cerebro, y las esferas de glioblastoma pacientes) (Figura 3A). La señal fluorescente asociados NP110 colocalized con los lisosomas en células endoteliales, astrocitos y células del tumor. Además, NP110s fueron detectada entre las células endoteliales y astrocitos, pasando a través de los poros de la membrana de la inserción (Figura 3A).
El paso de NP110s se cuantificó midiendo la fluorescencia de las muestras recogidas de la sangre y el cerebro de lado. Estos valores de permeabilidad fueron comparados con los determinados para las nanopartículas de ø 350 nm (NP350). Los resultados muestran que sólo NP110 era capaz de atravesar a los imitadores BBTB (figura 3B). NP350 permaneció en el lado arterial de la imitador BBTB, que dio lugar a valores más bajos de la permeabilidad de estas nanopartículas.
Para resaltar la importancia de la mímica BBTB frente a los modelos en vivo, ratones desnudos fueron inyectados por vía intravenosa con nanopartículas NP110 o NP350 cubierto con el péptido tumor targeting CooP y conjugado con colorante fluorescente rojo (TRITC) para la detección. Los tejidos recogidos en varios puntos del tiempo revelaron que después de 8 h, permeable a la BBB nanopartículas han extravasados en el parénquima cerebral, mientras que el nonpermeable que me alojé en la circulación principalmente eran despejaron de la circulación sistémica en vivo. Por lo tanto, se recogieron los cerebros y había cuantificado el número de nanopartículas por milímetro cuadrado postinjection de 8 h. Acuerdo con los resultados in vitro, NP110, pero no NP350, con éxito extravasados en el parénquima cerebral (figura 3). Proyección de imagen de alta magnificación de la ubicación de nanopartículas en el cerebro mostró que NP110 fue homogéneamente distribuidos en el parénquima cerebral fuera de los capilares sanguíneos y alojados con éxito a las células de glioblastoma implantado (figura 3D). A pesar de que el mismo tumor targeting moiety (CooP), NP350 pudo extravasate en el parénquima cerebral y sólo fue detectada en el lado luminal de cerebro los vasos sanguíneos (figura 3E), similares a los resultados obtenidos in vitro.
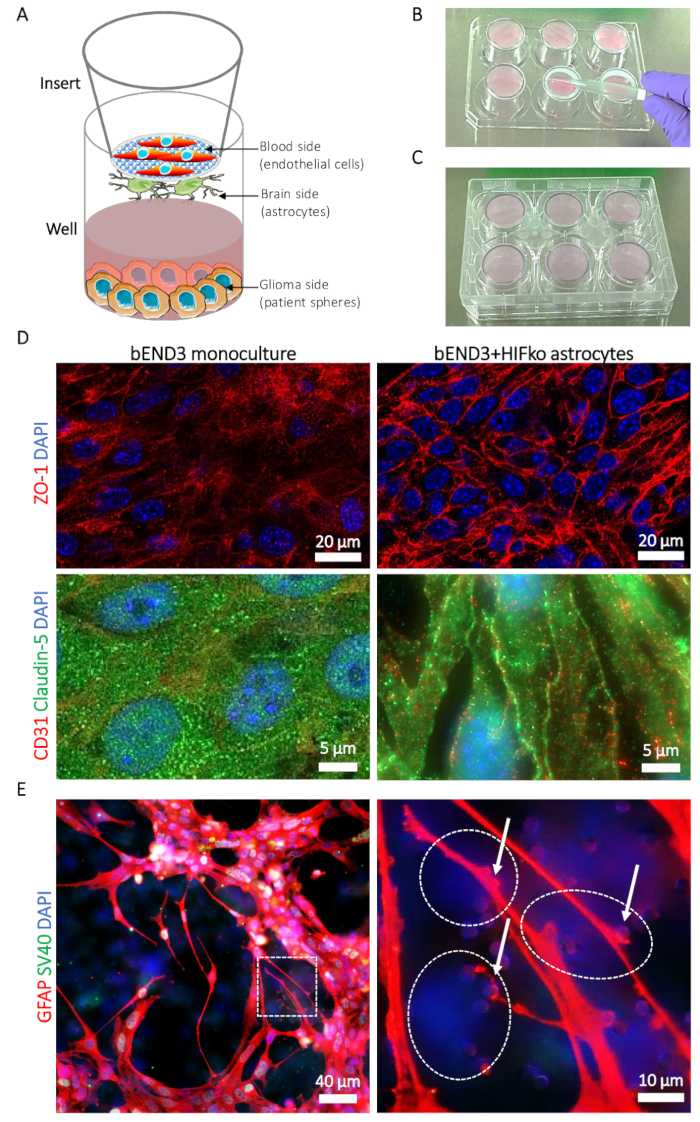
Figura 1: Descripción del modelo (BBTB) tumor-barrera sangre-cerebro. (A) representación esquemática de la ubicación de diferentes tipos de células. (B) ilustración de la colocación de insertar en la cubierta de placa de 6 pozos y la técnica de siembra por los astrocitos en el lado del cerebro de la inserción'membrana s. (C) ilustración de la colocación de placa de 6 pozos que permite la adherencia de los astrositos. (D) imágenes de inmunofluorescencia de la ensambladura apretada proteínas zonula occludens-1 (ZO-1, superior de la fila, rojo) y claudin-5 (fila inferior, verde). La expresión de la proteína es comparada con el cerebro murino microvascular células endoteliales (bEND3) cultivadas en la parte de la sangre de lo BBTB solo como un monocultivo (columna izquierda) o con astrocitos de HIFko inmortalizados murinos (columna derecha). Núcleos celulares son contratinción con DAPI (azul). (E) micrografía de inmunofluorescencia mostrando la proteína ácida fibrilosa glial (GFAP, rojo) en los astrocitos de HIFko cultivados en el lado del cerebro de lo BBTB. La imagen de alta magnificación muestra procesos de astrositos y final-pies (flechas) en contacto con las células endoteliales a través de la membrana de poros (panel derecho). Se verificó la identidad de los astrocitos HIFko manchando de la inmunofluorescencia del simian virus 40 grandes T antígeno (SV40 grande T, verde) utilizado para la inmortalización de las células. Las células endoteliales expresan la GFAP ni la T grande de SV40 y, por lo tanto, se pueden observar parcialmente a través de la transparencia, opuesta al lado de la membrana como DAPI sólo células (líneas discontinuas). Núcleos celulares son contratinción con DAPI (azul). Haga clic aquí para ver una versión más grande de esta figura.
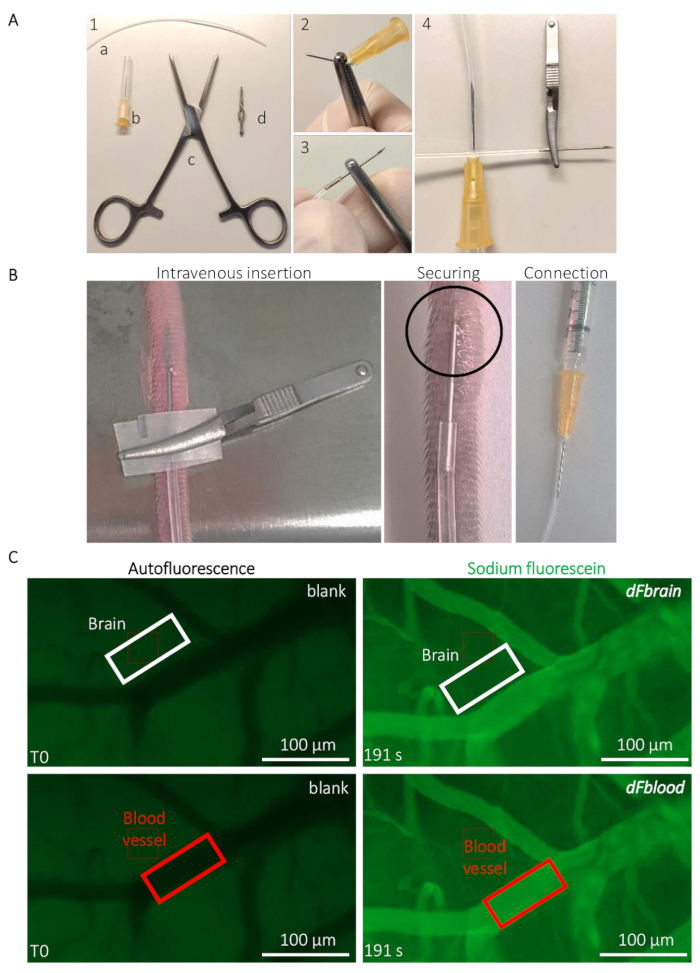
Figura 2: Determinación vivo intravital del ratón permeabilidad BBB. (A) preparación del catéter implantable vena caudal. (1) herramientas y equipos son los siguientes: (a) un PE20 tubo de polietileno (b) dos 25 G agujas fórceps (c) Rochester-Ochsner y (d) un pequeño bulldog pinza. Se retira aguja (2) A 25 G por varias torsiones con las pinzas y (3) con cuidado introduce en el tubo. (4) al otro lado del tubo se conecta a otra aguja de 25 G. (B) guía para la implantación del catéter y posicionamiento para infundir la solución de fluoresceína de sodio a través de la vena de la cola de un ratón. El área dentro de un círculo indica el área donde se coloca una gota de pegamento del cianocrilato para asegurar el catéter. La pinza bulldog se utiliza para manejar el catéter y retirar una vez que el catéter está asegurado. (C) método representativo la proyección de imagen y cuantificación para determinar los valores de permeabilidad de la fluoresceína de sodio. Antes de la infusión de la fluoresceína de sodio (columna izquierda), se mide el autofluorescence/espacio en blanco dentro de una región de interés (ROI) a las áreas de vasos sanguíneos (rectángulo de fondo panel rojo) y cerebro (rectángulo del panel superior, blanco). Durante la infusión de la fluoresceína de sodio (columna derecha), la intensidad de fluorescencia se mide en ambos ROIs, lo que permite el cálculo de la permeabilidad BBB. Haga clic aquí para ver una versión más grande de esta figura.
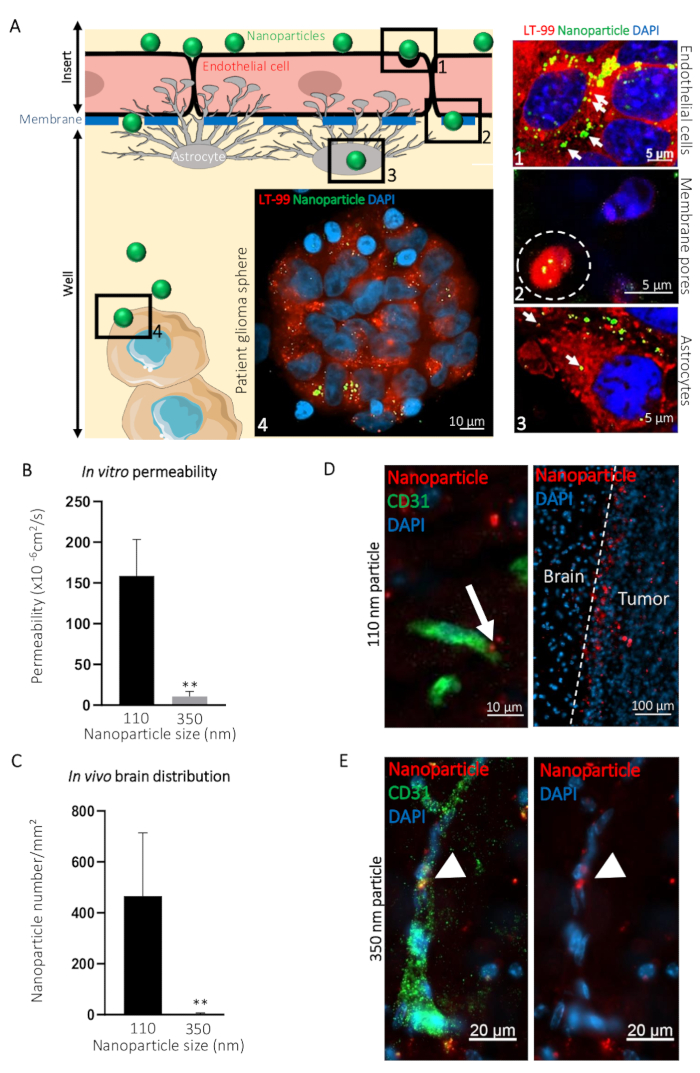
Figura 3: predicción de la transcitosis intracerebral de nanopartículas a través de la BBB en vivo usando el modelo in vitro de BBTB. (A) representación gráfica del ensayo BBTB con imágenes confocales representativos obtenidos en los distintos niveles señalados del modelo murino BBTB. Nanopartículas de 110 nm de diámetro (NP110) y conjugado a FITC (verde) fueron agregados a la sangre parte de las células BBTB fueron etiquetados con la sonda lisosomal (LT-99, rojo). (1) endotelial de las células, (2) endotelial transcitosis de las nanopartículas a través de los poros de la membrana (línea blanca punteada), astrocitos (3), y (4) pacientes glioblastoma esferas están identificadas en el gráfico y micrografías confocales correspondientes (derecha). Lysosomal encapsulación de nanopartículas (flechas) sugiere transcitosis activa a través de las capas endoteliales y astrositos de lo BBTB. (B) cuantificación de la permeabilidad de la nanopartícula indicado a través de lo BBTB in vitro (n = 6). (C) la cuantificación de la densidad indicada nanopartículas en el tejido cerebral secciones, 8 h después de la infusión de la vena caudal de ratones nude (n = 3). (D) micrografías confocales mostrando la distribución de la ø 110 nm nanopartículas (NP110, rojo) en las secciones de tejido de cerebro de ratón marcado con un anticuerpo anti-ratón de CD31 (verde). La flecha destaca la transcitosis de nanopartículas (panel izquierdo). Las nanopartículas acumulan alrededor de las células del tumor cerebral (tumor, panel derecho) debido al péptido CooP-targeting presentada en su superficie. No significativo autoguiado hacia el blanco se observa en el tejido cerebral (cerebro). Fotografías Confocal (E) muestran la distribución de la ø 350 nm nanopartículas (NP350 rojo) en secciones del tejido de cerebro de ratón marcadas con un anticuerpo anti-ratón de CD31 (verde). Punto de puntas de flecha a la NP350s que se conservaron en el lumen del vaso sanguíneo y no pudieron cruzar el BBB, debido probablemente a su mayor diámetro en comparación con los núcleos de la célula NP110s. son counterstained con DAPI (azul). P < 0.01. P-los valores se calcularon mediante una prueba de dos colas, no paramétrica U de Mann-Whitney. Las barras de error representan el desvío estándar. Haga clic aquí para ver una versión más grande de esta figura.
| mimic BBTB murino | bEND3 | bEND3 + HIFko como | bEND3 + GB | bEND3 + HIFko como + GB | En vivo |
| Permeabilidad (10-6 cm/s) | 27.63 | 6.74 | 26.8 | 10,83 | 5.57 |
| SD (10-6 cm/s) | 3.45 | 3.01 | 7.99 | 2.65 | 2.19 |
| humano imitador BBTB | HuAR2T | HuAR2T + hIAs | HuAR2T + GB | HuAR2T hIAs + GB | |
| Permeabilidad (10-6 cm/s) | 104.92 | 47.4 | 89.08 | 48.24 | |
| SD (10-6 cm/s) | 27.1 | 14.32 | 10.21 | 13.07 |
Tabla 1: valores de la permeabilidad del sodio-fluoresceína (Na-Fl) (en centímetros por segundo) en vitro en los sistemas de co-cultivo indicado e in vivo en ratones desnudos NMRI. Los datos de un experimento representativo (n = 3 ratones).
Discusión
La subida del concepto de variabilidad notable tumor había rejuvenecido la investigación de medicina personalizada del cáncer21. Esta variabilidad es también un sello de neoplasias del sistema nervioso central. Debido a la imprevisibilidad del tumor, respuesta a la quimioterapia agrega en el sentido de acogida de la BBB para la entrega de la droga y en conjunto constituye grandes desafíos en el cuidado de los pacientes22. Para desarrollar terapias más eficaces, a menudo es necesario a las bibliotecas grandes de la pantalla de nuevas moléculas. Para evaluar la eficacia antitumoral y la capacidad de la nueva terapéutica conduce al llegar al sitio del tumor, la mejor opción es el estudio preclínico en células derivadas del paciente implantado en vivo en avatares paciente murinos. Debido a la práctica (recursos financieros, de tiempo, humanos y facilidad) y razones éticas (3R principio al usar animales de laboratorio), el desarrollo de una plataforma de proyección en vivo en gran escala a menudo no es posible y por lo tanto, los ensayos celulares siendo un modelo de elección23. La razón principal para la selección de líneas celulares establecidas y evitar células primarias es facilitar la reproducibilidad y reducir el uso de animales de laboratorio, que son la principal fuente para el aislamiento y el establecimiento de cultivos primarios murinos. Los métodos que presenta aquí, cumpliendo firmemente con las 3Rs, podrían descartar eficientemente nanopartículas de una posterior investigación preclínica en el criterio de su incapacidad para cruzar el modelo BBTB. Como una prueba de principio, Describimos aquí resultados obtenidos durante el desarrollo y validación de lo BBTB. Hemos podido confirmar hallazgos in vitro in vivo, por ejemplo, cuando mide la difusión pasiva de un 376 Da la fluoresceína sódica.
El protocolo descrito en este artículo describe la preparación de las células endoteliales morfología con astrocitos para formar una interfaz de tumoración barrera sangre-cerebro en una configuración en vitro. Una vez que se establece un contacto físico entre estos dos tipos celulares, la capa de células endoteliales exhibe semejanzas con el BBB (por ejemplo, una célula expresión superficial de las proteínas de Unión estrecha y relativamente baja permeabilidad). Curiosamente, el imitador BBTB murino parecía proporcionar valores de permeabilidad de Na-Fl particularmente similares a los obtenidos con el ratón en vivo de las mediciones de permeabilidad BBB24. Por lo tanto, el rendimiento de los imitadores BBTB estará directamente vinculado a la elección de las células utilizadas para formar la barrera. Las células endoteliales bEND3 originan en el cerebro y se saben que tener éxito en la formación de barreras cuando morfología con astrocitos25. Sin embargo, hemos utilizado el inmortalizado de astrocitos HIFko26 para generar al imitador BBTB. Debido a su carencia del factor inducible por la hipoxia, los astrocitos no producen VEGF-A, que es por excelencia en la estabilización de los mimic BBTB descrita aquí. Los astrocitos se han identificado como moduladores de la permeabilidad BBB, por ejemplo a través de la liberación de VEGF-A en respuesta a neuroinflamación27. Activación de los receptores del factor de crecimiento endotelial vascular (VEGFRs) es un regulador clave de la permeabilidad endotelial vascular tanto en vitro28 y29de en vivo. Por lo tanto, suplementos de VEGF-A en el medio de activan el VEGFR2 en las células endoteliales, que induce la fosforilación de proteínas de Unión adherentes como VE-cadherina30. La pérdida de contactos de la célula endotelial genera gran permeabilidad de los vasos sanguíneos. Del mismo modo, la fuerte característica mitogénica y composición desconocida del suero bovino fetal utilizado en los ensayos de cultura de célula causan problemas importantes en la reproducibilidad de la estabilización y el análisis de barrera.
Las células endoteliales de vena umbilical humano (HUVECs) se utilizan a veces para formar BBB en vitro31; sin embargo, significativamente difieren de las células endothelial microvasculares del cerebro, tales como la celda D3/hCMEC línea32, en términos de la expresión génica y la formación de barrera propiedades. Sin embargo, la permeabilidad relativamente mayor que los valores obtenidos con las células HuAR2T cultivadas solo comparados con el bEND3 fueron reducidos grandemente por cocultivo con astrocitos primarios humanos. Aunque las células endoteliales son necesarios para formar la pared celular, es claro que los astrocitos tienen un papel igualmente importante para la formación de BBTB y estabilización.
Cuando esferas de glioma derivados del paciente se agrega a esta ecuación, el imitador BBTB ratón recapitula algunas de las características de xenoinjertos murinos, tales como la difusión del fármaco a través de la vasculatura cerebral y tumor de la célula objetivo. Los imitadores BBTB aquí lograron, por ejemplo, refleja el comportamiento in vivo cuando defendimos varias nanopartículas con diferentes diámetros. Para ilustrar el paralelismo entre los modelos in vitro e in vivo, hemos utilizado el de nanopartículas de silicato mesoporosos previamente descritos33 con penetración celular propiedades34 conjugado con el péptido tumor targeting CooP en su surface20. Los hogares dirigidos a CooP de péptido a las células del tumor invasivo a través de la unión específica para el inhibidor de crecimiento mamario derivados (MDGI). Varios tipos de cáncer, como los gliomas, son overexpressing MDGI en comparación con el tejido normal35, que hace la cooperativa un grupo de metas de tumor muy eficiente capaz de aumentar la entrega de una capacidad de carga20. Las nanopartículas usadas aquí se ha demostrado previamente que difusa en el parénquima cerebral (27547955), y cuando funcionalizados con Taxol, estas nano-cargas han tenido éxito en la reducción del crecimiento de la glioma en modelos preclínicos36. La adición de residuos de polietileno glicol (PEG) en la superficie de las nanopartículas también mantuvo su carga estática a valores positivos (alrededor de + 4 mV), lo que permite mejor interacción con la unidad neurovascular del37 y también aumenta su estabilidad en la circulación. En los datos presentados, 3 kDa de PEG fue conjugado con NP110s, mientras NP350s se cubren de 10 kDa de PEG. Sin embargo, PEG de mayor peso molecular también resultó en un aumento significativo en el diámetro de nanopartículas, por lo tanto sus capacidades físicas para cruzar el BBB. Por lo tanto, comprobamos si las dimensiones físicas de las partículas impidieron su paso a través de lo BBTB y si estas observaciones pueden espejarse en vivo.
Acuerdo con las observaciones previamente publicadas, observamos que NP110s extravasados a través lo BBTB in vitro y la BBB de ratones con tumores intracraneales, mientras que NP350s retenido en el lado luminal de la imitador BBTB y en los vasos sanguíneos de la ratones. Estos resultados similares sugieren fuertemente que el modelo BBTB predijo la capacidad in vivo de nanopartículas para cruzar el BBB y alcanzar el cerebro.
Con frecuencia se discute la pertinencia de modelos de la BBB, incluso para el suministro central de nanopartículas38. Aquí mostramos que primaria astrocitos y células endoteliales, ambos considerados como los más relevantes instrumentos in vitro, se pueden substituir por las células inmortalizadas o disponibles en el mercado, garantizando una mayor escalabilidad y reproducibilidad. La próxima generación de los imitadores BBB in vitro podría ser desarrollada mediante la incorporación de los dispositivos microfluídicos, permitiendo unidades neurovasculares maravillosamente formado que estructuralmente se parecen a los reales BBB12,14. Sin embargo, tales modelos son actualmente inadecuados para el cribado de alto rendimiento de moléculas a gliomas, debido a limitaciones técnicas en el seguimiento de la entrega de14. Es de hecho difícil de capturar la complejidad fisiológica de la BBB en un plato, y la falta de algunos receptores/proteínas, conocido por ser expresada por el BBB, puede afectar la interpretación de los resultados. Otro argumento refiere a la gran variabilidad en la expresión génica entre las condiciones in vivo e in vitro, así como de la línea de una celda a otra, teniendo en cuenta las células endoteliales. Sin embargo, también se podría argumentar que la unidad neurovascular no es una entidad uniforme dentro el cerebro39. Investigación científica en biología ha llegado a una era humana donde el bienestar animal, responsabilidad ética y el costo del uso de vidas animales son considerados siempre antes de diseñar un experimento. Por lo tanto, para apoyar la sustitución de los animales, un creciente número de estudios recientes muestra que la conciencia de las limitaciones de los modelos y una cuidadosa selección de los modelos para establecer la barrera — con énfasis en los astrocitos, garantiza un coincidencia entre los resultados obtenidos en un plato y en animales modelos de40. Con la metodología aquí descrita, conseguimos un paso más cerca de reducir el número de animales de experimentación utilizados para la detección de efectos de transcitosis BBB para terapéutica potencial.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por donaciones de las organizaciones de cáncer de Finlandia, Jane & Aatos Erkko Fundación y Sigrid Juselius Fundación (P.L. y V.L.J.), la Fundación Nacional Suiza de ciencia (Advanced Postdoc.Mobility subsidio no: P300PB_164732, al S. K.), la Fundación de investigación Orion (a S.K.), la Fundación Maud Kuistila Memorial (a S.K.) y la Academia de Finlandia (TERVA 2017, subsidio no: 314 498). La unidad de imagen Biomedicum (Helsinki) es reconocida por ofrecer la microscopia instalaciones centrales para la proyección de imagen.
Materiales
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
Referencias
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225(2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, el-S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083(2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017(2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16(2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423(2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119(2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545(2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12(2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados