Method Article
皿に血液脳腫瘍-障壁を使用して生体ペイロード配信で予測
要約
中枢神経系腫瘍にターゲティングは大きな課題です。ここで我々 はマウスやヒトの細胞を用いた血液脳腫瘍関門の in vitro における模倣を生産し、中枢神経系腫瘍生体内ターゲットの予測可能性の重要性を議論するためのプロトコルについて説明します。
要約
生まれつき高選択的、血液脳関門 (BBB) 生理学的条件下で脳の恒常性に不可欠です。ただし、脳腫瘍の中では、BBB の分子選択性も盾腫瘍細胞末梢投与化学療法の配信をブロックすることによって。新薬 (含むナノ粒子) の開発を理想的に悪性脳腫瘍を対象には、薬剤のトランスサイトーシスと抗腫瘍効果を検討する臨床動物モデルが必要です。3 r の原則に従うために (絞り込む、軽減、および置換) 実験装置で実験動物の数を減らす、抗腫瘍剤の大規模なライブラリの高速スクリーニングを行うと、我々 は再現性のある生体外で人間開発と3 層培養内皮細胞、アストロ サイト、および神経膠芽腫患者由来の球を使用して血液脳腫瘍関門 (BBTB) のマウス似ています。高いスケーラビリティと再現性、商業細胞株あるいは不死化細胞実際 BBB に似た障壁の形成を許可するように合わせた条件で使用されています。ここで挿入に特定のセル密度でアストロ サイトと接触して内皮細胞を培養によって BBTB 模倣を取得するためのプロトコルについて述べる。例えば、この BBTB 模倣は、定量化と同じアッセイ内腫瘍細胞標的の評価に加えて、内皮細胞とアストロ サイトの障害物を通過するナノ粒子の共焦点レーザー顕微鏡では使用できます。さらに、前臨床動物モデルにおけるナノ粒子の行動を予測する得られたデータが使えることを紹介します。広い視野でこの in vitro モデル BBB を通じて新しい治療上の分子の通路の決定のための他の神経変性疾患に適応することができるまたは直接の有効性を評価する脳オルガノイドを補完します。薬。
概要
単位はニューロンとアストロ サイト、形成脳血管1関連する基底膜、血管内皮細胞、アストロ サイト ペリサイトの複雑な関係によって形成された BBB の構成。細かく連続、穴の血管によって形成されるこのタイトな細胞壁は、イオンと分子 (ホルモン、栄養素、薬物など) も循環セル1の動きを調節します。高分子量の分子、抗体医薬品、薬物の抱合体、nanocompounds などの BBB を特に低トランスサイトーシス大幅に制限されて、悪性を含む神経疾患の創薬における進歩神経膠腫2。確かに、経口または静脈内配信化学療法は抗腫瘍効果を誘導するために不十分な低濃度でしばしば脳実質に到達または単にクロス BBTB3腫瘍細胞に到達することができません。いくつかの前臨床および臨床研究はない BBTB 浸透の問題を扱っているが、妨害、BBTB 一時的、例えば集束超音波4、5を使用して、その場で直接それを回避しようとしました。薬6の配信。しかし、これらの技術のどれもが必然的な腫瘍の拡大に対抗する再発できた。したがって、新規 antiglioma 治療法を開発する際、BBTB を介して拡散を考慮治療薬7の配信の成功の重要な側面の一つとして必要があります。
BBTB 内細胞の相互作用の非常に複雑な性質のため実験動物の生体内での研究はの明白な選択肢として、血液から脳への分子の通路を勉強するようです。しかし、高-規模体内メソッドは、比較的複雑な確立し、したがって、合理的なコストで合理的な時間で分子の高速スクリーニングを許可しません。さらに重要なは、動物実験では、i) リファインとして定義された 3 r 倫理的なガイドラインに従う、ii) 軽減、および、代替プロトコル (例えばで体外にシリコ メソッド) によって iii) 交換, 現在のコンテキストに関連。したがって、BBTB 体外を再作成、興味深く、魅力的な可能性として表示されますが、それはまた様々 な制限によって挑戦複雑なタスクを構成します。多くは、培養細胞や細胞株犬、ブタ、マウス、および人間の起源は、(ラーマンら8とヘルムズら9によって再検討されました) として公開されているこの複雑なコンパートメントを再作成を試みます。これらのモデル三次元マイクロ流体システム10、BBB オンチップ11,12多数の古典的な共培養に基づくバリエーションの挿入システムがあります。それにもかかわらず、現在のマイクロ流体チップ システムがないか急速なスループットの高い創薬検証研究13,14か脳腫瘍への薬物送達の研究と現在互換性のない、適切な。さらに、初代培養細胞、誘導性多能性幹細胞 (iPSC)、または商業のセルラインを使用して 155 のパブリッシュされたモデルのレビューすべての共培養挿入傾向を示した interstudy 不一致の測定および/または結論8。室間再現性のこの欠乏はことができる例えば細胞培養器、ii) サブカルチャーと使用量の増加に基底膜マトリックス蛋白質とオプションのコーティング i) 正規化培養条件と相関します。血清を含むメディア、セル行15、または iii の遺伝的・形態の変更の両方の主要なドライバー) グリアと皿に内皮のコンポーネントの正しい平衡を再現性をもって再現する難しさ。不死化細胞または商業セルの使用回線のみ一次電池を使用する同様のモデルと比較してプロパティのいくつかを欠いている BBB 生体外モデルを確立するがで記述されているメソッドを示すの適切な組み合わせが展示物を細胞に非常に匹敵する性能は、参照16,17の他のモデルの研究を発表しました。最終的には、治療化合物、BBTB を通じて脳腫瘍を対象と通路を勉強する堅牢かつ再現可能なモデルの欠如は、私たちはここで説明する方法を開発する動機。
目標は、前臨床動物モデルにおけるナノ粒子の in vivo のデリバリーを予測するモデルを使用することでした、ので最初マウスアストロと接触してマウスの血管内皮細胞を含む挿入を用いた BBTB モデルを検証しました。これに加えて、我々 はまた特定のひと細胞ラインを使用するモデルを最適化されています。一度安定化、細胞壁は膠芽腫の患者由来の球または商業神経膠腫細胞株と文化に転送されます。その後、ナノ粒子および腫瘍細胞の標的のトランスサイトーシスを共焦点顕微鏡による可視化し、時間をかけてサンプルを集めることによって定量化できます。重要なは、BBTB 模倣を使用して得られた結果確実に挙動を予測できるナノ粒子の体内、BBTB 模倣事前の使用をサポートの前臨床検証。
プロトコル
動物実験は動物実験の南フィンランド地区 (ESAVI/6285/04.10.07/2014) のための委員会によって承認されました。
1. BBTB Mimics の確立
注:細胞培養液やサプリメント素材の表で詳細に説明します。
- アストロ サイトの準備
注:次のボリュームは 10 cm シャーレまたはコート t75 フラスコ細胞培養用フラスコに適しています。- 無菌細胞文化フードの下で滅菌リン酸緩衝生理食塩水 (PBS) の 5 mL の培養アストロ サイトを慎重に洗います。優しく真空ポンプを使用して PBS を破棄し、5 分の細胞解離試薬の 2 mL を追加 (37 °C、材料表を参照してください)、細胞をデタッチします。顕微鏡下で細胞の剥離を確認します。培養細胞のストレスを制限する 5 分を超えないようにします。
- 細胞解離試薬の活性を阻害する容器に 10 mL 滅菌完了アストロ サイト細胞培養培地 (ABM +) を追加します。滅菌血清ピペットを使用すると、滅菌 15 mL チューブに容器から剥離細胞を転送します。250 メーカで 3 分の細胞懸濁液を遠心分離 (加速度: 9 メーカ/秒、減速: 5 メーカ/s) 室温 (RT) で。
- 一方、挿入 (材料の表を参照) を準備: 滅菌鉗子を使用して、滅菌 6 ウェル プレート (図 1 b) の蓋の脳側 (図 1 a) を挿入を配置。あらかじめプレートは挿入には接触または処理中に挿入を移動しなくても逆さま配置することを確認します。
注:挿入の適切な配置によって、膜と井戸の底アストロ サイトのサスペンションのわなに掛ける事の間できます。 - 細胞懸濁液; から上澄みを慎重に廃棄、遠心分離後アストロ サイトのペレットを再懸濁します優しくチューブ'にペレットを再で ABM + 1 ml s 壁まで 5 倍。細胞にストレスを制限する細胞の過剰なピペッティングを避けてください。セルをカウントし、1.5 倍の ABM の 400 μ L で 10 の5細胞に細胞懸濁液密度を調整 + 挿入します。
- 挿入'の脳側の真ん中に細胞懸濁液を置く s 膜 (図 1 b) と、非常に慎重に滅菌ピペット先端部にキャピラリー力を使用して、それを広めます。膜は特に壊れやすいので、直接接触を避けます。
- まだ挿入の脳側まで、ドライブベイ カバー背面 6 ウェル プレートを置きます。これは井戸 (図 1) の実際の底と膜間細胞懸濁液がトラップされたことを保証します。それはアストロ サイト細胞膜上の均一な拡散を防ぐ細胞懸濁液、空気の泡を避けてください。
- インキュベーターに上プレートとインサートで、脳側に置きます (37 °C 5 %co2) (人間プライマリ アストロ サイト) 2 h (マウスアストロ不死化) と最大 6 h 以上の細胞接着を許可します。
注:挿入は逆さまに維持される、細胞粘着の視覚化を顕微鏡下でことすることはできません。したがっては、セルごとに通常の培養器をシードし、時間の経過とともに血管内細胞接着を制御する勧めします。膜の操作は、膜が破損している場合結果は信頼性の高いする必要があります注意してください。 - インキュベーション時間の最後に、シード圏外細胞懸濁液漏れの有無を確認、水漏れしている場合、挿入を破棄します。6 ウェル プレートが血液側 (図 1 a) を挿入して、正規の位置に戻します。各ウェルに ABM + 2.6 mL を追加します。各挿入に完全なアストロ サイト媒体の 2.5 mL を注ぎ、インキュベーターにプレートを置き (37 °C 5 %co2)。
- 血管内皮細胞の調製
注:マウスの脳微小血管内皮細胞 (bEND3)、セル最大細胞間の接触実験の日に最適なタイト結合蛋白の発現をトリガーできるように 100% 合流点に到達する必要があります。これはアストロ サイトの存在は、これらのセルのタイト結合蛋白発現に必要なひと臍帯静脈血管内皮細胞 (HuAR2T) の適用はされません。- (手順 1.1.1 と 1.1.2) アストロ サイトの前述のように進みます。上澄みを慎重に廃棄後、遠心分離内皮細胞ペレットを再懸濁します'チューブに細胞懸濁液をゆっくりとピペッティングによる (EBM +) 完全な血管内皮細胞を培養するための培地 1 ml s 壁まで 5 倍。細胞にストレスを制限する細胞の過剰なピペッティングを避けてください。セルをカウント、2.5 mL の 2 × 105セルに細胞懸濁液の密度を調整/血清 (EBM-) と血管内皮増殖因子を欠いている内皮細胞培地の挿入-(VEGF A)。
- 挿入を含むプレートを取り出し、慎重に血液側から媒体を廃棄し、内皮細胞懸濁液 2.5 mL を置き換えます。インキュベーターにプレートを返す (37 °C 5 %co2) 血管内皮細胞膜に付着するため一晩おきます。
- 次の日は、prewarmed 無血清アストロ サイト媒体 (ABM-) の 3 mL を各ウェルに転送することによって滅菌 6 ウェル プレートを準備します。滅菌ピンセットで挿入を処理することによりには、慎重に血液側から内皮細胞の完全な媒体を廃棄、ABM-を含む新しいプレートに挿入を配置し、EBM の 2.5 mL を追加します。
注:EBM の使用は内皮の障壁を確立するための重要な (ディスカッション セクションを参照してください)。 - インキュベーターの挿入のまま (37 °C 5 %co2) 最小限の物理的な障害と血管内皮の基底膜の生産を許可する 5 日間の温度変化とアストロ サイトの連絡先血管内皮細胞と、最終的には、BBTB 模倣形成。神経膠腫細胞の培養上の転送の日に媒体を交換 (セクション 1.4 を参照してください)。
- (省略可能) BBTB 模倣透磁率測定
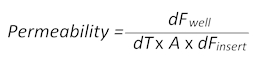
- 挿入の脳側に血液中から時間をかけて小分子蛍光色素フルオレセイン (Na フロリダ州) の受動の拡散は、次の数式によると透磁率の値の計算を使用できます。
ここでは、特定セル培蛍光値を引いた時点で井戸で測定された蛍光値をdFもは、 dTは秒単位で時間、平方センチメートルとの障壁の表面は、dFを挿入中の蛍光値を引いた同じ時点で挿入単位蛍光値)。 - 血と BBTB 模倣の脳側の両方から媒体の 100 μ L を収集し、その後蛍光測定用別平底、黒 96 ウェルのプレートにそれらのそれぞれを転送します。空白として普通のメディアを使用して、自発蛍光を修正します。
- Na フロリダ州の井戸あたり 2.5 mL を準備 (50 μ M) における EBM-。37 ° C への Na フロリダ解決策を prewarm します。挿入の血液側からメディアを含む Na フロリダ州開始タイマー培地を交換するとすぐにメディアに置き換えます。
- 慎重に血と 5、30、60 での挿入の脳側の両方からメディアの 100 μ L を収集し、120 分は黒 96 ウェル プレートの井戸を分離する各サンプルを転送します。
- したがって、双方のボリューム バランスを維持するために挿入から収集されたメディアを交換します。温度の変化を最小限に抑えるための各サンプル コレクションのインキュベーターにインサートを配置します。
- 480/560 の設定フィルター プレート リーダーを使用して、収集されたサンプルからの蛍光性を定量化する nm (励起と放射、それぞれ)。
注:脳側から蛍光がほぼ 5 分時点で検出です。ブランクと比較して高い値のリークを示す/挿入'にダメージを与える s 膜または障壁;したがって、これらのさらなる解析から除外します。10-5 10-6 cm/s 範囲 (表 1) で、BBTB の予想される Na フロリダ透磁率の値をはずです。
- 挿入の脳側に血液中から時間をかけて小分子蛍光色素フルオレセイン (Na フロリダ州) の受動の拡散は、次の数式によると透磁率の値の計算を使用できます。
- 神経膠腫細胞の調製
注:膠芽腫の患者由来の球はここで使われますが、次のプロトコルが付着、市販膠芽腫細胞 U-87 MG など簡単に合わせることができます。- 必要に応じて、蛍光イメージングのために最大 4 つのラウンドの滅菌ホウケイ酸 coverslips に配置 (ø 0.9 cm) 2 mL ポリ-D-リジン (0.01%) を含む 6 ウェル プレートのウェルあたり。30 分間室温でインキュベートします。
- 一方、慎重に腫瘍球細胞培養容器からに転送滅菌血清ピペットを使用して 15 mL 滅菌チューブ。250 メーカで 3 分間腫瘍球を遠心します。
- 上澄みを廃棄、優しく bFGF 空き EGF (GBM-) 神経膠腫細胞培地 1 mL で球を再懸濁します、セルをカウントします。約 104球/ml (105セル/mL) に糸球体基底膜 - 細胞密度を調整します。
- 井戸からポリ-D-リジンを破棄し、洗浄し滅菌 PBS の 3 倍。シード 3 ml/腫瘍回転楕円体懸濁液のプレート、腫瘍細胞懸濁液上 BBB 模倣と挿入。
- 一晩インキュベート (37 °C 5 %co2) アッセイの腫瘍側血液と脳との間の平衡を許可します。次の日に EBM - 興味の分子/薬/粒子を添加した血液側でメディアを置き換えます。サンプルは、前のセクションで説明したように直接定量化のため時間をかけて収集されます。細胞の蛍光イメージングのための正確な時点で修正される (セクション 2.1 と 2.2 を参照してください)。
2. 高分解能共焦点イメージング、BBTB
注: 4% パラホルムアルデヒド (PFA、pH 7.4 BBTB あたり 6 mL) 常に PBS で新鮮な準備です。氷の上におきます。
注意:PFA は、発がん性があります。PFA を処理し、化学の発煙のフードの下で溶液を調製するニトリル手袋を使用します。
-
BBTB 内皮タイト結合タンパク質発現
- 氷冷 PBS で膜の両側をリンス (3 x 5 分、2.5 mL の挿入、3 mL/よく)。PBS を破棄し、3 mL と氷の 4% の 2.5 mL を追加 PFA 井戸と挿入、それぞれ。10 分破棄、PFA の氷の上を孵化させなさい (機関'によると s 有害化学処分) と RT (2.5 mL/挿入、3 mL/ウェル) に PBS で 3 x をすすいでください。
注:一度固定、サンプルに格納できる PBS (2.5 mL/挿入、3 mL/ウェル) 4 °C で 1 週間。 - 綿棒を使用して、挿入の脳側を一掃し、アストロ サイトを削除します。鋭いメスを使用して、膜の十字 2 つの垂直カットすることによって慎重に 4 等分に切り。次に、挿入の壁に膜がアタッチされている時点でメスを挿入し、4 つのサンプルを解放するためにもう一方の手で挿入を回転させます。高級ピンセットを使用して、慎重に PBS/まあ、各井戸を血液側に 200 μ L を含む 24 ウェル プレートに各サンプルを転送します。
- 10% 牛胎児血清の PBS (常温、200 μ L/ウェル分) のための膜をブロックします。タイト結合免疫染色蛋白質 (図 1) の 1°抗体溶液を準備 (精巣毛細血管-1、クローディン-5;材料の表を参照してください) ソリューション/ウェルをブロックの 200 μ L で。必要に応じて、内皮細胞の識別、各タイト結合抗体溶液に血小板内皮細胞接着分子 (PECAM1 または CD31;材料の表を参照してください)、抗体を追加することによって検証されます。ブロッキング液を捨て、一次抗体' O/N 4 °c. で孵化させなさい
- 次の日に一次抗体を破棄し、200 μ L の PBS で洗浄し (常温 5 分の 3 倍)。適切な種特異的蛍光標識二次抗体とそれらを孵化させなさい (1: 500 希釈 200 μ L/ウェルがブロッキング液で希釈した;材料の表を参照してください 2 時間室温
- 二次抗体を破棄、200 μ L の PBS で洗い (常温 5 分の 3 倍)。PBS を取り外して、4', 6-diamidino-2-phenylindole (DAPI) 溶液 1 μg/mL の純粋な蒸留水 H2O (dH2O; 200 μ L/ウェル;材料の表を参照してください最終的な集中を使用して細胞核を counterstain).DAPI ルート削除で 7 分間インキュベートし、洗って膜 3 dH2O と x (200 μ L/ウェル)。
- メディアをマウント一滴を配置 (材料表参照) ガラス顕微鏡スライドの上。高級ピンセットを使用して、慎重に膜を取り出すだけでなくと向きを維持し、dH2O の過剰を削除メディアをマウントの上に置きます。膜上にメディアをマウントの別のドロップを追加し、慎重にカバー ガラスとそれをカバーします。内包された空気の泡がないことを確認します。共焦点顕微鏡観察まで 4 °C におよび光源から離れた側のサンプルを格納します。
注:アストロ サイト染色 24 ウェル プレート、脳側と選択したアストロ サイト特異的抗体の使用の膜の部分を配置することによって実行できます (例えば、グリア線維性酸性蛋白質 [GFAP] に対して監督) (図 1E).
- 氷冷 PBS で膜の両側をリンス (3 x 5 分、2.5 mL の挿入、3 mL/よく)。PBS を破棄し、3 mL と氷の 4% の 2.5 mL を追加 PFA 井戸と挿入、それぞれ。10 分破棄、PFA の氷の上を孵化させなさい (機関'によると s 有害化学処分) と RT (2.5 mL/挿入、3 mL/ウェル) に PBS で 3 x をすすいでください。
-
BBTB 蛍光ナノ粒子トランスサイトーシスを検出する染色
- 生細胞リソソームのラベリングを行う (例えば、蛍光プローブの使用 [材料表を参照])。50 の作業濃度でリソソーム蛍光染料を薄める nM prewarmed EBM - (2.5 mL/挿入) または ABM prewarmed-75 mm (3 mL/ウェル) リソソームのそれぞれの血管内皮細胞とアストロ サイト、ラベリングします。45 分のセルを孵化させなさい (37 °C 5 %co2);その後、氷冷 PBS (2.5 mL/挿入、3 mL/ウェル) と 3 x をすすいでください。
- PBS を破棄し、3 mL と氷の 4% の 2.5 mL を追加 PFA 井戸と挿入、それぞれ。氷上で 10 分間破棄 PFA を孵化させなさいし、リンスの細胞 3 x ((RT)、2.5 mL/挿入、3 mL/ウェル) PBS の。
注:一度固定、サンプルに格納できる PBS (2.5 mL/挿入、3 mL/ウェル) 4 ° C で 1 週間。 - PBS を削除し、dH2O に 1 μ g/mL (1 mL/挿入、1 mL/ウェル) の最終濃度の DAPI 溶液を使用して細胞核を counterstain します。ルート削除で 7 分間、DAPI を孵化させなさい、洗って膜 3 dH2O (2.5 mL/挿入、3 mL/ウェル) と x。
- 慎重に膜を切り取り、dH2O の過剰を削除およびメディアをマウントの上に置きます (材料表参照) ガラス顕微鏡スライドの上。膜の反対側に取り付け中の別のドロップを追加し、慎重にカバー ガラスとそれをカバーします。内包された空気の泡を避けるため。4 °C でサンプルを格納し、それらを共焦点顕微鏡観察までの光から保護維持します。
-
腫瘍細胞の蛍光染色
- 高級ピンセットを使用して、慎重に氷冷 PBS でいっぱい 24 ウェル プレートに腫瘍の球を含むラウンド coverslips を転送します。生細胞リソソーム 75 蛍光リソソーム プローブを使用したラベリングを続行 prewarmed GBM の nM (200 μ L/ウェル)。45 分; サンプルをインキュベートします。洗浄し、氷冷 PBS の 3 倍 (200 μ L/ウェル)。
- PBS を破棄し、200 μ L/ウェル冷たい PFA を追加します。10 分破棄、PFA の氷の上を孵化し、リンス サンプル 3 (常温) PBS の x。
注:サンプルを PBS で格納できる固定、一度 (200 μ L) 週 4 ° C で。 - PBS を削除し、dH2O で 1 μ G/ml の最終的な集中に DAPI 溶液を使用して細胞核を counterstain (200 μ L/ウェル)。ルート削除で 7 分間、DAPI を孵化させなさい、洗って coverslips 3 dH2O と x (200 μ L/ウェル)。
- 高級ピンセットを使用して、coverslip を取る、dH2O の過剰を削除、メディアをマウントの上に置きます (材料の表を参照してください) ガラス顕微鏡スライドの上。空気の泡を封入しないでください。4 °C でサンプルを格納し、それらを共焦点顕微鏡観察までの光から保護維持します。
3. 生体内のの比較研究
- BBB を通じてナトリウム フルオレセイン拡散の原記録
- 生理学的なソリューションの 50 nM Na フロリダ ソリューションの 150 μ L を準備します。37 °C 点滴配信時にソリューションをしてください。
- ケタミン ・ キシラジン カクテル (PBS で、100 mg/kg 10 mg/kg とケタミン キシラジンの 300 μ L) の腹腔内注入マウスを麻酔します。深い麻酔が確立されると、その体温を維持するために加熱パッドに動物を配置します。
注:10 週齢雌の海軍医学研究所 (技研) 裸免疫不全マウスは、図 2で示したデータを取得に使用されています。しかし、このプロトコルは免疫と免疫不全マウスに適応です。麻酔・鎮痛法は、'科学裁量。ただし、BBB 透過性18が大幅に増えると、イソフルランなどの吸入麻酔はお勧めしません。 - 脳定位固定装置のフレーム上にマウスを置く (材料の表を参照してください) 高級ハサミ頭蓋骨を明らかにする高級ピンセットを使用して、結合組織の穏やかな dilacerations 続いて頭皮の縦切開を行い。微細ドリルで円形の動きを使用して、左または右頭頂骨から頭蓋骨の ø の 0.3 mm の円形の部分を削除します。掘削中に、基になる硬膜組織や血管の傷害を回避する頭蓋骨部分を除去しながら慎重に進みます。
- 公開される組織の生理的溶液の一滴を配置します。微細鉗子の 2 つのペアを使用して、大脳皮質にアクセスする硬膜組織を慎重に取り外します。脳組織は、空気と直接接触してはいけません。
注:硬膜の損傷からマイナーな出血を停止するには、血液のスポンジ (材料の表を参照してください)。 - 一度硬膜組織が削除され、大脳皮質は完全にさらされる、皮質と ø 0.5 mm ホウケイ酸 coverslip の生理的溶液のドロップをわなに掛けます。シアノアクリ レート系接着剤のドロップで観察領域を確保 (材料の表を参照してください)、針、coverslip の周りに 。聞かせて 1 分乾燥接着剤。
- 埋込型カテーテルを尾静脈注射 (図 2 a) に備えます。ロチェスター オクスナー鉗子を使用して 25 G 針の先端を打破し、10 cm ロング PE20 ポリウレタン チューブの先端を挿入 (材料の表を参照してください) (図 2 a)。
- カテーテル操作と挿入のためブルドッグ クランプを使って、マウスの外側尾静脈にカテーテルを挿入 (材料の表を参照してください) (図 2 b)。シアノアクリ レート系接着剤のドロップで挿入した針を固定します。みましょう 20 乾燥接着剤ブルドッグ クランプを取り外す前に s。慎重に Na フロリダ ソリューション (図 2 b) が含まれている注射器に接続されている 25 G 針にカテーテルのもう一方の端を接続します。
- 注:ブルドッグ クランプ; と尾を固定しないでカテーテルの正確な処理のための使用だけです。適切なカテーテル挿入は、透明なチューブに血液逆流現象によって確認できます。
- 個人差の下で動物を配置 (材料の表を参照してください)。緑のチャネルで低レベルの自発蛍光を使用して (480 nm)、比較的大きい血管 (彼らはこの波長で光のヘモグロビンの吸収のため暗く見える) と小さい毛細血管 (図 2) を含む領域に焦点を当てます。背景の蛍光性の測定値を得るに蛍光色素を注入する前に簡潔にコマ撮りの集録を開始します。
注:または、コマ撮り録画 T0 からスナップショットの画像で置き換えることができ、他から所定の時間ポイント。 - ゆっくりと継続的なペースで溶液を注入または自動注入システムを使用する代わりに、します。Na フロリダ州蛍光の血液中に検出する必要があります安定 (血中半減期: 286 分)、数分頭蓋窓から BBB 拡散の記録が可能します。買収が完了する、慎重にカテーテルを削除、頚部転位によって、動物を安楽死させます。
- BBB 透過性の体内
注:利益 (率 ROI) のカスタム領域内の蛍光信号強度の測定を許可する ImageJ などの画像処理ソフトウェアから値を取得します。- 脳組織で、血管の外に投資収益率を四角形を描画注釈ツールを使用して、約 5 μ m で、目に見える血管からの距離は Na フロリダ州メモでいっぱい投資収益率とその ROI の T0 で測定された蛍光強度の寸法を'組織の空白として使用される s 蛍光。投資収益率をずらすことがなく早送り注射後時間を指す (例えば、ソリューション全体が動物に注入されたときの最後の非常に記録されたフレーム) と投資収益率 (図 2) で測定した正確な時間と蛍光の値に注意してください。
- 目に見える血管 (図 2) に投資収益率を移動し、血液から T0 蛍光値に注意してください。投資収益率をずらすことがなく 3.2.1 のステップで定義されている同じ時間ポイントに早送りします。蛍光値を測定 ROI (図 2) に注意してください。
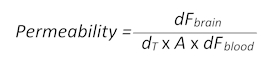
- BBB 透過性を決定する (セクション 1.3 から適応) 次の数式を使用します。
- ここでdF脳は脳内 T0 空白値を引いた蛍光強度値、 dTは秒で集録時間ポイント、A は平方センチメートルとの ROI 領域としておおよそ容器表面積 dF血血で T0 空白値を引いた蛍光強度の値です。
注: BBB の予想される透過性値 10-6 cm/s の範囲 (表 1) にする必要があります。
- マウス脳における蛍光ナノ粒子の検出のために処理するティッシュ
- 麻酔 6 週齢女性当所ヌードマウスにおける脳梁の膠芽腫の患者由来の球 (5 × 104 5 μ L の滅菌 PBS セル) をインプラントします。前から始まって次の定位座標でこの脳領域検出: 前後 + 0.5 mm、左右に 2.5 mm、イエコウモリ + 3 mm. こと 2 週間成長する脳腫瘍。
- ナノ粒子を静脈内注入 (滅菌生理溶液を 100 μ l 添加の 100 μ g) 8 h. 注入コントロール マウス静脈内の滅菌生理溶液 100 μ L を循環するようにし、。
- 頚部転位によってマウスを安楽死させるし、ドライアイス (-50 °C 1 分) で保持されるイソペンタンでスナップ凍結用急速に脳を収集します。ティッシュの処理まで-80 °C で脳を格納します。
- Cryomicrotome とコロナの脳のセクションをカットします。傷跡それは皮質に形成され、(材料表参照) 適切な顕微鏡スライド上にその地域から 9 μ m 厚のセクションをカットして頭蓋内注入を見つけます。
- 氷冷 PBS のスライドに固定されている脳のセクションを浸す (5 分の 2 倍) と、冷えた 4% でそれらを修正し、PFA (5 分) のため。PBS でスライドを洗う (常温 5 分の 3 倍)。水平方向にスライドを配置し、ピペット、ブロッキング ソリューション含む 10% 牛胎児血清 PBS で組織のセクション (常温、500 μ L/スライド 1 h) の全体の表面を覆います。CD31 抗体を準備 (材料の表を参照してください) ソリューション/スライド ブロックの 250 μ L で。抗体とブロッキング液を交換し、4 °C 加湿チャンバー内で一晩インキュベートします。
- 次の日、PBS でスライドを浸す (常温 5 分 3 x)、対応する蛍光標識二次抗体 (RT で 2 h の 250 μ L の PBS で 1: 500) とそれらを孵化させなさいと。(常温) PBS で 3 x を洗浄し、dH2O で 1 μ G/ml の最終的な集中に DAPI 溶液を使用して細胞核を counterstain (250 μ L/スライド)。削除した DAPI ソリューションで 7 分間サンプルをインキュベートし、スライド 3 を洗って dH2o ・ x
- 各組織切片の封入剤 1 滴を追加 (材料の表を参照してください)、観察試料を固定します。空気の泡を封入しないでください。4 °C でサンプルを格納し、それらを共焦点顕微鏡観察までの光から保護維持します。
結果
マウス BBTB 模倣の共焦点レーザー顕微鏡は、bEND3 の表現とタイト結合蛋白質精巣毛細血管 1 (ZO-1) とクローディン 5 の細胞局在を示しています。血管内皮細胞とアストロ サイトの連絡先は明確に zo-1 とクローディン-5 bEND3 モノカルチャー (図 1) と比較して血管内皮細胞間の連絡先に移転を誘発しました。蛍光抗体染色膜の脳側に gfap アストロ サイトを使用して、それは観察し、星状膠細胞と終わり足の膜 (図 1E を介して血管内皮細胞に連絡することが可能).アストロ サイト内皮細胞の接触を促進し、細胞壁の締め付けを安定させるために知られているし、BBB19の低い透磁率の値に関連付けられています。締め切り 6.74 (± 3.01) × 10-6 cm/s に × 10-6 cm/s モノカルチャーの場合 (± 3.45) 27.63 から Na Fl のマウス BBTB 模倣の透磁率の相当な減少を見ました、それに従って時低酸素誘導と共培養要因ノックアウト (HIFko) アストロ (表 1)。不死化 HuAR2T は、浸透性の高い細胞障壁 (104.92 ± 27.1 x 10-6 cm s,表 1) を形成します。マウスのモデルと同様に、測定した Na フロリダ州に 47.4 (± 14.32) × 10-6 cm/s、すなわち BBTB の有意に低い透磁率 HuAR2T 細胞が人間のプライマリ アストロ サイト (表 1) との共培養いた。
マウスと人間の両方の BBTB 模倣膠芽腫の患者由来の球の存在は単独で血管内皮細胞・ グリア共培養に比べて透磁率の値 (表 1) のわずかな増加を誘導しました。いくつかのこのような現象が観察されるが、患者の神経膠腫全球モデル。これらの患者さん由来の細胞によって分泌される VEGF の可能性があります。
生体内で BBB に体外 BBTB mimics の透磁率の値を比較するには、は、ヌードマウスに移植頭蓋窓から Na フロリダのリアルタイムの拡散をイメージしました。蛍光実体顕微鏡を使用すると、メインの軟膜血管から派生する血管毛細血管から Na フロリダ拡散はプローブ (図 2) の全身投与中に、前後を記録しました。時間をかけて循環血液と脳皮質実質微分蛍光値の測定は、'の裸のマウスのおおよその透磁率の値を計算することができました BBB Na フロリダ (5.57 ± 2.19 x 10-6 cm/s, s表 1)。
脳側から血液側に化合物の通路の可視化のためのこの BBTB 模倣の使用方法を説明するために、ø 110 nm (NP110) と ø 350 nm (NP350) ナノ粒子ターゲット神経膠芽腫患者由来球のトランスサイトーシスを比較しました。結果体外体内トランスサイトーシスと比較されたし。提示の例では、ナノ粒子は腫瘍標的化ペプチド小屋20表面コーティングをされ、蛍光色素の可視化を容易にする (FITC) を読み込まれました。標識細胞リソソームの染料を使用して行い、BBTB の血液側に FITC ナノ粒子添加を模倣し、さまざまなレベル (例えば、血液側膜、脳側で共焦点顕微鏡を取得後、DAPI 24 h counterstained膠芽腫患者球) (図 3 a)。内皮細胞、アストロ サイト、および腫瘍細胞のリソソームと,、NP110 関連の蛍光信号。さらに、NP110s が検出された間血管内皮細胞とアストロ サイト、挿入 (図 3 a) の膜の細孔を通過します。
NP110s の通路の血液と脳の両方の側から採取した試料からの蛍光を測定することによって定量化を行った。これらの透磁率の値それらのナノ粒子の決定と比較した ø 350 nm (NP350)。結果を示します (図 3 b) BBTB mimics を横断する NP110 だけができた。NP350 は、これらのナノ粒子が低透磁率値につながった BBTB 模倣の血液側に残った。
体内のモデルに比べて BBTB mimics の関連性を強調するには、裸のマウス静脈内腫瘍標的化ペプチド小屋でコーティングし、検出のための赤色蛍光色素 (TRITC) を有する共役 NP110 または NP350 のナノ粒子を注入しました。いくつかの時点で採取された組織は、8 h 後に BBB 透過性ナノ粒子が循環にとどまったものがオフに体内循環された主に nonpermeable ながら、脳実質にバリウムしたことを明らかにしました。したがって、脳を収集し、ナノ粒子毎平方ミリメートル 8 h これらの数を定量化.試験管内の発見、NP110、しかしない NP350、に従って正常に脳実質 (図 3) にバリウムしました。脳でナノ粒子の位置の高倍率画像を示した NP110 が毛細血管外脳実質内に均一に分散され、正常に注入された膠芽腫細胞 (図 3 D) に所属します。同じ腫瘍部位 (小屋) をターゲットを展示にもかかわらず NP350 は脳実質に extravasate ことができませんでしたし、脳血管 (図 3E) の in vitro.を得られた結果と同様の内腔側内でのみ検出されました
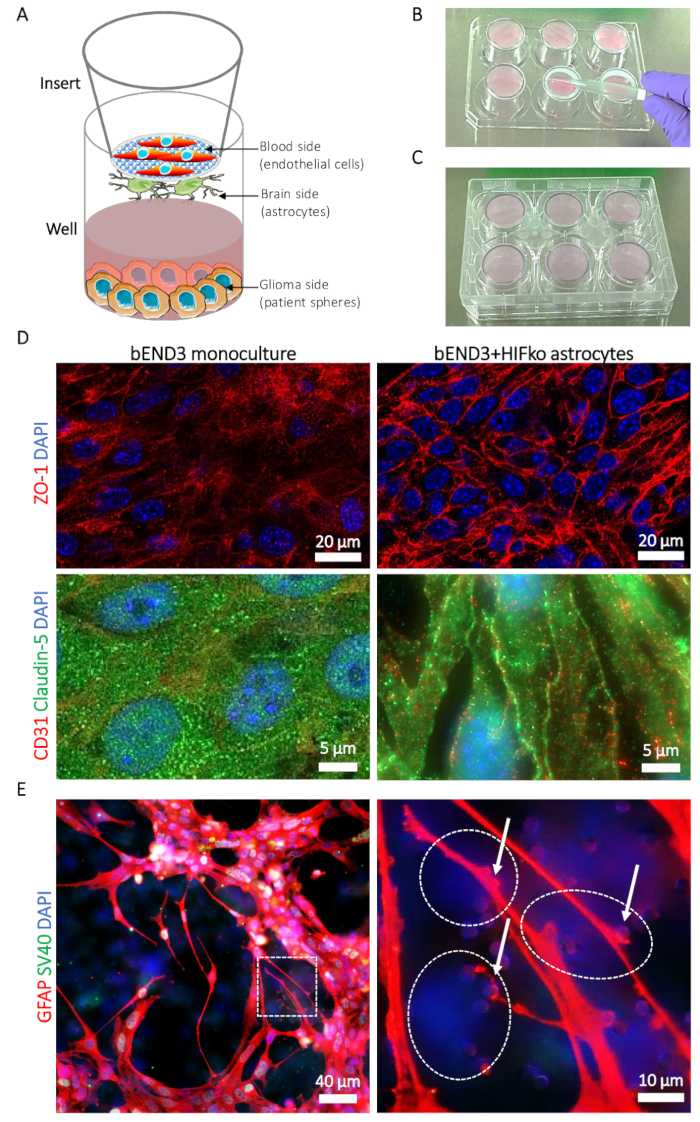
図 1: 血液脳腫瘍の壁 (BBTB) モデルの説明です。(A) 異なる種類の細胞の場所の略図。(B) 図 6 ウェル プレート カバーと挿入'の脳側にアストロ サイトの播種技術挿入位置の s の膜。アストロ接着できるように 6 ウェル プレート配置の (C) 図。(D) タイト結合蛋白質精巣毛細血管-1 (ZO 1、上行、赤) とクローディン-5 (下段、緑) の蛍光顕微鏡写真。蛋白質の表現は、マウスの脳微小血管内皮細胞 (bEND3) BBTB 単独での血液側にモノカルチャー (左の列) と不死化 HIFko マウスアストロ (右列) と比較されます。細胞核は、DAPI (青) と counterstained です。(E) HIFko アストロ サイト、BBTB 脳側培養グリア線維性酸性蛋白 (GFAP、赤) を示す蛍光顕微鏡像。高倍率画像がアストロ サイトのプロセスを示しています、終わりフィート (矢印) 内皮細胞膜を通しての連絡孔 (右側のパネル)。HIFko アストロ サイトの id は、シミアン ウイルス 40 大きい T の抗原 (SV40 大きい T、緑) 細胞の不死化用の免疫蛍光染色により確認しました。血管内皮細胞は、GFAP も SV40 大きい T を表現し、したがって、部分的に観察できる透明な DAPI だけ陽性細胞 (破線) として膜の反対側から。細胞核は、DAPI (青) と counterstained です。この図の拡大版を表示するのにはここをクリックしてください。
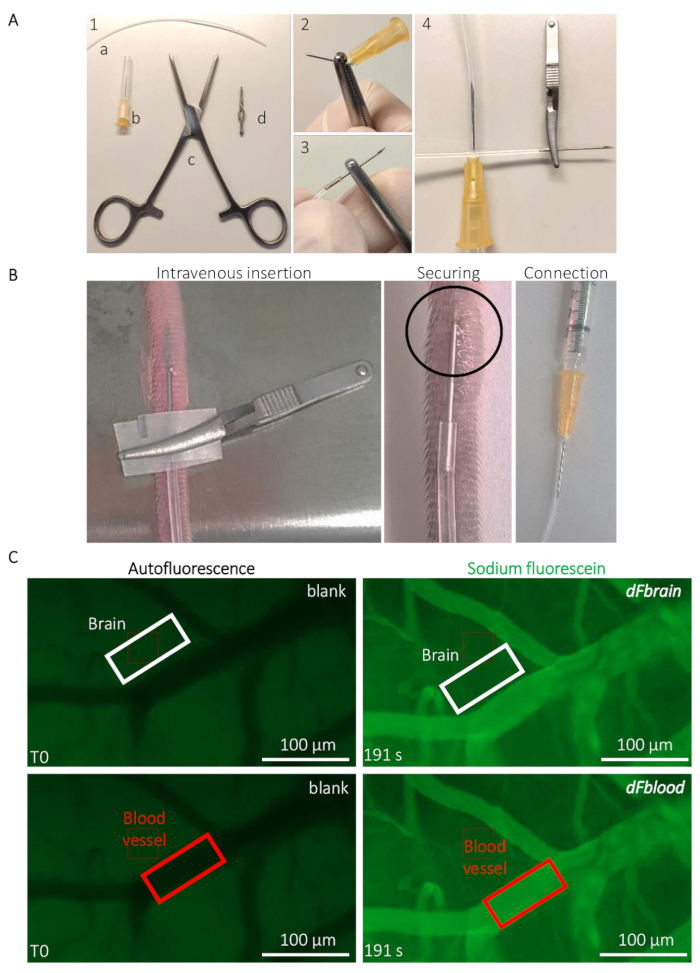
図 2:マウス BBB 透過性の生体ライブ決定します。(A) 埋込型の尾静脈カテーテルの準備。(1) ツールと機器が次: (、)、PE20 ポリエチレン管 (b) 2 つの 25 G 針 (c) ロチェスター オクスナー鉗子、および (d) 小さいブルドッグ クランプ。(2) A 25 G 針は、いくつかのねじりによって削除されるチューブ挿入鉗子 (3) を慎重に使用します。(4) チューブの反対側は、別の 25 G 針に接続されます。カテーテル注入と位置決めに関するガイダンスをマウスの尾静脈を介してナトリウム フルオレセイン ソリューションを注入する (B)。丸で囲んだ領域は、カテーテルを保護するシアノアクリ レート系接着剤のドロップを配置する場所の領域を示します。ブルドッグ クランプはカテーテルを処理するために使用、カテーテルを確保したらを削除します。フルオレセイン ナトリウムの透磁率の値を決定する代表的なイメージングと定量メソッドを (C)。フルオレセイン ナトリウム注入 (左列) 前、脳 (上部パネル、白い四角形) および血管領域 (底パネル、赤四角形) に置かれる利益 (率 ROI) の領域内蛍光/ブランクを測定します。(右列) [ナトリウム フルオレセイン液注入時に蛍光強度は BBB 透過性の計算を許可する両方の Roi で測定されます。この図の拡大版を表示するのにはここをクリックしてください。
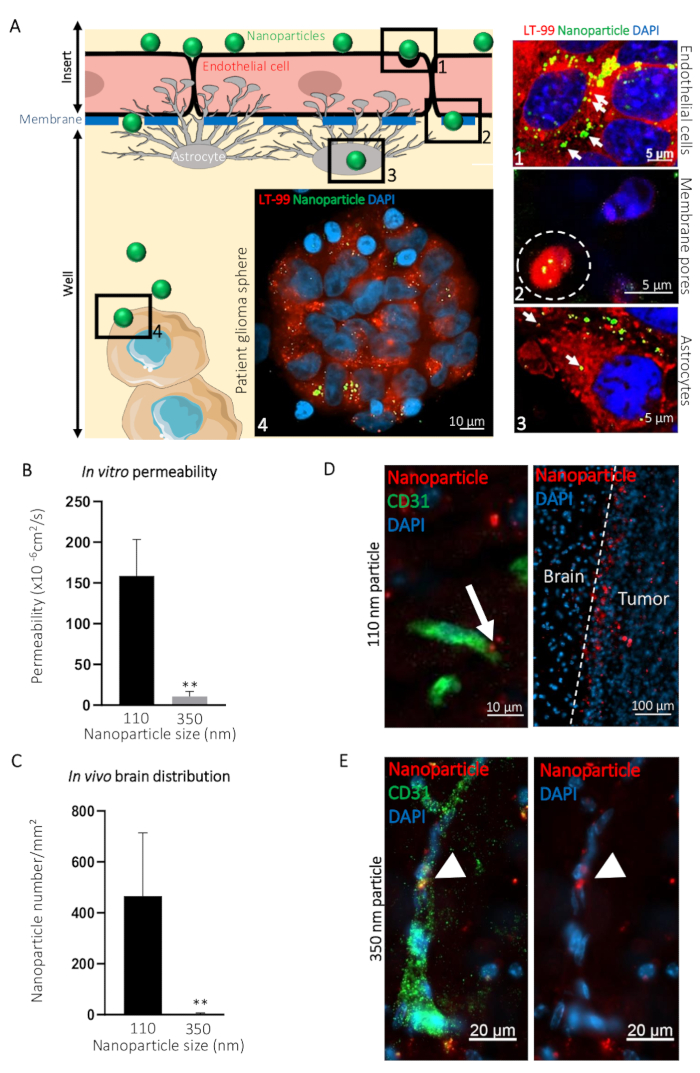
図 3: BBB in vitro BBTB モデルによる in vivo でのナノ粒子の脳内トランスサイトーシスの予測します。(A) BBTB マウスモデルの示されたさまざまなレベルで得られた代表的な共焦点画像を BBTB アッセイのグラフィック表現。110 のナノ粒子径 (NP110) で nm と FITC (緑) に共役追加されたライソゾーム プローブ (LT-99、赤) で標識された BBTB 細胞の側血液に。 (1) 内皮細胞、内皮 (2) (白破線)、(3) アストロ サイトの膜の細孔を通してナノ粒子のトランスサイトーシスとグラフィックの識別 (4) 患者膠芽球と対応する共焦点顕微鏡 (右)。ナノ粒子 (矢印) のライソゾーム封入、BBTB の内皮細胞とアストロ サイトのレイヤーを通してアクティブ トランスサイトーシスを示唆しています。指定されたナノ粒子の透過 BBTB 体外の (B) の定量化 (n = 6)。脳組織で示されたナノ粒子密度の (C) 数量セクション、裸のマウスの尾静脈投与後 8 h (n = 3)。マウス脳切片で、ø の分布 110 nm ナノ粒子 (NP110、赤) を示す (D) 共焦点顕微鏡は、抗マウス CD31 抗体 (緑) が付いています。矢印は、ナノ粒子トランスサイトーシス (左側のパネル) を強調表示します。ナノ粒子を表面に提示、小屋を対象としたペプチドにより脳の腫瘍細胞 (腫瘍, 右のパネル) のまわりで集まります。脳 (脳) で観察される重要なホーミングはないです。(E) 共焦点顕微鏡は、抗マウス CD31 抗体 (緑) の付いたマウス脳切片の 350 nm のナノ粒子 (NP350、赤)、ø の分布を示します。矢印を指して血管内腔で保持された、おそらく NP110s 細胞核と比較して、大きな直径のため、BBB を通過することができませんでした NP350s、DAPI (青) と counterstained。P < 0.01。P-値は両側検定、ノンパラ メトリック マン-ホイットニーの U 検定を算出しました。誤差範囲は、標準偏差を表します。この図の拡大版を表示するのにはここをクリックしてください。
| マウス BBTB ミミック | bEND3 | bEND3 + HIFko | bEND3 + GB | bEND3 + HIFko として + GB | 生体内で |
| 透水性 (10-6 cm/s) | 27.63 | 締め切り 6.74 | 26.8 | 10.83 | 5.57 |
| SD (10-6 cm/s) | 3.45 | 3.01 | 7.99 | 2.65 | 2.19 |
| 人間 BBTB ミミック | HuAR2T | HuAR2T + ハイアス | HuAR2T + GB | HuAR2T + ハイアス + GB | |
| 透水性 (10-6 cm/s) | 104.92 | 47.4 | 89.08 | 48.24 | |
| SD (10-6 cm/s) | 27.1 | 14.32 | 10.21 | 13.07 |
表 1: 値の in vitro 決定 (秒速センチメートル) のフルオレセイン (Na フロリダ州) 透水性指定された共培養システムおよび in vivo海技研ヌードマウスで。代表的な実験からのデータ (n = 3 のマウス)。
ディスカッション
抗腫瘍の可変性の概念の台頭は、パーソナライズされたがん医学21の研究を活性化。この変動は、また中枢神経系腫瘍の特徴です。腫瘍の予測のため化学療法への応答はドラッグデリバリー、BBB の遮蔽を追加し、全体で患者のケアの22の主要な挑戦を構成します。効果的な治療法を開発するために、新しい分子の画面サイズの大きなライブラリする必要は多くの場合です。抗腫瘍効果と腫瘍の部位に到達するための新しい治療上の鉛の能力を評価するには、最良の選択肢は、患者アバターをマウス体内注入患者由来細胞の臨床研究です。実用的な (金融、時間、人間、および施設資源) や倫理的な理由 (3 r 原則実験動物を使用する場合)、このような大規模な in vivo スクリーニング プラットフォームの開発は頻繁にしない、可能なしたがって、細胞に基づく試金選択23のモデルのままです。選択の主な理由の確立し、再現性を容易にし、分離とマウス初代培養の確立のための主な源である実験動物の使用を減らすには一次電池を回避します。ここでは、提示方法は効率的に、さらに臨床調査からクリテリウムのクロス モデル BBTB 彼らの無力のナノ粒子を破棄できるのでしっかりと 3 r の遵守。証拠-の-原則として、我々 は開発と、BBTB の検証時に得られた知見をここでについて説明します。376 Da のフルオレセインの受動的拡散で測定を行う場合に例えばが生体内で生体外で調査結果を確認することができました。
本稿で説明したプロトコルでは、in vitro におけるセットアップの血液脳腫瘍の壁のようなインターフェイスを形成する内皮細胞の遊走とアストロ サイトの準備について説明します。これらの 2 つの細胞型との間の物理的な接触を確立すると、内皮細胞層は BBB (など、セル表面の式タイト結合タンパク質や比較的低透磁率) との類似点を展示します。興味深いことに、マウス BBTB 模倣体内マウス BBB 透過性測定24で特に類似 Na フロリダ透磁率の値を提供するように見えた。したがって、BBTB mimics のパフォーマンスはバリアを形成するために使用するセルの選択に直接リンクされます。BEND3 血管内皮細胞、脳で発生したアストロ サイト25遊走するときの障壁を形成で成功するために知られています。しかし、我々 は BBTB 模倣を生成するのに不死化 HIFko アストロ サイト26を使用しています。低酸素誘導因子の欠如に起因するこれらのアストロ サイトを生成しない、VEGF はここで説明 BBTB 模倣の安定化の典型的な。アストロ サイトは、neuroinflammation27レスポンスの VEGF-A のリリースを介して例えば、BBB 透過性の調節因子として同定されています。血管内皮細胞増殖因子受容体 (VEGFRs) の活性化は内皮/血管透過性体外28と29の体内の両方の重要な調節因子です。したがって、培地での VEGF のサプリメントは、VE カドヘリン30など単結合蛋白質のリン酸化を誘導する血管内皮細胞 VEGFR2 をアクティブにします。内皮細胞間の接触の損失は、浸透性の高い血管を生成します。同様に、強い幼若化プロパティと細胞培養の試金で使用される胎児の牛血清中の未知の組成の両方バリア安定化と測定の再現性に大きな問題が発生します。
ひと臍帯静脈血管内皮細胞 (Huvec) は体外31; BBB を形成する使用されることしかし、彼らの異なる脳微小血管内皮細胞からよう hCMEC/D3 セル行32、遺伝子発現とバリア形成の面でのプロパティ。ただし、単独で成長した HuAR2T 細胞で得られた値が、bEND3 と比較して相対的に高い透磁率は、人間プライマリ アストロ サイトと取込みで大きく減った。細胞壁を形成する内皮細胞が必要ですが、アストロ サイトが BBTB 形成および安定化のためにプレー同様に重要な役割を持っていることは明らかです。
神経膠腫の患者由来の球は、この方程式に追加された、いくつかのマウス異種移植片、脳血管と腫瘍細胞標的薬物拡散などの機能マウス BBTB ミミックが締めくくっています。ここで説明 BBTB 模倣、例えばに成功した体内動作をミラーリングするときに異なる直径を持ついくつかのナノ粒子で仕切った。In vitro および in vivo モデル間の並列性を示すためには、細胞貫通プロパティ34上腫瘍標的化ペプチド小屋に共役前述メソポーラス ケイ酸塩粒子33を使用、surface20。乳腺由来成長阻害剤 (MDGI) への特定のバインディングを介して侵襲性の腫瘍細胞に小屋を対象としたペプチド家。神経膠腫を含む、いくつかのがんは、ペイロード20の配達を高めることができる非常に効率的な腫瘍を対象とした部位を小屋になります正常組織35と比較して MDGI を過剰発現します。ここで使用されるナノ粒子は以前 (27547955)、脳実質内に拡散させる示されているし、修飾とタキソールとき、これらのナノ貨物は前臨床モデル36の神経膠腫の成長を減らすことに成功しています。ポリエチレング リコール (PEG) ナノ粒子の表面残基の付加も正の値に、その静的な電荷を維持 (周り + 4 mV)、神経血管ユニット37との相互運用ができ、また彼らの安定性が向上循環。提示されたデータでペグの 3 kDa は NP350s が PEG の 10 kDa でコーティングした、NP110s に共役だった。しかし、増加-分子量ペグも結果になったナノ粒子の直径で、それゆえの大幅な増加、BBB を交差させる彼らの物理的な機能したがって、我々 は粒子の物理的な寸法が、BBTB の通過を防止するかどうか、かどうかこれらの観察がミラー化も体内をチェックしました。
以前に発行された観察に基づき体外 BBTB と NP350s BBTB ミミックとの血管の内腔側に保持しながらの頭蓋内腫瘍を有するマウスの BBB の両方を通じて NP110s がバリウムしたを見ました、マウス。これらの同じような結果は強く BBTB モデルが BBB を通過し、脳に到達するナノ粒子の生体内での機能を予測することをお勧めします。
BBB の携帯電話モデルの妥当性が頻繁に議論、ナノ粒子38の中央の配信のためにも。紹介、プライマリ アストログリア細胞や内皮細胞、両方が最も関連性の in vitro におけるツールとして考慮される取替えることができる不死化や市販のセルより高いスケーラビリティと再現性を確保します。構造的に実際の BBB12,14のように美しく形成された神経単位、マイクロ流体デバイスを組み込むことによって生体外での BBB mimics の次世代を開発できます。しかし、このようなモデルは現在配信配信14のフォロー アップの技術的な制限により、神経膠腫の分子の高スループット スクリーニングに適してではありません。確かに、皿に BBB の生理学的複雑さをキャプチャすることは困難だし、いくつかの受容体/、知られていた蛋白質、BBB によって表現することの可能性の欠如は、結果の解釈を妥協できます。別の引数にかかわる遺伝子発現特に内皮細胞を考慮して別に 1 つのセルの行からだけでなく、生体内および生体外での条件の間で大きな変動。ただし、単位が脳39内均一エンティティではないことに主張もことができます。生物学の科学的な研究は、動物福祉、倫理的な責任と動物たちの生活を使用してのコストは常に実験を設計する前に見なされ慈悲深い時代を達しています。したがって、動物の交換をサポートするための最近の研究の増加する数を示すモデルの制限事項と障壁を確立する細胞モデルの慎重な選択の意識-アストロ サイトに重点を置いて、保証、結果の間の一致の皿、動物モデル40。ここで説明した方法論とは、スクリーニングの潜在的な治療の BBB トランスサイトーシス目的に使用される実験動物の数を減らすことへの一歩を得る。
開示事項
著者が明らかに何もありません。
謝辞
この研究は、フィンランドの癌組織、ジェーン ・ Aatos Erkko 財団と (パ V.L.J. し) ねんどろいど Juselius 財団、スイスの全米科学財団からの助成金によって支えられた (高度な Postdoc.Mobility 付与なし: P300PB_164732 sK.)、(s. k.) にオリオン研究財団、(に s. k.)、Maud Kuistila 記念財団、フィンランド アカデミー (TERVA、2017 年を付与なし: 314 498)。Biomedicum イメージング ユニット (ヘルシンキ) は、中核施設をイメージング顕微鏡を提供するために認められています。
資料
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
参考文献
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412(2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225(2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, el-S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083(2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017(2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16(2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423(2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119(2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545(2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12(2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved