Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un método de congelación y descongelación para preparar hidrogeles de chitosan-poly (alcohol de vinilo) sin agentes reticulantes y estudios de liberación difluídor
En este artículo
Resumen
El método de congelación y descongelación se utiliza para producir hidrogeles de quitosano-polisino (alcohol de vinilo) sin agentes reticulantes. Para este método, es importante tener en cuenta las condiciones de congelación (temperatura, número de ciclos) y la relación polímero, que pueden afectar a las propiedades y aplicaciones de los hidrogeles obtenidos.
Resumen
Los hidrogeles de chitosan-poli (alcohol de vinilo) se pueden producir mediante el método de congelación de sin necesidad de reticulación. Las aplicaciones de estos sistemas están limitadas por sus características (por ejemplo, porosidad, flexibilidad, capacidad de hinchazón, carga de fármacos y capacidad de liberación de fármacos), que dependen de las condiciones de congelación y del tipo y la proporción de polímeros. Este protocolo describe cómo preparar hidrogeles a partir de quitosano y poli(alcohol de vinilo) a 50/50 p/p % de la composición del polímero y variar la temperatura de congelación (-4 oC, -20 oC, -80 oC) y ciclos de congelación (4, 5, 6 ciclos de congelación). Se obtuvieron espectros FT-IR, micrografía SEM y datos de porosimetría de hidrogeles. Además, se evaluó la capacidad de hinchazón y la carga y liberación de fármacos. Los resultados de las micrografías SEM y la porosimetría muestran que el tamaño de los poros disminuye, mientras que la porosidad aumenta a temperaturas más bajas. El porcentaje de hinchazón fue mayor a la temperatura de congelación menor. Se ha estudiado la liberación de difluunisal de los hidrogeles. Todas las redes mantienen la liberación de fármacos durante 30 h y se ha observado que un simple mecanismo de difusión regula la liberación difluunista según los modelos Korsmeyer-Peppas e Higuchi.
Introducción
Recientemente, los hidrogeles han atraído gran interés en el campo biomédico porque son redes tridimensionales con alto contenido de agua y son suaves y flexibles, por lo que pueden imitar los tejidos naturales fácilmente1. Además, no se disuelven en medio acuoso a temperatura fisiológica y pH, pero presentan una gran hinchazón2. Los hidrogeles pueden actuar como andamios de ingeniería de tejidos, productos de higiene, lentes de contacto y vendajes para heridas; porque pueden atrapar y liberar compuestos activos y drogas, se utilizan como sistemas de administración de medicamentos3. Dependiendo de su aplicación, los hidrogeles pueden estar hechos de polímeros naturales o sintéticos, o una combinación de ambos, con el fin de obtener las mejores características4.
Las propiedades de los hidrogeles son consecuencia de muchos factores físicos y químicos. A nivel físico, su estructura y morfología dependen de su porosidad, tamaño de poro y distribución de poros5. A nivel químico y molecular, el tipo de polímero, el contenido del grupo hidrófilo en la cadena de polímeros, el tipo de punto de reticulación y la densidad de reticulación son los factores que determinan la capacidad de hinchazón y las propiedades mecánicas6,7.
Según el tipo de agente reticulante utilizado para formar la red, los hidrogeles se clasifican como hidrogeles químicos o hidrogeles físicos. Los hidrogeles químicos se unen a las interacciones covalentes entre sus cadenas, que se forman a través de la irradiación UV y gamma o utilizando un agente reticulante7,8. Los hidrogeles químicos suelen ser fuertes y resistentes pero, generalmente, el agente reticulante es tóxico para las células y su eliminación es difícil, por lo que su aplicación es limitada. Por otro lado, los hidrogeles físicos se forman por la conexión de las cadenas de polímeros a través de interacciones no covalentes, evitando el uso de agentes reticulantes4,9. Las principales interacciones no covalentes en la red son las interacciones hidrofóbicas, las fuerzas electrostáticas, los límites complementarios e hidrógeno7.
Poly(alcohol vinílico) (PVA, Figura 1a) es un polímero sintético y soluble en agua con excelente rendimiento mecánico y biocompatibilidad que puede de los hidrogeles libres de agentes de reticulación a través del método de congelación10,11. Este polímero tiene la capacidad de formar zonas concentradas de enlaces de hidrógeno entre grupos -OH de sus cadenas (zonas cristalinas) cuando se están congelando12. Estas zonas cristalinas actúan como puntos de reticulación en la red, y son promovidas por dos eventos: el acercamiento de las cadenas de polímeros cuando el agua cristalina se expande y la conformación del PVA cambia de isotáctica a sindiotáctica PVA durante la congelación13. Debido al liofilizador, los cristales de agua se subliman, dejando espacios vacíos que son los poros en el hidrogel14. Para obtener hidrogeles con mejores propiedades, PVA se puede combinar fácilmente con otros polímeros.
En ese sentido, el quitosano constituye una opción, ya que es el único biopolímero de fuentes naturales con cargas positivas. Se obtiene mediante la deacetilación de la quitina y se compone de combinaciones aleatorias de D-glucosamina (unidad deacetilada) y N-acetil-D-glucosamina (unidad acetilada)15,16 (Figura 1b). El quitosano es biodegradable por las enzimas humanas y es biocompatible. Además, por su naturaleza catiónica, puede interactuar con la carga negativa de la superficie celular, y esta propiedad se ha asociado con su actividad antimicrobiana17. Este polímero es fácil de procesar; sin embargo, sus propiedades mecánicas no son suficientes y se han añadido algunos materiales para formar complejos con mejores características.
Teniendo en cuenta las características específicas de chitosan y PVA, la fabricación exitosa de hidrogeles ha sido alcanzada por el método de congelación-descongelación2,18 para evitar el uso de agentes reticulantes tóxicos. En los hidrogeles de quitosano-PVA, también se forman las zonas cristalinas de PVA, y las cadenas de quitosano se interpenetran y forman simples enlaces de hidrógeno con grupos -NH2 y grupos -OH en PVA. El hidrogel chitosan-PVA final es mecánicamente estable, con altas tasas de hinchazón y baja toxicidad, y con efecto antibacteriano18. Sin embargo, dependiendo de las condiciones de congelación utilizadas en la preparación (temperatura, tiempo y número de ciclos), las características finales pueden cambiar. Algunos estudios informan que aumentar el número de ciclos de congelación disminuye el grado de hinchazón y aumenta la resistencia a la tracción19,20. Con el fin de fortalecer la red, otros agentes como la radiación gamma y UV y los retiticores químicos se han utilizado adicionalmente después de la preparación congelada21,22,23. Los hidrogeles con una mayor proporción de quitosano tienen una red más porosa y una alta capacidad de hinchazón, pero menos resistencia y estabilidad térmica. En este contexto, es importante tener en cuenta las condiciones de preparación para obtener hidrogeles adecuados para su aplicación objetivo.
El objetivo de este trabajo es presentar en detalle cómo las condiciones de congelación (temperatura de congelación y número de ciclos) afectan a las características finales de los hidrogeles CS-PVA. Se evaluaron los espectros FT-IR, las características morfológicas y de porosidad y la capacidad de hinchazón, así como la capacidad de carga y liberación de fármacos. En los estudios de liberación, diflunisal(Figura 1c) se utilizó como fármaco modelo, debido a su tamaño adecuado a la estructura de hidrogel.
Protocolo
1. Preparación de hidrogeles de quitosano-PVA
- Prepare 2% (p/p) de chitosano y 10% (p/w) soluciones de PVA. Disolver 0,2 g de quitosano en 10 ml de solución COOH de 0,1 M CH3(previamente filtrada) a temperatura ambiente y mantener la agitación mecánica continua durante la noche. Disolver 1 g de PVA en 10 ml de agua destilada y remover a 80oC durante 1 h.
- Mezclar ambas soluciones 1:1 utilizando un agitador magnético hasta que sean homogéneos a temperatura ambiente, y verter las mezclas en los platos de Petri. Deje las muestras durante 2 h a presión atmosférica a desgasificación.
- Congelar los hidrogeles a -4 oC, -20 oC o -80 oC durante 20 h y 4 ciclos (muestras CP4-4, CP4-20 y CP4-80, respectivamente). Congele otro hidrogel a -80 oC durante 20 h utilizando 5 o 6 ciclos de congelación (muestras CP5-80 y CP6-80). Después del tercer ciclo de congelación, lave los hidrogeles con agua desionizada. Al final, secar los hidrogeles a -46oC durante 48 h y almacenarlos para su posterior caracterización (metodología adaptada a partir de2).
2. Caracterización FT-IR
- Coloque una pequeña pieza (1 mm x 2 mm) de hidrogel en el espectrómetro FT-IR en modo ATR. Tome los espectros FT-IR de 4000 a 600 cm-1 (2 cm-1 de resolución y promedio de 32 escaneos).
3. Ensayos de hinchazón
- Corte los discos (13 mm de diámetro y 10 mm de altura) del hidrogel y pesínlos. Incubar los discos en 50 ml de agua desionizada con agitación a 25oC. Repita tres veces.
- Cada 30 minutos retire la muestra del medio, blotter para eliminar el exceso de agua, y pesar. Calcular el grado de hinchazón utilizando la
 ecuación 1 y calcular el estado de equilibrio de la hinchazón, , a 24 h utilizando la ecuación 2.
ecuación 1 y calcular el estado de equilibrio de la hinchazón, , a 24 h utilizando la ecuación 2.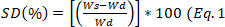 )
)
¿Dónde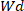 está el peso
está el peso 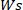 del hidrogel seco y es el peso del hidrogel húmedo.
del hidrogel seco y es el peso del hidrogel húmedo.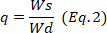
4. Microscopía electrónica
- Cubra un pequeño trozo de hidrogel con una fina capa de oro (30 s y 10 mA) en una capa de esputo.
- Coloque la muestra en un microscopio electrónico de barrido (SEM). Analice las muestras en vacío a 20 kV y tome las imágenes con un aumento de 500x y 1500x.
5. Porosimetría
- Coloque discos de 15 mm de diámetro con un peso aproximado de 0,26 g en el penetrómetro (un penetrómetro sólido, con un volumen a granel de 0,3660 ml y 5,7831 ml de volumen del vástago). Analice la porosidad y el tamaño de los poros por Mercury Intrusion Porosimetry (MIP).
- Lleve a cabo el experimento en el modo histéresis (intrusión-extrusión). Mida el volumen total de intrusión (mL/g), el área total de los poros (m2/g), el diámetro de los poros (m), la porosidad (%), la permeabilidad (mDarcy) y la tortuosidad. Repita dos veces.
6. Carga y liberación de medicamentos
- Antes de cargar, prepare 4 L de 15 mg/L de solución diflundía y revuelva durante la noche. Confirmar la concentración de la solución mediante espectroscopia UV-Vis (concentración inicial). De hecho, se hinchan 400 mg de muestras liofilizadas de hidrogel en 6 ml de agua destilada durante 24 h.
- Para la carga, llenar un matraz con 50 ml de solución diflunisal y mantener a 25oC con agitación constante. Sumerja cada hidrogel hinchado en el matraz.
- Tomar alícuotas de la solución difluunista restante (2 ml) en diferentes momentos para determinar la región de la meseta de la curva, por ejemplo: 3, 6, 24, 27, 30 y 48 h. Después de 24 h reemplace la solución por una nueva.
- Mida la absorbancia a 252 nm de cada alícuota y determine la concentración de presente diverunisal en la solución, utilizando una curva de calibración de diflunisal. Calcular la cantidad de diflunisal retenida en el hidrogel a 24 y 48 h, como la diferencia de concentraciones iniciales y finales, teniendo en cuenta el volumen total (56 ml).
- Determine la eficiencia de encapsulación (EE) utilizando la ecuación 3.
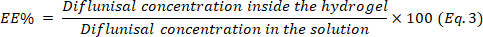
- Congele los hidrogeles cargados a -80 oC y liofilícelos a -50 oC.
- Determine la eficiencia de encapsulación (EE) utilizando la ecuación 3.
- Para la liberación de fármacos, sumerja 300 mg de hidrogeles diflunisales liofunciales en 50 ml de tampón de fosfato (pH 7.4) a 25 oC. Mantenga la agitación constante. Retirar alícuotas de 2 ml en diferentes momentos y reemplazar con medio fresco para mantener un volumen constante.
- Determinar el diflusio liberado espectrofotométricamente a 252 nm, de acuerdo con una curva de calibración.
- Deducir el mecanismo predominante de liberación de fármacos en los hidrogeles ajustando los datos de liberación de fármacos correspondientes al primer 60%, al modelo Korsmeyer-Peppas (Ecuación 4), para obtener las constantes cinéticas (k) y la difusión (n). Los valores n indican el mecanismo de liberación defármacos 24,25. A continuación, los valores n cercanos a 0,5 están relacionados con la difusión de Fickian, mientras tanto los valores de 0,5-1,0 para el transporte anómalo, donde están implicados cadenas de difusión y relajación, y finalmente, los valores de 1,0 están relacionados con el transporte del caso II.
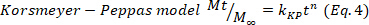
- Para confirmar los resultados, utilice los modelos matemáticos Higuchi, First order y Zero order (Ecuaciones 5 a 7) y seleccione el ajuste mejor.
-
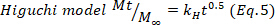
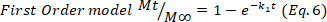
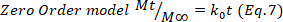
donde t representa el tiempo de liberación, Mt la cantidad de medicamento entregado en un momento dado, y M- la cantidad total de medicamento entregado al final del proceso.
Resultados
Preparación de hidrogeles
Los hidrogeles Detosan-PVA se obtuvieron a -4oC, -20oC y -80oC con 4 ciclos de congelación y a -80oC con 5 y 6 ciclos de congelación por el método de congelación previamente notificado2. Todos los hidrogeles eran homogéneos, semitransparentes, flexibles y resistentes a la manipulación.
Caracterización FT-IR
Los espectros FT-IR se mu...
Discusión
El método de congelación-descongelación es un proceso adecuado para preparar hidrogeles biocompatibles enfocados en aplicaciones biomédicas, farmacéuticas o cosméticas34,35,36. La ventaja más importante de este método, en comparación con otros métodos bien conocidos para preparar hidrogeles, es que se evita el uso de agentes reticulantes, que podría causar una respuesta inflamatoria o efectos adversos en el cuerpo hum...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores están agradecidos a C. Luzuriaga por el apoyo en las mediciones de porosimetría. Autores también gracias al Ministerio de Economía y Competitividad de España por su apoyo financiero (Proyecto MAT2014-59116-C2-2-R) y PIUNA (ref. 2018-15). Los autores también quieren reconocer al Dr. Amir Maldonado, del Departamento de Física-UNISON, por su apoyo y comentarios útiles, y al Dr. SE Burruel-Ibarra, de DIPM-UNISON para imágenes SEM y Rubio Pharma y Asociados S. A. de C. V. por su apoyo financiero. ME Martínez-Barbosa desea agradecer a los proyectos CONACyT (México) No 104931 y No 256753, además del apoyo financiero de Red Temática de Nanociencias y Nanotecnología del programa de Redes Temáticas del CONACyT. Y, también el proyecto USO316001081. MD Figueroa-Pizano desea reconocer a CONACyT por su apoyo financiero (beca 373321).
Materiales
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Chitosan medium molecular weight | Sigma-Aldrich | 448877 | Mw determined by capillary viscometry (637,000 Da) and deacetylation degree of 70% |
| Diflunisal (2'-4'-difluoro-4-hydroxy-3-biphenyl-carboxylicacid) | Merck | ||
| Glacial acetic acid | Sigma-Aldrich | 1005706 | |
| Poly(vinyl alcohol) | Sigma-Aldrich | 341584 | Mw 89,000-98,000, 99+% hydrolyzed |
| Equipment: | |||
| Cressington Sputter Coater 108 auto | TED PELLA INC | ||
| Cryodos Lyophilizator | Telstar | ||
| Falcon tubes | Thermo Fisher Company | ||
| FT-IR spectroscopy | Nicolet iS50 | in ATR mode | |
| Lyophilizator | LABCONCO | ||
| Micromeritics Autopore IV 9500 | Micromeritics | ||
| Scanning electron microscope | Pemtron SS-300LV | ||
| UV-visible spectrophotometer | Agilent 8453 |
Referencias
- Gyles, D. A., Castro, L. D., Silva, J. O. C., Ribeiro-Costa, R. M. A review of the designs and prominent biomedical advances of natural and synthetic hydrogel formulations. European Polymer Journal. 88 (01), 373-392 (2017).
- Abdel-Mohsen, a. M., Aly, a. S., Hrdina, R., Montaser, a. S., Hebeish, a. Eco-Synthesis of PVA/Chitosan Hydrogels for Biomedical Application. Journal of Polymers and the Environment. 19, 1005-1012 (2011).
- Caló, E., Khutoryanskiy, V. V. Biomedical applications of hydrogels: A review of patents and commercial products. European Polymer Journal. 65, 252-267 (2015).
- Ahmadi, F., Oveisi, Z., Samani, M., Amoozgar, Z. Chitosan based hydrogels: Characteristics and pharmaceutical applications. Research in Pharmaceutical Sciences. 10 (1), 1-16 (2015).
- Siepmann, J., Siegel, R. A., Rathbone, M. J. Fundamentals and applications of controlled release drug delivery. Fundamentals and Applications of Controlled Release Drug Delivery. , (2012).
- Gulrez, S. K. H., Al-Assaf, S., Phillips, O. G. Hydrogels: Methods of Preparation, Characterisation and Applications. Progress in Molecular and Environmental Bioengineering - From Analysis and Modeling to Technology Applications. , 117-146 (2011).
- Ahmed, E. M. Hydrogel: Preparation, characterization, and applications. Journal of Advanced Research. 6 (2), 105-121 (2015).
- Deligkaris, K., Tadele, T. S., Olthuis, W., van den Berg, A. Hydrogel-based devices for biomedical applications. Sensors and Actuators, B: Chemical. 147 (2), 765-774 (2010).
- Patel, A., Mequanint, K. Hydrogel Biomaterials. Biomedical Engineering - Frontiers and Challenges. , 275-296 (2012).
- Kenawy, E., Kamoun, E. A., El-meligy, M. A., Mohy, M. S. Physically crosslinked poly ( vinyl alcohol ) - hydroxyethyl starch blend hydrogel membranes Synthesis and characterization for biomedical applications. Arabian Journal of Chemistry. 7 (3), 372-380 (2014).
- Kamoun, E. A., Kenawy, E. R. S., Chen, X. A review on polymeric hydrogel membranes for wound dressing applications: PVA-based hydrogel dressings. Journal of Advanced Research. 8 (3), 217-233 (2017).
- Hassan, C. M., Peppas, N. A. Structure and Morphology of Freeze / Thawed PVA Hydrogels. Macromolecules. 33, 2472-2479 (2000).
- Tsou, Y. H., Khoneisser, J., Huang, P. C., Xu, X. Hydrogel as a bioactive material to regulate stem cell fate. Bioactive Materials. 1 (1), 39-55 (2016).
- Kumar, A., Mishra, R., Reinwald, Y., Bhat, S. Cryogels: Freezing unveiled by thawing. Materials Today. 13 (11), 42-44 (2010).
- Wu, T., Li, Y., Lee, D. S. Chitosan-based composite hydrogels for biomedical applications. Macromolecular Research. 25 (6), 480-488 (2017).
- Dutta, P. K., Dutta, J., Tripathi, V. S. Chitin and chitosan: Chemistry, properties and applications. Journal of Scientific and Industrial Research. 63, 20-31 (2004).
- Szymańska, E., Winnicka, K. Stability of Chitosan—A Challenge for Pharmaceutical and Biomedical Applications. Marine Drugs. 13, 1819-1846 (2015).
- Yang, X., Liu, Q., Chen, X., Yu, F., Zhu, Z. Investigation of PVA/ws-chitosan hydrogels prepared by combined gamma-irradiation and freeze-thawing. Carbohydrate Polymers. 73 (3), 401-408 (2008).
- Mathews, D. T., Birbey, Y. A., Cahill, P. A., McGuinness, G. B. Mechanical and Morphological Characteristics of Poly(vinyl alcohol)/Chitosan Hydrogels. Journal of Applied Polymer Science. 109, 1129-1137 (2008).
- Hosseini, M. S., Amjadi, I., Haghighipour, N. Preparation of Poly(vinyl alcohol)/Chitosan-Blended Hydrogels: Properties, in Vitro Studies and Kinetic Evaluation. Journal of Biomimetics, Biomaterials, and Tissue Engineering. 15, 63-72 (2012).
- Afshari, M. J., Sheikh, N., Afarideh, H. PVA/CM-chitosan/honey hydrogels prepared by using the combined technique of irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 113, 28-35 (2015).
- Agnihotri, S., Mukherji, S. S., Mukherji, S. S. Antimicrobial chitosan-PVA hydrogel as a nanoreactor and immobilizing matrix for silver nanoparticles. Applied Nanoscience. 2 (3), 179-188 (2012).
- Yang, X., et al. Cytotoxicity and wound healing properties of PVA/ws-chitosan/glycerol hydrogels made by irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 79 (5), 606-611 (2010).
- Machín, R., Isasi, J. R., Vélaz, I. Hydrogel matrices containing single and mixed natural cyclodextrins. Mechanisms of drug release. European Polymer Journal. 49 (12), 3912-3920 (2013).
- Ritger, P. L., Peppas, N. A. A Simple Equation for Description of Solute Release. Journal of Controlled Release. 5, 37-42 (1987).
- Abureesh, M. A., Oladipo, A. A., Gazi, M. Facile synthesis of glucose-sensitive chitosan-poly(vinyl alcohol) hydrogel: Drug release optimization and swelling properties. International Journal of Biological Macromolecules. 90, 75-80 (2016).
- Mansur, H. S., Sadahira, C. M., Souza, A. N., Mansur, A. A. P. FTIR spectroscopy characterization of Poly(vinyl alcohol) hydrogel with different hydrolysis degree and chemically crosslinked with glutaraldehyde. Materials Science and Engineering C. 28 (4), 539-548 (2008).
- Parida, U. K., Nayak, A. K., Binhani, B. K., Nayak, P. L. Synthesis and Characterization of Chitosan-Polyvinyl Alcohol Blended with Cloisite 30B for Controlled Release of the Anticancer Drug Curcumin. Journal of Biomaterials and Nanobiotechnology. 02 (04), 414-425 (2011).
- Zu, Y., et al. Preparation and characterization of chitosan-polyvinyl alcohol blend hydrogels for the controlled release of nano-insulin. International Journal of Biological Macromolecules. 50 (1), 82-87 (2012).
- Lejardi, A., Hernández, R., Criado, M., Santos, J. I., Etxeberria, A., Sarasua, J. R. Novel hydrogels of chitosan and poly ( vinyl alcohol ) -g-glycolic acid copolymer with enhanced rheological properties. Carbohydrate Polymers. , 267-273 (2014).
- dos Reis, E. F., et al. Synthesis and characterization of Poly(vinyl alcohol) hydrogels and hybrids for rMPB70 protein adsorption. Materials Research. 9 (2), 185-191 (2006).
- Thanyacharoen, T., Chuysinuan, P., Techasakul, S., Nooeaid, P., Ummartyotin, S. Development of a gallic acid-loaded chitosan and polyvinyl alcohol hydrogel composite: Release characteristics and antioxidant activity. International Journal of Biological Macromolecules. 107, 363-370 (2018).
- Lozinsky, V. I., et al. Polymeric cryogels as promising materials of biotechnological interest. Trends in Biotechnology. 21 (10), 445-451 (2003).
- Liu, Y., Vrana, N. E., Cahill, P. A., McGuinness, G. B. Physically crosslinked composite hydrogels of PVA with natural macromolecules: Structure, mechanical properties, and endothelial cell compatibility. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 90 (2), 492-502 (2009).
- Yang, W., et al. Polyvinyl alcohol/chitosan hydrogels with enhanced antioxidant and antibacterial properties induced by lignin nanoparticles. Carbohydrate Polymers. 181 (August 2017), 275-284 (2018).
- Park, H., Kim, D. Swelling and mechanical properties of glycol chitosan/poly(vinyl alcohol) IPN-type superporous hydrogels. Journal of Biomedical Materials Research Part A. 78 (4), 662-667 (2006).
- Zhang, H., Zhang, F., Wu, J. Physically crosslinked hydrogels from polysaccharides prepared by freeze-thaw technique. Reactive and Functional Polymers. 73 (7), 923-928 (2013).
- Hassan, C. M., Peppas, N. A. Structure and Applications of Poly ( vinyl alcohol ) Hydrogels Produced by Conventional Crosslinking or by Freezing / Thawing Methods. Advances in Polymer Science. 153, 37-65 (2000).
- Sung, J. H., et al. Gel characterisation and in vivo evaluation of minocycline-loaded wound dressing with enhanced wound healing using polyvinyl alcohol and chitosan. International Journal of Pharmaceutics. 392 (1-2), 232-240 (2010).
- Lin, C. C., Metters, A. T. Hydrogels in controlled release formulations: Network design and mathematical modeling. Advanced Drug Delivery Reviews. 58 (12-13), 1379-1408 (2006).
- Fan, L., Yang, H., Yang, J., Peng, M., Hu, J. Preparation and characterization of chitosan/gelatin/PVA hydrogel for wound dressings. Carbohydrate Polymers. 146, 427-434 (2016).
- Islam, A., et al. Evaluation of selected properties of biocompatible chitosan / poly ( vinyl alcohol) blends. International Journal of Biological Macromolecules. 82, 551-556 (2016).
- Physical Montaser, A. S. mechanical and antimicrobial evaluations of physically crosslinked PVA/chitosan hydrogels containing nanoparticles. Journal of Applied Pharmaceutical Science. 6 (5), 1-6 (2016).
- Hou, Y., Chen, C., Liu, K., Tu, Y., Zhang, L., Li, Y. Preparation of PVA hydrogel with high-transparence and investigations of its transparent mechanism. RSC Advances. 5 (31), 24023-24030 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados