É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um método de congelamento-descongelamento para preparar chitosan-poly (álcool de vinil) hidrogéis sem agentes crosslinking e estudos de liberação diflunisal
Neste Artigo
Resumo
O método de congelamento-descongelamento é usado para produzir hidrogéis quitosan-poli (álcool de vinil) sem agentes de crosslinking. Para este método, é importante considerar as condições de congelamento (temperatura, número de ciclos) e razão de polímero, que podem afetar as propriedades e aplicações dos hidrogéis obtidos.
Resumo
Os hidrogéis chitosan-poly (álcool de vinil) podem ser produzidos pelo método de congelamento de descongelamento sem o uso de agentes tóxicos de crosslinking. As aplicações desses sistemas são limitadas por suas características (por exemplo, porosidade, flexibilidade, capacidade de inchaço, carregamento de drogas e capacidade de liberação de medicamentos), que dependem das condições de congelamento e do tipo e proporção de polímeros. Este protocolo descreve como preparar hidrogéis a partir de quitosana e poli (álcool de vinil) em 50/50 w/w % da composição do polímero e variando a temperatura de congelamento (-4 °C, -20 °C, -80 °C) e ciclos de congelamento-descongelamento (4, 5, 6 ciclos de congelamento). Foram obtidos espectraFT-IR, micrografia SEM e dados de porosimetria de hidrogéis. Além disso, a capacidade de inchaço e carregamento de drogas e liberação de diflunisal foram avaliados. Os resultados das micrografias sem e porosimetry mostram que o tamanho dos poros diminui, enquanto a porosidade aumenta em temperaturas mais baixas. A porcentagem de inchaço foi maior na temperatura de congelamento menor. A liberação do diflunisal dos hidrogéis foi estudada. Todas as redes mantêm a liberação de drogas por 30 h e observou-se que um mecanismo simples de difusão regula a liberação diflunisal de acordo com os modelos Korsmeyer-Peppas e Higuchi.
Introdução
Recentemente, os hidrogéis têm atraído grande interesse no campo biomédico, porque eles são redes tridimensionais com alto teor de água e são macios e flexíveis, para que eles possam imitar os tecidos naturais facilmente1. Além disso, eles não se dissolvem em meio aquoso a temperatura fisiológica e pH, mas apresentam um grande inchaço2. Hidrogéis podem atuar como andaimes de engenharia de tecidos, produtos de higiene, lentes de contato e curativos; porque eles podem prender e liberar compostos ativos e drogas, eles são usados como sistemas de entrega de drogas3. Dependendo de sua aplicação, hidrogéis podem ser feitos de polímeros naturais ou sintéticos, ou uma combinação de ambos, a fim de obter as melhores características4.
As propriedades dos hidrogéis são uma conseqüência de muitos fatores físicos e químicos. No nível físico, sua estrutura e morfologia dependem de sua porosidade, tamanho dos poros e distribuição de poros5. No nível químico e molecular, o tipo de polímero, o conteúdo do grupo hidrofílico na cadeia de polímeros, o tipo de ponto transversal e a densidade cruzada são os fatores que determinam a capacidade de inchaço e as propriedades mecânicas6,7.
De acordo com o tipo de agente crosslinking usado para formar a rede, os hidrogéis são classificados como hidrogéis químicos ou hidrogéis físicos. Hidrogéis químicos são unidos por interações covalentes entre suas cadeias, que são formadas através de irradiação UV e gama ou usando um agente crosslinking7,8. Hidrogéis químicos geralmente são fortes e resistentes, mas, geralmente, o agente crosslinking é tóxico para as células e sua remoção é difícil, por isso a sua aplicação é limitada. Por outro lado, hidrogéis físicos se formam pela conexão das cadeias de polímeros através de interações não covalentes, evitando o uso de agentes crosslinking4,9. As principais interações não covalentes na rede são interações hidrofóbicas, forças eletrostáticas, limites complementares e de hidrogênio7.
Poly (álcool de vinil) (PVA, Figura 1a)é um polímero sintético e solúvel em água com excelente desempenho mecânico e biocompatibilidade que pode de hidrogéis livres de agentes crosslink através do método de congelamento-descongelamento10,11. Este polímero tem a capacidade de formar zonas concentradas de ligações de hidrogênio entre grupos -OH de suas cadeias (zonas cristalinas) quando eles estão congelando12. Estas zonas cristalinas atuam como pontos de cruzamento na rede, e são promovidas por dois eventos: a aproximação das cadeias de polímeros quando a água cristalina se expande e as mudanças conformais pva de isotática para pva sindicotático durante o congelamento13. Por causa da liofilagem, os cristais de água são sublimados, deixando espaços vazios que são os poros no hidrogel14. Para obter hidrogéis com melhores propriedades, pva pode ser facilmente combinado com outros polímeros.
Nesse sentido, a quitosana constitui uma opção, pois é o único biopolímero de fontes naturais com cargas positivas. É obtido pela deacetilação da citona e é composto por combinações aleatórias de β-1,4 ligada saciedade D (unidade deacetilada) e N-acetil-D-glucosamina (unidade acetilada)15,16 (Figura 1b). Quitosana é biodegradável por enzimas humanas e é biocompatível. Além disso, por sua natureza cationic, pode interagir com a carga negativa da superfície celular, e esta propriedade tem sido associada com sua atividade antimicrobiana17. Este polímero é fácil de processar; no entanto, suas propriedades mecânicas não são suficientes e alguns materiais foram adicionados para formar complexos com melhores características.
Considerando características específicas da quitosa na quitarina e da PVA, a fabricação bem-sucedida de hidrogéis foi atingida pelo métododecongelamento-descongelamento2,18 para evitar o uso de agentes tóxicos de crosslinking. Em hidrogéis chitosan-PVA, as zonas cristalinas do PVA também são formadas, e as cadeias de quitosana são interpenetradas e formam ligações simples de hidrogênio com grupos -NH2 e grupos -OH no PVA. O hidrogel quitosan-PVA final é mecanicamente estável, com altas taxas de inchaço e baixa toxicidade, e com efeito antibacteriano18. No entanto, dependendo das condições de congelamento utilizadas na preparação (temperatura, tempo e número de ciclos), as características finais podem mudar. Alguns estudos relatam que aumentar o número de ciclos de congelamento diminui o grau de inchaço e aumenta a força de tração19,20. A fim de fortalecer a rede, outros agentes, como a radiação gama e UV e crosslinkers químicos têm sido utilizados adicionalmente após a preparação congelado21,22,23. Hidrogéis com maior proporção de quitosana têm uma rede mais porosa e alta capacidade de inchaço, mas menos força e estabilidade térmica. Neste contexto, é importante considerar as condições de preparação para obter hidrogéis adequados para a sua aplicação alvo.
O objetivo deste trabalho é apresentar em detalhes como as condições de congelamento (temperatura de congelamento e número de ciclos) afetam as características finais dos hidrogéis CS-PVA. Foram avaliadas características de espectros FT-IR, morfológicas e porosidades e capacidade de inchaço, bem como capacidade de carregamento e liberação de medicamentos. Nos estudos de liberação, diflunisal (Figura 1c)foi usado como droga modelo, devido ao seu tamanho adequado à estrutura hidrogel.
Protocolo
1. Preparação de hidrogéis chitosan-PVA
- Prepare 2% (w/w) chitosan e 10% (w/w) soluções PVA. Dissolva 0,2 g de quitosana em 10 mL de 0,1 M CH3COOH solução (previamente filtrada) à temperatura ambiente e manter agitação mecânica contínua durante a noite. Dissolva 1 g de PVA em 10 mL de água destilada e mexa a 80 °C por 1 h.
- Misture ambas as soluções 1:1 usando um agitador magnético até que sejam homogêneas à temperatura ambiente, e despeje as misturas em placas de Petri. Deixe as amostras para 2 h na pressão atmosférica para degas.
- Congele os hidrogéis em -4 °C, -20 °C ou -80 °C para 20 h e 4 ciclos (amostras CP4-4, CP4-20 e CP4-80, respectivamente). Congele outro hidrogel a -80 °C por 20 h usando 5 ou 6 ciclos de congelamento (amostras CP5-80 e CP6-80). Após o terceiro ciclo de congelamento, lave os hidrogéis com água desionizada. No final, congele os hidrogéis a -46 °C por 48 h e guarde para maior caracterização (metodologia adaptada a partir de2).
2. Caracterização FT-IR
- Coloque um pequeno pedaço (1 mm x 2 mm) de hidrogel no espectrômetro FT-IR no modo ATR. Pegue os espectros FT-IR de 4000 a 600 cm-1 (2 cm-1 de resolução e média de 32 exames).
3. Ensaios inchaço
- Corte discos (13 mm de diâmetro e 10 mm de altura) do hidrogel e pesem-nos. Incubar os discos em 50 mL de água desionizada com agitação a 25 °C. Repita três vezes.
- Cada 30 min remover a amostra do meio, mancha para eliminar o excesso de água, e pesar. Calcule o grau de inchaço usando a equação
 1 e calcule o estado de equilíbrio do inchaço, às 24 h usando a equação 2.
1 e calcule o estado de equilíbrio do inchaço, às 24 h usando a equação 2.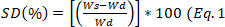 )
)
Onde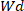 está o peso do
está o peso do 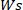 hidrogel seco e é o peso do hidrogel molhado.
hidrogel seco e é o peso do hidrogel molhado.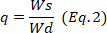
4. Microscopia Eletrônica
- Cubra um pequeno pedaço de hidrogel com uma fina camada de ouro (30 s e 10 mA) em um coater sputter.
- Coloque a amostra em um microscópio eletrônico de varredura (SEM). Analise as amostras vácuo a 20 kV e tire as imagens com uma ampliação de 500x e 1500x.
5. Porosimetry 5. Porosimetry
- Coloque discos de 15 mm de diâmetro pesando cerca de 0,26 g no penetrômetro (um penetrômetro sólido, com um volume maior de 0,3660 mL e 5,7831 mL de volume de caule). Analise o tamanho da porosidade e dos poros por Porosimetry de intrusão de mercúrio (MIP).
- Conduzir o experimento no modo histerese (intrusão-extrusão). Medir o volume total de intrusão (mL/g), área total de poros (m2/g),diâmetro dos poros (μm), porosidade (%), permeabilidade (mDarcy) e tortuosidade. Repita duas vezes.
6. Carregamento e liberação da droga
- Antes de carregar, prepare 4 L de 15 mg/L solução diflunisal e mexa durante a noite. Confirme a concentração da solução pela espectroscopia UV-Vis (concentração inicial). Na verdade, inchar 400 mg de amostras liofilizadas de hidrogel em 6 mL de água destilada para 24 h.
- Para carregar, encha um frasco com 50 mL de solução diflunisal e mantenha a 25 °C com agitação constante. Submergir cada hidrogel inchado no frasco.
- Tome alíquotas de solução diflunisal restante (2 mL) em momentos diferentes, a fim de determinar a região do planalto da curva, por exemplo: 3, 6, 24, 27, 30 e 48 h. Após 24 h substituir a solução com um fresco.
- Medir a absorção em 252 nm de cada alibado, e determinar a concentração de diflunisal presente na solução, usando uma curva de calibração de diflunisal. Calcule a quantidade de diflunisal retida no hidrogel às 24 e 48 h, como a diferença de concentrações iniciais e finais, levando em conta o volume total (56 mL).
- Determine a eficiência de encapsulamento (EE) usando a equação 3.
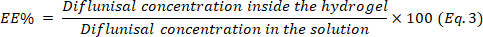
- Congele os hidrogéis carregados a -80 °C e liofilize-os a -50 °C.
- Determine a eficiência de encapsulamento (EE) usando a equação 3.
- Para a liberação de drogas, submergir 300 mg de hidrogéis liofilizados diflunisal carregado em 50 mL de tampão de fosfato (pH 7,4) a 25 °C. Mantenha a agitação constante. Retire alíquotas de 2 mL em momentos diferentes e substituir por meio fresco para manter um volume constante.
- Determinou o diflunisal liberado espectrophotometricamente em 252 nm, de acordo com uma curva de calibração.
- Deduza o mecanismo predominante de liberação de drogas nos hidrogéis ajustando os dados de liberação de drogas correspondentes aos primeiros 60%, ao modelo Korsmeyer-Peppas (Equação 4), para obter as constantes cinéticas(k)e a difusão(n). Os valores n indicam o mecanismo de liberação de drogas24,25. Em seguida, os valores próximos a 0,5 estão relacionados à difusão fickiana, enquanto os valores de 0,5-1,0 para o transporte anômalo, onde estão envolvidos difusão e cadeias de relaxamento, e, finalmente, os valores de 1,0 estão relacionados ao transporte caso II.
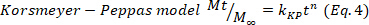
- Para confirmar os resultados, use os modelos matemáticos de Higuchi, Primeira ordem e Ordem Zero (Equações 5 a 7) e selecione o melhor ajuste.
-
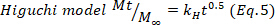
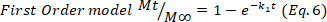
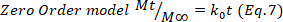
onde t representa o tempo de liberação, Mt a quantidade de droga entregue em um determinado momento, e Ma quantidade total de drogas entregues no final do processo.
Resultados
Preparação de hidrogéis
Hidrogéis Chitosan-PVA foram obtidos a -4 °C, -20 °C e -80 °C com 4 ciclos de congelamento e a -80 °C com 5 e 6 ciclos de congelamento pelo método de congelamento-descongelamento relatado anteriormente2. Todos os hidrogéis eram homogêneos, semitransparentes, flexíveis e resistentes à manipulação.
Caracterização FT-IR
Os espec...
Discussão
O método de congelamento-descongelamento é um processo adequado para preparar hidrogéis biocompatíveis focados em aplicações biomédicas, farmacêuticas ou cosméticas34,35,36. A vantagem mais importante deste método, em comparação com outros métodos bem conhecidos para preparar hidrogéis, é que o uso de agentes crosslinking é evitado, o que poderia causar uma resposta inflamatória ou efeitos adversos no corpo huma...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores são gratos a C. Luzuriaga pelo apoio nas medições porosimetry. Autores também graças ao Ministerio de Economía y Competitividad da Espanha para apoio financeiro (Projeto MAT2014-59116-C2-2-R) e PIUNA (ref. 2018-15). Os autores também gostariam de reconhecer o Dr. Amir Maldonado do Departamento de Física-UNISON para apoio e comentários úteis e Dr. SE Burruel-Ibarra de DIPM-UNISON para imagens SEM e Rubio Pharma y Asociados S. A. de C. V. para apoio financeiro. Me Martínez-Barbosa gostaria de agradecer aos projetos da CONACyT (México) nº 104931 e Nº 256753, além do apoio financeiro da Red Temática de Nanociencias y Nanotecnología del programa de Redes Temáticas del CONACyT. E, também projeto USO316001081. MD Figueroa-Pizano gostaria de reconhecer CONACyT para apoio financeiro (bolsa 373321).
Materiais
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Chitosan medium molecular weight | Sigma-Aldrich | 448877 | Mw determined by capillary viscometry (637,000 Da) and deacetylation degree of 70% |
| Diflunisal (2'-4'-difluoro-4-hydroxy-3-biphenyl-carboxylicacid) | Merck | ||
| Glacial acetic acid | Sigma-Aldrich | 1005706 | |
| Poly(vinyl alcohol) | Sigma-Aldrich | 341584 | Mw 89,000-98,000, 99+% hydrolyzed |
| Equipment: | |||
| Cressington Sputter Coater 108 auto | TED PELLA INC | ||
| Cryodos Lyophilizator | Telstar | ||
| Falcon tubes | Thermo Fisher Company | ||
| FT-IR spectroscopy | Nicolet iS50 | in ATR mode | |
| Lyophilizator | LABCONCO | ||
| Micromeritics Autopore IV 9500 | Micromeritics | ||
| Scanning electron microscope | Pemtron SS-300LV | ||
| UV-visible spectrophotometer | Agilent 8453 |
Referências
- Gyles, D. A., Castro, L. D., Silva, J. O. C., Ribeiro-Costa, R. M. A review of the designs and prominent biomedical advances of natural and synthetic hydrogel formulations. European Polymer Journal. 88 (01), 373-392 (2017).
- Abdel-Mohsen, a. M., Aly, a. S., Hrdina, R., Montaser, a. S., Hebeish, a. Eco-Synthesis of PVA/Chitosan Hydrogels for Biomedical Application. Journal of Polymers and the Environment. 19, 1005-1012 (2011).
- Caló, E., Khutoryanskiy, V. V. Biomedical applications of hydrogels: A review of patents and commercial products. European Polymer Journal. 65, 252-267 (2015).
- Ahmadi, F., Oveisi, Z., Samani, M., Amoozgar, Z. Chitosan based hydrogels: Characteristics and pharmaceutical applications. Research in Pharmaceutical Sciences. 10 (1), 1-16 (2015).
- Siepmann, J., Siegel, R. A., Rathbone, M. J. Fundamentals and applications of controlled release drug delivery. Fundamentals and Applications of Controlled Release Drug Delivery. , (2012).
- Gulrez, S. K. H., Al-Assaf, S., Phillips, O. G. Hydrogels: Methods of Preparation, Characterisation and Applications. Progress in Molecular and Environmental Bioengineering - From Analysis and Modeling to Technology Applications. , 117-146 (2011).
- Ahmed, E. M. Hydrogel: Preparation, characterization, and applications. Journal of Advanced Research. 6 (2), 105-121 (2015).
- Deligkaris, K., Tadele, T. S., Olthuis, W., van den Berg, A. Hydrogel-based devices for biomedical applications. Sensors and Actuators, B: Chemical. 147 (2), 765-774 (2010).
- Patel, A., Mequanint, K. Hydrogel Biomaterials. Biomedical Engineering - Frontiers and Challenges. , 275-296 (2012).
- Kenawy, E., Kamoun, E. A., El-meligy, M. A., Mohy, M. S. Physically crosslinked poly ( vinyl alcohol ) - hydroxyethyl starch blend hydrogel membranes Synthesis and characterization for biomedical applications. Arabian Journal of Chemistry. 7 (3), 372-380 (2014).
- Kamoun, E. A., Kenawy, E. R. S., Chen, X. A review on polymeric hydrogel membranes for wound dressing applications: PVA-based hydrogel dressings. Journal of Advanced Research. 8 (3), 217-233 (2017).
- Hassan, C. M., Peppas, N. A. Structure and Morphology of Freeze / Thawed PVA Hydrogels. Macromolecules. 33, 2472-2479 (2000).
- Tsou, Y. H., Khoneisser, J., Huang, P. C., Xu, X. Hydrogel as a bioactive material to regulate stem cell fate. Bioactive Materials. 1 (1), 39-55 (2016).
- Kumar, A., Mishra, R., Reinwald, Y., Bhat, S. Cryogels: Freezing unveiled by thawing. Materials Today. 13 (11), 42-44 (2010).
- Wu, T., Li, Y., Lee, D. S. Chitosan-based composite hydrogels for biomedical applications. Macromolecular Research. 25 (6), 480-488 (2017).
- Dutta, P. K., Dutta, J., Tripathi, V. S. Chitin and chitosan: Chemistry, properties and applications. Journal of Scientific and Industrial Research. 63, 20-31 (2004).
- Szymańska, E., Winnicka, K. Stability of Chitosan—A Challenge for Pharmaceutical and Biomedical Applications. Marine Drugs. 13, 1819-1846 (2015).
- Yang, X., Liu, Q., Chen, X., Yu, F., Zhu, Z. Investigation of PVA/ws-chitosan hydrogels prepared by combined gamma-irradiation and freeze-thawing. Carbohydrate Polymers. 73 (3), 401-408 (2008).
- Mathews, D. T., Birbey, Y. A., Cahill, P. A., McGuinness, G. B. Mechanical and Morphological Characteristics of Poly(vinyl alcohol)/Chitosan Hydrogels. Journal of Applied Polymer Science. 109, 1129-1137 (2008).
- Hosseini, M. S., Amjadi, I., Haghighipour, N. Preparation of Poly(vinyl alcohol)/Chitosan-Blended Hydrogels: Properties, in Vitro Studies and Kinetic Evaluation. Journal of Biomimetics, Biomaterials, and Tissue Engineering. 15, 63-72 (2012).
- Afshari, M. J., Sheikh, N., Afarideh, H. PVA/CM-chitosan/honey hydrogels prepared by using the combined technique of irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 113, 28-35 (2015).
- Agnihotri, S., Mukherji, S. S., Mukherji, S. S. Antimicrobial chitosan-PVA hydrogel as a nanoreactor and immobilizing matrix for silver nanoparticles. Applied Nanoscience. 2 (3), 179-188 (2012).
- Yang, X., et al. Cytotoxicity and wound healing properties of PVA/ws-chitosan/glycerol hydrogels made by irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 79 (5), 606-611 (2010).
- Machín, R., Isasi, J. R., Vélaz, I. Hydrogel matrices containing single and mixed natural cyclodextrins. Mechanisms of drug release. European Polymer Journal. 49 (12), 3912-3920 (2013).
- Ritger, P. L., Peppas, N. A. A Simple Equation for Description of Solute Release. Journal of Controlled Release. 5, 37-42 (1987).
- Abureesh, M. A., Oladipo, A. A., Gazi, M. Facile synthesis of glucose-sensitive chitosan-poly(vinyl alcohol) hydrogel: Drug release optimization and swelling properties. International Journal of Biological Macromolecules. 90, 75-80 (2016).
- Mansur, H. S., Sadahira, C. M., Souza, A. N., Mansur, A. A. P. FTIR spectroscopy characterization of Poly(vinyl alcohol) hydrogel with different hydrolysis degree and chemically crosslinked with glutaraldehyde. Materials Science and Engineering C. 28 (4), 539-548 (2008).
- Parida, U. K., Nayak, A. K., Binhani, B. K., Nayak, P. L. Synthesis and Characterization of Chitosan-Polyvinyl Alcohol Blended with Cloisite 30B for Controlled Release of the Anticancer Drug Curcumin. Journal of Biomaterials and Nanobiotechnology. 02 (04), 414-425 (2011).
- Zu, Y., et al. Preparation and characterization of chitosan-polyvinyl alcohol blend hydrogels for the controlled release of nano-insulin. International Journal of Biological Macromolecules. 50 (1), 82-87 (2012).
- Lejardi, A., Hernández, R., Criado, M., Santos, J. I., Etxeberria, A., Sarasua, J. R. Novel hydrogels of chitosan and poly ( vinyl alcohol ) -g-glycolic acid copolymer with enhanced rheological properties. Carbohydrate Polymers. , 267-273 (2014).
- dos Reis, E. F., et al. Synthesis and characterization of Poly(vinyl alcohol) hydrogels and hybrids for rMPB70 protein adsorption. Materials Research. 9 (2), 185-191 (2006).
- Thanyacharoen, T., Chuysinuan, P., Techasakul, S., Nooeaid, P., Ummartyotin, S. Development of a gallic acid-loaded chitosan and polyvinyl alcohol hydrogel composite: Release characteristics and antioxidant activity. International Journal of Biological Macromolecules. 107, 363-370 (2018).
- Lozinsky, V. I., et al. Polymeric cryogels as promising materials of biotechnological interest. Trends in Biotechnology. 21 (10), 445-451 (2003).
- Liu, Y., Vrana, N. E., Cahill, P. A., McGuinness, G. B. Physically crosslinked composite hydrogels of PVA with natural macromolecules: Structure, mechanical properties, and endothelial cell compatibility. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 90 (2), 492-502 (2009).
- Yang, W., et al. Polyvinyl alcohol/chitosan hydrogels with enhanced antioxidant and antibacterial properties induced by lignin nanoparticles. Carbohydrate Polymers. 181 (August 2017), 275-284 (2018).
- Park, H., Kim, D. Swelling and mechanical properties of glycol chitosan/poly(vinyl alcohol) IPN-type superporous hydrogels. Journal of Biomedical Materials Research Part A. 78 (4), 662-667 (2006).
- Zhang, H., Zhang, F., Wu, J. Physically crosslinked hydrogels from polysaccharides prepared by freeze-thaw technique. Reactive and Functional Polymers. 73 (7), 923-928 (2013).
- Hassan, C. M., Peppas, N. A. Structure and Applications of Poly ( vinyl alcohol ) Hydrogels Produced by Conventional Crosslinking or by Freezing / Thawing Methods. Advances in Polymer Science. 153, 37-65 (2000).
- Sung, J. H., et al. Gel characterisation and in vivo evaluation of minocycline-loaded wound dressing with enhanced wound healing using polyvinyl alcohol and chitosan. International Journal of Pharmaceutics. 392 (1-2), 232-240 (2010).
- Lin, C. C., Metters, A. T. Hydrogels in controlled release formulations: Network design and mathematical modeling. Advanced Drug Delivery Reviews. 58 (12-13), 1379-1408 (2006).
- Fan, L., Yang, H., Yang, J., Peng, M., Hu, J. Preparation and characterization of chitosan/gelatin/PVA hydrogel for wound dressings. Carbohydrate Polymers. 146, 427-434 (2016).
- Islam, A., et al. Evaluation of selected properties of biocompatible chitosan / poly ( vinyl alcohol) blends. International Journal of Biological Macromolecules. 82, 551-556 (2016).
- Physical Montaser, A. S. mechanical and antimicrobial evaluations of physically crosslinked PVA/chitosan hydrogels containing nanoparticles. Journal of Applied Pharmaceutical Science. 6 (5), 1-6 (2016).
- Hou, Y., Chen, C., Liu, K., Tu, Y., Zhang, L., Li, Y. Preparation of PVA hydrogel with high-transparence and investigations of its transparent mechanism. RSC Advances. 5 (31), 24023-24030 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados