JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
가교제와 디플루니살 방출 연구를 하지 않고 키토산-폴리(비닐 알코올) 하이드로겔을 준비하는 동결 해동 방법
요약
동결 해동 방법은 가교제없이 키토산 폴리 (비닐 알코올) 하이드로 겔을 생산하는 데 사용됩니다. 이 방법의 경우, 수득된 하이드로겔의 특성 및 용도에 영향을 미칠 수 있는 동결 조건(온도, 사이클 수) 및 폴리머 비율을 고려하는 것이 중요하다.
초록
키토산 폴리(비닐 알코올) 하이드로겔은 독성 가교제를 사용하지 않고 동결 해동 방법에 의해 제조될 수 있다. 이러한 시스템의 적용은 동결 조건 및 폴리머의 종류 및 비율에 따라 달라지며 특성(예: 다공성, 유연성, 팽창 용량, 약물 로딩 및 약물 방출 용량)에 의해 제한됩니다. 이 프로토콜은 폴리머 조성의 50/50/w%에서 키토산 및 폴리(비닐 알코올)에서 하이드로겔을 준비하고 동결 온도(-4°C, -20°C, -80°C) 및 동결 해동 주기(4, 5, 6 동결 주기)를 변화하는 방법을 설명합니다. FT-IR 스펙트라, SEM 현미경 및 하이드로겔의 조색측정 데이터를 수득하였다. 또한, 팽창 용량 및 약물 로딩 및 디플루니살의 방출을 평가했다. SEM 현미경 및 porosimetry의 결과는 다공도가 더 낮은 온도에서 증가하는 동안, 공극 의 크기가 감소한다는 것을 보여줍니다. 부종 비율은 경미한 동결 온도에서 더 높았다. 하이드로겔로부터의 디플루니살 방출이 연구되고 있다. 모든 네트워크는 30 시간 동안 약물 방출을 유지하고 간단한 확산 메커니즘이 Korsmeyer-Peppas 및 히구치 모델에 따라 디플루니컬 방출을 조절하는 것으로 관찰되었습니다.
서문
최근 하이드로겔은 수분 함량이 높고 부드럽고 유연하기 때문에 생체 의학 분야에서 큰 관심을 끌고 있으며, 따라서 자연 조직을 쉽게 모방할 수 있다1. 또한 생리적 온도와 pH에서 수성 매질에 용해되지 않고 큰 부종2를제시합니다. 하이드로겔은 조직 공학 비계, 위생 제품, 콘택트 렌즈 및 상처 드레싱역할을 할 수 있습니다. 활성 화합물과 약물을 포획하고 방출 할 수 있기 때문에 약물 전달 시스템3으로사용됩니다. 그들의 용도에 따라, 하이드로겔은 최상의 특성을 얻기 위해 천연 또는 합성 중합체, 또는 둘 다의 조합으로 만들어질 수 있다4.
하이드로 겔의 특성은 많은 물리적 및 화학적 요인의 결과입니다. 물리적 인 수준에서, 그들의 구조와 형태는 그들의 다공성, 기공 크기 및 기공 분포에 따라 달라집니다5. 화학적 및 분자적 수준에서, 중합체 유형, 중합체 사슬내의 친수성 군 함량, 가교점 유형 및 가교 밀도는 팽윤 용량 및 기계적성질을결정하는 인자이다6,7.
네트워크를 형성하는 데 사용되는 가교제의 종류에 따라, 하이드로겔은 화학적 하이드로겔 또는 물리적 하이드로겔로 분류된다. 화학적 하이드로겔은 UV 및 감마 조사를 통해 형성되거나 가교제7,8을사용하여 형성되는 그들의 사슬 들 사이의 공유 상호작용에 의해 결합된다. 화학 하이드로겔은 일반적으로 강하고 내성이 있지만, 일반적으로 가교제는 세포에 독성이 있으며 제거가 어렵기 때문에 적용이 제한됩니다. 한편, 물리적 하이드로겔은 비공유 상호작용을 통해 중합체 사슬의 연결에 의해 형성되어,가교제4,9의사용을 피한다. 네트워크의 주요 비 공유 상호 작용은 소수성 상호 작용, 정전기력, 상보및 수소 경계7입니다.
폴리(비닐 알콜) (PVA, 도 1a)는동결 해동 방법10,11을통해 가교제 무하이드로겔로부터 수 있는 우수한 기계적 성능 및 생체 적합성을 가진 합성 및 수용성 중합체이다. 이 중합체는12를동결할 때 그들의 사슬(결정성 영역)의 -OH 그룹 사이에 수소 결합의 농축 영역을 형성하는 능력을 가지고 있다. 이러한 결정성 영역은 네트워크에서 가교 지점역할을 하며, 이들은 두 가지 사건에 의해 추진된다: 결정물이 팽창할 때 중합체 사슬의 접근과 동결13동안 등방PVA로 의 PVA 형태 변화. 동결 건조로 인해, 물 결정이 승화되고,하이드로겔(14)의기공인 공극 공간을 남긴다. 더 나은 특성을 가진 하이드로겔을 얻기 위해 PVA는 다른 폴리머와 쉽게 결합 될 수 있습니다.
그런 의미에서 키토산은 천연 공급원에서 유일하게 양전하를 가진 생체 고분자이기 때문에 선택지입니다. 치틴의 탈세틸화에 의해 수득되고 β-1,4 연결된 D-글루코사민(deacetylated unit) 및 N-아세틸-D-글루코사민(acetylated unit)의 무작위 조합으로 구성되며15,16 (도 1b). 키토산은 인간의 효소에 의해 생분해성이며 생체 적합성입니다. 또한, 그 양이온 성질에 의해, 세포 표면의 음전하와 상호 작용할 수 있고, 이 성질은 그 항균활성(17)과연관되어 있다. 이 중합체는 가공이 용이합니다. 그러나, 그들의 기계적 특성은 충분하지 않으며, 일부 재료는 더 나은 특성을 가진 복합체를 형성하기 위해 추가되었습니다.
키토산 및 PVA의 특성을 고려하여, 독성 가교제의 사용을 피하기 위해 동결 해동 방법2,18에 의해 하이드로겔의 성공적인 제조에 도달하였다. 키토산-PVA 하이드로겔에서는 PVA의 결정성 영역도 형성되고, 키토산 사슬은 -NH2 기 및 -OH 그룹과 간단한 수소 결합을 형성합니다. 최종 키토산 -PVA 하이드로 겔은 기계적으로 안정적이며 붓기비율이 높고 독성이 낮으며 항균 효과18. 그러나, 준비에 사용되는 동결 조건(온도, 시간 및 사이클 수)에 따라 최종 특성이 변경될 수 있습니다. 일부 연구는 동결 주기의 수를 증가 붓기 정도를 감소시키고 인장 강도를 증가보고19,20. 네트워크를 강화하기 위해, 감마 및 UV 방사선 및 화학 적 가교와 같은 다른 제제는 동결 해동 제제21,22,23후에 추가로 사용되어 왔다. 키토산 비율이 높은 하이드로겔은 다공성 네트워크와 높은 팽창 용량을 가지고 있지만 강도와 열 안정성은 적습니다. 이러한 맥락에서, 그들의 표적 적용에 적합한 하이드로겔을 얻기 위해 준비 조건을 고려하는 것이 중요하다.
이 작업의 목적은 동결 조건 (동결 온도 및 사이클 수)이 CS-PVA 하이드로 겔의 최종 특성에 미치는 영향을 자세히 제시하는 것입니다. FT-IR 스펙트럼, 형태학적 및 다공성 특성 및 팽윤 용량뿐만 아니라 약물 로딩 및 방출 용량을 평가하였다. 방출 연구에서, 디플루니살(도1c)은하이드로겔 구조에 적합한 크기로 인해 모델 약물로 사용하였다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 키토산-PVA 하이드로겔 의 준비
- 2% (w/ w) 키토산 및 10% PVA 용액을 준비합니다. 0.1 M CH3COOH 용액(이전에 여과)의 10 mL에 0.2 g의 키토산을 용해시키고 밤새 연속기계적 교반을 유지합니다. 증류수 10 mL에 PVA 1 g을 용해시키고 80 °C에서 1 시간 동안 저어줍니다.
- 실온에서 균일할 때까지 마그네틱 교반기로 두 용액을 1:1 혼합하고 페트리 접시에 혼합물을 붓습니다. 샘플을 기압에서 2시간 동안 방치하여 탈기합니다.
- 하이드로겔을 -4°C, -20°C 또는 -80°C에서 20시간 및 4주기 동안 동결합니다(CP4-4, CP4-20 및 CP4-80 시료). 5 또는 6 의 동결 주기 (샘플 CP5-80 및 CP6-80)를 사용하여 20 시간 동안 -80 °C에서 다른 하이드로 겔을 동결하십시오. 세 번째 동결 주기 후, 탈이온수로 하이드로겔을 씻는다. 끝에서, 하이드로겔을 -46°C에서 48시간 동안 동결건조시키고 추가적인 특성화를 위해저장한다(2로부터적응된 방법론).
2. FT-IR 특성화
- ATR 모드에서 FT-IR 분광기에 하이드로겔의 작은 조각(1mm x 2mm)을 놓습니다. FT-IR 스펙트럼을 4000에서 600cm-1(2cm -1의 해상도 및 평균 32회 스캔)으로 가져가라.
3. 팽윤 성 아세
- 하이드로겔에서 디스크(직경 13mm, 높이 10mm)를 잘라무게를 측정합니다. 25 °C에서 흔들어 탈이온수의 50 mL에서 디스크를 배양. 세 번 반복합니다.
- 매 30 분마다 매체에서 샘플을 제거하고, 물의 과잉을 제거하고, 무게를 달수 있습니다. 방정식 1을 사용하여 팽윤 정도를 계산하고 24시간에서
 24시간에서 팽윤의 평형 상태를 계산합니다.
24시간에서 팽윤의 평형 상태를 계산합니다.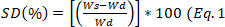 )
)
건조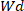 하이드로겔의 중량은
하이드로겔의 중량은 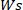 어디에 있고 습식 하이드로겔의 중량이다.
어디에 있고 습식 하이드로겔의 중량이다.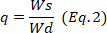
4. 전자 현미경 검사법
- 스퍼터 코터에 얇은 금층(30s 및 10mA)으로 하이드로겔 을 약간 덮습니다.
- 샘플을 주사 전자 현미경(SEM)에 넣습니다. 20kV에서 진공 상태의 시료를 분석하고 500x 및 1500배 배율로 이미지를 찍습니다.
5화 포로시내
- 직경 약 0.26g의 디스크를 페널티미터(0.3660 mL 및 스템 부피 5.7831mL의 부피)에 넣습니다. 수은 침입 공청체(MIP)에 의한 다공도 및 기공 크기를 분석합니다.
- 히스테리시스 모드(침입 압출)에서 실험을 수행합니다. 총 침입 량(mL/g), 총 기공 면적(m2/g), 기공 직경(μm), 다공성(%), 투과성(mDarcy) 및 비틀거림을 측정합니다. 두 번 반복합니다.
6. 약물 로딩 및 방출
- 로딩하기 전에 15 mg/L 디플루니솔 용액 4L을 준비하고 밤새 저어주세요. UV-Vis 분광법(초기 농도)으로 용액의 농도를 확인합니다. 실제로, 24 시간 동안 증류수 6 mL에서 하이드로 겔의 동결 건조 샘플 400 mg을 팽창시킵니다.
- 적재를 위해 플라스크를 50 mL의 디플루니살 용액으로 채우고 일정한 교반으로 25 °C에서 유지하십시오. 부풀어 있는 하이드로겔을 플라스크에 담급니다.
- 곡선의 고원 영역을 결정하기 위해 상이한 시간에 나머지 디플루니살 용액(2 mL)의 aliquots를 취합니다: 예를 들어 3, 6, 24, 27, 30 및 48 h. 24 시간 후 새로운 것으로 용액을 교체하십시오.
- 각 알리쿼트의 252 nm에서 흡광도를 측정하고, 디플루니솔의 캘리브레이션 곡선을 사용하여 용액에 존재하는 디플루니날의 농도를 결정한다. 총 부피(56 mL)를 고려하여 초기 및 최종 농도의 차이로 하이드로겔에 유지되는 디플루니살양을 24 및 48h로 계산합니다.
- 수학식 3을 사용하여 캡슐화 효율(EE)을 결정합니다.
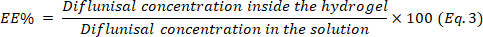
- 로드된 하이드로겔을 -80°C에서 동결시키고 -50°C에서 동결시식건조합니다.
- 수학식 3을 사용하여 캡슐화 효율(EE)을 결정합니다.
- 약물 방출을 위해, 25°C에서 50 mL의 인산완충(pH 7.4)에 동결 건조 된 디플루니살 로드 하이드로겔 300 mg을 담급니다. 일정한 교반을 유지합니다. 다른 시간에 2 mL의 aliquots를 철회하고 일정한 볼륨을 유지하기 위해 신선한 매체로 교체하십시오.
- 교정 곡선에 따라 252 nm에서 분광광도 측정으로 방출된 디플루니솔을 확정합니다.
- 하이드로겔에서 우세한 약물 방출 메커니즘을 추론하여 제1 60%에 해당하는 약물 방출 데이터를, Korsmeyer-Peppas 모델(수학식 4)에,운동(k)및확산(n)상수를 수득하였다. n 값은 약물 방출24,25의메커니즘을나타낸다. 그런 다음 0.5에 가까운 n 값은 Fickian 확산과 관련이 있으며, 한편 비정상적인 전송의 경우 0.5-1.0의 값은 확산 및 이완 체인과 관련된 반면, 마지막으로 1.0의 값은 CASE II 전송과 관련이 있습니다.
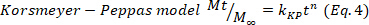
- 결과를 확인하려면 Higuchi, 1차 및 0차 수학적 모델(방정식 5~7)을 사용하고 더 나은 적합을 선택합니다.
-
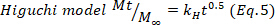
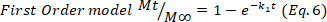
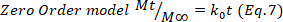
여기서 t는 방출 시간을 나타내며, Mt는 주어진 시간에 전달되는 약물의 양, 및 M∞ 프로세스의 끝에서 전달되는 약물의 총량.
Access restricted. Please log in or start a trial to view this content.
결과
하이드로겔 준비
키토산-PVA 하이드로겔은 -4°C, -20°C 및 -80°C에서 4회 동결 사이클및 -80°C에서 5 및 6의 동결 사이클을 이전에 보고된 동결 해동 방법에 의해 수득하였다2. 모든 하이드로겔은 균일하고 반투명하며 유연하며 조작에 대한 저항력이 있었습니다.
FT-IR 특성화
FT-IR 스펙...
Access restricted. Please log in or start a trial to view this content.
토론
동결 해동 방법은 생체 의학, 제약 또는 미용 응용 분야에서 초점을 맞춘 생체 적합성 하이드로겔을 제조하는 데 적합한공정(34,35,36)이다. 이 방법의 가장 중요한 장점은 하이드로겔을 제조하는 다른 잘 알려진 방법과 비교하여, 가교제 사용이 회피된다는 것입니다, 이는 인체에 염증 반응 또는 부작용을 일으킬 수 있는
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 공로시측정측정에 대한 지원에 대해 C. Luzuriaga에게 감사드립니다. 저자는 또한 재정 지원을 위한 스페인의 장관 드 Economía y Competitividad 덕분에 (프로젝트 MAT2014-59116-C2-2-R) 및 PIUNA (참조. 2018-15). 저자는 또한 지원과 도움이 의견에 대한 Departamento 드 피시카 - UNISON에서 박사 아미르 말도나도를 인정하고 싶습니다 및 SEM 이미지에 대한 DIPM-UNISON에서 박사 SE 부루엘 -이바라 와 루비오 제약 y Asociados S. De C. C. 재정 지원을 위해. ME Martínez-Barbosa는 CONACyT (멕시코) 프로젝트 No. 104931 및 No. 256753, 레드 테마티카 데 나노시엔시아스 y Nanotecnología del programa 드 Redes Táticas del CONACyT의 재정 지원을 감사하고 싶습니다. 또한 USO316001081을 투영합니다. MD 피게로아-피자노는 재정 지원을 위해 CONACyT를 인정하고 싶습니다 (장학금 373321).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Chitosan medium molecular weight | Sigma-Aldrich | 448877 | Mw determined by capillary viscometry (637,000 Da) and deacetylation degree of 70% |
| Diflunisal (2'-4'-difluoro-4-hydroxy-3-biphenyl-carboxylicacid) | Merck | ||
| Glacial acetic acid | Sigma-Aldrich | 1005706 | |
| Poly(vinyl alcohol) | Sigma-Aldrich | 341584 | Mw 89,000-98,000, 99+% hydrolyzed |
| Equipment: | |||
| Cressington Sputter Coater 108 auto | TED PELLA INC | ||
| Cryodos Lyophilizator | Telstar | ||
| Falcon tubes | Thermo Fisher Company | ||
| FT-IR spectroscopy | Nicolet iS50 | in ATR mode | |
| Lyophilizator | LABCONCO | ||
| Micromeritics Autopore IV 9500 | Micromeritics | ||
| Scanning electron microscope | Pemtron SS-300LV | ||
| UV-visible spectrophotometer | Agilent 8453 |
참고문헌
- Gyles, D. A., Castro, L. D., Silva, J. O. C., Ribeiro-Costa, R. M. A review of the designs and prominent biomedical advances of natural and synthetic hydrogel formulations. European Polymer Journal. 88 (01), 373-392 (2017).
- Abdel-Mohsen, aM., Aly, aS., Hrdina, R., Montaser, aS., Hebeish, a Eco-Synthesis of PVA/Chitosan Hydrogels for Biomedical Application. Journal of Polymers and the Environment. 19, 1005-1012 (2011).
- Caló, E., Khutoryanskiy, V. V. Biomedical applications of hydrogels: A review of patents and commercial products. European Polymer Journal. 65, 252-267 (2015).
- Ahmadi, F., Oveisi, Z., Samani, M., Amoozgar, Z. Chitosan based hydrogels: Characteristics and pharmaceutical applications. Research in Pharmaceutical Sciences. 10 (1), 1-16 (2015).
- Siepmann, J., Siegel, R. A., Rathbone, M. J. Fundamentals and applications of controlled release drug delivery. Fundamentals and Applications of Controlled Release Drug Delivery. , (2012).
- Gulrez, S. K. H., Al-Assaf, S., Phillips, O. G. Hydrogels: Methods of Preparation, Characterisation and Applications. Progress in Molecular and Environmental Bioengineering - From Analysis and Modeling to Technology Applications. , 117-146 (2011).
- Ahmed, E. M. Hydrogel: Preparation, characterization, and applications. Journal of Advanced Research. 6 (2), 105-121 (2015).
- Deligkaris, K., Tadele, T. S., Olthuis, W., van den Berg, A. Hydrogel-based devices for biomedical applications. Sensors and Actuators, B: Chemical. 147 (2), 765-774 (2010).
- Patel, A., Mequanint, K. Hydrogel Biomaterials. Biomedical Engineering - Frontiers and Challenges. , 275-296 (2012).
- Kenawy, E., Kamoun, E. A., El-meligy, M. A., Mohy, M. S. Physically crosslinked poly ( vinyl alcohol ) - hydroxyethyl starch blend hydrogel membranes Synthesis and characterization for biomedical applications. Arabian Journal of Chemistry. 7 (3), 372-380 (2014).
- Kamoun, E. A., Kenawy, E. R. S., Chen, X. A review on polymeric hydrogel membranes for wound dressing applications: PVA-based hydrogel dressings. Journal of Advanced Research. 8 (3), 217-233 (2017).
- Hassan, C. M., Peppas, N. A. Structure and Morphology of Freeze / Thawed PVA Hydrogels. Macromolecules. 33, 2472-2479 (2000).
- Tsou, Y. H., Khoneisser, J., Huang, P. C., Xu, X. Hydrogel as a bioactive material to regulate stem cell fate. Bioactive Materials. 1 (1), 39-55 (2016).
- Kumar, A., Mishra, R., Reinwald, Y., Bhat, S. Cryogels: Freezing unveiled by thawing. Materials Today. 13 (11), 42-44 (2010).
- Wu, T., Li, Y., Lee, D. S. Chitosan-based composite hydrogels for biomedical applications. Macromolecular Research. 25 (6), 480-488 (2017).
- Dutta, P. K., Dutta, J., Tripathi, V. S. Chitin and chitosan: Chemistry, properties and applications. Journal of Scientific and Industrial Research. 63, 20-31 (2004).
- Szymańska, E., Winnicka, K. Stability of Chitosan—A Challenge for Pharmaceutical and Biomedical Applications. Marine Drugs. 13, 1819-1846 (2015).
- Yang, X., Liu, Q., Chen, X., Yu, F., Zhu, Z. Investigation of PVA/ws-chitosan hydrogels prepared by combined gamma-irradiation and freeze-thawing. Carbohydrate Polymers. 73 (3), 401-408 (2008).
- Mathews, D. T., Birbey, Y. A., Cahill, P. A., McGuinness, G. B. Mechanical and Morphological Characteristics of Poly(vinyl alcohol)/Chitosan Hydrogels. Journal of Applied Polymer Science. 109, 1129-1137 (2008).
- Hosseini, M. S., Amjadi, I., Haghighipour, N. Preparation of Poly(vinyl alcohol)/Chitosan-Blended Hydrogels: Properties, in Vitro Studies and Kinetic Evaluation. Journal of Biomimetics, Biomaterials, and Tissue Engineering. 15, 63-72 (2012).
- Afshari, M. J., Sheikh, N., Afarideh, H. PVA/CM-chitosan/honey hydrogels prepared by using the combined technique of irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 113, 28-35 (2015).
- Agnihotri, S., Mukherji, S. S., Mukherji, S. S. Antimicrobial chitosan-PVA hydrogel as a nanoreactor and immobilizing matrix for silver nanoparticles. Applied Nanoscience. 2 (3), 179-188 (2012).
- Yang, X., et al. Cytotoxicity and wound healing properties of PVA/ws-chitosan/glycerol hydrogels made by irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 79 (5), 606-611 (2010).
- Machín, R., Isasi, J. R., Vélaz, I. Hydrogel matrices containing single and mixed natural cyclodextrins. Mechanisms of drug release. European Polymer Journal. 49 (12), 3912-3920 (2013).
- Ritger, P. L., Peppas, N. A. A Simple Equation for Description of Solute Release. Journal of Controlled Release. 5, 37-42 (1987).
- Abureesh, M. A., Oladipo, A. A., Gazi, M. Facile synthesis of glucose-sensitive chitosan-poly(vinyl alcohol) hydrogel: Drug release optimization and swelling properties. International Journal of Biological Macromolecules. 90, 75-80 (2016).
- Mansur, H. S., Sadahira, C. M., Souza, A. N., Mansur, A. A. P. FTIR spectroscopy characterization of Poly(vinyl alcohol) hydrogel with different hydrolysis degree and chemically crosslinked with glutaraldehyde. Materials Science and Engineering C. 28 (4), 539-548 (2008).
- Parida, U. K., Nayak, A. K., Binhani, B. K., Nayak, P. L. Synthesis and Characterization of Chitosan-Polyvinyl Alcohol Blended with Cloisite 30B for Controlled Release of the Anticancer Drug Curcumin. Journal of Biomaterials and Nanobiotechnology. 02 (04), 414-425 (2011).
- Zu, Y., et al. Preparation and characterization of chitosan-polyvinyl alcohol blend hydrogels for the controlled release of nano-insulin. International Journal of Biological Macromolecules. 50 (1), 82-87 (2012).
- Lejardi, A., Hernández, R., Criado, M., Santos, J. I., Etxeberria, A., Sarasua, J. R. Novel hydrogels of chitosan and poly ( vinyl alcohol ) -g-glycolic acid copolymer with enhanced rheological properties. Carbohydrate Polymers. , 267-273 (2014).
- dos Reis, E. F., et al. Synthesis and characterization of Poly(vinyl alcohol) hydrogels and hybrids for rMPB70 protein adsorption. Materials Research. 9 (2), 185-191 (2006).
- Thanyacharoen, T., Chuysinuan, P., Techasakul, S., Nooeaid, P., Ummartyotin, S. Development of a gallic acid-loaded chitosan and polyvinyl alcohol hydrogel composite: Release characteristics and antioxidant activity. International Journal of Biological Macromolecules. 107, 363-370 (2018).
- Lozinsky, V. I., et al. Polymeric cryogels as promising materials of biotechnological interest. Trends in Biotechnology. 21 (10), 445-451 (2003).
- Liu, Y., Vrana, N. E., Cahill, P. A., McGuinness, G. B. Physically crosslinked composite hydrogels of PVA with natural macromolecules: Structure, mechanical properties, and endothelial cell compatibility. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 90 (2), 492-502 (2009).
- Yang, W., et al. Polyvinyl alcohol/chitosan hydrogels with enhanced antioxidant and antibacterial properties induced by lignin nanoparticles. Carbohydrate Polymers. 181 (August 2017), 275-284 (2018).
- Park, H., Kim, D. Swelling and mechanical properties of glycol chitosan/poly(vinyl alcohol) IPN-type superporous hydrogels. Journal of Biomedical Materials Research Part A. 78 (4), 662-667 (2006).
- Zhang, H., Zhang, F., Wu, J. Physically crosslinked hydrogels from polysaccharides prepared by freeze-thaw technique. Reactive and Functional Polymers. 73 (7), 923-928 (2013).
- Hassan, C. M., Peppas, N. A. Structure and Applications of Poly ( vinyl alcohol ) Hydrogels Produced by Conventional Crosslinking or by Freezing / Thawing Methods. Advances in Polymer Science. 153, 37-65 (2000).
- Sung, J. H., et al. Gel characterisation and in vivo evaluation of minocycline-loaded wound dressing with enhanced wound healing using polyvinyl alcohol and chitosan. International Journal of Pharmaceutics. 392 (1-2), 232-240 (2010).
- Lin, C. C., Metters, A. T. Hydrogels in controlled release formulations: Network design and mathematical modeling. Advanced Drug Delivery Reviews. 58 (12-13), 1379-1408 (2006).
- Fan, L., Yang, H., Yang, J., Peng, M., Hu, J. Preparation and characterization of chitosan/gelatin/PVA hydrogel for wound dressings. Carbohydrate Polymers. 146, 427-434 (2016).
- Islam, A., et al. Evaluation of selected properties of biocompatible chitosan / poly ( vinyl alcohol) blends. International Journal of Biological Macromolecules. 82, 551-556 (2016).
- Physical Montaser, A. S. mechanical and antimicrobial evaluations of physically crosslinked PVA/chitosan hydrogels containing nanoparticles. Journal of Applied Pharmaceutical Science. 6 (5), 1-6 (2016).
- Hou, Y., Chen, C., Liu, K., Tu, Y., Zhang, L., Li, Y. Preparation of PVA hydrogel with high-transparence and investigations of its transparent mechanism. RSC Advances. 5 (31), 24023-24030 (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유