このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
架橋剤を用いたキトサンポリ(ビニルアルコール)ヒドロゲルを架橋剤とジフルニサル放出研究用に調製する凍結解凍法
要約
凍結解凍法は、架橋剤を用いたキトサンポリ(ビニルアルコール)ヒドロゲルの製造に用いられる。この方法では、得られたヒドロゲルの特性および用途に影響を及ぼす可能性のある凍結条件(温度、サイクル数)およびポリマー比を考慮することが重要である。
要約
キトサンポリ(ビニルアルコール)ヒドロゲルは、有毒な架橋剤を用いずに凍結解凍法により製造することができる。これらのシステムの適用は、凍結条件およびポリマーの種類および比率に依存する特性(例えば、空隙率、柔軟性、膨潤能、薬物負荷および薬物放出能力)によって制限される。このプロトコルは、キトサンおよびポリ(ビニルアルコール)からヒドロゲルをポリマー組成物の50/50 w/w%で調製し、凍結温度(-4°C、-20°C、-80°C)および凍結解凍サイクル(4、5、6凍結サイクル)を変化させる方法を記述します。ヒドロゲルのFT-IRスペクトル、SEM顕微鏡写真及びポロシメトリーデータが得られた。また、膨潤能力および薬物のローディングおよび二十種の放出を評価した。SEM顕微鏡写真とポロシメトリーの結果は、細孔サイズが小さくなり、気孔率が低い温度で増加することを示しています。腫脹率は、軽度の凍結温度で高かった。ヒドロゲルからのジフルーニサルの放出が研究されている。すべてのネットワークは30時間の薬物放出を維持し、単純な拡散メカニズムがコルスマイヤー・ペパスおよび樋口モデルに従ってジフニザル放出を調節することが観察されている。
概要
近年、ヒドロゲルは含水率の高い三次元ネットワークであり、柔らかく柔軟であるため、自然組織を容易に模倣できるため、生物医学分野に大きな関心を集めています。また、それらは生理的温度およびpHで水性媒体に溶解しないが、大きな腫脹2を示す。ヒドロゲルは、組織工学足場、衛生製品、コンタクトレンズ、および創傷ドレッシングとして機能することができます。彼らは、活性化合物および薬物をトラップして放出することができるので、それらは薬物送達システム3として使用される。それらの用途に応じて、ヒドロゲルは、天然または合成ポリマー、またはその両方の組み合わせから作製することができ、最良の特性を得るために4。
ヒドロゲルの特性は、多くの物理的および化学的要因の結果です。物理的なレベルでは、その構造と形態は、その空隙率、細孔サイズおよび細孔分布5に依存する。化学的及び分子レベルにおいて、ポリマー型、ポリマー鎖中の親水性基含有量、架橋点型、及び架橋密度は、膨潤能能力及び機械的性質を決定する因子である6、7である。
ネットワークを形成するために使用される架橋剤の種類に応じて、ヒドロゲルは、化学ヒドロゲルまたは物理的ヒドロゲルとして分類される。化学ヒドロゲルは、UVおよびガンマ照射を介して形成される鎖間の共有相互作用によって結合されるか、架橋剤7、8を使用する。化学ヒドロゲルは、通常、強く、耐性であるが、一般的に、架橋剤は細胞に有毒であり、その除去は困難であるため、その適用は限られている。一方、非共有相互作用を介したポリマー鎖の接続により物理的ヒドロゲルが形成され、架橋剤4、9の使用を回避する。ネットワーク内の主な非共有相互作用は疎水性相互作用、静電力、相補的および水素境界7である。
ポリ(ビニルアルコール)(PVA、図1a)は、凍結解凍法10、11を介して架橋剤フリーヒドロゲルから得ることができる優れた機械的性能および生体適合性を有する合成および水溶性ポリマーである。このポリマーは、12個を凍結している場合に、鎖の-OH基(結晶性ゾーン)間の水素結合の濃縮ゾーンを形成する能力を有する。これらの結晶帯はネットワーク内の架橋点として機能し、結晶水が膨張し、PVA立体構造が凍結13時にアイソタクティックからシンジオタクチックPVAに変化するポリマー鎖の接近という2つの事象によって促進される。凍結乾燥のために、水結晶は昇華され、ヒドロゲル14内の細孔である空隙空間を残す。より良い特性を有するヒドロゲルを得るために、PVAは他のポリマーと容易に組み合わせることができる。
その意味で、キトサンは天然源由来の唯一の生体高分子であり、正電荷を有する選択肢である。キチンの脱アセチル化により得られ、β-1,4連結D-グルコサミン(脱アセチル化単位)とN-アセチル-D-グルコサミン(アセチル化単位)15,16(図1b)のランダムな組み合わせから構成されている。キトサンはヒト酵素によって生分解性であり、生体適合性である。また、そのカチカチ性によって、細胞表面の負電荷と相互作用することができ、そしてこの性質は、その抗菌活性17と関連している。このポリマーは、処理が容易です。しかし、その機械的特性は十分ではなく、より良い特性を持つ複合体を形成するためにいくつかの材料が追加されました。
キトサンおよびPVAの特定の特性を考慮すると、ヒドロゲルの製造が成功し、有毒架橋剤の使用を回避するために凍結解凍法2、18によって達成された。キトサンPVAヒドロゲルでは、PVAの結晶性ゾーンも形成され、キトサン鎖が相互に浸透し、PVA中の-NH2基および-OH基との単純な水素結合を形成する。最終的なキトサンPVAヒドロゲルは機械的に安定しており、膨潤率が高く毒性が低く、抗菌効果は18である。ただし、調製に使用される凍結条件(温度、時間、サイクル数)によっては、最終的な特性が変化する場合があります。いくつかの研究は、凍結サイクルの数を増やすと腫れの程度を減少させ、引張強度19、20を増加させると報告しています。ネットワークを強化するために、ガンマやUV放射線、化学架橋剤などの他の薬剤が、凍結解凍製剤21、22、23の後に追加的に使用されている。キトサンの割合が高いヒドロゲルは、より多孔質なネットワークと高い膨潤能力を有するが、強度と熱安定性は低い。この文脈では、標的アプリケーションに適したヒドロゲルを得るための調製条件を考慮することが重要である。
この研究の目的は、凍結条件(凍結温度およびサイクル数)がCS-PVAヒドロゲルの最終的な特性にどのように影響するかを詳細に提示することです。FT-IRスペクトル、形態学的および気孔率特性および膨潤能、ならびに薬物の負荷および放出能を評価した。放出試験では、ジフルニサル(図1c)をモデル薬剤として用いた。
プロトコル
1. キトサンPVAヒドロゲルの調製
- 2%(w/w)キトサンおよび10%(w/w)PVA溶液を調製します。0.2gのキトサンを室温で0.1 M CH3COOH溶液(以前に濾過)の10mLに溶解し、一晩連続機械的攪拌を維持する。蒸留水の10mLにPVAの1gを溶解し、1時間80°Cで攪拌する。
- 両方の溶液1:1を室温で均質になるまで磁気攪拌機を使用して混合し、ペトリ皿に混合物を注ぎます。試料を大気圧で2時間放置して脱気します。
- ヒドロゲルを-4°、-20°C、または-80°Cで20時間および4サイクル凍結します(サンプルCP4-4、CP4-20、CP4-80)。5または6の凍結サイクル(サンプルCP5-80およびCP6-80)を使用して、20時間-80°Cで別のヒドロゲルを凍結します。3回目の凍結サイクルの後、ヒドロゲルを脱イオン水で洗浄します。最後に、48時間-46°Cでヒドロゲルを凍結乾燥し、さらなる特性評価のために保存します(2から適応した方法論)。
2. FT-IR特性評価
- FT-IR分光計に少しのヒドロゲル(1mm x 2 mm)をATRモードで置きます。FT-IR スペクトルを 4000 ~ 600 cm-1 (解像度の 2 cm-1、平均 32 スキャン) にします。
3. 腫れアッセイ
- ヒドロゲルからディスク(直径13mm、高さ10mm)を切り取り、重くします。25°Cで振とう脱イオン水の50 mLでディスクをインキュベートします。3 回繰り返します。
- 30分ごとに培地からサンプルを取り出し、ブロッターして過剰な水分を除去し、重くします。式1を用いて膨潤度を計算し、
 式2を用いて24時間で膨潤の平衡状態を計算する。
式2を用いて24時間で膨潤の平衡状態を計算する。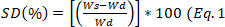 )
)
乾燥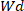 ヒドロゲルの重量はどこにいて、
ヒドロゲルの重量はどこにいて、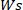 湿式ヒドロゲルの重量です。
湿式ヒドロゲルの重量です。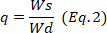
4. 電子顕微鏡
- スパッタコーターで薄い金層(30sと10 mA)でヒドロゲルの小片をカバーします。
- 試料を走査型電子顕微鏡(SEM)に入れます。20 kVで真空下でサンプルを分析し、500xおよび1500x倍率で画像を撮ります。
5. ポロシメトリー
- 直径0.26g前後のディスク15mmをペネトロメーター(固体ペネトロメーター、0.3660 mL、5.7831 mLの幹容積)に入れます。水銀侵入ポロシメトリー(MIP)による気孔率と細孔サイズを分析します。
- ヒステリシスモード(侵入押し出し)で実験を行います。総侵入量(mL/g)、総細孔面積(m2/g)、細孔径(μm)、気孔率(%)、透湿性(mDarcy)、およびトルチュポシティを測定します。2 回繰り返します。
6. 薬物の積み込みと放出
- ロードする前に、15 mg/Lの4 Lを調製し、一晩撹拌する。UV-Vis分光法(初期濃度)により溶液の濃度を確認します。実際、24時間の蒸留水の6 mLでヒドロゲルの凍結乾燥サンプルの400mgを膨潤させる。
- ローディングの場合は、50mLのフラス溶液を充填し、一定攪拌しながら25°Cに維持します。フラスコに各膨らんだヒドロゲルを沈める。
- 残りの二鼻水(2mL)のアリコートを異なる時間に取り、曲線の高原領域を決定します(例えば、3、6、24、27、30および48時間)。24時間後、溶液を新鮮なものに置き換えます。
- 各アリコートの252nmで吸光度を測定し、溶液中に存在するディフルニザルの濃度を決定し、ダイルニザルの較正曲線を用いた。総体積(56mL)を考慮して、初期濃度と最終濃度の差として、24時間と48時間のヒドロゲル中に保持されるジフルニシャルの量を計算します。
- 式 3 を使用してカプセル化効率 (EE) を決定します。
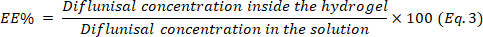
- ロードしたヒドロゲルを-80°Cで凍結し、-50°Cで凍結乾燥させます。
- 式 3 を使用してカプセル化効率 (EE) を決定します。
- 薬物放出の場合、25°Cで50mLのリン酸緩衝液(pH 7.4)に凍結乾燥ジフルニサル装填ヒドロゲルの300mgを沈下させる。一定の攪拌を維持します。異なる時間に2 mLのアリコートを撤回し、一定のボリュームを維持するために新鮮な媒体に置き換えます。
- キャリブレーション曲線に従って、252 nmでディフルニサル放出分光法を確定します。
- 最初の60%に対応する薬物放出データを調整するヒドロゲル中の主な薬物放出機構を推測し、コルスマイヤー・ペパスモデル(式4)に、動態(k)および拡散(n)定数を得た。n値は、薬物放出24、25のメカニズムを示す。次に、0.5に近いn値はフィッキアン拡散に関連し、一方、異常輸送の場合は0.5~1.0の値が拡散および緩和鎖に関与し、最後に1.0の値はケースII輸送に関連する。
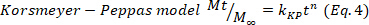
- 結果を確認するには、樋口、一次、ゼロオーダーの数学モデル(方程式5~7)を使用し、より良い適合度を選択します。
-
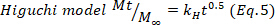
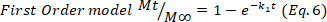
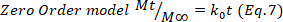
ここで、tは放出時間を表し、所定の時間に送達された薬物の量をMt、およびM∞プロセスの終了時に送達される薬物の総量を表す。
結果
ヒドロゲル調製
キトサンPVAヒドロゲルは、-4°、-20°Cおよび-80°Cで4つの凍結サイクルで、および-80°Cで、前回報告された凍結解凍法2による5および6の凍結サイクルで得られた。すべてのヒドロゲルは、均質で半透明で、柔軟で、操作に対して耐性がありました。
FT-IR特性評価
ディスカッション
凍結解凍法は、生体医、医薬または化粧品用途34、35、36に焦点を当てた生体適合性ヒドロゲルを調製するのに適したプロセスである。この方法の最も重要な利点は、ヒドロゲルを調製する他の公知の方法と比較して、架橋剤の使用が回避され、人体34に炎症反応または有害作用を引き起こす可能性がある?...
開示事項
著者たちは何も開示する必要はない。
謝辞
著者は、ポロシメトリー測定のサポートのためにC.ルズリアガに感謝しています。著者はまた、財政支援のためのスペインの大臣デ・エコノミア・イ・コンペティビダード(プロジェクトMAT2014-59116-C2-2-R)とPIUNA(ref. 2018-15)に感謝します。著者らはまた、ディペタメント・デ・フィシカ・ユニゾンのアミール・マルドナード博士に対し、サポートと有益なコメントと、SEM画像のDIPM-UNISONのSEバレル・イバラ博士と、ルビオ・ファーマ・イ・アソシアドスS.A.デ・C.V.の資金援助を認めたい。MEマルティネス・バルボサは、レッド・テマティカ・デ・ナノシエンシアス・イ・ナノテクノロジア・デル・プログラム・デ・レデス・テマティタス・デル・CONACyTの資金援助に加えて、CONACyT(メキシコ)プロジェクトNo.104931およびNo.256753に感謝したいと思います。そして、また、プロジェクトUSO316001081。MDフィゲロア・ピッツァーノは、財政支援(奨学金373321)のためのCONACyTを認めたい。
資料
| Name | Company | Catalog Number | Comments |
| Materials: | |||
| Chitosan medium molecular weight | Sigma-Aldrich | 448877 | Mw determined by capillary viscometry (637,000 Da) and deacetylation degree of 70% |
| Diflunisal (2'-4'-difluoro-4-hydroxy-3-biphenyl-carboxylicacid) | Merck | ||
| Glacial acetic acid | Sigma-Aldrich | 1005706 | |
| Poly(vinyl alcohol) | Sigma-Aldrich | 341584 | Mw 89,000-98,000, 99+% hydrolyzed |
| Equipment: | |||
| Cressington Sputter Coater 108 auto | TED PELLA INC | ||
| Cryodos Lyophilizator | Telstar | ||
| Falcon tubes | Thermo Fisher Company | ||
| FT-IR spectroscopy | Nicolet iS50 | in ATR mode | |
| Lyophilizator | LABCONCO | ||
| Micromeritics Autopore IV 9500 | Micromeritics | ||
| Scanning electron microscope | Pemtron SS-300LV | ||
| UV-visible spectrophotometer | Agilent 8453 |
参考文献
- Gyles, D. A., Castro, L. D., Silva, J. O. C., Ribeiro-Costa, R. M. A review of the designs and prominent biomedical advances of natural and synthetic hydrogel formulations. European Polymer Journal. 88 (01), 373-392 (2017).
- Abdel-Mohsen, a. M., Aly, a. S., Hrdina, R., Montaser, a. S., Hebeish, a. Eco-Synthesis of PVA/Chitosan Hydrogels for Biomedical Application. Journal of Polymers and the Environment. 19, 1005-1012 (2011).
- Caló, E., Khutoryanskiy, V. V. Biomedical applications of hydrogels: A review of patents and commercial products. European Polymer Journal. 65, 252-267 (2015).
- Ahmadi, F., Oveisi, Z., Samani, M., Amoozgar, Z. Chitosan based hydrogels: Characteristics and pharmaceutical applications. Research in Pharmaceutical Sciences. 10 (1), 1-16 (2015).
- Siepmann, J., Siegel, R. A., Rathbone, M. J. Fundamentals and applications of controlled release drug delivery. Fundamentals and Applications of Controlled Release Drug Delivery. , (2012).
- Gulrez, S. K. H., Al-Assaf, S., Phillips, O. G. Hydrogels: Methods of Preparation, Characterisation and Applications. Progress in Molecular and Environmental Bioengineering - From Analysis and Modeling to Technology Applications. , 117-146 (2011).
- Ahmed, E. M. Hydrogel: Preparation, characterization, and applications. Journal of Advanced Research. 6 (2), 105-121 (2015).
- Deligkaris, K., Tadele, T. S., Olthuis, W., van den Berg, A. Hydrogel-based devices for biomedical applications. Sensors and Actuators, B: Chemical. 147 (2), 765-774 (2010).
- Patel, A., Mequanint, K. Hydrogel Biomaterials. Biomedical Engineering - Frontiers and Challenges. , 275-296 (2012).
- Kenawy, E., Kamoun, E. A., El-meligy, M. A., Mohy, M. S. Physically crosslinked poly ( vinyl alcohol ) - hydroxyethyl starch blend hydrogel membranes Synthesis and characterization for biomedical applications. Arabian Journal of Chemistry. 7 (3), 372-380 (2014).
- Kamoun, E. A., Kenawy, E. R. S., Chen, X. A review on polymeric hydrogel membranes for wound dressing applications: PVA-based hydrogel dressings. Journal of Advanced Research. 8 (3), 217-233 (2017).
- Hassan, C. M., Peppas, N. A. Structure and Morphology of Freeze / Thawed PVA Hydrogels. Macromolecules. 33, 2472-2479 (2000).
- Tsou, Y. H., Khoneisser, J., Huang, P. C., Xu, X. Hydrogel as a bioactive material to regulate stem cell fate. Bioactive Materials. 1 (1), 39-55 (2016).
- Kumar, A., Mishra, R., Reinwald, Y., Bhat, S. Cryogels: Freezing unveiled by thawing. Materials Today. 13 (11), 42-44 (2010).
- Wu, T., Li, Y., Lee, D. S. Chitosan-based composite hydrogels for biomedical applications. Macromolecular Research. 25 (6), 480-488 (2017).
- Dutta, P. K., Dutta, J., Tripathi, V. S. Chitin and chitosan: Chemistry, properties and applications. Journal of Scientific and Industrial Research. 63, 20-31 (2004).
- Szymańska, E., Winnicka, K. Stability of Chitosan—A Challenge for Pharmaceutical and Biomedical Applications. Marine Drugs. 13, 1819-1846 (2015).
- Yang, X., Liu, Q., Chen, X., Yu, F., Zhu, Z. Investigation of PVA/ws-chitosan hydrogels prepared by combined gamma-irradiation and freeze-thawing. Carbohydrate Polymers. 73 (3), 401-408 (2008).
- Mathews, D. T., Birbey, Y. A., Cahill, P. A., McGuinness, G. B. Mechanical and Morphological Characteristics of Poly(vinyl alcohol)/Chitosan Hydrogels. Journal of Applied Polymer Science. 109, 1129-1137 (2008).
- Hosseini, M. S., Amjadi, I., Haghighipour, N. Preparation of Poly(vinyl alcohol)/Chitosan-Blended Hydrogels: Properties, in Vitro Studies and Kinetic Evaluation. Journal of Biomimetics, Biomaterials, and Tissue Engineering. 15, 63-72 (2012).
- Afshari, M. J., Sheikh, N., Afarideh, H. PVA/CM-chitosan/honey hydrogels prepared by using the combined technique of irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 113, 28-35 (2015).
- Agnihotri, S., Mukherji, S. S., Mukherji, S. S. Antimicrobial chitosan-PVA hydrogel as a nanoreactor and immobilizing matrix for silver nanoparticles. Applied Nanoscience. 2 (3), 179-188 (2012).
- Yang, X., et al. Cytotoxicity and wound healing properties of PVA/ws-chitosan/glycerol hydrogels made by irradiation followed by freeze-thawing. Radiation Physics and Chemistry. 79 (5), 606-611 (2010).
- Machín, R., Isasi, J. R., Vélaz, I. Hydrogel matrices containing single and mixed natural cyclodextrins. Mechanisms of drug release. European Polymer Journal. 49 (12), 3912-3920 (2013).
- Ritger, P. L., Peppas, N. A. A Simple Equation for Description of Solute Release. Journal of Controlled Release. 5, 37-42 (1987).
- Abureesh, M. A., Oladipo, A. A., Gazi, M. Facile synthesis of glucose-sensitive chitosan-poly(vinyl alcohol) hydrogel: Drug release optimization and swelling properties. International Journal of Biological Macromolecules. 90, 75-80 (2016).
- Mansur, H. S., Sadahira, C. M., Souza, A. N., Mansur, A. A. P. FTIR spectroscopy characterization of Poly(vinyl alcohol) hydrogel with different hydrolysis degree and chemically crosslinked with glutaraldehyde. Materials Science and Engineering C. 28 (4), 539-548 (2008).
- Parida, U. K., Nayak, A. K., Binhani, B. K., Nayak, P. L. Synthesis and Characterization of Chitosan-Polyvinyl Alcohol Blended with Cloisite 30B for Controlled Release of the Anticancer Drug Curcumin. Journal of Biomaterials and Nanobiotechnology. 02 (04), 414-425 (2011).
- Zu, Y., et al. Preparation and characterization of chitosan-polyvinyl alcohol blend hydrogels for the controlled release of nano-insulin. International Journal of Biological Macromolecules. 50 (1), 82-87 (2012).
- Lejardi, A., Hernández, R., Criado, M., Santos, J. I., Etxeberria, A., Sarasua, J. R. Novel hydrogels of chitosan and poly ( vinyl alcohol ) -g-glycolic acid copolymer with enhanced rheological properties. Carbohydrate Polymers. , 267-273 (2014).
- dos Reis, E. F., et al. Synthesis and characterization of Poly(vinyl alcohol) hydrogels and hybrids for rMPB70 protein adsorption. Materials Research. 9 (2), 185-191 (2006).
- Thanyacharoen, T., Chuysinuan, P., Techasakul, S., Nooeaid, P., Ummartyotin, S. Development of a gallic acid-loaded chitosan and polyvinyl alcohol hydrogel composite: Release characteristics and antioxidant activity. International Journal of Biological Macromolecules. 107, 363-370 (2018).
- Lozinsky, V. I., et al. Polymeric cryogels as promising materials of biotechnological interest. Trends in Biotechnology. 21 (10), 445-451 (2003).
- Liu, Y., Vrana, N. E., Cahill, P. A., McGuinness, G. B. Physically crosslinked composite hydrogels of PVA with natural macromolecules: Structure, mechanical properties, and endothelial cell compatibility. Journal of Biomedical Materials Research - Part B Applied Biomaterials. 90 (2), 492-502 (2009).
- Yang, W., et al. Polyvinyl alcohol/chitosan hydrogels with enhanced antioxidant and antibacterial properties induced by lignin nanoparticles. Carbohydrate Polymers. 181 (August 2017), 275-284 (2018).
- Park, H., Kim, D. Swelling and mechanical properties of glycol chitosan/poly(vinyl alcohol) IPN-type superporous hydrogels. Journal of Biomedical Materials Research Part A. 78 (4), 662-667 (2006).
- Zhang, H., Zhang, F., Wu, J. Physically crosslinked hydrogels from polysaccharides prepared by freeze-thaw technique. Reactive and Functional Polymers. 73 (7), 923-928 (2013).
- Hassan, C. M., Peppas, N. A. Structure and Applications of Poly ( vinyl alcohol ) Hydrogels Produced by Conventional Crosslinking or by Freezing / Thawing Methods. Advances in Polymer Science. 153, 37-65 (2000).
- Sung, J. H., et al. Gel characterisation and in vivo evaluation of minocycline-loaded wound dressing with enhanced wound healing using polyvinyl alcohol and chitosan. International Journal of Pharmaceutics. 392 (1-2), 232-240 (2010).
- Lin, C. C., Metters, A. T. Hydrogels in controlled release formulations: Network design and mathematical modeling. Advanced Drug Delivery Reviews. 58 (12-13), 1379-1408 (2006).
- Fan, L., Yang, H., Yang, J., Peng, M., Hu, J. Preparation and characterization of chitosan/gelatin/PVA hydrogel for wound dressings. Carbohydrate Polymers. 146, 427-434 (2016).
- Islam, A., et al. Evaluation of selected properties of biocompatible chitosan / poly ( vinyl alcohol) blends. International Journal of Biological Macromolecules. 82, 551-556 (2016).
- Physical Montaser, A. S. mechanical and antimicrobial evaluations of physically crosslinked PVA/chitosan hydrogels containing nanoparticles. Journal of Applied Pharmaceutical Science. 6 (5), 1-6 (2016).
- Hou, Y., Chen, C., Liu, K., Tu, Y., Zhang, L., Li, Y. Preparation of PVA hydrogel with high-transparence and investigations of its transparent mechanism. RSC Advances. 5 (31), 24023-24030 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved